Los glucocorticoides son un componente fundamental en el tratamiento de la artritis reumatoide (AR). En los últimos años, numerosos ensayos clínicos controlados de alta calidad metodológica han demostrado su acción como fármaco antirreumático modificador de enfermedad (FAME) y un favorable perfil de seguridad en la AR de reciente comienzo. No obstante, es frecuente que se utilicen más como terapia puente hasta que otros FAME comienzan a actuar que como auténticos agentes modificadores de enfermedad. Los glucocorticoides a dosis bajas durante los 2 primeros años de la enfermedad frenan el deterioro radiológico y reducen la necesidad de usar agentes biológicos para conseguir la remisión clínica en la AR de inicio por lo que se debería valorar su utilización sistemática en este contexto clínico.
Corticosteroids are a mainstay in the therapy of rheumatoid arthritis (RA). In recent years, a number of high-quality controlled clinical trials have shown their effect as a disease-modifying anti-rheumatic drug (DMARD) and a favourable safety profile in recent-onset RA. Despite this, they are more frequently used as bridge therapy while other DMARDs initiate their action than as true disease-modifying agents. Low-dose corticosteroid use during the first two years of disease slows radiologic damage and reduces the need of biologic therapy aimed at reaching a state of clinical remission in recent-onset RA. Thus, their systematic use in this clinical scenario should be considered.
Los glucocorticoides (GC) comenzaron a usarse en el tratamiento de la artritis reumatoide (AR) en 1948 por Hench con resultados clínicos espectaculares en pacientes con elevada actividad inflamatoria confinados al reposo en cama1. Su excelente actividad supresora de la inflamación articular se vio pronto ensombrecida por la aparición de un amplio abanico de efectos secundarios asociados a su utilización prolongada a dosis medias y altas. Esto provocó que quedaran relegados a una auténtica medicación de rescate que se usaba, en cierta medida, asumiendo el fracaso terapéutico de no poder controlar la actividad de la enfermedad con fármacos modificadores de enfermedad (FAME) como sales de oro, antipalúdicos o sulfasalazina (SSZ). No obstante, algunos estudios iniciales2,3 ya indicaron el papel modificador de la enfermedad de los GC.
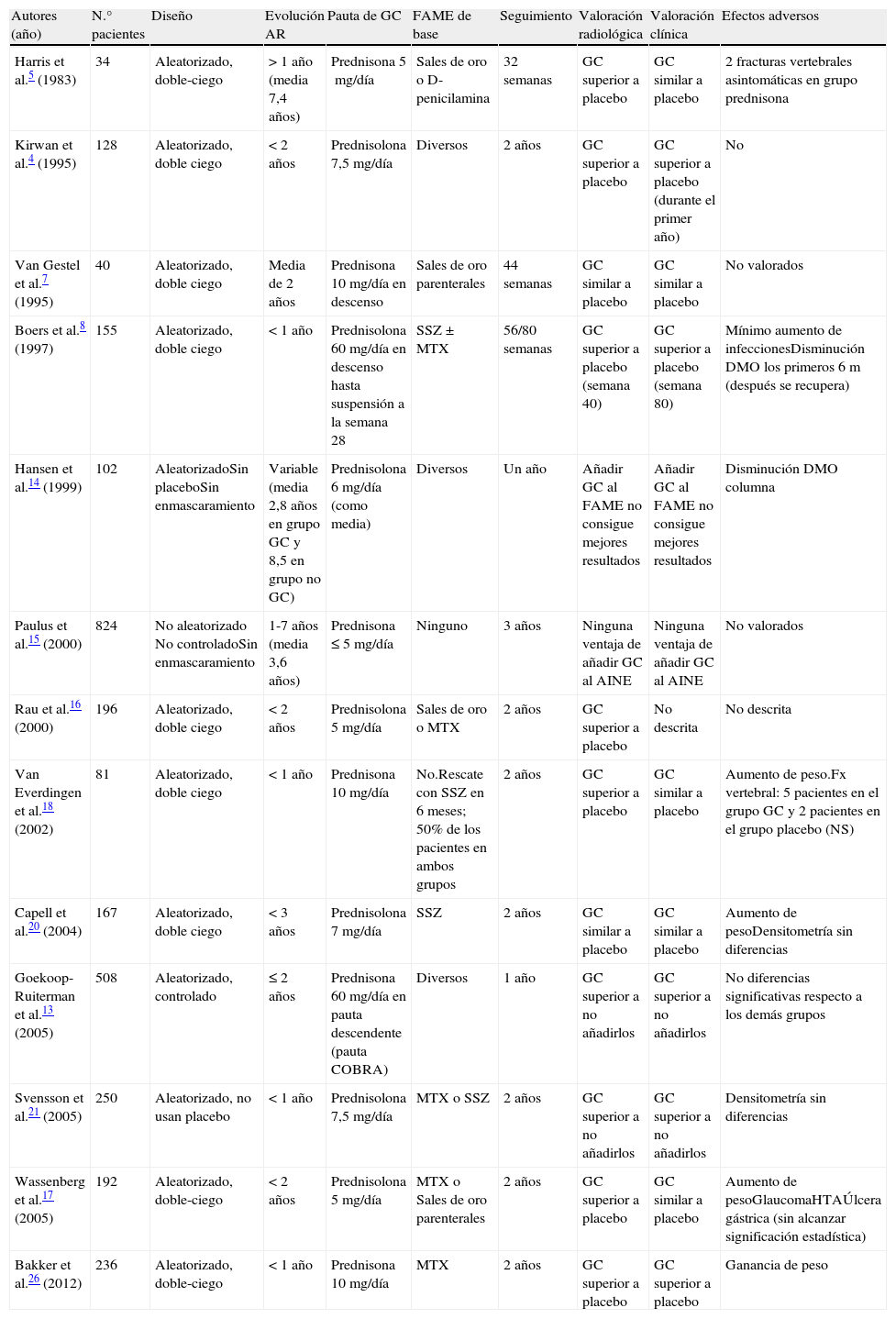
No sería hasta 1995 cuando se planteó la hipótesis sobre su capacidad para prevenir el daño radiológico y, en definitiva, su acción como FAME4. En los últimos años se han publicado diferentes ensayos clínicos y metaanálisis que han estudiado el papel de los GC a dosis bajas como FAME en la AR, así como su perfil de seguridad. Las principales características y conclusiones de estos ensayos clínicos aleatorizados aparecen resumidas en la tabla 1.
Ensayos clínicos que evalúan el efecto de los glucocorticoides en la artritis reumatoide
| Autores (año) | N.° pacientes | Diseño | Evolución AR | Pauta de GC | FAME de base | Seguimiento | Valoración radiológica | Valoración clínica | Efectos adversos |
| Harris et al.5 (1983) | 34 | Aleatorizado, doble-ciego | > 1 año (media 7,4 años) | Prednisona 5mg/día | Sales de oro o D-penicilamina | 32 semanas | GC superior a placebo | GC similar a placebo | 2 fracturas vertebrales asintomáticas en grupo prednisona |
| Kirwan et al.4 (1995) | 128 | Aleatorizado, doble ciego | < 2 años | Prednisolona 7,5mg/día | Diversos | 2 años | GC superior a placebo | GC superior a placebo (durante el primer año) | No |
| Van Gestel et al.7 (1995) | 40 | Aleatorizado, doble ciego | Media de 2 años | Prednisona 10mg/día en descenso | Sales de oro parenterales | 44 semanas | GC similar a placebo | GC similar a placebo | No valorados |
| Boers et al.8 (1997) | 155 | Aleatorizado, doble ciego | < 1 año | Prednisolona 60mg/día en descenso hasta suspensión a la semana 28 | SSZ±MTX | 56/80 semanas | GC superior a placebo (semana 40) | GC superior a placebo (semana 80) | Mínimo aumento de infeccionesDisminución DMO los primeros 6m (después se recupera) |
| Hansen et al.14 (1999) | 102 | AleatorizadoSin placeboSin enmascaramiento | Variable (media 2,8 años en grupo GC y 8,5 en grupo no GC) | Prednisolona 6mg/día (como media) | Diversos | Un año | Añadir GC al FAME no consigue mejores resultados | Añadir GC al FAME no consigue mejores resultados | Disminución DMO columna |
| Paulus et al.15 (2000) | 824 | No aleatorizado No controladoSin enmascaramiento | 1-7 años (media 3,6 años) | Prednisona ≤ 5mg/día | Ninguno | 3 años | Ninguna ventaja de añadir GC al AINE | Ninguna ventaja de añadir GC al AINE | No valorados |
| Rau et al.16 (2000) | 196 | Aleatorizado, doble ciego | < 2 años | Prednisolona 5mg/día | Sales de oro o MTX | 2 años | GC superior a placebo | No descrita | No descrita |
| Van Everdingen et al.18 (2002) | 81 | Aleatorizado, doble ciego | < 1 año | Prednisona 10mg/día | No.Rescate con SSZ en 6 meses; 50% de los pacientes en ambos grupos | 2 años | GC superior a placebo | GC similar a placebo | Aumento de peso.Fx vertebral: 5 pacientes en el grupo GC y 2 pacientes en el grupo placebo (NS) |
| Capell et al.20 (2004) | 167 | Aleatorizado, doble ciego | < 3 años | Prednisolona 7mg/día | SSZ | 2 años | GC similar a placebo | GC similar a placebo | Aumento de pesoDensitometría sin diferencias |
| Goekoop-Ruiterman et al.13 (2005) | 508 | Aleatorizado, controlado | ≤ 2 años | Prednisona 60mg/día en pauta descendente (pauta COBRA) | Diversos | 1 año | GC superior a no añadirlos | GC superior a no añadirlos | No diferencias significativas respecto a los demás grupos |
| Svensson et al.21 (2005) | 250 | Aleatorizado, no usan placebo | < 1 año | Prednisolona 7,5mg/día | MTX o SSZ | 2 años | GC superior a no añadirlos | GC superior a no añadirlos | Densitometría sin diferencias |
| Wassenberg et al.17 (2005) | 192 | Aleatorizado, doble-ciego | < 2 años | Prednisolona 5mg/día | MTX o Sales de oro parenterales | 2 años | GC superior a placebo | GC similar a placebo | Aumento de pesoGlaucomaHTAÚlcera gástrica (sin alcanzar significación estadística) |
| Bakker et al.26 (2012) | 236 | Aleatorizado, doble-ciego | < 1 año | Prednisona 10mg/día | MTX | 2 años | GC superior a placebo | GC superior a placebo | Ganancia de peso |
AINE: antiinflamatorio no esteroideo; AR: artritis reumatoide; DMO: densidad mineral ósea; FAME: fármaco antirreumático modificador de enfermedad; GC: glucocorticoide; MTX: metotrexato; NS: no significativo; SSZ: sulfasalazina.
Harris et al.5 publicaron en 1983 el primer estudio que sugirió un posible efecto de los GC sobre el daño estructural en la AR. Era un estudio aleatorizado y controlado con placebo en el que se trató a 18 pacientes con AR activa con dosis bajas de prednisona (5mg/día) durante 24 semanas, frente a 16 pacientes con placebo, objetivándose al final del seguimiento erosiones en un paciente del grupo de prednisona y en 4 pacientes del grupo placebo. Sin embargo, el pequeño tamaño muestral no permitió alcanzar conclusiones sólidas.
En 1995, Kirwan et al.4 incluyeron a 128 pacientes con AR activa de menos de 2 años de evolución en un ensayo clínico doble-ciego que comparaba 7,5mg diarios de prednisolona frente a placebo añadidos a un tratamiento con FAME convencionales. La enfermedad progresó en el primer año una media de 0,73 unidades en el grupo de prednisolona, según el método radiológico de Larsen, frente a 3,63 unidades en el grupo placebo (p=0,052). Además, se evidenció una mejoría clínica significativa en el grupo tratado con prednisolona. Tras 2 años de seguimiento, solo un 22% de los pacientes que habían recibido prednisolona presentaba erosiones radiológicas frente a un 45% en el grupo placebo (p=0,007). Tras suspender el tratamiento con prednisolona a los 2 años, se evidenció que durante el tercero6 hubo un incremento del daño radiológico, a pesar de que la mayoría de los pacientes seguían recibiendo tratamiento de fondo con un FAME.
Por el contrario, Van Gestel et al.7 no encontraron datos que probaran que el tratamiento con GC disminuyera el daño radiológico, a pesar de evidenciarse una mejoría clínica inicial. Su estudio consistió en un ensayo aleatorizado, doble-ciego y controlado con placebo en el que incluyeron a 40 pacientes con AR tratados con sales de oro parenterales tras el fracaso de otro FAME. Veinte pacientes recibieron 7,5mg diarios de prednisona y 20 recibieron placebo durante 18 semanas. La duración media de la AR era de alrededor de 2 años en los 2 grupos.
El estudio COBRA8 comparó, en AR de menos de 2 años de evolución con criterios de mal pronóstico, una combinación de SSZ, MTX y prednisolona —en pauta descendente, desde 60mg/día hasta 7,5mg/día y suspensión a la semana 28— frente a SSZ en monoterapia. Se observó que el índice modificado de Sharp era significativamente mayor en el grupo de SSZ a las 28 (p<0,0001), 56 (p=0,004) y 80 semanas (p=0,01). El menor deterioro radiológico en el grupo cuyo tratamiento incluía prednisolona se mantuvo a los 5 años de seguimiento9. Asumiendo que la SSZ en monoterapia y la combinación de MTX y SSZ tienen un efecto similar sobre la progresión de la enfermedad10, la diferencia entre los 2 grupos podría verosímilmente atribuirse a la administración de la prednisolona. Van Tuyl et al.11 publicaron en 2009 un estudio que evaluaba la supervivencia, las comorbilidades y el daño estructural tras 11 años de seguimiento de los pacientes del estudio COBRA8. Los autores encontraron una diferencia significativa de 3,1 puntos por año en la puntuación del índice radiológico de Sharp/van der Heijde favorable al grupo de tratamiento combinado. Además, se observó una reducción de la mortalidad en el grupo que recibió tratamiento combinado.
Así mismo, se ha publicado un análisis del impacto de los diferentes regímenes de tratamiento del estudio BeSt a los 5 años de seguimiento12. En el estudio BeSt13 se comparaba la pauta combinada del estudio COBRA8 con otros regímenes de tratamiento (monoterapia secuencial con diversos FAME, adición escalonada de MTX, SSZ e HCQ y tratamiento de inicio con MTX más infliximab) en 508 pacientes con AR de menos de 2 años de evolución. Se observó que los pacientes que habían recibido la pauta COBRA o la terapia combinada con MTX e infliximab experimentaron una mejoría funcional más rápida y una menor progresión radiológica al año de tratamiento que los pacientes de los grupos de monoterapia secuencial o de adición escalonada de FAME convencionales. El grupo que recibió la pauta COBRA presentó un menor daño articular, probablemente debido a una respuesta inicial más rápida que la obtenida en los grupos de monoterapia con FAME o de adición escalonada de FAME convencionales.
Sin embargo, Hansen et al.14, en un estudio aleatorizado, sin enmascaramiento y no controlado con placebo, publicado en 1999, no fueron capaces de demostrar superioridad de la prednisolona a una dosis media de 6mg diarios frente a no añadir GC al FAME en la prevención del daño radiológico tras un año de tratamiento. Es posible que esta diferencia de resultados con respecto al estudio de Kirwan et al.4 se deba en parte a que no se incluyeron pacientes con AR de reciente comienzo y a que los pacientes del grupo que recibió GC presentaban una AR con un tiempo de evolución significativamente menor (2,8 años frente a 8,5 años en el grupo sin GC), lo que pudo haber condicionado una mayor velocidad de progresión radiológica en el grupo tratado con GC.
En otro estudio, publicado por Paulus et al.15, un análisis post hoc tampoco demostró ninguna acción de la prednisona sobre la progresión radiológica, aunque dicho ensayo no se diseñó específicamente para estudiar los efectos del GC y se incluyó a pacientes con AR de 1 a 7 años de evolución.
En cambio, Rau et al.16 estudiaron una población con AR de menos de 2 años de evolución, encontrando diferencias significativas en los índices de daño radiológico a los 6, los 12 y los 24 meses entre 2 grupos (con o sin 5mg diarios de prednisolona, ambos con MTX o sales de oro parenterales). El grupo placebo cuadruplicó la progresión del grupo tratado con prednisolona, principalmente en los primeros 6 meses de tratamiento. Los autores recomendaban el tratamiento con dosis bajas de prednisolona durante los 12 primeros meses tras el diagnóstico de AR como terapia puente, en espera del efecto del FAME. Posteriormente, el mismo grupo publicó nuevos resultados al respecto17, esta vez incluyendo a 192 pacientes (94 en el grupo prednisolona 5mg/día y 98 en el grupo placebo) con AR de menos de 2 años de evolución, tratados con MTX o sales de oro parenterales. Las diferencias en la progresión radiológica según el índice de Ratingen entre ambos grupos fueron significativas a favor del grupo prednisolona durante todo el seguimiento de 24 meses, aunque mucho más marcadas durante los 6 primeros meses. Sin embargo, la mayor eficacia clínica de los GC no se mantuvo más allá de los 6 meses.
En 2002 salieron a la luz los resultados del ensayo clínico controlado con placebo de van Everdingen et al.18 en el que se incluyó a 81 pacientes con AR de menos de un año de evolución y que no habían recibido ningún FAME previamente. Se dividió a los pacientes en 2 grupos de tratamiento: 41 pacientes recibieron 10mg de prednisona diaria y 40 recibieron placebo durante 2 años. Se permitió el uso de antiinflamatorios no esteroideos (AINE) en ambos grupos y el inicio de SSZ a dosis de 2g/día tras los 6 primeros meses de tratamiento, que fue introducida en los 2 grupos de forma homogénea. El grupo de prednisona mostró una mayor mejoría clínica en casi todas las variables medidas (principalmente, variables de valoración de la enfermedad por el paciente) pero esta diferencia no se mantuvo pasados 6 meses salvo en lo referente al recuento de articulaciones dolorosas y la fuerza de prensión. La progresión radiológica fue significativamente menor en el grupo de prednisona y esta diferencia sí persistió a los 2 años, con una puntuación del índice de Sharp de 16±23 en el grupo prednisona frente a 29±26 en el grupo placebo (p=0,007). En opinión de los autores del estudio, la discrepancia entre los resultados clínicos y radiológicos probablemente pudo atribuirse a un mayor uso de terapias complementarias en el grupo placebo. En el estudio de seguimiento a los 5 años19 (entre 2 y 3 años después de suspender el tratamiento) se encontró una menor progresión radiológica en el grupo de prednisona, en comparación con el grupo placebo, tanto en la puntuación total del índice radiológico de Sharp/van der Heijde (p=0,01) como en la puntuación de pinzamiento articular (p=0,02), No se encontraron diferencias en cuanto a las variables clínicas ni en el uso y duración del FAME.
El estudio de Capell et al.20 no puso de manifiesto diferencias significativas de los GC en la prevención del daño radiológico. Dicho ensayo clínico, aleatorizado doble ciego y controlado con placebo, incluyó a 167 pacientes con AR de menos de 3 años de evolución tratados con SSZ que fueron a aleatorizados a recibir 7mg diarios de prednisolona (84 pacientes) o placebo (83 pacientes) durante 2 años. El 59% de los pacientes con erosiones del grupo placebo y el 61% del grupo prednisolona presentaron progresión radiológica, sin diferencias entre los 2 grupos en ninguna de las variables radiológicas. Tampoco se observaron diferencias significativas en cuanto a la eficacia clínica. Estos resultados contrastan enormemente con los obtenidos por otros autores4,16,18. Diferencias entre las poblaciones estudiadas (genéticas y en el porcentaje de pacientes con enfermedad erosiva), el uso sistemático de SSZ como FAME y diferentes métodos para cuantificar el daño radiológico podrían explicar esta discrepancia.
Svensson et al.21 seleccionaron a 250 pacientes con AR activa de menos de un año de evolución, aleatorizando a 119 a recibir 7,5mg/día de prednisolona y 131 a no recibir tratamiento ni placebo. Todos los pacientes recibieron un FAME a elección de su médico, fundamentalmente MTX o SSZ. El cambio en la puntuación radiográfica total según el índice de Sharp/van der Heijde fue menos pronunciado en el grupo prednisolona tanto al año como a los 2 años, siendo significativas las diferencias entre ambos grupos. El índice de erosiones también fue significativamente menor en el grupo de prednisolona y se registró una tendencia similar, pero sin significación estadística, en las puntuaciones de pinzamiento articular. Con respecto a la eficacia clínica, cuantificada con el DAS28, se encontraron diferencias significativas a favor del grupo prednisolona desde los 3 meses de tratamiento; dichas diferencias se mantuvieron durante un seguimiento de 2 años.
En 1997 se publicó el primer metaanálisis22, en el que se incluyeron 9 estudios sobre el uso de GC, con un total de 472 pacientes con AR. Un primer análisis comparó la eficacia de la prednisona a una dosis media de 10,2mg/d frente a placebo, ácido acetilsalicílico, cloroquina y deflazacort. En el segundo, se comparó la prednisona frente a diversos FAME, entre los que se encontraban el MTX, la SSZ, la HCQ y las sales de oro parenterales. La prednisona resultó ser superior al placebo y aproximadamente igual de eficaz que los FAME convencionales con respecto a los parámetros clínicos y analíticos. No se estudió formalmente la evolución radiológica por la gran disparidad en la valoración de la progresión radiológica entre los diferentes estudios.
En 2010, se publicó otro metaanálisis23, que intentaba definir las diferencias respecto al daño articular entre diferentes estrategias de tratamiento: monoterapia con FAME, terapia combinada de FAME más GC, GC en monoterapia y agentes biológicos. Se analizaron los datos de 70 ensayos y compararon con placebo la velocidad de progresión radiológica anual. Se evidenció que todos los grupos reducían en el primer año el índice de progresión en un 48-84%. Comparado con el grupo de monoterapia, el ritmo de progresión radiológica anual fue un 0,62% menor en el grupo de 2 FAME más GC (p < 0,001) y un 0,61% menor en el grupo de biológico más MTX (p<0,00001). Los autores proponían reservar los agentes biológicos para pacientes que no responden al tratamiento combinado. Además, recomendaban futuros ensayos en los que se comparara directamente el tratamiento con un agente biológico más un FAME con 2 o 3 FAME y GC.
En una revisión de la Cochrane Library24 de 2006, en la que solo se tuvieron en cuenta estudios con GC a dosis bajas comparados con placebo o AINE y en seguimiento a corto plazo, se concluyó que dosis equivalentes o inferiores a 15mg de prednisolona diaria eran altamente efectivas en el control clínico de la AR. Este análisis excluyó la mayoría de los estudios anteriormente citados por tratarse de seguimientos a largo plazo.
Un metaanálisis posterior de la Cochrane Library25 sobre la eficacia de los corticoides para inhibir la progresión del daño radiológico identificó 15 estudios controlados y aleatorizados que incluían a 1.414 pacientes con AR, la mayoría de reciente comienzo, en los que se comparaba un GC con placebo o ausencia de tratamiento. En la mayoría de los casos, el GC se usó sobre un régimen estándar de un FAME convencional. Se evaluaron las radiografías de manos o manos y pies de una forma estandarizada y la diferencia en cuanto a la progresión radiológica fue significativa en todos los estudios, menos en uno. Este metaanálisis aporta una evidencia sólida y de calidad a favor del papel de los GC como FAME en la AR de menos de 2 años de evolución y añadidos a un FAME convencional.
Por último, es de destacar los resultados del estudio CAMERA II26, un ensayo aleatorizado, controlado con placebo, que comparó directamente el tratamiento con MTX más 10mg/día de prednisona frente a MTX y placebo, dentro de un protocolo de escalada de dosis y tratamiento ajustado a objetivo prefijado con intensificación terapéutica protocolizada. En el grupo de MTX+GC, el 78% de los pacientes no presentaba erosiones a los 2 años de seguimiento frente al 67% en el otro grupo (p=0,022) y la puntuación de daño radiológico según el índice radiológico de Sharp/van der Heijde era 0,87 unidades menor en el grupo tratado con prednisona (p=0,001). Dicho grupo también presentaba una mejor y más rápida respuesta clínica, incluyendo capacidad funcional y calidad de vida. Otro dato de enorme relevancia farmacoeconómica fue que solo el 20% de los pacientes tratados con MTX+GC frente al 40% de los tratados con MTX+placebo necesitó añadir un agente antifactor de necrosis tumoral alfa para conseguir un buen control de la enfermedad, siendo esta diferencia estadísticamente significativa (p < 0,001).
En resumen, la adición de dosis bajas de GC al FAME convencional, idealmente MTX, en la AR de menos de 2 años de evolución ha demostrado sólidamente reducir la progresión radiológica, mejorar los síntomas y signos de la enfermedad, mejorar el pronóstico funcional de los pacientes y reducir la necesidad de usar terapia biológica para mantener a los pacientes con un adecuado control clínico de la enfermedad.
Seguridad de los glucocorticoides sistémicos en la artritis reumatoideTras más de 60 años de experiencia, no se ha clarificado totalmente en qué medida el riesgo de los principales efectos adversos (EA) derivados del uso de GC depende del régimen de tratamiento, qué probabilidad de EA presenta el uso de GC y si este riesgo se mantiene a largo plazo a pesar de su suspensión. Sigue existiendo desconfianza hacia sus efectos secundarios por parte de los médicos y pacientes a pesar de que los estudios controlados comentados anteriormente han puesto de manifiesto un perfil de seguridad excepcionalmente favorable. Además, hay que valorar las características del paciente, la enfermedad de base, las comorbilidades presentes, la dosis y el tiempo de uso para definir los riesgos de forma individualizada.
Hoes et al.27 demostraron en un metaanálisis que en la AR el riesgo de EA debidos al uso de GC es notablemente menor (43 EA de cada 100 paciente-años) que en la polimialgia reumática (88 EA de cada 100 paciente-años) o en la enfermedad inflamatoria intestinal (EII) (550 EA de cada 100 paciente-años). En estos resultados parecen influir no solo el diseño del estudio (en la mayoría de los diseños de los estudios en AR no se recogen de forma sistematizada la frecuencia de EA al contrario que en EII), sino también las características de la población estudiada. En la AR es conocido que la mayoría de los EA de los GC se producen con dosis altas y que a largo plazo se produce un menor número de EA. En dicho metaanálisis cuantificaron el riesgo de EA con dosis medias o bajas de GC a partir del primer mes de tratamiento y seguían encontrando un riesgo bajo, confirmando el buen perfil de seguridad a corto plazo de las dosis bajas de GC descrito en estudios anteriores4. Los EA más frecuentes que encontraron fueron alteraciones psicológicas leves o del comportamiento, seguidos de problemas gastrointestinales menores, como dispepsia.
En el seguimiento a 11 años del estudio COBRA8, los principales EA que se atribuyeron al uso de GC fueron la hipertensión, la hiperglucemia y las cataratas (p=0,02). Sin embargo, en el grupo tratado con GC, fueron menos frecuentes la hipercolesterolemia, el cáncer y las infecciones. Además, los pacientes tratados con GC no presentaron una mayor incidencia de problemas cardiovasculares u osteoporosis. De hecho, el tratamiento de la enfermedad, al reducir la actividad inflamatoria, podría revertir la alteración del perfil lipídico, actuando como cardioprotector28.
En otro metaanálisis publicado en 200929, se encontró también un balance favorable entre el beneficio esperado y el riesgo de EA asociado al uso de dosis bajas GC a largo plazo —más de un año— en AR. Las mismas conclusiones pueden extraerse del estudio BeST tras 5 años de seguimiento12, en el que no se evidenció que comenzar con una terapia combinada con GC aumentara el riesgo de toxicidad a largo plazo, siendo la mortalidad y los EA similares en todos los grupos de tratamiento.
El ensayo CAMERA II26 encontró incluso efectos beneficiosos en el grupo MTX+GC, con menos náuseas y menor alteración del perfil hepático. Sin embargo, encontraron mayor ganancia de peso y mayores niveles de glucemia tras los 2 años de tratamiento atribuibles al uso de GC. Un ligero aumento de peso es habitual, incluso con dosis bajas de GC, pero suele ser reversible tras la suspensión del tratamiento8,17,18,20.
Otra de las grandes inquietudes respecto al uso crónico de GC es el aumento de la susceptibilidad a infecciones. El riesgo de infección aumenta con la dosis y la duración del tratamiento y es discreto en pacientes que usan dosis bajas, aunque la dosis acumulada sea elevada30. En un metaanálisis31 de 71 estudios, que incluía a 2.111 pacientes con diferentes afecciones y diferentes dosis de GC, se observó que el riesgo relativo de infección era de 2. Sin embargo, en los 5 estudios que incluían a pacientes tratados con GC indicados por enfermedades reumáticas no se encontró un riesgo de infección significativamente elevado, así como tampoco en el subgrupo de pacientes tratados con dosis inferiores a 20mg al día de prednisona, independientemente del proceso por el que se indicaba el GC.
Sin embargo, Dixon et al.32 encontraron, mediante un modelo en el que se usó la dosis acumulada de GC, que haber consumido GC en el pasado en una población con AR de más de 65 años también aumentaba el riesgo de infecciones a los 2-3 años tras su suspensión, si bien el riesgo era mucho mayor si el consumo de GC era actual o en los 6 meses previos. De 16.207 pacientes, 1.947 desarrollaron una infección grave en un seguimiento de 3,8 años. Los autores calcularon que un uso actual de 5mg diarios de prednisolona de forma continuada confería un aumento del riesgo de infección grave de un 30, un 46 y un 100% al tercer mes, sexto mes y tercer año, respectivamente. Obviamente, no es posible descartar un sesgo de indicación, al prescribirse los GC a pacientes con una AR con mayor actividad inflamatoria a pesar del tratamiento convencional, dado que la actividad inflamatoria de la AR también se ha implicado como un factor favorecedor del desarrollo de infecciones.
Diversos estudios sobre la aparición de fracturas en la osteoporosis corticoidea han sugerido que dicho riesgo viene determinado por varios factores, como la densidad mineral ósea (DMO) antes y después del tratamiento, la dosis de GC, la duración del tratamiento, la enfermedad subyacente, el riesgo de caídas y, por último, la resistencia ósea, ya que se ha observado que los pacientes que reciben GC tienen fracturas con valores más elevados de DMO33-36. De todos estos factores, los más contrastados son la dosis y la duración del tratamiento, aunque no se ha logrado llegar a un consenso sobre la dosis que podría considerarse segura. A un subgrupo de 24 pacientes incluidos en el estudio de Kirwan4, se les realizó una DMO anual de columna lumbar y cuello femoral. Aunque el grupo prednisolona perdió más masa ósea en la columna lumbar durante el primer año de tratamiento, esta diferencia con el grupo placebo se compensó durante el segundo año y al final del mismo no había diferencias significativas37. En esta misma línea, en una revisión38 de Verhoeven y Boers se concluyó que la pérdida de masa ósea ocurría precozmente en el curso del tratamiento con dosis bajas de GC pero se estabilizaba con el tiempo en pacientes que recibían tratamiento prolongado e incluso se revertía al suspender el tratamiento. Estos hallazgos sugieren que el efecto perjudicial inicial de los GC sobre el remodelado óseo se vería compensado por la importante reducción en la carga inflamatoria, llegando incluso a proteger el hueso21,30. Es necesario tener en cuenta que la actividad de la AR conlleva una reducción en la actividad física y una considerable elevación de citocinas inflamatorias que estimularían la diferenciación de los osteoclastos. Por ello, la disminución en la carga inflamatoria reduciría la pérdida de masa ósea30,33.
La hiperglucemia puede aparecer con relativa rapidez tras el inicio de tratamiento con GC. Con dosis diarias inferiores a 8mg de prednisona, el riesgo de hiperglucemia se sitúa en 1,77 (IC del 95%, 1,54-2,02) y aumenta paralelamente a la dosis de GC usada, llegando a ser de 10,34 (IC del 95%, 3,16-33,90) para dosis superiores a 25mg de prednisona diarios39. Los pacientes que previamente tienen factores de riesgo para el desarrollo de diabetes mellitus, como obesidad o antecedentes familiares, tienen a su vez un mayor riesgo de presentar hiperglucemia durante el tratamiento con GC28. Afortunadamente, la aparición de una diabetes mellitus franca con dosis bajas de GC es muy rara33.
Los efectos secundarios de los GC a dosis bajas documentados por los diferentes estudios son mucho menos frecuentes que los observados con dosis elevadas de GC. Si además se tiene en cuenta el sesgo de indicación, es bastante probable que las complicaciones directamente relacionadas con el uso de GC a dosis bajas sean incluso menos frecuentes. Es necesario resaltar que los pacientes con enfermedad más grave y con más comorbilidades tienen una mayor probabilidad de recibir tratamiento con GC que los pacientes con AR bien controlada, por lo que la atribución de determinados acontecimientos adversos al uso de GC en los estudios observacionales no aleatorizados es cuestionable desde un punto de vista metodológico.
ConclusionesExiste evidencia sólida, generada en ensayos clínicos de alta calidad metodológica, de que los GC a dosis bajas poseen un efecto modificador del daño estructural en la AR de corta evolución. Esto es debido probablemente a que los GC inhiben la producción de citocinas inducidas por el receptor del factor-κβ ligando, que activan los osteoclastos.
No existen estudios que hayan evaluado si el efecto protector se sigue manteniendo a partir de los 2 años de uso continuado. No obstante, hay evidencia de que la mejoría producida en la AR temprana mejora el pronóstico tras 10 años de seguimiento. La recomendación sería interrumpirlos a los 2 años40. Por otra parte, los GC también han demostrado eficacia como terapia puente40.
Nuestra recomendación es empezar tratamiento de forma temprana con una pauta ascendente de MTX más GC a dosis bajas durante los 2 primeros años de la enfermedad, como así postulan las últimas guías EULAR41 en el tratamiento de la AR. La toxicidad no ha demostrado ser más elevada que la de otros FAME y su uso a dosis bajas durante los 2 primeros años de la enfermedad parece razonablemente seguro, en parte debido a los beneficios que provoca el lograr el control de la actividad inflamatoria sobre el metabolismo óseo y lipídico. Por tanto, los GC deberían posicionarse, junto al MTX adecuadamente escalado, como piedra angular en el tratamiento de la AR de reciente comienzo, atendiendo al aval de una evidencia científica firme, numerosa y de calidad. No se conocen con precisión las dosis óptimas, las pautas de descenso y el momento de la administración, así como de la eficacia de su utilización a largo plazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.