Investigar si existe asociación del polimorfismo rs20541 (R130Q) del gen de la IL-13 con la susceptibilidad y la expresión clínica de pacientes con enfermedades inflamatorias crónicas asociadas al envejecimiento.
Material y métodosSe estudiaron 78 pacientes con arteritis de células gigantes (ACG), 174 con polimialgia reumática (PMR), 90 con artritis reumatoide de comienzo en el anciano (EORA), y 465 controles sanos de la misma zona geográfica. El polimorfismo rs20541 (R130Q) para IL-13 se evaluó mediante PCR-RFLP. Los niveles de IL-13 circulante se determinaron por ELISA.
ResultadosEn los pacientes con ACG se observó una mayor frecuencia del genotipo AA [2,349 (0,994-5,554)], así como del alelo A [1,589 (1,085-2,328)] y de portadores de dicho alelo [1,656 (1,021-2,686)] (p<0,05). No encontramos diferencias significativas entre los pacientes con PMR y EORA respecto al grupo control. Cuando comparamos las diferentes patologías entre sí, tampoco encontramos diferencias significativas entre ellas. En los pacientes con ACG las diferencias en el genotipo se asociaron con el pronóstico de la enfermedad. En pacientes con PMR, el genotipo AA se asoció con niveles más elevados de IL-13 circulante comparado con el GA. Sin embargo, esta asociación no se apreció para los controles o las otras enfermedades.
ConclusionesLa ACG es más frecuente en individuos portadores del polimorfismo rs20541 (R130Q) del gen de la IL13. La utilidad de este gen para predecir el pronóstico en ACG debe ser confirmada en estudios con mayor número de pacientes.
To investigate whether there is association between the rs20541 (R130Q) polymorphism in the IL-13 gene with disease susceptibility and clinical subsets in patients with elderly-associated inflammatory chronic diseases.
Material and methods78 patients with giant cell arteritis (GCA), 174 with polymyalgia rheumatica (PMR), 90 elderly-onset rheumatoid arthritis (EORA), and 465 healthy controls from the same geographic area were studied. The rs20541 (R130Q) polymorphism in the IL-13 gene was evaluated by PCR-RFLP. Circulating levels of IL-13 were measured by ELISA.
ResultsA higher frequency of the AA genotype [2.349 (0.994-5.554)], as well as the allele A [1.589 (1.085-2.328] and the A carriers [1.656 (1.021-2.686)] (p<0.05) was observed in the GCA patients. No significant differences were observed in the PMR and EORA patients as compared with the healthy controls. Neither difference was observed among the different disease groups studied. In GCA patients, differences in the genotype were associated with a worse prognosis. In PMR patients, the AA genotype was associated with higher levels of serum IL-13 than the GA one. However, such an association was not detected for controls and the other disease groups.
ConclusionsGCA is more frequent in carriers of the rs20541 (R130Q) polymorphism in the IL-13 gene. The utility of this polymorphism to predict the GCA prognosis must be confirmed in studies with a higher number of patients.
El proceso de envejecimiento se acompaña de cambios cualitativos y cuantitativos en el sistema inmune, que se agrupan bajo el término de inmunosenescencia1. Como consecuencia de ello, los ancianos muestran un aumento en la susceptibilidad a padecer neoplasias, infecciones y enfermedades autoinmunes2. En este sentido, el envejecimiento se acompaña de la aparición de algunas enfermedades asociadas a la edad, y uno de los mejores ejemplos es la arteritis de células gigantes (ACG), una vasculitis sistémica granulomatosa con preferencia por arterias de mediano y gran vaso3. Las manifestaciones clínicas de la ACG varían desde síntomas craneales clásicos, hasta el síndrome del arco aórtico o manifestaciones menos específicas tales como fiebre, pérdida de peso o síndrome polimiálgico4–7. La polimialgia reumática (PMR) es un síndrome caracterizado por dolor y rigidez en cuello, cintura escapular y pélvica que también afecta solo a individuos de edad avanzada8. Aunque la PMR ocurre normalmente en ausencia de ACG, algunos pacientes pueden también desarrollar arteritis en el transcurso de la enfermedad9. Por otro lado, se ha sugerido que la PMR y la artritis reumatoide de inicio en el anciano (EORA), especialmente la forma seronegativa, tienen mucho en común10.
El perfil de citocinas derivadas de células T en este tipo de patologías inflamatorias asociadas al envejecimiento sugiere que se trata de enfermedades fundamentalmente dirigidas o mediadas por una respuesta Th1. Esto puede deberse a un aumento en la expresión de citocinas Th1, como es el caso del IFN-γ el cual desempeña un papel crucial en el desarrollo de la ACG11, o bien a un defecto en la regulación activa por parte de citocinas Th2.
En los últimos años se han realizado numerosos estudios de polimorfismos de genes de citocinas en PMR y ACG12. Sin embargo, estos estudios se han centrado en citocinas pro-inflamatorias y Th1 más que en citocinas Th2. La respuesta inmune Th2 se caracteriza por la expresión de IL-4, IL-5, IL-9 e IL-13. Teóricamente un descenso en la actividad de estas citocinas Th2 podría acompañarse de mayor gravedad en estas enfermedades mientras que una actividad Th2 aumentada podría asociarse con un cuadro clínico más leve. Existe solo un estudio previo llevado a cabo por Amoli et al.13 en el cual se observa una asociación ligeramente significativa entre ACG y algunos polimorfismos genéticos de un solo nucleótido (SNPs) de IL-4.
La IL-13 es una proteína inmunorreguladora producida principalmente por las células Th2 activadas14 y está implicada en la maduración y diferenciación de células B. Promueve la expresión de CD23 y moléculas de histocompatibilidad de clase ii15 así como el cambio de isotipo a IgE en las células B16. Asimismo, IL-13 disminuye la actividad de los macrófagos, inhibiendo por tanto la producción de citocinas pro-inflamatorias tales como IL-1β, IL-6 y TNF-α entre otras. Recientemente se han identificado numerosos polimorfismos en el gen de IL-13 y se han asociado con niveles de IgE y/o enfermedades alérgicas17. Uno de los SNPs se localiza en el exón 4 en la posición 2044 (cambio de G por A, llamado G2044A) y causa un cambio de aminoácido (arginina por glutamina en el codón 130, denominado R130Q), lo que posiblemente afecta a la interacción ligando-receptor18,19.
El objetivo de este estudio fue investigar la asociación entre el polimorfismo R130Q del gen de la IL-13 y la susceptibilidad en ACG y otras 2 enfermedades inflamatorias asociadas a la edad como son la PMR y la EORA.
Pacientes y métodosPacientesEl presente estudio incluyó 78 pacientes con ACG, 174 pacientes con PMR y 90 pacientes con EORA (tabla 1). Como grupo control se incluyeron 465 individuos sanos reclutados en la misma región que no presentaban evidencia alguna de las enfermedades antes mencionadas. Tanto pacientes como controles eran de origen caucásico, de ancestros españoles y residentes en la misma área geográfica del norte de España, Cantabria. La obtención de muestras y los estudios se realizaron tras la obtención de un consentimiento informado escrito, y el estudio fue aprobado por el Comité de Ética regional.
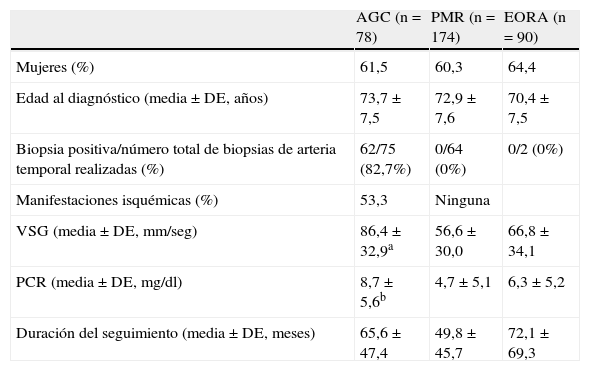
Características demográficas, clínicas y de laboratorio en los pacientes con arteritis de células gigantes (ACG), polimialgia reumática (PMR), y artritis reumatoide de inicio en el anciano (EORA) incluidos en el estudio
| AGC (n=78) | PMR (n=174) | EORA (n=90) | |
| Mujeres (%) | 61,5 | 60,3 | 64,4 |
| Edad al diagnóstico (media±DE, años) | 73,7±7,5 | 72,9±7,6 | 70,4±7,5 |
| Biopsia positiva/número total de biopsias de arteria temporal realizadas (%) | 62/75 (82,7%) | 0/64 (0%) | 0/2 (0%) |
| Manifestaciones isquémicas (%) | 53,3 | Ninguna | |
| VSG (media±DE,mm/seg) | 86,4±32,9a | 56,6±30,0 | 66,8±34,1 |
| PCR (media±DE,mg/dl) | 8,7±5,6b | 4,7±5,1 | 6,3±5,2 |
| Duración del seguimiento (media±DE, meses) | 65,6±47,4 | 49,8±45,7 | 72,1±69,3 |
DE: desviación estándar; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
aACG vs PMR: p≤0,001 tanto para VSG como PCR.
bACG vs EORA: p=0,004 para VSG y p=0,021 para PCR.
Todos los pacientes con ACG cumplían los criterios de clasificación del American College of Rheumatology de 1990 para la ACG20. Como se muestra en la tabla 1, el 82,7% de los pacientes con ACG presentaban evidencia histológica característica en las biopsias de la arteria temporal21. Los pacientes con PMR se diagnosticaron de acuerdo a los criterios propuestos por Chuang et al.8. También se incluyeron en el estudio pacientes con PMR con VSG<40mm/1 h pero que cumplían los otros criterios clínicos22. Los pacientes con artritis reumatoide (AR) debían satisfacer los criterios clínicos para AR revisados por la ACR en 198723. Los pacientes con AR se consideraron de inicio en el anciano si los síntomas de la enfermedad comenzaban a partir de la edad de 60 años24. Un tercio de los pacientes con EORA eran factor reumatoide (FR) positivo (280,3±509,7 IU/ml) y el 25% eran positivos para los anticuerpos anti-péptidos cíclicos citrulinados (APCC) (1.012±623 U/ml).
En la PMR y la ACG las características clínicas al diagnóstico y durante el seguimiento, los valores de PCR y VSG al diagnóstico, así como la dosis inicial de prednisona, se recogieron de forma protocolizada mediante la revisión de las historias clínicas de los pacientes. Los pacientes se agruparon de acuerdo a la presencia o ausencia de síndrome polimiálgico, y a la presencia o ausencia de manifestaciones isquémicas. Las manifestaciones isquémicas se definieron como la presencia de pérdida visual, claudicación mandibular, accidentes cerebrovasculares y/o síndromes del arco aórtico4,7. En los pacientes con más de 2 años de seguimiento se incluyó el análisis de algunas variables como recidivas, duración del tratamiento con corticosteroides (CS), y dosis acumulada de prednisona5,8,25. En los pacientes con ACG y PMR evaluamos la gravedad de la enfermedad en términos de presencia de recidivas y/o recurrencias, la duración del tratamiento con corticoides y la dosis acumulada de los mismos. En pacientes con EORA no se evaluó la gravedad de la enfermedad de forma sistemática.
Al diagnóstico los pacientes con PMR aislada recibieron una dosis inicial de prednisona de 10mg/día (5mg/12h). Los pacientes con ACG recibieron una dosis inicial de prednisona entre 40-60mg/día. Aquellos con complicaciones isquémicas también recibieron 3 pulsos i.v. de 1g de metil-prednisolona/día. La reducción en el tratamiento con CS fue individualizada y según juicio médico.
Genotipaje del polimorfismo R130Q del gen de la IL-13El ADN genómico de los individuos estudiados se extrajo a partir de sangre usando un kit de purificación para ADN (GENTRA, GENERATION® DNA Purification kits; MN; EE. UU.). El polimorfismo de IL13 rs20541 (R130Q)18 se determinó mediante la amplificación del gen usando 2 cebadores: Sentido 5’-CTTCCGTGAGGACTGAATGAGACGGTC-3’ y antisentido 5′- GCAAATAATGATGCTTTCGAAGTTTCAGTGGA-3’. Las condiciones de amplificación fueron 4min a 94°C, 1min a 69°C y 2min a 72°C, y después se sometieron a 35 ciclos de 30s a 94°C, 45s a 67°C y 30s y 72°C, 5min para la extensión a 72°C. Los productos de la PCR se digirieron mediante la adición de 0,25 U NlaIV e incubación a 37°C durante 3,30h. El tamaño de los fragmentos esperados tras la digestión en el genotipo normal fue de 210 pares de bases (pb) y 26 pb, mientras que el alelo mutante se determinó por la presencia de 3 bandas de 178, 32 y 26 pb.
Cuantificación de IL-13 en sueroLa determinación de la concentración de IL-13 en suero se realizó mediante ELISA. El suero se recogió y se almacenó a −80°C hasta su posterior análisis. Los niveles séricos de IL-13 se determinaron mediante el kit de ELISA Pelikine Compact Human IL-13 (Sanquin, Ámsterdam, Holanda). El límite de detección fue de 3pg/ml.
Análisis estadísticoEl análisis estadístico de los datos se llevó a cabo usando el software SPSS 15,0 (Chicago, IL, EE. UU.). La asociación entre PMR, ACG o EORA y los alelos o genotipos del gen de IL-13 se estimó usando odd ratios (OR) e intervalos de confianza al 95% (IC). Las frecuencias de los alelos y genotipos se compararon con el test de Chi cuadrado. Para evaluar las diferencias entre grupos en el caso de variables numéricas, se emplearon los test de Mann-Whitney y el de Kruskal-Wallis según estuviese indicado. Las diferencias se consideraron significativas cuando el valor de p fue<0,05.
ResultadosCaracterísticas demográficas y clínicasLas principales características demográficas, clínicas y de laboratorio de las diferentes poblaciones a estudio se muestran en la tabla 1. La mayoría de los pacientes con ACG tenían una biopsia de la arteria temporal positiva. En la mitad de los pacientes con ACG se observaron complicaciones isquémicas. Además, los pacientes con ACG tenían niveles más elevados de VSG y PCR comparado con aquellos pacientes con PMR y EORA. No encontramos diferencias estadísticamente significativas de VSG y PCR entre PMR y EORA.
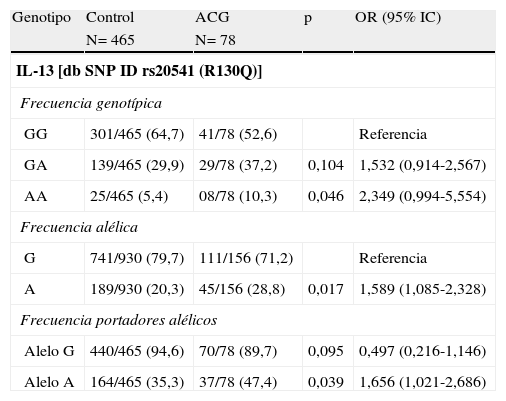
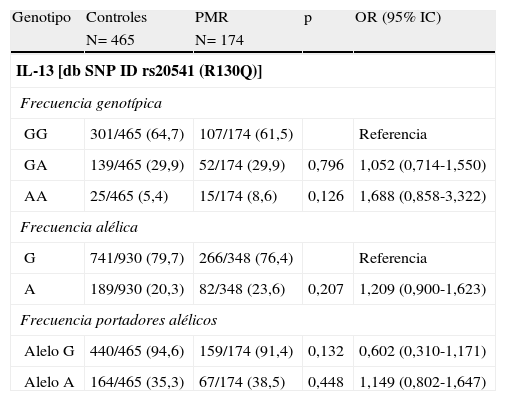
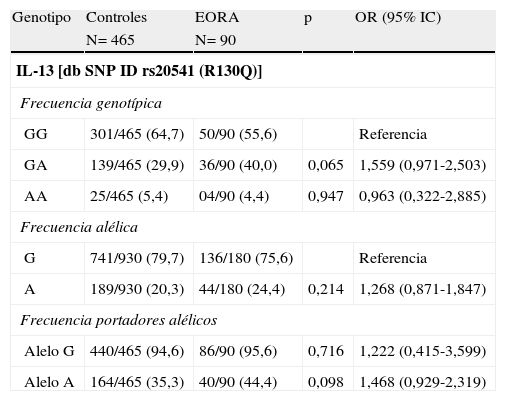
El polimorfismo R130Q del gen de la IL-13 se asocia a la susceptibilidad a padecer arteritis de células gigantesLas distribuciones alélicas de las poblaciones a estudio se hallaban en equilibrio de Hardy–Weinberg, excepto para los pacientes con PMR (p=0,025). Las distribuciones alélicas y genotípicas del polimorfismo R130Q del gen de la IL-13 en los distintos grupos de pacientes comparado con los controles se muestran en las tablas 2–4. En los pacientes con ACG comparado con el grupo control se observó una mayor frecuencia del genotipo AA, así como del alelo A y de ser portador de dicho alelo (tabla 2). No se observaron diferencias significativas en la distribución del polimorfismo R130Q del gen de la IL-13 entre los pacientes con PMR o EORA y los controles sanos (tablas 3 y 4). Cuando comparamos las diferentes patologías entre sí, no encontramos ninguna diferencia significativa entre ellas (tablas suplementarias 1, 2 y 3). Cuando se analizaron las 3 patologías asociadas al envejecimiento de forma conjunta (tabla suplementaria 4) observamos una tendencia similar a la observada en los pacientes con ACG.
Frecuencias alélicas y genotípicas del polimorfismo del gen de IL-13 rs20541 (R130Q) en pacientes con arteritis de células gigantes (ACG) comparado con controles sanos
| Genotipo | Control | ACG | p | OR (95% IC) |
| N= 465 | N= 78 | |||
| IL-13 [db SNP ID rs20541 (R130Q)] | ||||
| Frecuencia genotípica | ||||
| GG | 301/465 (64,7) | 41/78 (52,6) | Referencia | |
| GA | 139/465 (29,9) | 29/78 (37,2) | 0,104 | 1,532 (0,914-2,567) |
| AA | 25/465 (5,4) | 08/78 (10,3) | 0,046 | 2,349 (0,994-5,554) |
| Frecuencia alélica | ||||
| G | 741/930 (79,7) | 111/156 (71,2) | Referencia | |
| A | 189/930 (20,3) | 45/156 (28,8) | 0,017 | 1,589 (1,085-2,328) |
| Frecuencia portadores alélicos | ||||
| Alelo G | 440/465 (94,6) | 70/78 (89,7) | 0,095 | 0,497 (0,216-1,146) |
| Alelo A | 164/465 (35,3) | 37/78 (47,4) | 0,039 | 1,656 (1,021-2,686) |
Frecuencias alélicas y genotípicas del polimorfismo del gen de IL-13 rs20541 (R130Q) en pacientes con polimialgia reumática (PMR) comparado con controles sanos
| Genotipo | Controles | PMR | p | OR (95% IC) |
| N= 465 | N= 174 | |||
| IL-13 [db SNP ID rs20541 (R130Q)] | ||||
| Frecuencia genotípica | ||||
| GG | 301/465 (64,7) | 107/174 (61,5) | Referencia | |
| GA | 139/465 (29,9) | 52/174 (29,9) | 0,796 | 1,052 (0,714-1,550) |
| AA | 25/465 (5,4) | 15/174 (8,6) | 0,126 | 1,688 (0,858-3,322) |
| Frecuencia alélica | ||||
| G | 741/930 (79,7) | 266/348 (76,4) | Referencia | |
| A | 189/930 (20,3) | 82/348 (23,6) | 0,207 | 1,209 (0,900-1,623) |
| Frecuencia portadores alélicos | ||||
| Alelo G | 440/465 (94,6) | 159/174 (91,4) | 0,132 | 0,602 (0,310-1,171) |
| Alelo A | 164/465 (35,3) | 67/174 (38,5) | 0,448 | 1,149 (0,802-1,647) |
Frecuencias alélicas y genotípicas del polimorfismo del gen de IL-13 rs20541 (R130Q) en pacientes con artritis reumatoide de inicio en el anciano (EORA) comparado con controles sanos
| Genotipo | Controles | EORA | p | OR (95% IC) |
| N= 465 | N= 90 | |||
| IL-13 [db SNP ID rs20541 (R130Q)] | ||||
| Frecuencia genotípica | ||||
| GG | 301/465 (64,7) | 50/90 (55,6) | Referencia | |
| GA | 139/465 (29,9) | 36/90 (40,0) | 0,065 | 1,559 (0,971-2,503) |
| AA | 25/465 (5,4) | 04/90 (4,4) | 0,947 | 0,963 (0,322-2,885) |
| Frecuencia alélica | ||||
| G | 741/930 (79,7) | 136/180 (75,6) | Referencia | |
| A | 189/930 (20,3) | 44/180 (24,4) | 0,214 | 1,268 (0,871-1,847) |
| Frecuencia portadores alélicos | ||||
| Alelo G | 440/465 (94,6) | 86/90 (95,6) | 0,716 | 1,222 (0,415-3,599) |
| Alelo A | 164/465 (35,3) | 40/90 (44,4) | 0,098 | 1,468 (0,929-2,319) |
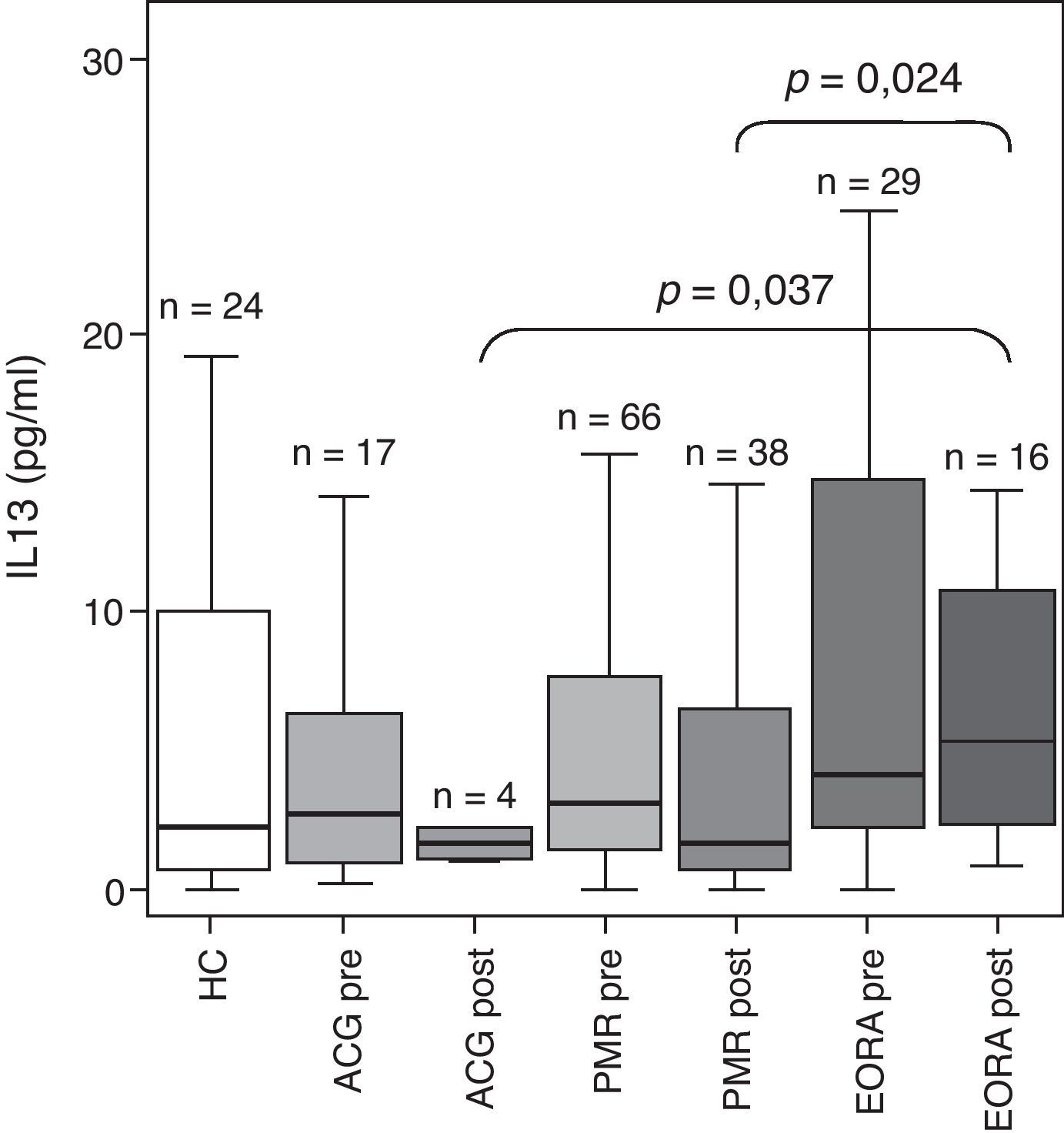
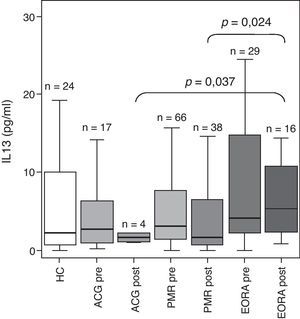
Dado que el estudio se centra en el análisis de un polimorfismo en el gen de la IL-13 analizamos las diferencias existentes en los niveles de IL-13 en el suero de los pacientes incluidos en el estudio (fig. 1). Los datos reflejan un aumento no significativo de la concentración de IL-13 sérica en pacientes con EORA activa respecto a los controles sanos en límite de la significación estadística (p=0,066) y a los pacientes con ACG y PMR activos. Tras el tratamiento esteroideo, los niveles disminuían en los 3 grupos de pacientes aunque en el grupo de EORA los niveles postratamiento se mantuvieron significativamente más elevados que en el de ACG y PMR (ACG post vs EORA post p=0,037 y PMR post vs EORA post p=0,024).
Concentración sérica de IL-13 en pacientes con arteritis de células gigantes (ACG), polimialgia reumática (PMR) y artritis reumatoide de inicio en el anciano (EORA) en comparación con sujetos controles sanos pareados para edad y sexo (HC). Los resultados se presentan como boxplots con mediana y rango intercuartílico en cada grupo. Se representan los datos obtenidos en pacientes en fase activa de la enfermedad (pre) y en remisión tras tratamiento esteroideo (post). Se indica el número de sujetos en cada grupo y la significación estadística solo cuando la p fue menor de 0,05.
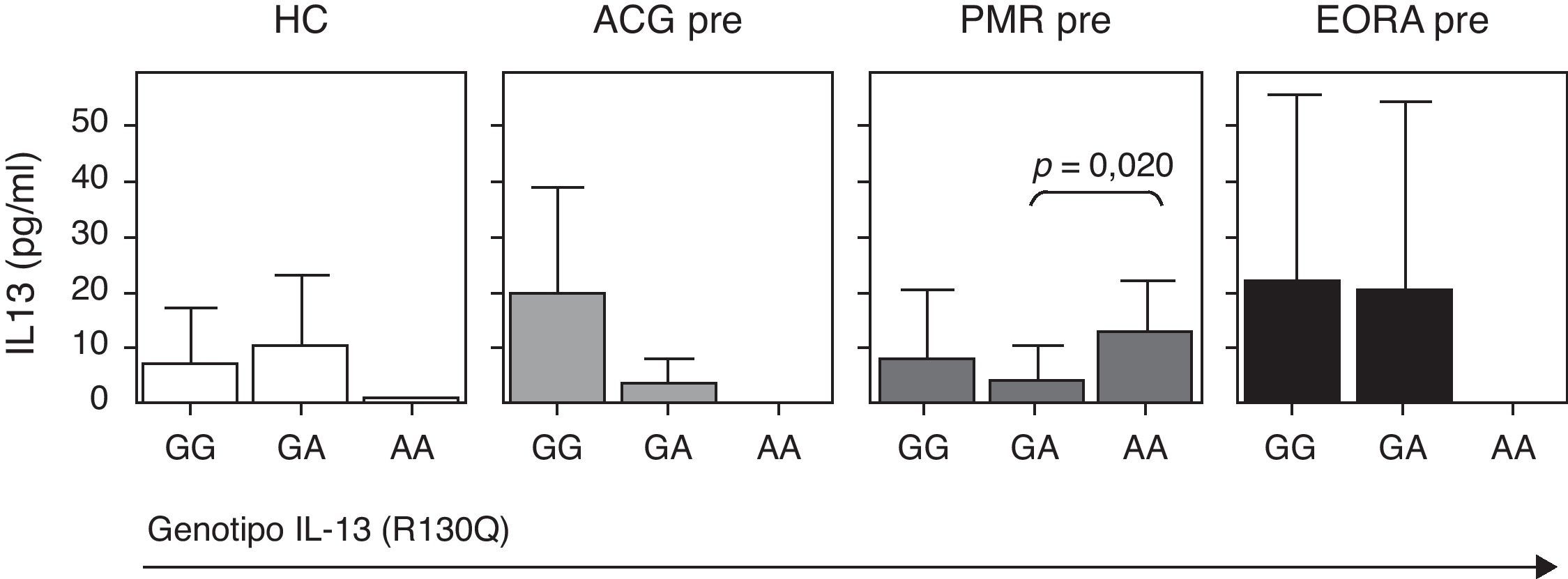
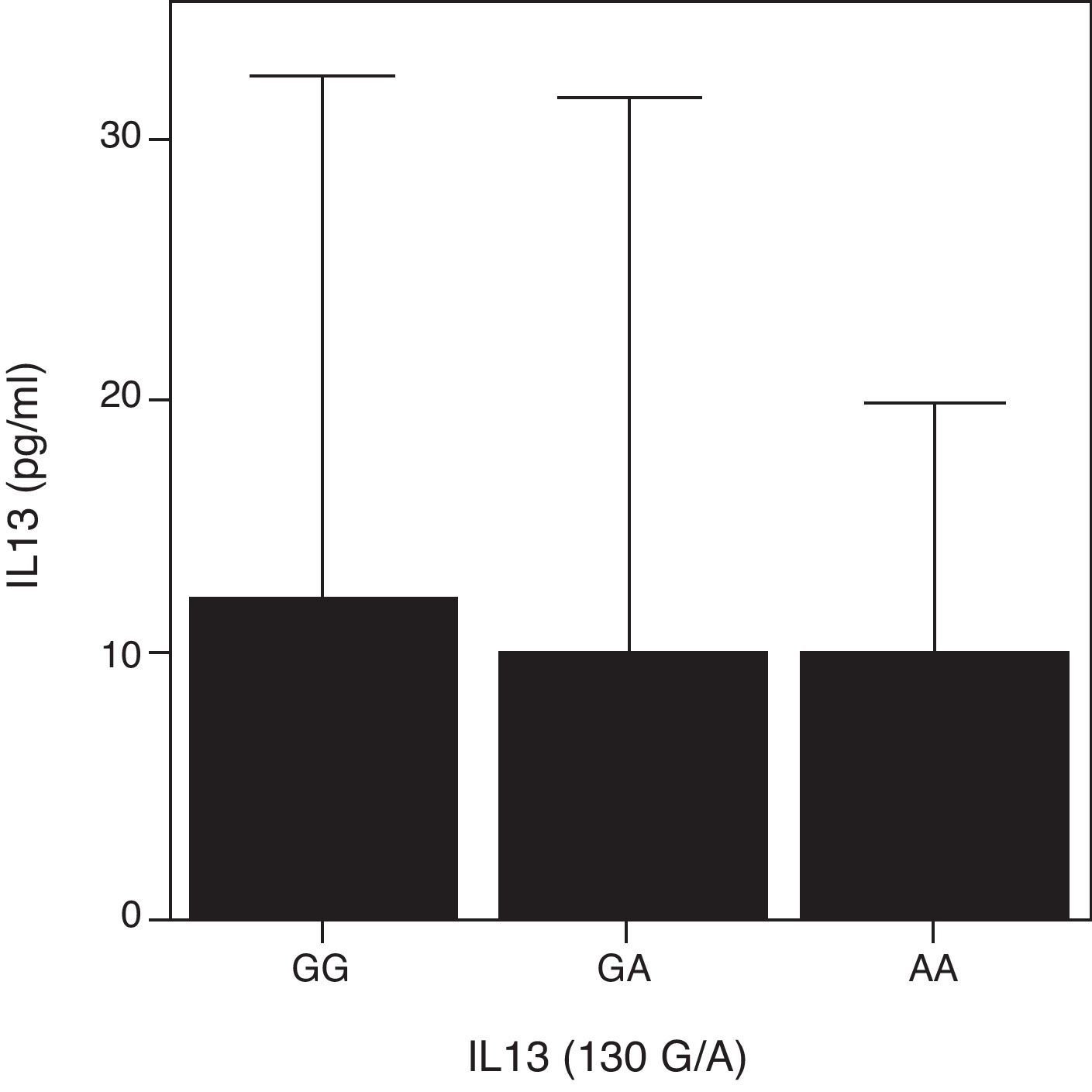
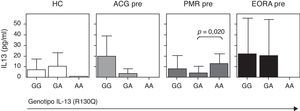
Puesto que el polimorfismo R130Q induce un cambio de aminoácido funcional, quisimos analizar la repercusión que dicho polimorfismo tenía en la concentración sérica de IL-13 en los distintos grupos de pacientes. Dado que el polimorfismo R130Q fue muy poco frecuente, los datos no fueron significativos, aunque se observó una tendencia a tener niveles más disminuidos de IL-13 sérica en los sujetos sanos AA comparado con los GA y GG. Esta misma tendencia se observó también en los pacientes con ACG y EORA. En cambio, los pacientes con PMR y portadores del genotipo AA mostraron niveles más elevados de IL-13 circulante (fig. 2). Cuando analizamos los 3 grupos de pacientes de forma conjunta no observamos diferencias significativas en los niveles de IL-13 circulante para los distintos genotipos (fig. 4).
Concentración sérica de IL-13 en función del SNP R130Q en el gen de la IL-13. Los datos se representan por separado en pacientes con enfermedad activa de arteritis de células gigantes (ACG; N=15), polimialgia reumática (PMR; N=71) y artritis reumatoide de inicio en el anciano (EORA; N=28) y sujetos controles sanos pareados para edad y sexo (HC; N=21).
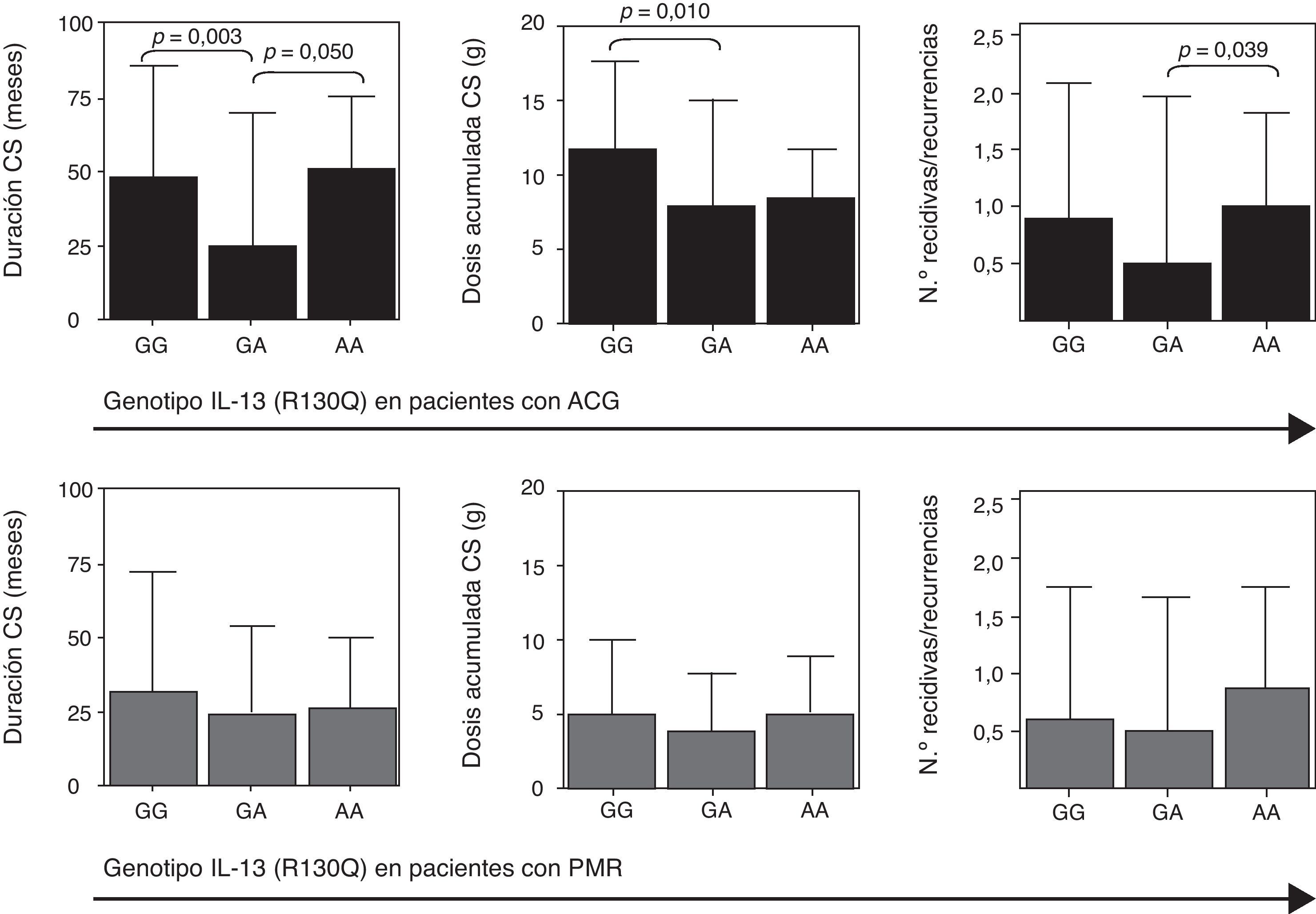
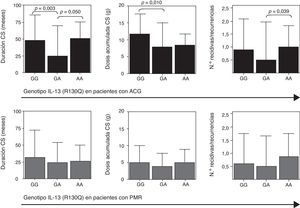
Duración en meses del tratamiento con corticoides (CS, izquierda), dosis acumulada de CS (medio) y número de recidivas y recurrencias (derecha) en función del SNP R130Q en el gen de la IL-13. Los datos se representan por separado en pacientes con enfermedad activa de arteritis de células gigantes (ACG, n=55; panel superior) y polimialgia reumática (PMR, n=120; panel inferior).
Concentración sérica de IL-13 en función del SNP R130Q en el gen de la IL-13. Los datos se representan de forma conjunta para los pacientes con enfermedad activa de las tres patologías incluidas en el estudio (N.° total=114: arteritis de células gigantes [ACG; N = 15], polimialgia reumática [PMR; N =71] y artritis reumatoide de inicio en el anciano [EORA; N = 28]).
Para evaluar la posible influencia tanto del genotipo del polimorfismo de IL-13 estudiado como de los niveles circulantes de IL-13 en los distintos subgrupos clínicos, analizamos los pacientes con ACG de acuerdo a la presencia o ausencia de manifestaciones isquémicas o síndrome polimiálgico, los pacientes con PMR de acuerdo a los niveles de VSG («baja» o menor de 40mm/1.a h y «clásica» o mayor de 40mm/1.a h), y los pacientes con EORA se subdividieron según su forma de inicio en inicio polimiálgico o clásico. Aunque no dispusimos de información detallada sobre la actividad y el pronóstico de los pacientes con EORA, se analizó también la posible influencia del genotipo en la presencia de autoanticuerpos típicos (FR y APCC) y su título. No encontramos ninguna asociación significativa entre el genotipo o los niveles circulantes de IL-13 con ninguna de las variables antes mencionadas.
En los pacientes con ACG y PMR evaluamos el pronóstico de la enfermedad analizando en aquellos pacientes con más de 2 años de seguimiento la presencia de recidivas y/o recurrencias, la duración del tratamiento con corticoides y la dosis acumulada de los mismos. Como se muestra en la figura 3 (panel superior), en los pacientes con ACG el genotipo GA se asoció con una menor duración del tratamiento con corticoides y una dosis acumulada más baja de los mismos, probablemente debido a una menor tasa de recidivas/recurrencias. No encontramos ninguna relación de estos factores pronósticos con los niveles circulantes de IL-13.
DiscusiónLa IL-13 es una proteína inmunorreguladora producida principalmente por las células Th2 activadas14 y está implicada en la maduración y diferenciación de células B15. Esta citocina se considera parte de la respuesta inmune Th2 y una hipótesis razonable es que el desequilibrio en el balance Th1/Th2 podría participar en la etiopatogenia de enfermedades crónicas relacionadas con la edad y que son el resultado de un desequilibrio en la regulación del sistema inmune. De acuerdo con esta hipótesis, una predisposición genética en la expresión de los genes codificantes para citocinas Th2 podría influir en la gravedad y/o susceptibilidad de estas 3 patologías. Existe solo un estudio previo llevado a cabo por Amoli et al.13 en el cual se observa una asociación ligeramente significativa entre ACG y algunos SNPs para IL-4. Sin embargo, estos resultados eran más significativos cuando se consideraban solo aquellos pacientes HLA-DRB1*04, sugiriendo una interacción entre HLA-DRB1 e IL-4 que contribuía a aumentar la susceptibilidad de la enfermedad13.
Por tanto, tomando en consideración la falta de estudios previos que estudian la influencia de genes de citocinas Th2 analizamos por primera vez la influencia del polimorfismo rs20541 (R130Q) en el gen que codifica para la IL-13 en estas patologías. Para ello, el presente estudio analizó el polimorfismo R130Q del gen de la IL-13 en una serie amplia de pacientes con enfermedades inflamatorias asociadas al envejecimiento.
Los datos muestran una asociación de este polimorfismo con la susceptibilidad a sufrir ACG. Aunque las diferencias encontradas en el presente trabajo solo son significativas para los pacientes con ACG, los pacientes con PMR muestran una tendencia similar. Sin embargo, la potencia estadística del estudio para las comparaciones en las frecuencias alélicas y genotípicas de los pacientes con PMR son bajas, oscilando entre el 12 y el 34%, por lo que los resultados obtenidos deben tomarse con cautela, y confirmarse en estudios que contengan un número más elevado de pacientes. Aunque en este estudio se observa una asociación significativa entre el polimorfismo analizado y la ACG no podemos excluir que otro polimorfismo dentro de este gen o de su receptor puedan asociarse a la susceptibilidad y/o gravedad de estas enfermedades. De hecho, el polimorfismo estudiado en el presente trabajo es el asociado de forma más clara con asma y atopia, sobre todo en niños. En cambio, en patología inflamatoria reumatológica se ha descrito la asociación de otros polimorfismos en el gen de la IL-13 distintos del rs20541 (R130Q), como el IL13 rs1800925 (IL13-1055) e IL13 rs2243204, los cuales no se han evaluado en el presente trabajo26–28.
Por otra parte, los SNPs pueden tener efectos biológicos diferentes dependiendo del tipo celular sobre el que actúa la citocina o bien del ambiente inflamatorio en el que desarrolla su efecto29. En este sentido, los estudios funcionales realizados en el SNP rs20541 (R130Q) han demostrado consecuencias funcionales en la actividad de transcripción, aumento de actividad o señalización a través de su proteína, o cambios en los niveles séricos de proteína en distintos tipos celulares30,31. Por lo tanto, en el presente trabajo no solo se investigó la posible asociación genética entre el polimorfismo R130Q y la susceptibilidad genética a padecer enfermedad, sino también su correlación con los niveles circulantes de IL-13. Se ha sugerido que los pacientes homocigotos para la mutación de este gen de la IL-13 presentan niveles aumentados de IL-13 circulante32. Parece ser que la presencia del genotipo AA se asocia con unos niveles disminuidos de IL-13 en suero tanto en los controles sanos como en los pacientes con ACG y EORA. Por el contrario, en PMR esta relación es la opuesta, encontrándose unos niveles de IL-13 circulantes más elevados con respecto a la población heterocigota, lo que se corresponde con lo publicado previamente32. En cualquier caso, estos datos deben tomarse con reserva dada la baja frecuencia de este genotipo y la ausencia de estudios similares.
Los niveles séricos y en líquido sinovial de IL-13 se han visto aumentados en pacientes con distintos tipos de artropatías, incluida la AR32,33. Además, los niveles séricos de IL-13 se han correlacionado con la presencia de autoanticuerpos, como el FR33. En nuestro estudio, a pesar de que no encontramos diferencias significativas con los controles sanos, los pacientes con EORA presentaban una tendencia a tener mayores niveles circulantes de IL-13, que se mantenía a pesar del tratamiento. Aunque no encontramos una correlación significativa entre los niveles de IL-13 circulante y los de autoanticuerpos característicos de la AR, nuestra serie difiere claramente de las antes mencionadas33 en cuanto a la población de estudio, solamente EORA, y por lo tanto en cuanto a la frecuencia de estos autoanticuerpos.
La asociación del genotipo GA con una menor tasa de recidivas/recurrencias, y, por lo tanto, con una menor duración y dosis acumulada de corticosteroides en los pacientes con ACG resulta de interés dada la ausencia actual de marcadores pronósticos para esta enfermedad, pero debe ser confirmada en series más amplias de pacientes.
En resumen, el polimorfismo rs20541 (R130Q) del gen de la IL13 se asocia con susceptibilidad a padecer ACG. La utilidad de este gen para predecir el pronóstico en ACG debe ser confirmada en estudios con mayor número de pacientes. Se necesitan más estudios genéticos de citocinas de Th2 que nos permitan aclarar esta cuestión.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo ha sido financiado por becas de la Fundación Marqués de Valdecilla-IFIMAV y Fondo de Investigación Sanitaria (PI050475 y PI080098). Lorena Álvarez-Rodríguez fue financiada por una beca de ayuda a la investigación de la Fundación Marqués de Valdecilla-IFIMAV. Iñaki Beares y Marta González (financiados por la Fundación Marqués de Valdecilla-IFIMAV) y Carolina Santa Cruz (financiada por una beca de ayuda a la investigación de Schering-Ploug, España).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Estamos especialmente agradecidos a Iñaki Beares y Marta González (financiados por la Fundación Marqués de Valdecilla-IFIMAV) y Carolina Santa Cruz (financiada por una beca de ayuda a la investigación de Schering-Ploug, España) por su ayuda técnica. Nos gustaría agradecer igualmente a los médicos del Servicio de Reumatología quienes han monitorizado a los pacientes, así como agradecer también a los pacientes y controles su participación en el estudio.




![Concentración sérica de IL-13 en función del SNP R130Q en el gen de la IL-13. Los datos se representan de forma conjunta para los pacientes con enfermedad activa de las tres patologías incluidas en el estudio (N.° total=114: arteritis de células gigantes [ACG; N = 15], polimialgia reumática [PMR; N =71] y artritis reumatoide de inicio en el anciano [EORA; N = 28]). Concentración sérica de IL-13 en función del SNP R130Q en el gen de la IL-13. Los datos se representan de forma conjunta para los pacientes con enfermedad activa de las tres patologías incluidas en el estudio (N.° total=114: arteritis de células gigantes [ACG; N = 15], polimialgia reumática [PMR; N =71] y artritis reumatoide de inicio en el anciano [EORA; N = 28]).](https://static.elsevier.es/multimedia/1699258X/0000000800000006/v1_201305061930/S1699258X12001325/v1_201305061930/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w937trqSwLGgTrQM2QjUSRyU=)


