Sr. Director: Se estima que entre el 0,5 y el 2% de las prótesis articulares sufrirá una infección1, especialmente a lo largo del primer año2,3. La incidencia de artritis sépticas sobre prótesis se sitúa alrededor de 40-68/105/año, tasa casi diez veces superior a la incidencia general de las artritis infecciosas3–5. En más de la mitad de los casos, las infecciones protésicas afectan a pacientes mayores de 70 años5, la mayoría con enfermedades crónicas subyacentes que, además de factores predisponentes, pueden enmascarar sus manifestaciones. En este sentido, las infecciones articulares en pacientes con artritis por microcristales resultan especialmente difíciles de reconocer, tanto por su escasa frecuencia como por la similitud de sus manifestaciones clínicas6–11.
Los estafilococos coagulasa negativos, en especial Staphylococcus epidermidis, son la principal causa de infección de implantes y de prótesis articulares12–14. No obstante, sólo se había descrito un caso de asociación de artritis por urato monosódico e infección por S. epidermidis sobre articulación nativa10, por lo que hemos considerado de interés presentar una paciente con gota secundaria a tiazidas que desarrolló una infección por S. epidermidis sobre una articulación protésica.
Mujer de 82 años que consultó por dolor, tumefacción e impotencia funcional en la rodilla izquierda (protésica). Los síntomas se habían iniciado 5 semanas antes durante un ingreso hospitalario y se acompañaron de febrícula vespertina (temperatura axilar de 37,4°C a 37,8°C). Entre sus antecedentes destacaban cirugía por síndrome del túnel carpiano derecho e hipertensión arterial (HTA), controlada durante más de 10 años con enalapril (20mg/día) e hidroclorotiazida (50mg/día). A lo largo de los últimos 5 años había presentado hiperuricemias entre 9,5 y 15mg/dl y, durante los 6 meses que precedieron a la consulta en nuestro servicio tuvo varias crisis de podagra bilateral y oligoartritis con afectación del tarso y el tobillo izquierdos. Dos años antes se le había implantado una prótesis de la rodilla izquierda por gonartrosis masiva.
Durante el trimestre previo a la consulta, había sido atendida en otro centro por artritis aguda aditiva de las primeras metatarsofalángicas, así como tarso y tobillo izquierdos. El estudio del líquido articular del tobillo izquierdo había permitido identificar cristales birrefringentes con elongación negativa compatibles con urato monosódico. Aunque la respuesta a diclofenaco (50mg/8h) fue excelente, con resolución del proceso inflamatorio articular en 5 días, desarrolló una insuficiencia cardíaca congestiva que obligó a su ingreso durante 13 días, período en el que sufrió varias tromboflebitis superficiales en los antebrazos y febrícula. En uno de los 3 hemocultivos y en un catéter intravenoso periférico se aisló S. epidermidis, pero no fue tratada con antibióticos. Durante las 4 semanas que siguieron al alta persistió la febrícula y se instauró una progresiva tumefacción e impotencia funcional en la rodilla izquierda (protésica), sin mejoría pese a reposo, paracetamol (1g/8h) y diclofenaco (75mg/24h).
En la exploración destacaba una temperatura axilar de 37,5°C, edemas con fóvea en ambas extremidades inferiores y derrame a tensión en la rodilla izquierda. Las restantes articulaciones periféricas estaban libres de sinovitis o derrame. La presión arterial era de 160/70mmHg. En la auscultación cardiopulmonar se apreciaba un soplo protomesosistólico eyectivo en el foco aórtico y disminución de la ventilación y las vibraciones vocales en ambas bases.
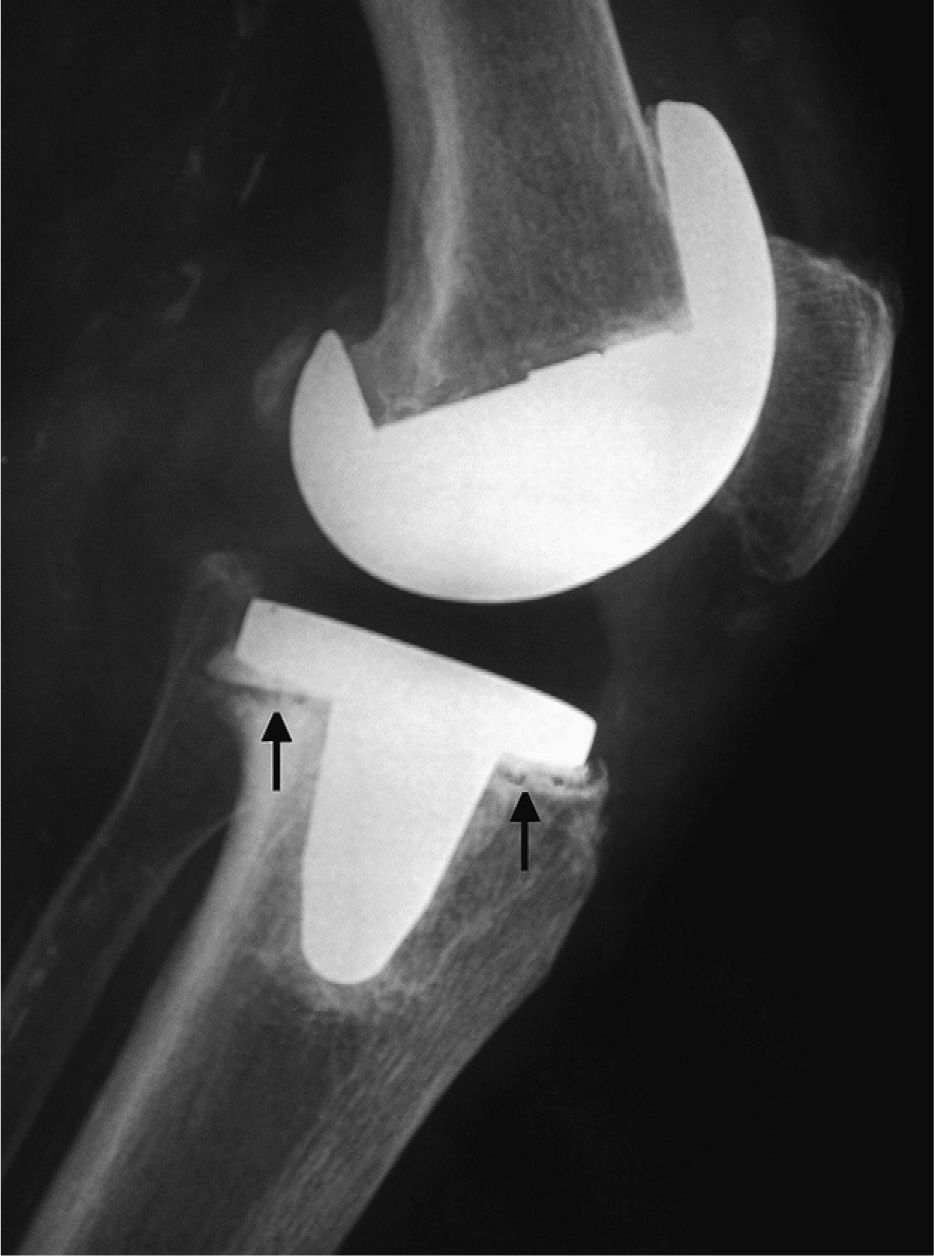
El hemograma mostró una anemia normocrómica normocítica con hemoglobina de 94g/l; 11,2 × 109 leucocitos/l con el 89% de polimorfonucleares neutrófilos. En los análisis destacaban: VSG (112mm/ primera hora), proteína C reactiva (61mg/l), urea (138mg/dl), creatinina (2,4mg/dl), ácido úrico (9,9mg/dl), albúmina (28g/l) y aclaramiento de creatinina (62ml/min). Los siguientes parámetros fueron normales o negativos: glucosa, colesterol total, triglicéridos, transaminasas, gammaglutamiltranspeptidasa, sodio, potasio, calcio, fósforo, lactatodeshidrogenasa, amilasa, fosfatasa alcalina, bilirrubina, proteínas totales, dosificación de inmunoglobulinas y complemento sérico (C3 y C4), factor reumatoide (látex) y anticuerpos antinucleares. Los 3 hemocultivos obtenidos fueron negativos. Se efectuó artrocentesis en la rodilla izquierda (prótesis) y se obtuvo 25ml de líquido purulento con 52.000 leucocitos/μl, el 92% de neutrófilos y glucosa de 32mg/dl. Con luz polarizada, en el microscopio óptico se visualizaron dentro y fuera de los leucocitos, cristales birrefringentes con elongación negativa compatibles con urato monosódico. Mediante tinción de Gram se identificaron abundantes cocos grampositivos que posteriormente se recuperaron en el cultivo y se tipificaron como S. epidermidis resistentes a meticilina. La radiografía de tórax sólo mostró un aumento de la silueta cardiopericárdica. En las radiografías de los pies se observaron erosiones de bordes esclerosos en la primera metatarsofalángica. La radiografía de la rodilla izquierda puso de manifiesto signos de aflojamiento protésico (fig. 1).
Se instauró antibioterapia intravenosa con vancomicina (500mg/8h) durante 6 semanas, a la que se asoció rifampicina oral (600mg/día). Posteriormente fue intervenida con desbridamiento de la prótesis de la rodilla izquierda y recambio del componente tibial, que presentaba claros signos de aflojamiento.
En el contexto clínico descrito, consideramos que S. epidermidis alcanzó la prótesis de la rodilla izquierda en el curso de una bacteriemia sufrida 5 semanas antes, durante el ingreso hospitalario, y la infección de uno de los catéteres intravenosos fue la puerta de entrada más probable. Así, aunque el 60-95% de las infecciones de las prótesis articulares ocurren durante el acto quirúrgico, bien por contaminación ambiental o bien por inoculación directa durante la manipulación, aquellas que se presentan a partir del segundo año se adquirirían en casi su totalidad por vía hematógena1,12. Las bacteriemias son una causa bien documentada de infección protésica tardía5,12 y la rodilla es la principal localización12,13.
El 70-80% de las infecciones sobre prótesis son producidas por un solo microorganismo1. Los estafilococos causan alrededor del 70% de las infecciones de las prótesis de rodilla. En las últimas dos décadas han cobrado mayor relevancia los estafilococos coagulasa negativos, que causan el 30-40% de los casos, y cuyo principal representante es S. epidermidis13,14. En nuestro medio, la mitad de las cepas de esta bacteria grampositiva y anaerobia facultativa son resistentes a meticilina. S. epidermidis posee proteínas de superficie como SSP-1, SSP-2 y la autolisina AtlE, que le confieren capacidad de adherirse al poliestireno y otros materiales sintéticos. Igualmente poseen importancia patogénica la proteína Fbe, capaz de unirse a la cadena β del fibrinógeno, el ácido teicoico de la pared, que facilita su fijación a la fibronectina del huésped, así como la secreción de un polisacárido con actividad adherente (PS/A), que recubre sus colonias a modo de capa impermeable, conocida como slime, preservándolas de las defensas del huésped y de los antibióticos15,16. S. epidermidis también sintetiza proteínas con capacidad osteolítica local, implicadas en el aflojamiento de las prótesis articulares15. Por otra parte, el entorno de las prótesis e implantes se encuentra escasamente vascularizado y algunos componentes de los cementos dificultan la actividad fagocítica de los leucocitos17. Estas características confieren a S. epidermidis, pese a su menor virulencia respecto a S. aureus, una notable capacidad de colonizar implantes y prótesis, especialmente en pacientes con déficit nutricionales, alcoholismo, diabetes mellitus, neoplasias17, enfermedades crónicas debilitantes, conectivopatías, inmunodeficiencias o tratamientos inmunosupresores1,16.
Aunque la infección tardía de una prótesis articular suele cursar con disfunción o aflojamiento, es difícil diferenciarla de otras causas18. Ante cualquier aflojamiento protésico debe investigarse la etiología infecciosa, y el medio más sencillo es el cultivo del líquido articular o del lavado protésico18,19. Elementos semiológicos indicativos, como fiebre y leucocitosis, sólo están presentes en el 50% de los pacientes con infecciones tardías de prótesis1,12 y en la tercera parte de quienes sufren simultáneamente una artritis microcristalina y séptica11. La similitud clínica de las artritis infecciosas y de las microcristalinas, junto con las dificultades para su diferenciación radiológica20,21, hacen necesario el estudio protocolizado del líquido sinovial, incluido el cultivo sistemático de los derrames de aspecto inflamatorio pese a la observación de microcristales7–9,11. Esta práctica permitió el diagnóstico en el caso descrito.
Aunque no hay consenso, se ha propuesto aplicar un protocolo de profilaxis antibiótica a los pacientes portadores de prótesis que se sometan a maniobras durante las que puedan producirse bacteriemias, como manipulaciones dentarias, instrumentaciones genitourinarias o fibroendoscopias digestivas5,22. Kaandorp et al5 estimaron que esta medida podría evitar la infección hemática de prótesis articulares y reducir un 8% la incidencia de las artritis sépticas.
Una vez establecida la infección protésica, el tratamiento médico con antibioterapia y lavados articulares sólo consigue un 15% de éxitos. Por lo tanto, es necesaria la combinación de antibioterapia y medidas quirúrgicas12,19,23. Vancomicina es el antibiótico de elección contra la mayoría de S. epidermidis, pero debido a que su penetración en el tejido óseo es pobre (el 14% de la concentración sérica), se recomienda su administración conjunta con rifampicina. A causa de la rapidez con la que S. epidermidis puede adquirir resistencia a rifampicina, ésta nunca debe emplearse en monoterapia. La teicoplanina es un glucopéptido con espectro microbiano similar a la vancomicina y consigue tasas de remisión clínica próximas al 80%. No obstante, hay cepas de estafilococos coagulasa negativos resistentes a teicoplanina. La duración de la antibioterapia oscila entre 12 y 24 semanas, y en ningún caso debe ser inferior a 6 semanas12,19. Las medidas quirúrgicas incluyen el desbridamiento y, frecuentemente, el recambio protésico en uno o dos tiempos; este último proporciona mejores resultados19,21. En pacientes con evolución desfavorable y sin posibilidad de recambio protésico, la artrodesis es una opción que, pese a sus malos resultados funcionales, se sigue de altas tasas de curación bacteriológica. En casos recidivantes, que amenazan la vida del paciente, la desarticulación o la amputación constituyen la última alternativa1,12,19.
Sólo hemos recogido otro paciente con artritis microcristalina e infecciosa sobre prótesis articular11. Se trata de un varón de 46 años con prótesis de rodilla infectada por S. aureus resistente a oxacilina y que requirió una artrodesis. Consideramos que, debido a que las prótesis son más susceptibles a las complicaciones infecciosas que las articulaciones nativas5,12, esta posibilidad debe ser la primera en investigarse ante la aparición de dolor y signos inflamatorios, incluso en quienes tengan una historia de artritis microcristalina.