La enfermedad de Behçet (EB) es una vasculitis sistémica, y afecta con mayor agresividad a varones jóvenes. Sus manifestaciones más frecuentes son las aftas orogenitales, la uveítis y las lesiones cutáneas.
Analizamos 6 pacientes con EB, que recibieron adalimumab para controlar la enfermedad. Todos habían recibido terapia inmunosupresora, además 2 de ellos recibieron infliximab. Observamos una buena respuesta clínica al fármaco. Actualmente, con un seguimiento medio de 26,8 meses, los pacientes siguen en tratamiento con adalimumab, con buen control clínico y sin que se hayan detectado efectos adversos relacionados con el anti-TNF.
Behçet's disease (BD) is a systemic vasculitis, with a more aggressive course in young males. Orogenital ulcers, uveitis and cutaneous lesions are the most frequent manifestations.
We analyzed the effects of adalimumab on six patients with BD pretreated with inmunosupressive therapy, two of whom had received infliximab. We observed a good clinical response in all patients. To date, after a mean follow-up of 26.8 months, patients continue receiving adalimumab, with good clinical control, no adverse effects have been reported with adalimumab.
La enfermedad de Behçet (EB) es una vasculitis sistémica. Sus manifestaciones más frecuentes son las aftas orogenitales, poliartritis, afectación ocular (uveítis) y afectación cutánea (eritema nudoso, foliculitis y fenómeno de patergia)1,2.
La utilización de los agentes biológicos antagonistas del factor de necrosis tumoral (anti-TNF) como parte de la estrategia terapéutica para el manejo de las vasculitis sistémicas es cada vez más frecuente3.
Adalimumab (Humira®), es un anticuerpo anti-TNF alfa humano que, en la mayor parte de ocasiones, es autoadministrado de forma subcutánea cada 14 días.
En la literatura médica se describen casos con EB tratados con adalimumab, con buena respuesta clínica4-12.
Presentamos nuestra experiencia con 6 pacientes con EB tratados con adalimumab.
Observación clínicaLos pacientes habían recibido tratamiento convencional: esteroides, azatioprina, ciclosporina, antiinflamatorios, colchicina y 2 además infliximab (tabla 1).
Debido a la falta de respuesta de control de los síntomas (una paciente con aftas orales y genitales recurrentes) y a la afectación ocular (5 pacientes con uveítis de repetición y empeoramiento visual), se decidió iniciar tratamiento con adalimumab (40mg/14 días s.c.).
Dos pacientes con uveítis (una de ellas además presentaba leucoencefalopatía inflamatoria), habían recibido infliximab por 6 y 12 meses, respectivamente, debido a la mala respuesta clínica con los inmunosupresores previos.
Se observó a partir de la segunda dosis del adalimumab, una mejoría de los síntomas en 4 pacientes, estando asintomáticos hasta el momento de la publicación.
Un paciente varón (caso n.° 6) actualmente presenta episodios de aftas orales, talalgia y coxalgia, al igual que una mujer (caso n.° 2) presenta aftas orales y dolor lumbar. En ambos pacientes las molestias relacionadas con su enfermedad de base son de menor intensidad que las que originaron el cambio terapéutico, y controlables con tratamiento sintomático.
Actualmente el tiempo medio de tratamiento con adalimumab es de 26,8±12,3 meses (rango 12-41), con buena tolerancia y sin secuelas por la medicación.
El protocolo de estudio fue aprobado por los comités éticos locales correspondientes siguiendo las directrices de la declaración de Helsinki.
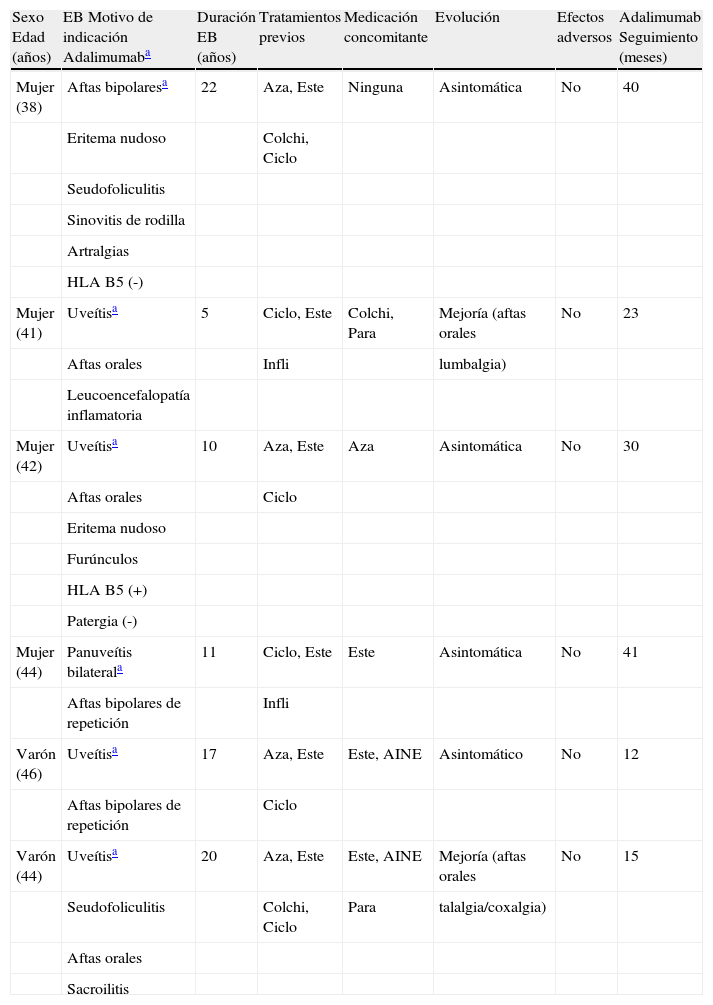
Describimos 6 pacientes españoles (raza caucásica), que cumplían con los criterios internacionales de EB13, 4 mujeres. Edad media de 42,5±2,8 años (rango 38-46). Tiempo medio de enfermedad de 14,1±6,5 años (rango 5-22). Todos los pacientes presentaron afectación de mucosas (úlceras orales y/o genitales). Cinco pacientes presentaron afectación ocular, 3 lesiones cutáneas y una mujer afectación neurológica (leucoencefalopatía inflamatoria) (tabla 1). Todos los pacientes presentaron autoanticuerpos negativos y complemento (C3, C4, factor B) normal.
Características de nuestros pacientes.
| Sexo Edad (años) | EB Motivo de indicación Adalimumaba | Duración EB (años) | Tratamientos previos | Medicación concomitante | Evolución | Efectos adversos | Adalimumab Seguimiento (meses) |
| Mujer (38) | Aftas bipolaresa | 22 | Aza, Este | Ninguna | Asintomática | No | 40 |
| Eritema nudoso | Colchi, Ciclo | ||||||
| Seudofoliculitis | |||||||
| Sinovitis de rodilla | |||||||
| Artralgias | |||||||
| HLA B5 (-) | |||||||
| Mujer (41) | Uveítisa | 5 | Ciclo, Este | Colchi, Para | Mejoría (aftas orales | No | 23 |
| Aftas orales | Infli | lumbalgia) | |||||
| Leucoencefalopatía inflamatoria | |||||||
| Mujer (42) | Uveítisa | 10 | Aza, Este | Aza | Asintomática | No | 30 |
| Aftas orales | Ciclo | ||||||
| Eritema nudoso | |||||||
| Furúnculos | |||||||
| HLA B5 (+) | |||||||
| Patergia (-) | |||||||
| Mujer (44) | Panuveítis bilaterala | 11 | Ciclo, Este | Este | Asintomática | No | 41 |
| Aftas bipolares de repetición | Infli | ||||||
| Varón (46) | Uveítisa | 17 | Aza, Este | Este, AINE | Asintomático | No | 12 |
| Aftas bipolares de repetición | Ciclo | ||||||
| Varón (44) | Uveítisa | 20 | Aza, Este | Este, AINE | Mejoría (aftas orales | No | 15 |
| Seudofoliculitis | Colchi, Ciclo | Para | talalgia/coxalgia) | ||||
| Aftas orales | |||||||
| Sacroilitis |
AINE: antiinflamatorios no esteroideos; Aza: azatioprina; Colchi: colchicina; Ciclo: ciclosporina; EB: enfermedad de Behçet; Este: esteroides; Infli: infliximab; Para: paracetamol.
La indicación de los anti-TNF como parte de la estrategia terapéutica para el manejo de las vasculitis sistémicas es cada vez más frecuente3. Siendo la EB una vasculitis de evolución crónica con recaídas donde, además, las opciones de tratamientos son limitadas y no exentas de efectos adversos, la utilización de los anti-TNF es una posibilidad para controlar los síntomas en estos pacientes.
Presentamos 6 pacientes con EB que recibieron adalimumab, observando una buena respuesta clínica y tolerancia (seguimiento medio de 26,8 meses).
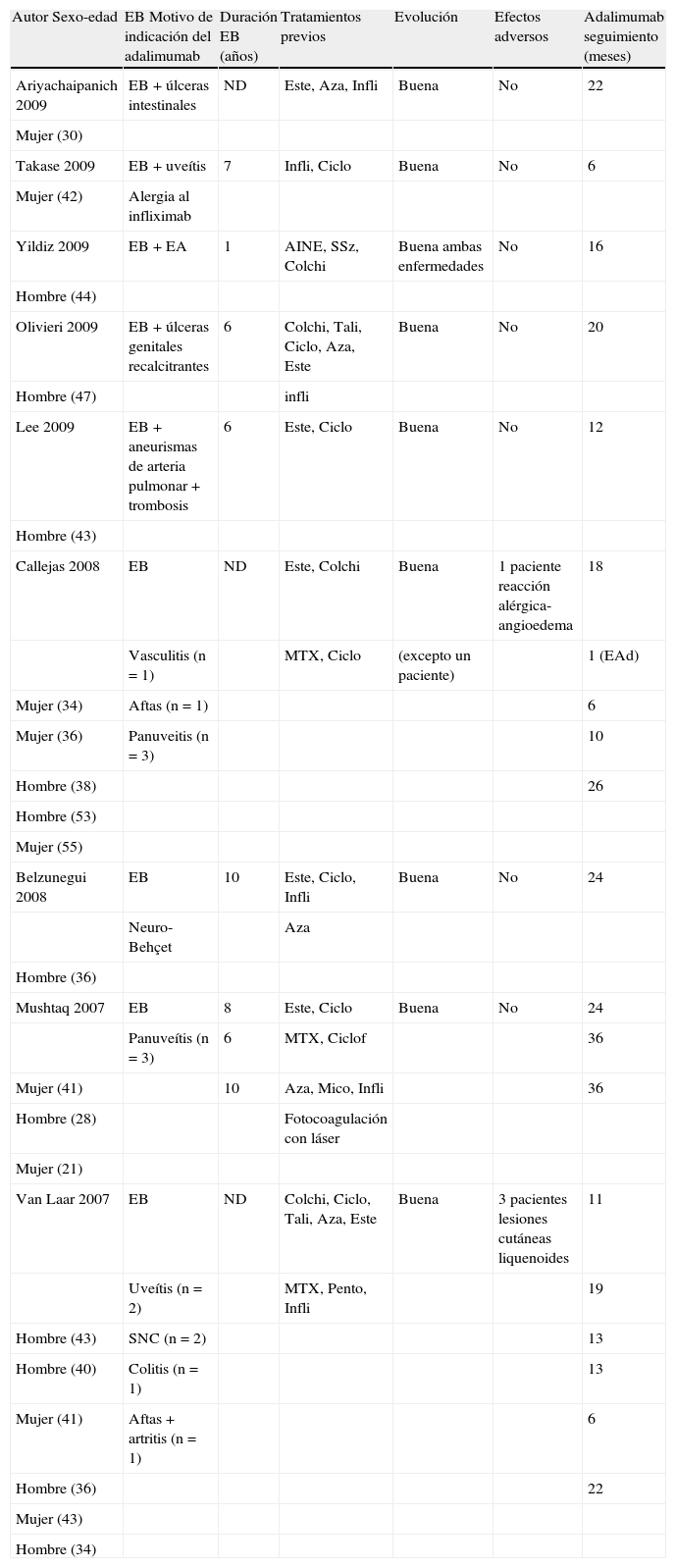
Hemos realizado una revisión de la literatura4-12, identificando 9 artículos, un total de 20 pacientes con EB que recibieron adalimumab (tabla 2). La edad media de los pacientes fue de 39,5 (rango 21-55) años, 9 mujeres, y el tiempo medio de enfermedad (n=8 pacientes) fue de 6,75 (rango 1-10) años.
Revisión de la literatura: casos de enfermedad de Behçet tratados con adalimumab.
| Autor Sexo-edad | EB Motivo de indicación del adalimumab | Duración EB (años) | Tratamientos previos | Evolución | Efectos adversos | Adalimumab seguimiento (meses) |
| Ariyachaipanich 2009 | EB+úlceras intestinales | ND | Este, Aza, Infli | Buena | No | 22 |
| Mujer (30) | ||||||
| Takase 2009 | EB+uveítis | 7 | Infli, Ciclo | Buena | No | 6 |
| Mujer (42) | Alergia al infliximab | |||||
| Yildiz 2009 | EB+EA | 1 | AINE, SSz, Colchi | Buena ambas enfermedades | No | 16 |
| Hombre (44) | ||||||
| Olivieri 2009 | EB+úlceras genitales recalcitrantes | 6 | Colchi, Tali, Ciclo, Aza, Este | Buena | No | 20 |
| Hombre (47) | infli | |||||
| Lee 2009 | EB+aneurismas de arteria pulmonar+trombosis | 6 | Este, Ciclo | Buena | No | 12 |
| Hombre (43) | ||||||
| Callejas 2008 | EB | ND | Este, Colchi | Buena | 1 paciente reacción alérgica-angioedema | 18 |
| Vasculitis (n=1) | MTX, Ciclo | (excepto un paciente) | 1 (EAd) | |||
| Mujer (34) | Aftas (n=1) | 6 | ||||
| Mujer (36) | Panuveitis (n=3) | 10 | ||||
| Hombre (38) | 26 | |||||
| Hombre (53) | ||||||
| Mujer (55) | ||||||
| Belzunegui 2008 | EB | 10 | Este, Ciclo, Infli | Buena | No | 24 |
| Neuro-Behçet | Aza | |||||
| Hombre (36) | ||||||
| Mushtaq 2007 | EB | 8 | Este, Ciclo | Buena | No | 24 |
| Panuveítis (n=3) | 6 | MTX, Ciclof | 36 | |||
| Mujer (41) | 10 | Aza, Mico, Infli | 36 | |||
| Hombre (28) | Fotocoagulación con láser | |||||
| Mujer (21) | ||||||
| Van Laar 2007 | EB | ND | Colchi, Ciclo, Tali, Aza, Este | Buena | 3 pacientes lesiones cutáneas liquenoides | 11 |
| Uveítis (n=2) | MTX, Pento, Infli | 19 | ||||
| Hombre (43) | SNC (n=2) | 13 | ||||
| Hombre (40) | Colitis (n=1) | 13 | ||||
| Mujer (41) | Aftas+artritis (n=1) | 6 | ||||
| Hombre (36) | 22 | |||||
| Mujer (43) | ||||||
| Hombre (34) |
AINE: ANTIINFlamatorios no esteroideos; Aza: azatioprina; Ciclo: CICLosporina; Ciclof: ciclofosfamida; Colchi: colchicina; EA: espondilitis anquilopoyética; EAd: efectos adversos; EB: enfermedad de Behçet; Este: esteroides; Infli: infliximab; Mico: micofenalato; MTX: metotrexato; ND: no hay datos; Pento: pentoxifilina; SNC: sistema nervioso central; SSz: sulfasalacina; Tali: talidomida.
Las indicaciones más frecuentes para recibir adalimumab fueron: la afectación ocular (uveítis y vasculitis retiniana)4,5,10,12 en 9 pacientes, de los cuales 64,10,12 habían recibido infliximab previamente para controlar los síntomas. Por su afectación cutánea (úlceras orogenitales y vasculitis cutánea)5,7,11,12 se trataron con adalimumab 5 pacientes, de los cuales 2 habían recibido infliximab previamente11,12.
Con menor frecuencia 3 pacientes con afectación neurológica6,12, 2 con afectación digestiva9,12, todos habían recibido infliximab y un paciente8 presentó un cuadro de hemorragia pulmonar con trombosis y aneurisma de la arteria pulmonar por lo que había recibido pulsos de ciclofosfamida y posteriormente adalimumab.
En total 13 pacientes de la literatura médica revisada4,6,9-12 recibieron infliximab por un rango de tiempo de 1 a 30 meses y un paciente11 además recibió etanercept (s.c.) por su afectación cutánea. El motivo de cambio de la terapia biológica fue una reacción alérgica en un paciente10, por preferencia del paciente en 4 casos4,9 y por recaídas de la enfermedad en los demás6,11,12.
El motivo de recaídas de la enfermedad a pesar de la terapia inmunosupresora y/o biológica4,6,9-12 se desconoce, lo que parece señalar diferentes mecanismos de acción de los fármacos en la EB, pendientes de ser identificados. Quizá estemos en una situación semejante al tratamiento de la artritis reumatoide con anti-TNF, donde el fallo de uno de ellos no indica que el paciente no responda a otro, seguramente relacionándose este efecto con la diferente estructura, antigenicidad e, incluso, mecanismo de acción en los diversos anti-TNF14.
En la patogenia de la EB se produce una alteración funcional de las células T, con un incremento del TNF alfa que inducirían los síntomas inflamatorios15-17. Por lo que la terapia inmunosupresora y con anti-TNF desempeñaría un papel importante en la patogenia de la EB. Existen múltiples publicaciones (principalmente estudios abiertos) con estos fármacos que mostraron su eficacia para controlar los síntomas18.
En las recomendaciones de la EULAR19,20 los autores confirman la falta de evidencia sólida (ensayos clínicos aleatorizados, doble ciego) sobre la eficacia de los fármacos en la EB, pero recomiendan, ante la afectación sistémica de la enfermedad, el uso de los inmunosupresores (ciclosporina A, azatioprina, interferón alfa y anti-TNF).
Todos los casos publicados respondieron a este fármaco, presentando un buen perfil de seguridad: solo hubo 4 eventos adversos descritos (una alergia5 y 3 lesiones cutáneas liquenoides en el sitio de inyección12). El tiempo medio de seguimiento con adalimumab fue de 17 meses (rango 1-36).
Comparando con nuestros pacientes observamos que la indicación más frecuente fue la afectación ocular, además una paciente presentó leucoencefalopatía inflamatoria. Dos habían recibido infliximab con recaída de los síntomas (inflamación ocular y afectación neurológica). Nuestros pacientes no presentaron eventos adversos hasta el momento de la publicación.
El adalimumab parece ser una opción terapéutica eficaz para la EB. Si bien la evidencia publicada hasta la fecha es limitada y se basa exclusivamente en series pequeñas de casos, ésta muestra una buena eficacia y tolerabilidad del fármaco en pacientes con este tipo de vasculitis resistente a otros inmunosupresores, aunque se necesitan más estudios para determinar las dosis y regímenes de tratamientos óptimos y seguros con anti-TNF para el manejo de la EB.
ConclusionesSegún nuestra casuística y los datos previos, publicados en la literatura médica, consideramos que la terapia con anti-TNF, y especialmente adalimumab, es una buena opción terapéutica en los pacientes con EB resistentes a la terapia convencional. No se detectó ningún efecto adverso en los pacientes tratados con adalimumab, coincidiendo con los pocos casos descritos en la literatura científica revisada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.