Se presentan un caso de dermatomiositis y otro de polimiositis refractarias a varios inmunosupresores convencionales y con respuesta a tratamiento con rituximab, con el que se posibilita la disminución de dosis de corticoide y se mantiene a la enfermedad en remisión durante un largo periodo.
We report one case of dermatomyositis and one of polymyositis refractory to several conventional inmunosupressive therapies, which present a response after treatment with rituximab, enabling steroid dose reduction and a prolonged remission.
Las miopatías inflamatorias idiopáticas (MII) son enfermedades inflamatorias del tejido conectivo de etiología desconocida y que afectan principalmente al músculo esquelético, piel y otros órganos internos. Para su tratamiento se han utilizado glucocorticoides (GC) e inmunosupresores como metotrexato (MTX) y azatioprina (AZA) con un porcentaje elevado de ineficacia1. Puntualmente se han usado diferentes terapias biológicas, entre ellas rituximab (RTX), un anticuerpo monoclonal quimérico anti CD20. Nosotros presentamos un caso de dermatomiositis (DM) y una polimiositis (PM) refractarias y con intolerancia a múltiples tratamientos convencionales que presentan una posterior respuesta a RTX.
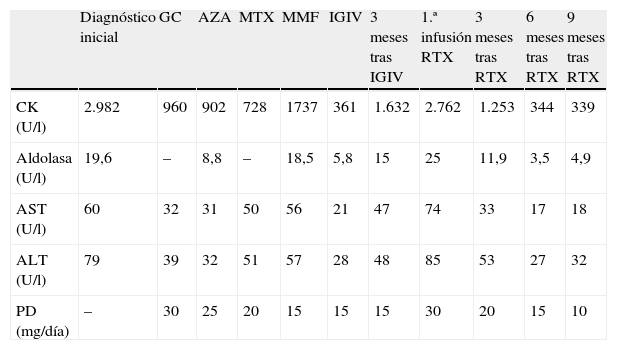
Casos clínicosCaso clínico 1Mujer de 50 años, con antecedente de hábito tabáquico y síndrome depresivo, que es diagnosticada en 2008 de DM por presencia de exantema cutáneo facial y en brazos, debilidad muscular proximal de extremidades, elevación de enzimas musculares (creatincinasa [CK]: 2.982 U/l y aldolasa: 19,6 U/l) y positividad para ANA a título 1/640 con negatividad para autoanticuerpos específicos. El electromiograma muestra una miopatía generalizada de distribución proximal e intensidad moderada. Por intolerancia gástrica e hipertensión arterial asociada a dosis altas de GC, inicialmente se pautó prednisona (PD) a dosis de 0,5mg/kg/día, con un descenso de los valores de CK (960 U/l), pero sin mejoría de la debilidad muscular. La evolución posterior de las enzimas musculares y de la dosis de PD respecto de los inmunosupresores que recibe la paciente se exponen en la tabla 1. AZA 150mg/día y MTX 15mg/semana se suspendieron por intolerancia gástrica sin producir tampoco una mejoría clínica importante. Micofenolato de mofetilo (MMF) 2g/día fue suspendido por ineficacia con empeoramiento clínico y analítico. Se mantuvieron 2 años de corticoterapia debido a las reticencias por parte de la paciente para recibir un tratamiento no convencional y sin indicación aprobada para MII. La aparición de fascies cushingoide y cataratas oculares, junto con la persistencia de actividad de la enfermedad, hace que se decida en 2010 pautar tratamiento con inmunoglobulinas intravenosas (IGIV) a dosis de 2g/kg/mes, durante 3 meses. Se produce una buena respuesta clínica y analítica pero con una rápida recaída a los 3 meses de su suspensión. De este modo, en febrero de 2011 se inicia tratamiento con RTX (ciclo de 2 infusiones iv de 1g, separadas por 2 semanas) sin otro inmunosupresor añadido, observándose una mejoría de la debilidad muscular y una casi normalización de las enzimas musculares. Esta respuesta se produce a los 5 meses después de la primera infusión, pero se mantiene a lo largo del tiempo tras 9 meses sin necesidad de retratamiento y posibilita una disminución de PD hasta 10mg/día. No se detectó durante este seguimiento ningún efecto adverso relacionado con RTX.
Caso 1: evolución de los valores de enzimas musculares y tratamiento
| Diagnóstico inicial | GC | AZA | MTX | MMF | IGIV | 3 meses tras IGIV | 1.ª infusión RTX | 3 meses tras RTX | 6 meses tras RTX | 9 meses tras RTX | |
| CK (U/l) | 2.982 | 960 | 902 | 728 | 1737 | 361 | 1.632 | 2.762 | 1.253 | 344 | 339 |
| Aldolasa (U/l) | 19,6 | – | 8,8 | – | 18,5 | 5,8 | 15 | 25 | 11,9 | 3,5 | 4,9 |
| AST (U/l) | 60 | 32 | 31 | 50 | 56 | 21 | 47 | 74 | 33 | 17 | 18 |
| ALT (U/l) | 79 | 39 | 32 | 51 | 57 | 28 | 48 | 85 | 53 | 27 | 32 |
| PD (mg/día) | – | 30 | 25 | 20 | 15 | 15 | 15 | 30 | 20 | 15 | 10 |
GC: glucocorticoides; AZA: azatioprina; MTX: metotrexato; MMF: micofenolato de mofetilo; IGIV: inmunoglobulinas intravenosas; RTX: rituximab; CK: creatincinasa (normal: < 250); aldolasa (normal: < 7); AST: aspartato aminotransferasa (normal: 10-40); ALT: alanino aminotransferasa (normal: 10-40); PD: prednisona.
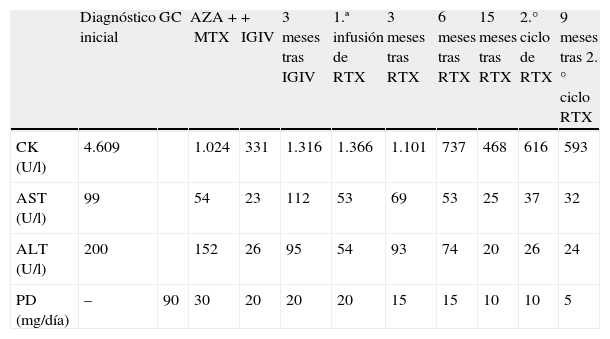
Mujer de 30 años, con antecedentes de HTA y obesidad mórbida, que es valorada en 2007 por debilidad proximal en extremidades y elevación de las enzimas musculares (CK: 4.609 U/l). Es diagnosticada de PM al demostrarse en el electromiograma una miopatía difusa proximal y en la biopsia muscular datos anatomopatológicos compatibles con miopatía inflamatoria. Inicialmente se pauta PD 1mg/kg/día con una respuesta parcial y disminuyendo la dosis a 0,5mg/kg/día tras la adición de inmunosupresores. Estos no impiden varios episodios de debilidad generalizada e intensa impotencia funcional que requieren tratamiento con bolos de metilprednisolona (1g/día durante 3 días consecutivos). La evolución de los valores de las enzimas musculares y del tratamiento queda reflejada en la tabla 2. A pesar de MTX (20mg/día) y AZA (150mg/día), es imposible disminuir la dosis de PD por debajo de 30mg/día por empeoramiento clínico, por lo que se inician IGIV (2g/kg/mes durante 3 meses), que producen una mejoría clínica y analítica, pero con recaída posterior a los 3 meses de su interrupción pese a mantener AZA y MTX asociados a los GC. En agosto de 2009 se decide pautar RTX (2 infusiones iv de 1g, separadas por 2 semanas), manteniéndose GC, AZA y MTX. A los 5 meses se observa una gran mejoría de la debilidad proximal y una disminución de las enzimas musculares, que se mantiene a lo largo del tiempo. En enero de 2011, y tras 17 meses del primer ciclo de RTX, se administra un segundo ciclo por temor a una recaída, ya que la paciente tiene que viajar al extranjero durante un tiempo prolongado y es imposible realizar su seguimiento. Con esta nueva dosis se mantiene en remisión durante un año más y hasta el momento actual, con una casi normalización de los valores de CK (468 U/l) y con la posibilidad de descender la dosis de PD a 5mg/día. Tampoco se objetivaron efectos secundarios relacionados con la infusión de RTX ni en el posterior seguimiento.
Caso 2: evolución de los valores de enzimas musculares y tratamiento
| Diagnóstico inicial | GC | AZA+MTX | + IGIV | 3 meses tras IGIV | 1.ª infusión de RTX | 3 meses tras RTX | 6 meses tras RTX | 15 meses tras RTX | 2.° ciclo de RTX | 9 meses tras 2.° ciclo RTX | |
| CK (U/l) | 4.609 | 1.024 | 331 | 1.316 | 1.366 | 1.101 | 737 | 468 | 616 | 593 | |
| AST (U/l) | 99 | 54 | 23 | 112 | 53 | 69 | 53 | 25 | 37 | 32 | |
| ALT (U/l) | 200 | 152 | 26 | 95 | 54 | 93 | 74 | 20 | 26 | 24 | |
| PD (mg/día) | – | 90 | 30 | 20 | 20 | 20 | 15 | 15 | 10 | 10 | 5 |
GC: glucocorticoides; AZA: azatioprina; MTX: metotrexato; IGIV: inmunoglobulinas intravenosas; RTX: rituximab; CK: creatincinasa (normal: < 250); AST: aspartato aminotransferasa (normal: 10-40); ALT: alanino aminotransferasa (normal: 10-40); PD: prednisona.
Las MII se caracterizan por la presencia de un infiltrado inflamatorio a nivel muscular donde parecen tener un papel importante en cuanto a la patogenia los linfocitos B, especialmente en la DM. El RTX es un anticuerpo monoclonal anti-CD20 indicado para el tratamiento del linfoma no Hodgkin y la artritis reumatoide, también utilizado en otras enfermedades autoinmunitarias refractarias como el LES, síndrome de Sjögren o vasculitis, al producir una profunda y mantenida depleción de linfocitos B CD20+ y sin afectar a las células madre ni a las células plasmáticas. Actualmente, el tratamiento de las PM/DM es principalmente empírico y no hay un acuerdo sobre cual es el más óptimo. Inicialmente se utilizan GC a dosis altas y si existe resistencia a estos o manifestaciones extramusculares graves se añaden inmunosupresores, como AZA, MTX, ciclosporina A, tacrolimús, MMF o ciclofosfamida2, existiendo alrededor de un 25% de pacientes que no responden o presentan recidivas incluso con estos inmunosupresores3. Se han ensayado IGIV (dosis de 1-2g/kg) que actúan rápidamente y mejoran la debilidad muscular, con pocos efectos adversos pero con un elevado coste y un efecto transitorio4. Los fármacos inhibidores de TNF-alfa no parecen ser efectivos, por lo que no se aconseja su uso en estas enfermedades, a menos que otras opciones de tratamiento hayan fracasado5. Existen publicados casos aislados o series pequeñas que demuestran la eficacia de RTX en el tratamiento de las MII refractarias6-9. En estas publicaciones, un porcentaje elevado de pacientes que responden de manera adecuada o que no necesitan un nuevo ciclo de retratamiento precoz son aquellos que reciben IGIV o ciclofosfamida conjuntamente con RTX. También existen diferencias en la dosis de RTX que se utiliza, sin que exista influencia significativa en el resultado (375mg/semanal por 4 dosis o ciclos de 1g cada dos semanas por 2 dosis), y en el tratamiento concomitante utilizado junto con RTX. García et al.10 recoge a 17 pacientes con MII donde se utiliza RTX además de ciclofosfamida iv y donde se obtiene una mejoría inicial en todos ellos (incluidos 4 con afectación respiratoria), siendo necesario un segundo ciclo de RTX a los 11 meses solo en 5 pacientes, con posterior respuesta favorable en todos ellos. La publicación con el mayor número de casos de MII refractarias tratadas con RTX es la de Couderc et al.11, basada en el registro francés AIR (Auto-inmunity and Rituximab). Se obtiene una respuesta favorable en 16 de los 30 pacientes con MII refractarias tratados con RTX, con una duración media de la eficacia de 15 meses y una disminución de los valores de CPK y de dosis diaria de GC en la mayoría de ellos. La dosis utilizada fue de 1g×2 dosis separadas 2 semanas en el 83% de los casos y de 375mg/m2 semanal×4 semanas en el 17%. La mayoría reciben concomitantemente GC e inmunosupresores (28 y 21 pacientes, respectivamente) y se retrata a 10 pacientes, con una nueva respuesta favorable en 8 de ellos.
Nosotros exponemos la eficacia de RTX en una DM y una PM que son refractarias a varios inmunosupresores pero sin la utilización simultánea de IGIV ni de ciclofosfamida y permitiendo la disminución de dosis de GC sin aparición de recaída. Utilizamos la dosis de RTX usada para artritis reumatoide al comprobar su eficacia para MII en otras publicaciones y estar mas habituados con su uso. En ambos casos la respuesta a RTX fue tardía (5 meses aproximadamente) pero, y a diferencia de la respuesta inducida por las IGIV, se mantuvo constante al menos durante 1 año tras el ciclo de infusión.
Respecto de los posibles efectos secundarios de RTX se han descrito varios, siendo el más frecuente la reacción infusional y otros como alteraciones hematológicas e infecciones (vías respiratorias altas, sistema urinario o piel) o más graves como la leucoencefalopatía multifocal progresiva. En nuestros 2 casos, la administración de RTX fue bien tolerada y no se acompañó de efecto adverso alguno.
ConclusiónSobre la base de los casos expuestos y las experiencias anteriormente publicadas, creemos que RTX es una alternativa muy válida a considerar en el tratamiento de las DM y PM refractarias al tratamiento convencional, incluso administrado sin otros inmunosupresores simultáneamente. La dosis de RTX y el esquema de retratamiento óptimo estarían aún por establecer.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.