El hallazgo de anticuerpos específicos y datos histopatológicos son indispensables para llegar al diagnóstico de síndrome de Sjögren (SS). La biopsia de glándulas salivales menores (BGSM), si bien es un procedimiento sencillo, debe ser realizada en una institución a fin de evitar complicaciones.
ObjetivoEstimar la frecuencia de complicaciones mediatas e inmediatas y el rédito de la técnica.
Materiales y métodosSe incluyeron los pacientes derivados al Hospital Rivadavia para realización de biopsia, entre octubre del 2007 y mayo del 2010. Los pacientes fueron citados a la semana y al mes del procedimiento para control de la lesión.
ResultadosFrecuencia de complicaciones inmediatas (n=186): 15 pacientes: 8,1%, IC del 95%, 4,7-13,2 (sangrado 7,5%, lipotimia 3,2%, hematomas 2,7%; no hubo accidentes). Complicaciones mediatas (n=164): 16 pacientes: 9,75%, IC del 95%, 5,9-15,6 (dolor 7,32%, signos inflamatorios 3,66%, trastornos de sensibilidad 3,05%, granuloma 1,22%). No hubo casos de infecciones, ni dehiscencia del punto de sutura. Rédito microscópico: total 154 biopsias: se obtuvo tejido glandular en el 90,9%, IC del 95%, 85-95 (típica, sialoadenitis, infiltrado grado III y IV).
ConclusionesLa BGSM presenta una baja frecuencia de complicaciones mediatas e inmediatas y un alto rédito en el estudio anatomo-patológico.
Findings of specific antibodies and histopathology data are essential for the diagnosis of Sjögren syndrome (SS). Although the minor salivary gland biopsy (MSGB) is technically simple, it needs to be performed in a medical institution to avoid complications.
ObjectiveTo determine the frequency of complications and the usefulness of this technique.
Materials and methodsPatients who underwent a minor salivary gland biopsy for a possible diagnosis of SS at Rivadavia Hospital between October 2007 and May 2010 where included. The patients were seen a week and a month after the procedure for follow up.
ResultsFrequency of acute complications (n=186): 15 patients; 8.1%, 95%CI: 4.7–13.2 (Bleeding 7.5%, syncope 3.2%, hematoma 2.7%. No accidents occurred). Medium term complications (n=164): 16 patients: 9.75%, 95%CI: 5.9-15.6 (pain 7.32%, inflammation 3.66%, sensitivity disorders 3.05%, granuloma 1.22%,). No infections or suture dehiscence occurred. Microscopic results: 154 biopsy reports were received: glandular 90.9%, 95%CI: 85-95 (typical, sialadenitis, grade III and IV infiltration).
ConclusionsMSGB has very low frequency of medium term and acute complications and it has high usefulness.
El síndrome de Sjögren (SS) es una enfermedad sistémica crónica de origen autoinmunitario de las glándulas exocrinas, que se manifiesta con síntomas que derivan de la hiposecreción de las mismas. El SS se puede presentar solo (SS primario [SSp]) o bien asociado a otras enfermedades autoinmunitarias (SS secundario)1.
El aspecto histopatológico de las glándulas salivales como parte del diagnóstico fue propuesto, por primera vez en 1970 por Waterhouse, Chisholm y Mason; estos últimos establecieron la puntuación por focos teniendo en cuenta los agregados de células inflamatorias2.
Según los criterios europeo-americanos3 para el diagnóstico de SSp es necesaria la presencia de una BGSM compatible y/o la presencia de anticuerpos anti-Ro/anti-La. La BGSM es un método utilizado también para el diagnóstico de otras enfermedades infiltrativas como la amiloidosis4 y la sarcoidosis5.
Numerosas técnicas quirúrgicas han sido descritas. Las mismas varían de acuerdo al tamaño desde 1,5mm a 30mm, la forma de la incisión (elíptica, horizontal, vertical y en cuña) y a su localización6. Si bien se trata de un procedimiento invasivo, el mismo es de fácil realización y con baja frecuencia de complicaciones7.
Caporali et al. describieron efectos adversos transitorios en 64 (12,7%) casos de su serie de 502 procedimientos: parestesias (57), hematoma (8), tumefacción local (27) y otros (5)8. En otros estudios se describen los trastornos sensitivos (anestesia, parestesia) como las complicaciones encontradas con mayor frecuencia, siendo las mismas transitorias en la mayoría de los casos. Sin embargo, otros autores no han reportado complicaciones6.
En cuanto a la muestra recolectada, se ha descrito un 99% de obtención de material útil para estudio8.
A pesar de la sencillez de la técnica, la BGSM no está incorporada en la práctica diaria en todos los centros. Si bien otros autores describieron la frecuencia de complicaciones de las diferentes técnicas y la utilidad del procedimiento, consideramos importante evaluar la seguridad y el rédito (obtención de material adecuado para estudio anatomopatológico) del método en nuestro centro.
En este trabajo estimamos el porcentaje de complicaciones mediatas e inmediatas de la BGSM y la frecuencia de obtención de material adecuado para estudio anatomopatológico.
Material y métodosSe diseñó un estudio prospectivo, observacional, descriptivo y longitudinal.
Se incluyeron los pacientes con sospecha de SS derivados para realización de BGSM. Los pacientes no debían tener evidencia de trastornos de coagulación y debían presentar un recuento de plaquetas en límites normales dentro del mes previo al procedimiento.
Los criterios de exclusión fueron: consumo de aspirina u otros AINE dentro de la semana previa al estudio, signos clínicos de infección local, pacientes anticoagulados y aquellos que se negaron a la inclusión en el protocolo.
El estudio fue aprobado por el comité de ética del hospital. Todos los pacientes firmaron un consentimiento informado.
Se estudiaron en forma prospectiva las BGSM realizadas entre octubre de 2007 y mayo de 2010, en el Servicio de Reumatología del Hospital Bernardino Rivadavia de la Ciudad Autónoma de Buenos Aires, Argentina.
A todos los pacientes se les realizó la biopsia de glándula salival menor con la técnica quirúrgica descrita por Caporali et al.8.
El material obtenido se conservo en formol al 10% y se envió para su análisis a anatomía patológica.
Luego de la intervención se registraron las características de la incisión y cualquier complicación surgida durante el procedimiento y posterior al mismo. El paciente fue citado para control a la semana y al mes del procedimiento. El rédito se valoró a través de los resultados de la anatomía patológica.
Mediciones: complicaciones inmediatas: sangrado que dificulte el procedimiento, lipotimia, accidentes del personal de salud con elementos corto punzantes durante la realización del procedimiento. Complicaciones mediatas: infección de la herida quirúrgica, dehiscencia de sutura, trastornos sensitivos (disestesia, anestesia, parestesias), cicatrización defectuosa: definida por presencia de granuloma o queloide en el sitio de cicatrización.
Análisis estadísticoLas complicaciones se estudiaron con análisis de frecuencia y se realizó el cálculo de los respectivos intervalos de confianza del 95%.
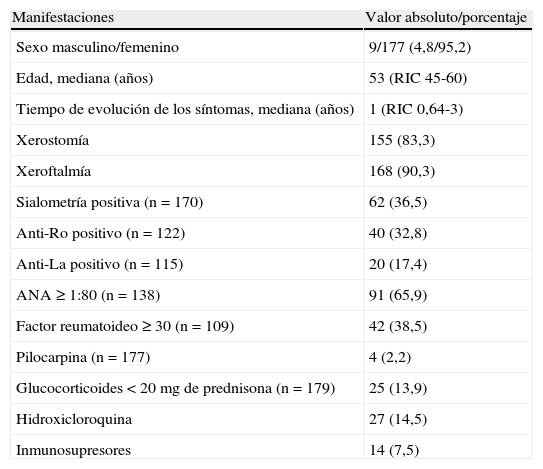
ResultadosSe incluyeron 186 procedimientos realizados entre octubre de 2007 y mayo de 2010, de los cuales 29 se realizaron para confirmar el diagnóstico de SS secundario y en el resto de SSp. Entre los pacientes con sospecha de SS secundario 21 tenían diagnóstico de artritis reumatoidea (AR), 3 de lupus eritematoso sistémico (LES), 3 de cirrosis biliar primaria (CBP), 1 de enfermedad mixta del tejido conectivo (EMTC) y 1 de vasculitis crioglobulinémica. Las características clínicas y serológicas se encuentran descritas en la tabla 1.
Manifestaciones clínicas y serológicas de los pacientes evaluados
| Manifestaciones | Valor absoluto/porcentaje |
| Sexo masculino/femenino | 9/177 (4,8/95,2) |
| Edad, mediana (años) | 53 (RIC 45-60) |
| Tiempo de evolución de los síntomas, mediana (años) | 1 (RIC 0,64-3) |
| Xerostomía | 155 (83,3) |
| Xeroftalmía | 168 (90,3) |
| Sialometría positiva (n=170) | 62 (36,5) |
| Anti-Ro positivo (n=122) | 40 (32,8) |
| Anti-La positivo (n=115) | 20 (17,4) |
| ANA ≥ 1:80 (n=138) | 91 (65,9) |
| Factor reumatoideo ≥ 30 (n=109) | 42 (38,5) |
| Pilocarpina (n=177) | 4 (2,2) |
| Glucocorticoides<20mg de prednisona (n=179) | 25 (13,9) |
| Hidroxicloroquina | 27 (14,5) |
| Inmunosupresores | 14 (7,5) |
RIC: rango intercuartílico.
De los 14 (7,5%) pacientes tratados con inmunosupresores al momento del procedimiento, 11 recibían metotrexato (9 de ellos tenían diagnóstico de AR), uno leflunomida y uno azatioprina.
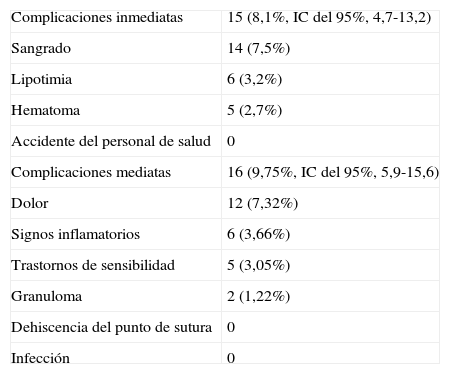
Todos los pacientes toleraron el procedimiento, no registrándose eventos adversos serios, 15 pacientes presentaron complicaciones inmediatas (8,1%, IC del 95%, 4,7-13,2). Las mismas consistieron en: sangrado 7,5%, lipotimia 3,2%, hematomas 2,7%. No se registraron accidentes del personal de salud con elementos cortopunzantes durante el procedimiento (tabla 2).
Complicaciones inmediatas y mediatas del procedimiento
| Complicaciones inmediatas | 15 (8,1%, IC del 95%, 4,7-13,2) |
| Sangrado | 14 (7,5%) |
| Lipotimia | 6 (3,2%) |
| Hematoma | 5 (2,7%) |
| Accidente del personal de salud | 0 |
| Complicaciones mediatas | 16 (9,75%, IC del 95%, 5,9-15,6) |
| Dolor | 12 (7,32%) |
| Signos inflamatorios | 6 (3,66%) |
| Trastornos de sensibilidad | 5 (3,05%) |
| Granuloma | 2 (1,22%) |
| Dehiscencia del punto de sutura | 0 |
| Infección | 0 |
Se registraron 164 pacientes, que concurrieron a las visitas a la semana y al mes del procedimiento para control de la práctica realizada. Se encontraron complicaciones mediatas en 16 pacientes (9,75%, IC del 95%, 5,9-15,6), distribuidas con las siguientes frecuencias: dolor 7,32%, signos inflamatorios 3,66%, trastornos de sensibilidad 3,05%, y granuloma 1,22%. Se destaca que los trastornos de sensibilidad fueron transitorios. No se detectaron casos de infecciones ni dehiscencia del punto de sutura.
Al momento del análisis se contaba con el informe anatomopatológico de 154 biopsias, en 140 (90,9%, IC del 95%, 85-95) se obtuvo material glandular (glándula salival menor típica, lipomatosis, sialoadenitis crónica inespecífica, infiltrado grado III y IV), y en el resto de los casos se obtuvo tejido fibromuscular y adiposo o escaso material.
DiscusiónEstablecer el diagnóstico de SS tiene cierta dificultad debido a la baja especificidad y sensibilidad de los marcadores serológicos y por la sintomatología poco especifica del síndrome. Hasta la fecha se han propuesto diferentes criterios de clasificación, los cuales se basan en la combinación de hallazgos clínicos, serológicos e histológicos3,9–13. Desde los criterios de San Francisco9 (en los cuales se jerarquiza el aspecto histopatológico) y los de San Diego10, en los que la BGSM es imprescindible para llegar al diagnostico de SS definido, pasando por los criterios de Copenhague11, los griegos12, los japoneses13 y los de la comunidad europea9, los cuales no requieren BGSM ni la presencia de anticuerpos, hasta llegar a los criterios americano-europeos 20023, los que exigen la presencia del criterio histopatológico o serológico. La biopsia de glándula salival menor es, por lo tanto, esencial para el diagnóstico en pacientes con sospecha de SS que presentan autoanticuerpos negativos.
Hemos destacado la importancia de la BGSM para el diagnóstico diferencial con otras patologías y actualmente se propone a la organización linfoide como marcador para el desarrollo de linfoma no Hodgkin14.
La BGSM es técnicamente simple y las complicaciones del procedimiento son raras. Además, con la técnica presentada, el 90,9% del material obtenido fue útil para el estudio anatomopatológico, frecuencia algo menor a la descrita por Caporali et al.8 (99,2%) y Treppo-Revonta15 (98,4%).
En este estudio se describe una prevalencia máxima de complicaciones inmediatas del 8,1% y de complicaciones mediatas del 9,75%, mostrando seguridad tanto para el personal de salud, como para los pacientes, ya que no se registraron complicaciones graves durante el procedimiento ni a mediano ni a largo plazo. A la semana de la BGSM 12 pacientes refirieron dolor y 6 signos inflamatorios durante los primeros días, 5 presentaron trastornos de sensibilidad leves que desaparecieron dentro del mes y en 2 de ellos se constató la formación de granuloma.
Distintos trabajos analizaron la biopsia de GSM con una técnica similar a la utilizada en este estudio y obtuvieron resultados comparables; las complicaciones fueron poco frecuentes y se destacan, como más prevalente, las parestesias en el sitio de incisión, de carácter transitorio en la mayoría de los pacientes6. Richards et al.16 reportaron 2 casos de trastornos de sensibilidad en el sitio de la incisión, de los cuales uno persistió más allá del año, siendo de características leves y sin evidencia objetiva de afección neurológica, mientras que Berquin et al.17 describieron anestesia permanente en un caso y Marx et al.18 reportaron 3 casos de los cuales uno fue persistente luego de 2 años de seguimiento. Caporali et al.8 reportaron eventos adversos transitorios en 64 de los 502 pacientes, de los cuales 57 tuvieron parestesias transitorias, 8 hematoma, 27 signos inflamatorios locales, y 5 otros (granuloma, sangrado y cicatriz interna). Pijpe et al.19 reportaron 4 casos de hipoestesia en el sitio de incisión, 2 de los cuales persistieron por más de 12 meses y 11 casos de dolor menor a un mes de duración. Por otra parte, Treppo y Revonta informaron un caso de granuloma piógeno15.
Se destaca que los pacientes a quienes se les practico la BGSM fueron derivados para estudio de síndrome sicca por profesionales tanto de nuestra institución como de otros servicios de reumatología, por no contar estos con los medios para realización de la misma. Esto explica la falta de algunos datos para el análisis.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Nora Castiglia por el asesoramiento científico.