La osteomielitis vertebral hematógena (OVH) es una entidad infrecuente (en España, 9 casos nuevos por millón de habitantes/año)1, cuya incidencia está aumentando en relación con el envejecimiento poblacional, el uso de inmunosupresores, el aumento de las bacteriemias nosocomiales y otros factores predisponentes, entre los que destaca la diabetes mellitus1-3. Pese a que son muchos los agentes causales posibles1-5, los gérmenes piógenos grampositivos, concretamente el Staphylococcus aureus, constituyen la etiología más frecuente (hasta el 51% en algunas series)1,2,6. Aunque la mortalidad es rara, se asocia con gran comorbilidad, muchas veces relacionada con la aparición de complicaciones secundariamente a la demora en el diagnóstico1,3. Presentamos un caso de OVH extensa por Parvimonas micra (P. micra), con gran afectación epidural, absceso prevertebral, mielopatía compresiva y derrame pleural bilateral.
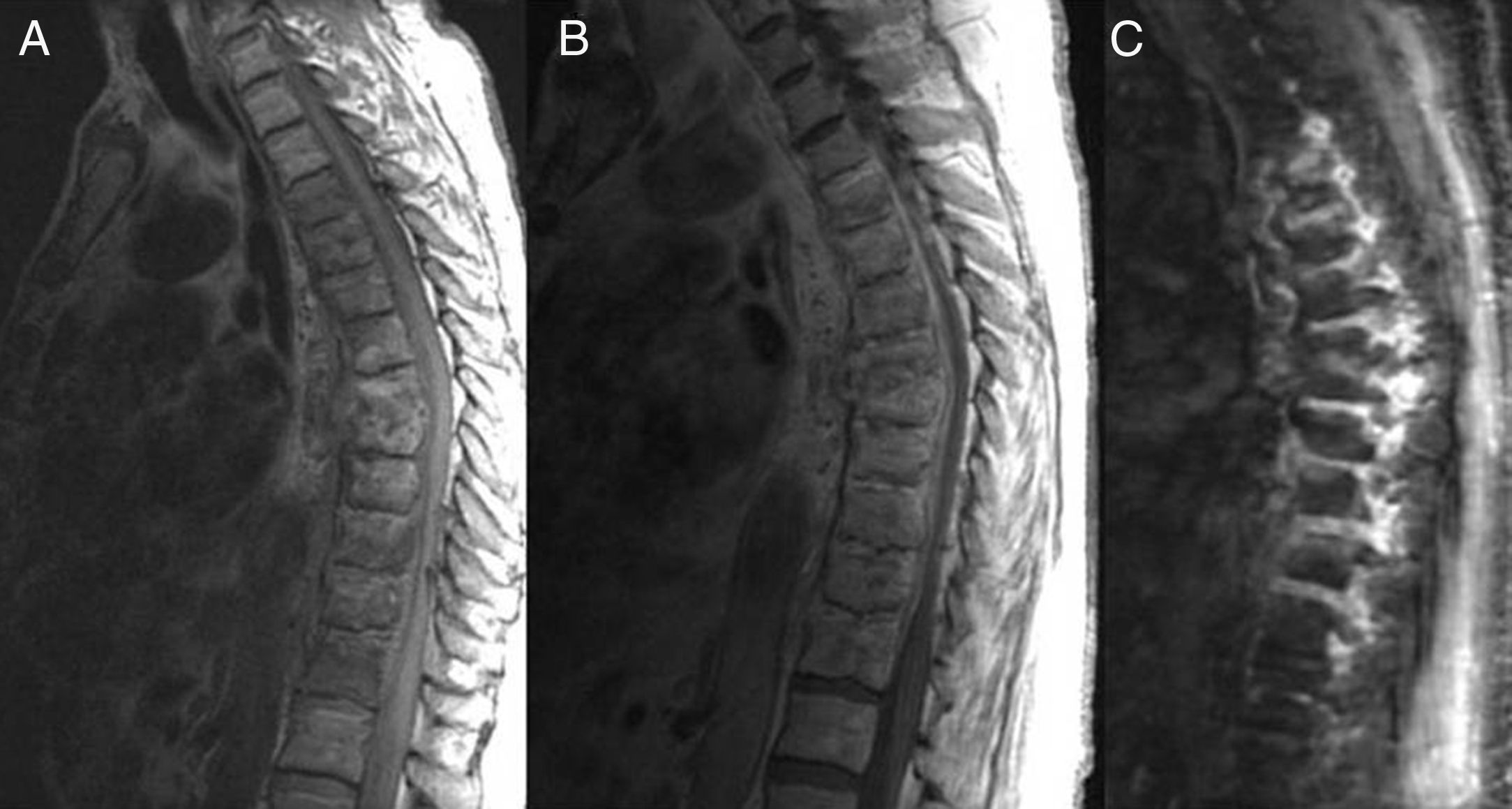
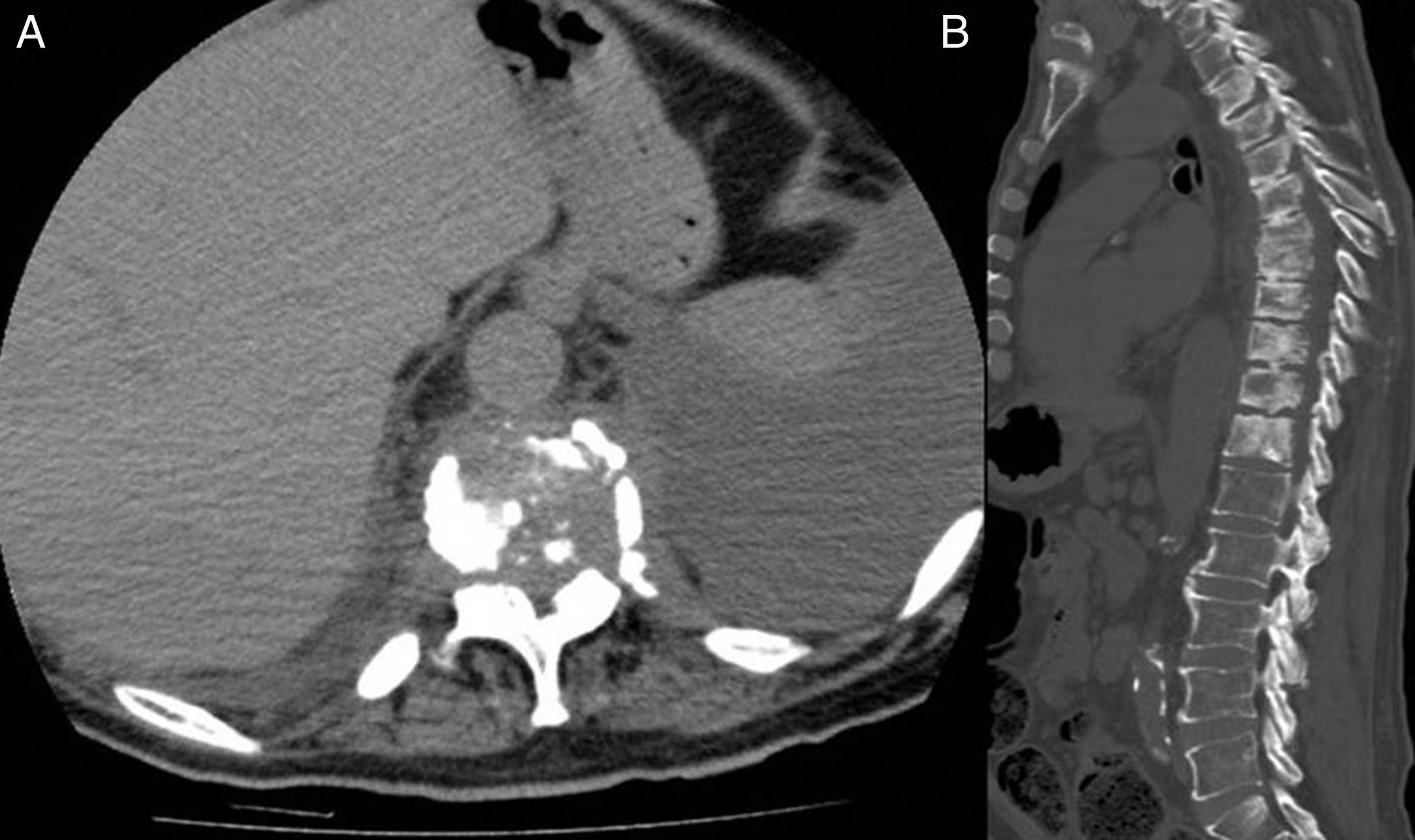
Se trata de un varón de 62 años, exfumador, hipertenso, diabético de larga evolución, hemiparético y afásico tras ictus hemorrágico frontoparietal izquierdo, presentado un año antes. La familia consultó por deterioro progresivo con dolor lumbar, sedestación inestable y debilidad del miembro inferior izquierdo de unos 6 meses de evolución. Exploración física: afebril, presión arterial 120/70mmHg, frecuencia cardiaca 80 lpm. Latido rítmico sin soplos, murmullo vesicular disminuido en ambas bases. Amiotrofia generalizada. Paresia, clonus aquíleo y Babinsky en el miembro inferior izquierdo. Hemiparesia derecha y afasia residuales. Resto de hallazgos exploratorios, anodinos. Datos de laboratorio: hemoglobina 11,7g/dl, leucocitos 11.500/mm3, neutrófilos 8.900/mm3, plaquetas 447.000/mm3; VSG 61mm/h y PCR 86,10mg/l. Bioquímica hepática y renal, iones, proteínas totales y glucosa, dentro de límites normales. La TC craneal no mostró lesiones nuevas. El electromiograma objetivó polineuropatía sensitivo-motora axonal y simétrica, y la RM de columna lumbar, rectificación de la lordosis y discreta espondilosis, sin datos indicativos de radiculopatía. Las radiografías de columna revelaron desestructuración del espacio intervertebral D7-D8, con borramiento de los platillos y disminución de la altura de ambos cuerpos vertebrales. La RM de columna dorsal evidenció importante alteración de señal de los cuerpos vertebrales D3 a D12 y de las partes blandas paravertebrales y epidurales adyacentes, con mayor afectación del disco y de los platillos del espacio D7-D8, absceso prevertebral a ese nivel y aumento de señal del cordón medular por compresión epidural (fig. 1). La TC con reconstrucciones multiplanares confirmó los hallazgos de osteomielitis dorsal con extensión epidural, paraprevertebral, y espondilodiscitis D7-D8, y además reveló derrame pleural bilateral de predominio izquierdo (fig. 2). La toracocentesis diagnóstica objetivó exudado pleural, con características de proceso inflamatorio crónico en el estudio citológico. Los hemocultivos fueron negativos. Se realizó biopsia percutánea del espacio intervertebral D7-D8, con estudio microbiológico negativo para micobacterias y positivo para P. micra, y estudio histológico indicativo de inflamación crónica inespecífica. Dados la comorbilidad del paciente y el rechazo por parte del mismo y de sus familiares a recibir antibioticoterapia por vía endovenosa, se optó por un manejo conservador basado en clindamicina 600mg por vía oral cada 8 h. Tras 4 meses, mejoraron el estado general y la debilidad en el miembro inferior izquierdo, desapareció la raquialgia y disminuyeron los reactantes de fase aguda (VSG 12mm, PCR 12.9mg/l). En la RM de control no se objetivaron cambios significativos.
RM de columna dorsal, plano sagital en secuencias eco del spin potenciadas en T1, sin (A) y con contraste (B), y en secuencia STIR (supresión grasa) (C), donde se observa extensa afectación epidural y de las partes blandas paravertebrales que reducen los diámetros del canal raquídeo, y pequeño absceso prevertebral D7-D8.
P. micra (antiguamente Peptostreptococcus micros) es una especie de cocos grampositivos anaerobios estrictos no esporulados, comensales de la orofaringe7. Aunque se ha asociado a infecciones polimicrobianas (abscesos intracraneales, infecciones de senos paranasales y periodontitis)8, su implicación en osteomielitis vertebral es rara, con solo 2 casos publicados en la literatura1,5.
En la última década, se ha descrito un aumento de las bacteriemias por gérmenes anaerobios, que parece estar relacionada con la atención sanitaria cada vez más frecuente a pacientes comórbidos con procesos subyacentes complejos, cambios en los patrones de susceptibilidad de dichos gérmenes y mejores técnicas de detección microbiológica9. En nuestro caso, habría que pensar en una diseminación hematógena espontánea a partir de la orofaringe o favorecida por eventuales broncoaspiraciones en el contexto del estado de coma que acompañó al ictus agudo presentado meses antes; otros posibles focos son bastante improbables, dados la cualidad de comensal del germen, el curso evolutivo del cuadro y la ausencia de datos exploratorios y/o microbiológicos que orientaran hacia endocarditis u otro proceso infeccioso satélite. La demora diagnóstica facilitada por la falta de sospecha ante una clínica insidiosa y atípica en un paciente ya debilitado con dificultades para comunicarse, así como por procesos intercurrentes que retrasaron las pruebas de imagen, justificarían la extensión de la afectación y el carácter crónico del proceso. La presencia concomitante de derrame pleural inflamatorio es un hallazgo muy infrecuente10, que se interpretó en el contexto de irritación pleural crónica secundariamente a la afectación paravertebral. La monoparesia izquierda con datos de piramidalismo concuerda con el hallazgo de mielopatía compresiva. Aunque el tratamiento mejoró los parámetros clínicos y analíticos, el carácter crónico de las lesiones, la ausencia de desbridamiento y drenaje del tejido abscesificado, y la falta de antibioticoterapia parenteral, justificarían la ausencia de mejoría radiológica.