Analizar la seguridad del tratamiento con antiinflamatorios no esteroideos (AINE) en embarazadas con afección reumática.
MétodosRevisión sistemática. Se definió una estrategia de búsqueda bibliográfica sensible en MEDLINE (desde 1961), EMBASE (desde 1980) y Cochrane Library (hasta enero de 2008); se definió la población (mujeres embarazadas mayores de 16 años con enfermedad reumática) y la intervención (tratamiento con AINE); se midió, como resultados, el número de recién nacidos vivos, las pérdidas fetales, la duración de la gestación y del parto, el peso del recién nacido y número y tipo de malformaciones congénitas. Se revisaron, por título y resumen, los artículos recuperados de la búsqueda y se incluyeron estudios de cohortes y de casos y controles.
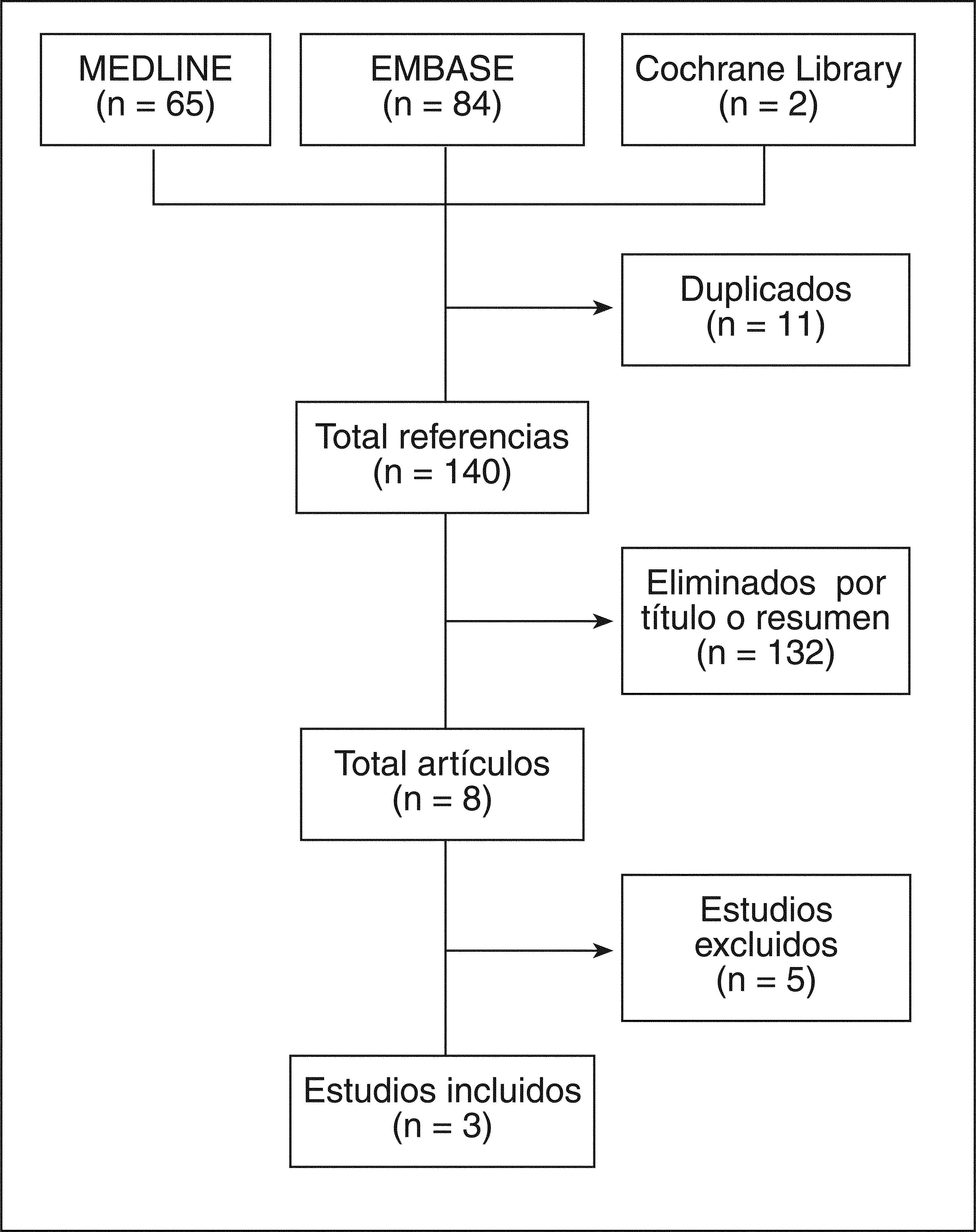
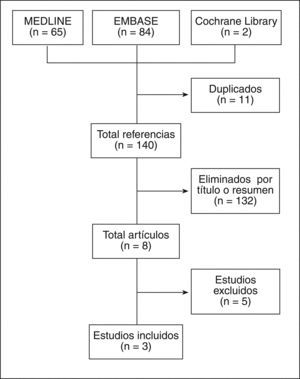
ResultadosDe un total de 149 artículos rescatados, se seleccionaron 8 para lectura en detalle, de los que finalmente se seleccionaron 3, que incluyeron a más de 2.600 pacientes embarazadas. Destaca la gran variedad en el tipo de AINE y en las medidas de desenlace. En 2 de los artículos no se encontró un aumento del riesgo de malformaciones, mientras que en el tercero se observó un aumento del riesgo de malformaciones cardíacas (odds ratio [OR]=1,86; intervalo de confianza [IC] del 95%, 1,32-2,62) y orofaciales (OR=2,61; IC del 95%, 1,01-6,78).
ConclusionesNo hay suficientes datos de que no sea seguro el uso de AINE durante el embarazo. Por otro lado, un estudio apunta que la utilización de AINE podría relacionarse con un discreto aumento en la frecuencia de malformaciones cardíacas y orofaciales, por lo que es aconsejable usar estos fármacos con precaución en el embarazo.
To analyze the security of non-steroidal anti-inflammatory drugs (NSAID) in rheumatic disease patients during pregnancy.
MethodsWe performed a systematic review using a sensitive search strategy. All studies published in MEDLINE (since 1961), EMBASE (since 1961) and Cochrane Library (up to January 2008) were selected. We defined the population (pregnant women 16 years or above with a musculoskeletal disease), the intervention (use of NSAID), and the outcomes related to safety (number of live births, stillbirths, length of gestation and of labour, birth-weight, number and type of congenital malformations). The titles and abstracts of articles retrieved from the search were reviewed and high quality cohorts and case-control studies were included.
ResultsOf a total of 149 references retrieved, only 8 were analyzed in detail, and 3 were finally included. More than 2600 pregnant patients were analyzed. There are many different NSAIDs as well as many different outcomes. Different NSAID were included as well as different outcomes. There was no increased risk of congenital malformations in two of the studies. In the third one there was an increased risk for cardiac malformations (OR=1.86; 95% CI, 1.32-2.62) and orofacial clefts (OR=2.61; 95% CI, 1.01-6.78).
ConclusionsThere is not enough information to support the negative effects of NSAIDs during pregnancy. On the other hand there is one study suggesting that the use of NSAIDs could increase the risk of cardiac and orofacial malformations in newborns, therefore these drugs should be used with caution.
El uso de antiinflamatorios no esteroideos (AINE) es muy frecuente en pacientes con enfermedades reumáticas1. La exposición durante el primer trimestre es habitual a pesar de estar clasificados como de categoría C o D (cuando se administran en el tercer trimestre)2. Se ha documentado que el uso de AINE al final del embarazo tiene como efecto el cierre prematuro del ductus arterioso3 y, en la función renal, produce oligohidramnios y anuria neonatal4. Debido a estos efectos, no está indicado el uso de AINE en el tercer trimestre del embarazo.
Sin embargo, se sabe poco acerca de los posibles efectos teratogénicos y si el beneficio de su uso en el primer trimestre supera los riesgos. Esto hace que cuando una paciente con enfermedad inflamatoria se queda embarazada, el manejo de la artritis sea un reto para su médico. La retirada de los AINE puede causar un brote inflamatorio difícil de controlar sólo con analgésicos. Normalmente las pacientes con artritis reumatoide mejoran con el embarazo, pero a veces esta mejoría se retrasa hasta el segundo o el tercer trimestre5. En ocasiones, si se produce exclusivamente afectación oligoarticular, sólo con AINE se pueden controlar los síntomas. Por esta razón se suele utilizarlos en el primer trimestre. Debido al riesgo que pueden suponer los fármacos en las gestantes hay muy poca información acerca del uso de los AINE en mujeres embarazadas con enfermedades reumáticas. Con esta revisión sistemática pretendemos determinar si los AINE se pueden utilizar con seguridad en este grupo de pacientes.
MétodosSe realizó una revisión sistemática para analizar la seguridad del uso de AINE en mujeres embarazadas. Los criterios de selección de estudios fueron:
- 1.
Estudios que incluyeran a pacientes embarazadas mayores de 16 años con enfermedad reumática.
- 2.
Estudios en que los pacientes tomaran AINE. No hubo restricción en cuanto al tipo y la dosis, pero se excluyeron los estudios en que los sujetos tomaban AINE a dosis antiagregantes y no analgésica o antiinflamatoria, así como con tratamientos tópicos. También se excluyeron los estudios en que las pacientes usaban los AINE como tocolíticos y en el posparto.
- 3.
Para valorar la seguridad se incluyeron estudios en los que analizaran algunas de las siguientes variables: número de nacidos vivos y pérdidas fetales, duración de la gestación y del parto, peso del recién nacido y malformaciones congénitas.
- 4.
En relación con el diseño de los estudios se incluyeron ensayos clínicos (EC), estudios de cohortes y estudios de casos y controles. Se excluyeron los estudios en sujetos sanos voluntarios y estudios en animales. Finalmente, se seleccionaron artículos en inglés y español.
Se buscó en las siguientes bases de datos electrónicas hasta enero de 2007: MEDLINE (desde 1960), EMBASE (desde 1980) y Cochrane Library (Central). Se buscaron tanto términos MeSH como en formato de texto libre. No se pusieron límites en cuanto a la fecha de publicación. La estrategia de búsqueda específica se detalla en la tabla 1. No se realizó búsqueda en lo publicado en los resúmenes de los congresos nacionales (SER) o internacionales (ACR, EULAR) dado el volumen de artículos rescatados en las bases de datos electrónicas.
Estrategia de búsqueda y resultados en MEDLINE
| Estrategia de búsqueda | Resultados | |
| 1 | (((((((((((((“Pregnancy”[MeSH] OR “Pregnancy Trimester, Third”[MeSH] OR “Pregnancy Trimester, Second”[MeSH] OR “Pregnancy Trimester, First”[MeSH] OR “Pregnancy Trimesters”[MeSH])) OR ((“Pregnant Women”[MeSH])))) OR ((“Pregnancy, High-Risk”[MeSH] OR “Pregnancy, Ectopic”[MeSH] OR “Pregnancy Outcome”[MeSH] OR “Pregnancy Complications”[MeSH] OR “Pregnancy, Tubal”[MeSH] OR “Pregnancy, Prolonged”[Mesh] OR “Pregnancy, Multiple” [MeSH] OR “Pregnancy, Abdominal”[MeSH] OR “Pre-Eclampsia”[MeSH]))) OR ((“Fetus”[MeSH] OR “Maternal-Fetal Relations”[MeSH]))) OR ((“Prenatal Care”[MeSH]))) OR ((pregnanc*[tiab] OR pregnant*[tiab]))) OR ((fetus[tiab] OR foetus[tiab]))) OR ((prenatal *[tiab] OR antenatal*[tiab] OR antepart*[tiab])))) | 704.835 |
| 2 | NSAID OR Nonsteroidal Anti-Inflammatory Agents OR Nonsteroidal Antiinflammatory Agents OR Analgesics, Anti Inflammatory OR Non-Steroidal Anti-Rheumatic Agents OR Non-Steroidal Antirheumatic Agents OR Aspirin-Like Agents OR Agents, Aspirin-Like OR naproxen* OR ibuprofen* OR dexibuprofen OR dexketoprofen OR flurbiprofen OR Ketoprofen OR Ketorola* OR aceclofenac OR diclofenac OR lornoxicam OR meloxicam OR piroxicam OR tenoxicam OR indometacin OR sulindac OR tolmetin OR fenilbutazon OR Phenylbutazone OR nabumeton OR celecoxib OR etoricoxib OR parecoxib OR rofecoxib OR valdecoxib OR lumiracoxib OR salicylic acid OR acetylsalicylic acid OR diflunisal OR Cyclooxygenase 2 Inhibitors OR COX-2 Inhibitors OR COX2 Inhibitors, OR Coxibs | 157.408 |
| 3 | 1 y 2 | 5-503 |
| 4 | (Musculoskeletal diseases OR Polymyalgia Rheumatica OR Lupus Erythematosus, Systemic OR vasculitis OR polymyositis OR dermatomyositis) OR (musculoskeletal diseases [tiab] OR polymyalgia[tiab] OR “lupus erythematosus systemic”[tiab] OR vasculitis[tiab] OR polymyositis[tiab] OR dermatomyositis[tiab]) | 742.806 |
| 5 | 3 y 4 | 367 |
| 6 | acute [All Fields] OR post-operative [All Fields] OR post-surgical[All Fields] OR postsurgical [All Fields] OR Postoperative Complications [MeSH] OR Intraoperative Complications [MeSH] dysmenorrhoea[All Fields] OR orthodontic [All fields] OR Cancer OR neoplasm OR cancers OR tumor OR tumors OR Benign Neoplasms OR metastasis OR metastases | 2.290.508 |
| 7 | 5 NOT 6 | 326 |
| 8 | 7, Limits: Humans, Clinical Trial, Meta-Analysis, Randomized Controlled Trial, Clinical Trial, Phase I, Clinical Trial, Phase II, Clinical Trial, Phase III, Clinical Trial, Phase IV, Comparative Study, Controlled Clinical Trial, English, Spanish | 65 |
Un único revisor analizó los artículos resultantes de la estrategia de búsqueda y realizó el análisis en detalle de los artículos incluidos. El resultado de la búsqueda, primeramente, se depuró por título y resumen o por artículo entero en caso de no haber resumen. Tras este proceso, los artículos restantes se analizaron en detalle. Finalmente, se realizó una búsqueda manual con las referencias de los artículos seleccionados para su análisis en detalle. Todas las referencias se bajaron de internet y se introdujeron en el programa Procite 5.1 para facilitar su gestión.
Para asignar la calidad metodológica de los estudios incluidos se utilizó la escala de niveles de evidencia de Oxford6 para los estudios de cohortes y de casos-controles.
ResultadosLos resultados de la búsqueda se detallan en la figura 1. Finalmente se incluyeron 3 estudios con más de 2.600 pacientes gestantes. Se observa una gran variedad en cuanto al tipo de AINE utilizado. Se incluyeron 2 estudios de cohortes (calidad 2b) y 1 estudio de casos-controles (calidad 3a). La mayoría de estos estudios incluyeron a pacientes con osteoartrosis (OA), lupus eritematoso sistémico (LES), artritis psoriásica (APs) o artritis reumatoide (AR). A continuación se describen los principales resultados de los estudios incluidos (tabla 2)7-9. El listado de artículos excluidos, así como la causa de exclusión, se detalla en la tabla 315-19.
Características de los estudios incluidos
| Estudio | Participantes e intervención | Resultados |
| Ericson et al9 (2001), estudio de casos y controles (Suecia). Calidad 3b | 2.487 mujeres (2.557 niños) expuestas a AINE. Casos: 40 niños con malformación cardíaca de madres expuestas a AINE en el primer trimestre. Controles: 40 niños sin defecto cardíaco de madres expuestas a AINE. Sólo indican tipo de enfermedad reumática en 14 casos y 18 controles. Edad al embarazo: 19-44 años | Tasa total de malformaciones: OR = 1,04; IC del 95%, 0,84-1,29. Malformaciones cardíacas (1,6%), entre ellas defectos de los septos (57,5%). Ibuprofeno: 1.129 expuestas, 15 niños con malformación (1,3%). Naproxeno: 918 expuestas, 14 malformaciones (1,5%). Diclofenaco: 574 expuestas, 8 malformaciones (1,4%) |
| Lewis et al7 (1973), estudio de cohortes retrospectivas (EE UU). Seguimiento 20 años. Calidad 2b | 103 pacientes expuestas a AAS > 3,25g en los meses 4-9 de embarazo. Grupo I: expuestas a AAS con enfermedad reumática (n = 103). Grupo II: no expuestas con enfermedad reumática (n = 52). Grupo III: no expuestas sanas (n = 50). Media de edad 26 ± 5,68 años | Aumento de la duración de la gestación en expuestas enfermas (42%, más de 42 semanas). Aumento de la duración del parto en expuestas enfermas (70% más largo). Aumento de la hemorragia media en el parto en expuestas enfermas. Reducción del peso del recién nacido de expuestas enfermas |
| Østensen et al8 (1996), estudio de cohortes prospectivas (Noruega). Calidad 2b | 88 pacientes expuestas (94 embarazos). Grupo I: expuestas a AINE, 45 (49 embarazos). Grupo II: no expuestas a AINE, 43 (45 embarazos). Media de edad, 28,4 años. Duración media de la enfermedad, 8,6 años | Nacidos vivos, 92. Pérdidas fetales, 2. Malformaciones congénitas, 2 en no expuestas a AINE. Sin aumento del tiempo de gestación. Sin aumento de la duración del parto. No hubo disminución del peso del recién nacido. No hubo aumento de hemorragia que requiriera transfusión |
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos; IC: Intervalo de confianza; OR: odds ratio.
Estudios excluidos y causas de exclusión
| Estudio | Causas de exclusión |
| Correy et al18 (1991) | Pacientes expuestas a los AINE durante el embarazo, pero no presentan afección reumática |
| Kozer et al15 (2002) | Pacientes expuestas a AAS durante el primer trimestre del embarazo, pero no presentan afección reumática |
| Li et al16 (2003) | Pacientes expuestas a AINE desde la última menstruación hasta la semana 20 del embarazo, pero sin enfermedad reumática |
| Nielsen et al17 (2001) | Pacientes embarazadas que toman AINE desde 30 días antes de la concepción hasta el parto. Sin afección reumática |
| Pons et al19 (1996) | Se trata de un caso clínico |
En el estudio de Lewis et al7 se mide la duración de la gestación, la duración del parto y la hemorragia que se produce durante el parto en tres grupos de pacientes distintos. El primero son pacientes con afección reumática expuestas a dosis de ácido acetilsalicílico (AAS) > 3g/día durante los últimos 6 meses del embarazo. El segundo grupo está formado por pacientes con enfermedad reumática que no utilizan AINE y el tercero por gestantes sanas no expuestas a estos fármacos. Observan que en las pacientes expuestas a dosis altas de AAS la duración media del embarazo es una semana más larga que en las no expuestas. El 42% de las pacientes que toman AAS tienen embarazos con una duración de más de 42 semanas. La duración media del parto es 5h más que en las pacientes no expuestas. No se observan diferencias significativas en la media del peso del recién nacido entre las gestantes con enfermedad reumática expuestas y no expuestas, pero sí al comparar con los hijos de las pacientes sanas. Otra diferencia que se observa es una pérdida media de sangre en el parto mayor en el grupo de las expuestas.
En el estudio realizado por Østensen et al8 se incluye a pacientes en 2 períodos. En el primero recogen datos de 45 pacientes y en el segundo añaden otros 43. Después dividen el total en 2 grupos, expuestos a AINE y no expuestos. Se usan dosis estándar, excepto en el caso del ibuprofeno y los salicilatos, que son menores. El fármaco más usado es el naproxeno (51%). En el primer trimestre, toma AINE el 71%; en el segundo, el 58%, y en el tercero, el 38% de las pacientes. Hubo 2 pérdidas fetales, una en cada grupo. No se observan diferencias al comparar la tasa de partos pretérmino en las expuestas y las no expuestas. La duración gestacional media es igual en los 2 grupos, 38,6 semanas. Tampoco hay diferencias estadísticamente significativas cuando se compara la duración del parto entre ambos grupos, ni al comparar el peso medio de los recién nacidos. En el grupo de las expuestas, hay 3 (6%) casos de preeclampsia, mientras que entre las no expuestas aparecen 2 (4%) casos. Respecto al sangrado durante el parto que requiera transfusión, se dan 2 casos, uno en cada grupo. Aparecen 2 malformaciones congénitas (síndrome de Turner y síndrome de Down) en el grupo de los no expuestos.
Principales resultados del estudio de casos y controlesEl artículo de Ericson et al9 tiene dos partes. Por un lado se compara la tasa de malformaciones aparecidas en hijos de madres expuestas a los AINE y la esperada en la población general, sin observar diferencias. Sin embargo, sí detectan una elevación del número de malformaciones cardíacas (odds ratio [OR] = 1,86; intervalo de confianza [IC] del 95%, 1,32-2,62). De los recién nacidos de madres (n = 1.129) que tomaban ibuprofeno, 15 (1,3%) presentaron malformaciones. Entre las 918 pacientes expuestas al naproxeno, hay 14 (1,5%) niños con defectos cardíacos. De las 574 pacientes que usaron diclofenaco, nacieron 8 (1,4%) niños con malformación cardíaca. Estas proporciones no difieren significativamente. También se detectaron 6 niños con labio leporino. En estos casos, 5 de las madres habían tomado naproxeno (OR = 2,61; IC del 95%, 1,01-6,78) y una ibuprofeno. A continuación deciden buscar las malformaciones que se asocian con cada AINE, para ello realizan un estudio de casos y controles, para lo que localizan a 40 mujeres expuestas a AINE y cuyos hijos tuvieron un defecto cardíaco y seleccionan 40 controles (sin malformación) entre mujeres expuestas a AINE. De las malformaciones cardíacas que aparecen, 23 son defectos septales ventriculares o auriculares o combinaciones de ambos (58%). En 8 (20%) casos no especifican el tipo de malformación. En estos casos no parece haber relación con el tipo de AINE.
DiscusiónLos AINE son fármacos utilizados con frecuencia en los pacientes con enfermedades reumáticas. Cuando estudiamos su efecto en el embarazo, encontramos que la mayoría de la información que poseemos viene de estudios realizados en animales10-12. En los humanos los AINE más estudiados han sido la indometacina y los salicilatos13,14. Del resto hay pocos estudios acerca de su uso en mujeres embarazadas. Los AINE se utilizan más en el primero y en el segundo trimestre del embarazo principalmente por 2 razones: a) las pacientes que están tomando medicación para estas enfermedades lo siguen haciendo hasta descubrir que están embarazadas, y b) normalmente las que siguen tomándolos sienten menos necesidad de usarlos en el último trimestre, debido a la frecuente mejoría o remisión de estas enfermedades en ese estado.
En este artículo se analizan los resultados de seguridad de uso de los AINE en el tratamiento de enfermedades reumáticas en mujeres embarazadas, mediante la revisión sistemática de la literatura. El objetivo es contribuir con la evidencia científica publicada a la hora de generar un consenso sobre el uso de AINE en mujeres embarazadas.
En el estudio realizado por Østensen et al8, a diferencia de lo observado en animales, no encuentran un aumento en la duración de la gestación ni del parto. Estos resultados difieren de los obtenidos por Lewis et al7, donde observan un incremento significativo en la duración de ambos. Lewis et al7 también observaron un aumento de la hemorragia en el parto, lo que no se aprecia en el estudio de Østensen et al8. En ambos estudios aprecian una reducción del peso de los recién nacidos de madres expuestas a AINE. Aquí aparece como factor de confusión la gravedad de la enfermedad, dato que no aparece en ninguno de esos 2 estudios, lo que no permite hacer un análisis estratificado.
Respecto a al teratogenia, mientras que Østensen et al8 no encuentran evidencia de ella en estas pacientes, Ericson et al9 observan un aumento de malformaciones cardíacas. En este estudio no encontraron una asociación específica entre un AINE concreto y las malformaciones cardíacas. Estas podrían ser debidas a un afecto general de los AINE o debido a alguna enfermedad subyacente que actúe como factor de confusión.
Un problema observado en los estudios de Ericson et al9 y Østensen et al8 es la falta de datos acerca del tiempo de exposición y las dosis utilizadas.
Entre los estudios excluidos, hay 3 que no se refieren al dolor osteomuscular, pero sí aportan información acerca del uso de los AINE en el embarazo. Debido a que presentan mayor calidad que los estudios incluidos, se describen a continuación para ampliar la información de la que disponemos.
Kozer et al15 realizan una revisión sistemática de la literatura en la que buscan datos acerca de los efectos teratogénicos del AAS durante el primer trimestre del embarazo. La tasa global de malformaciones no está elevada en los niños nacidos de madres expuestas. Sin embargo, los estudios son heterogéneos por las diferentes maneras en que se detectan las malformaciones y la variedad de edades en que se observan los defectos en los estudios. Al analizar el riesgo de malformaciones en el sistema nervioso central, éste no está elevado comparado con los niños control. En referencia a las malformaciones cardíacas no se detecta elevación del riesgo respecto a la población control. En los niños con labio leporino encontraron un aumento del riesgo en los hijos de las expuestas (OR = 2,87; IC del 95%, 2,04-4.02). También se observó una elevación del riesgo de gastrosquisis (OR = 2,87; IC del 95%, 1,44-3,88).
El estudio realizado por Li et al16 es una cohorte prospectiva en la que se evalúa si la exposición prenatal a AINE, AAS o paracetamol se asocia con un aumento del riesgo de aborto espontáneo. En él detectan un aumento del riesgo de aborto cuando los AINE y AAS se utilizan en el período más cercano a la concepción (OR = 5,6; IC del 95%, 2,3-13,7) o se usan más de una semana en el primer trimestre (OR = 8,1; IC del 95%, 2,8-23,4). No observan un aumento del riesgo con el uso de paracetamol independientemente del momento de la exposición.
Por último, Nielsen et al17 realizan 2 estudios, uno de cohortes y otro de casos y controles. En los dos se buscan malformaciones y riesgo de aborto espontáneo. En el estudio de cohortes observan 46 (4,2%) malformaciones en 1.106 embarazos de mujeres que tomaron AINE en el primer trimestre del embarazo, comparado con 564 (3,3%) en 17.259 embarazos en la cohorte de referencia (OR ajustada = 1,27; IC del 95%, 0,93-1,75). Las OR ajustadas para bajo peso y parto pretérmino entre las mujeres expuestas fueron, respectivamente, 0,79 (IC del 95%, 0,45-1,38) y 1,05 (IC del 95%, 0,8-1,39). No hubo asociación significativa. En el estudio de casos y controles observan un riesgo aumentado de aborto espontáneo en pacientes expuestas a AINE, que es mayor cuanto más cerca de la concepción está la exposición.
ConclusionesEsta revisión nos muestra la escasez de datos acerca de la seguridad de uso de AINE en el embarazo. Los datos obtenidos en mujeres con afección reumática expuestas a AINE, aunque indican un aumento de malformaciones cardíacas y orofaciales, no son concluyentes debido al bajo nivel de evidencia de los artículos incluidos. En estudios realizados en mujeres expuestas a estos fármacos sin enfermedades reumáticas, a diferencia de los anteriores, no se observa un aumento de las malformaciones cardíacas, aunque sí se detecta un aumento de defectos orofaciales, gastrosquisis y aborto espontáneo. Ante la falta de datos más concluyentes, se debería restringir el uso de AINE en el embarazo.