Evaluar sistemáticamente la literatura en relación con la aparición de osteonecrosis de mandíbula (ONM) con el uso de bisfosfonatos (BF) en el tratamiento de la osteoporosis (OP).
MétodosSe realizó una búsqueda sistemática de la literatura en Pubmed, EMBASE y la Cochrane Central Register of Controlled Trials hasta julio de 2010 incluyendo términos relativos a OP, ONM, y BF (mesh y texto libre). Se seleccionaron metaanálisis, revisiones sistemáticas y ensayos clínicos (EC), en inglés o español, que incluían pacientes>18 años de ambos sexos con OP en tratamiento con BF (por vías intravenosa y oral). Además, los estudios debían evaluar la aparición de ONM durante el tratamiento con BF. Se excluyeron los estudios que incluían pacientes con cáncer u otra enfermedad distinta de la OP, estudios en animales y ciencia básica. La selección de los artículos, tanto por título y abstract como la revisión en detalle, la realizaron 2 revisores de forma independiente. Se utilizó la escala de Oxford modificada (versión del 2001) para evaluar la calidad de los estudios incluidos.
ResultadosSe identificaron 1.422 artículos, de los que se incluyeron 18 (8 revisiones sistemáticas, 8 EC y 2 metaanálisis). La mayoría de los estudios son de buena calidad y estudiaron el uso de BF en mujeres de mediana edad con OP. La frecuencia de ONM fue baja.
ConclusionesNo hemos encontrado evidencia suficiente para afirmar que los BF por vía oral ni intravenosa utilizados exclusivamente para el tratamiento de la OP confieran un riesgo significativo de ONM al paciente (nivel de evidencia 2a, grado de recomendación B).
To systematically assess the literature related to the occurrence of osteonecrosis of the jaw (ONJ) using bisphosphonates (BP) in the treatment of osteoporosis (OP).
MethodsWe conducted a systematic literature search in PubMed, EMBASE and the Cochrane Central Register of Controlled Trials up to July 2010, including terms relating to OP, ONJ, and BP (MeSH and free text). We selected meta-analysis, systematic reviews and clinical trials (CT), English or Spanish, including patients > 18 years of both sexes with OP treated with BF (intravenous and oral). Furthermore, studies should evaluate the occurrence of ONJ during treatment with BF. We excluded studies that included patients with cancer or diseases other than OP, animal studies and basic science. The selection of articles both by title and 2 independent reviewers conducted a detailed review of the abstracts. We used the modified Oxford Scale (version 2001) to assess the quality of the included studies.
ResultsWe identified 1422 articles of which we included 18 (8 systematic reviews, 8 CT and 2 meta-analysis). Most studies were of good quality and examined the use of BF in middle-aged women with OP. Frequency of ONJ was low.
ConclusionsWe found insufficient evidence to affirm that intravenous or oral BF used exclusively for the treatment of OP lead to a significant risk of ONJ (evidence level 2a, grade B recommendation).
La osteoporosis (OP) es una enfermedad caracterizada por una resistencia ósea disminuida, que predispone al aumento del riesgo de fractura1. Su prevalencia aumenta con la edad y constituye un grave problema de salud pública, ya que puede producir resultados potencialmente devastadores y una tasa acumulativa de fracturas elevada. Se estima que hasta un 50% de las mujeres caucásicas (y 20% de los hombres) mayores de 50 años tendrán alguna fractura osteoporótica a lo largo de su vida2–4. Las fracturas con mayor relevancia son las vertebrales, las de antebrazo y, sobre todo, las de cadera. Producen deterioro funcional y aumento de la morbimortalidad, así como un incremento del uso de los recursos sociosanitarios.
Los ensayos clínicos aleatorizados (ECA) han demostrado que los bisfosfonatos (BF) aumentan la densidad mineral ósea y reducen el riesgo de fracturas5,6. Los BF nitrogenados (alendronato, risedronato, ibandronato, pamidronato y zoledronato) son la primera opción terapéutica para el manejo de la OP. Los BF son análogos del pirofosfato inorgánico; se unen, sin ser metabolizados, a la hidroxiapatita del hueso, permanecen en el mismo durante 10-12 años7,8 y son liberados en muy pequeñas cantidades durante el remodelado óseo. Inhiben la resorción osteoclástica por medio de la inhibición de la difosfato-farnesil-sintetasa. La potencia antirresortiva y la permanencia en el hueso difieren dependiendo del tipo de BF.
Por otro lado, en 2003 se publicó un primer caso clínico de osteonecrosis de mandíbula (ONM) en un paciente tratado con BF. Desde entonces, se han publicado más de 2.400 casos9, por lo general en pacientes con cáncer en tratamiento con BF por vía intravenosa. Basado en comunicaciones de casos o series de casos, se ha estimado una incidencia de ONM asociada a BF por vía intravenosa en pacientes con cáncer entre 1 y 10%10. La ausencia de concordancia en las estimaciones de incidencia se atribuye a las diferencias metodológicas para identificar los casos y a las dificultades para cuantificar con exactitud a los pacientes en tratamiento con BF. Se han publicado también algunos casos de ONM en pacientes tratados con BF por OP, pero se desconoce su incidencia real. Las estimaciones sugeridas varían entre menos de 1/100.000 y más de 1/10.000 casos-año10.
Diseñamos el presente estudio para estimar la incidencia de ONM en pacientes diagnosticados de OP que reciben tratamiento con BF.
Material y métodosSe realizó una revisión sistemática de la literatura científica dirigida a estimar la incidencia de ONM en pacientes con OP tratados con BF.
Estrategia de búsquedaLos estudios fueron identificados mediante estrategias sensibles de búsqueda bibliográfica en las principales bases de datos. Con este propósito, una experta documentalista colaboró y verificó las mismas. Los términos utilizados para la captura y sus resultados se muestran en la tabla I (disponible en la versión electrónica de este artículo). Fueron cribadas las siguientes bases de datos: Medline (desde 1996 hasta el 20 de julio del 2010), Embase (desde 1991 hasta el 20 de julio del 2010) y Cochrane Central. También se buscó en los abstracts de los congresos de EULAR y ACR de los años 2008, 2009 y 2010. No hubo restricciones de idioma. Todas las referencias recuperadas fueron manejadas en EndNote X3 (Thomson Reuters). Finalmente, se realizó una búsqueda manual mediante la revisión de las referencias de los estudios incluidos.
Criterios de selección de estudiosLos estudios recuperados mediante la anterior estrategia de búsqueda fueron incluidos si cumplían los siguientes criterios de inclusión. Los pacientes tenían que ser ≥ 18 años con OP, de cualquier etiología no maligna, y recibir tratamiento para la OP con uno de los bisfosfonatos (ácido alendrónico, etidronato disódico, ácido ibandrónico, pamidronato disódico, risedronato sódico o ácido zoledrónico) o con ranelato de estroncio. Se incluyeron metaanálisis, revisiones sistemáticas (RS) y EC. El grupo comparador en los EC podía ser placebo o un fármaco activo. Se debía analizar la presencia de ONM como medida de desenlace. Se excluyeron estudios en animales y de ciencia básica.
Selección de los estudios, recopilación de datos y análisisDos revisores examinaron los títulos y los resúmenes de los artículos recuperados según los criterios de selección de forma independiente. Este proceso se llevó a cabo en sesiones de 20 min. Los 2 revisores recolectaron los datos de los estudios incluidos utilizando formularios normalizados ad hoc. Toda la recolección de artículos fue doble e independiente. Uno de los revisores introdujo los datos de los formularios en hojas de cálculo. Si, al hacer esto, el revisor encontraba alguna discrepancia entre su información y la del otro revisor, entonces se llegaba a un consenso revisando el artículo original o preguntando al mentor. Los artículos que no cumplían todos los criterios de inclusión o que tenían datos insuficientes fueron excluidos. Para clasificar la calidad, se utilizó una modificación del Oxford Centre for Evidence-based Medicine Levels of Evidence11 en la que los niveles de evidencia se corresponden con: 1a) revisión sistemática de ECA, con homogeneidad, o sea que incluya estudios con resultados comparables y en la misma dirección; 1b) ECA individual (con intervalos de confianza estrechos); 1c) eficacia demostrada por la práctica clínica y no por la experimentación; 2a) revisión sistemática de estudios de cohortes, con homogeneidad; 2b) estudio de cohortes individual y ensayos clínicos aleatorios de baja calidad (< 80% de seguimiento); 2c) estudios de investigación de «Resultados» y ecológicos; 3a) RS de estudios de casos y controles con homogeneidad; 3b) estudios individuales de casos y controles; 4) serie de casos y estudios de cohortes y casos y controles de baja calidad; 5) opinión de expertos sin valoración crítica explícita, o basada en fisiología, investigación de laboratorio o «primeros principios». Se construyeron tablas de evidencia. El metaanálisis fue planeado solo en caso de que hubiera suficiente homogeneidad entre los estudios incluidos.
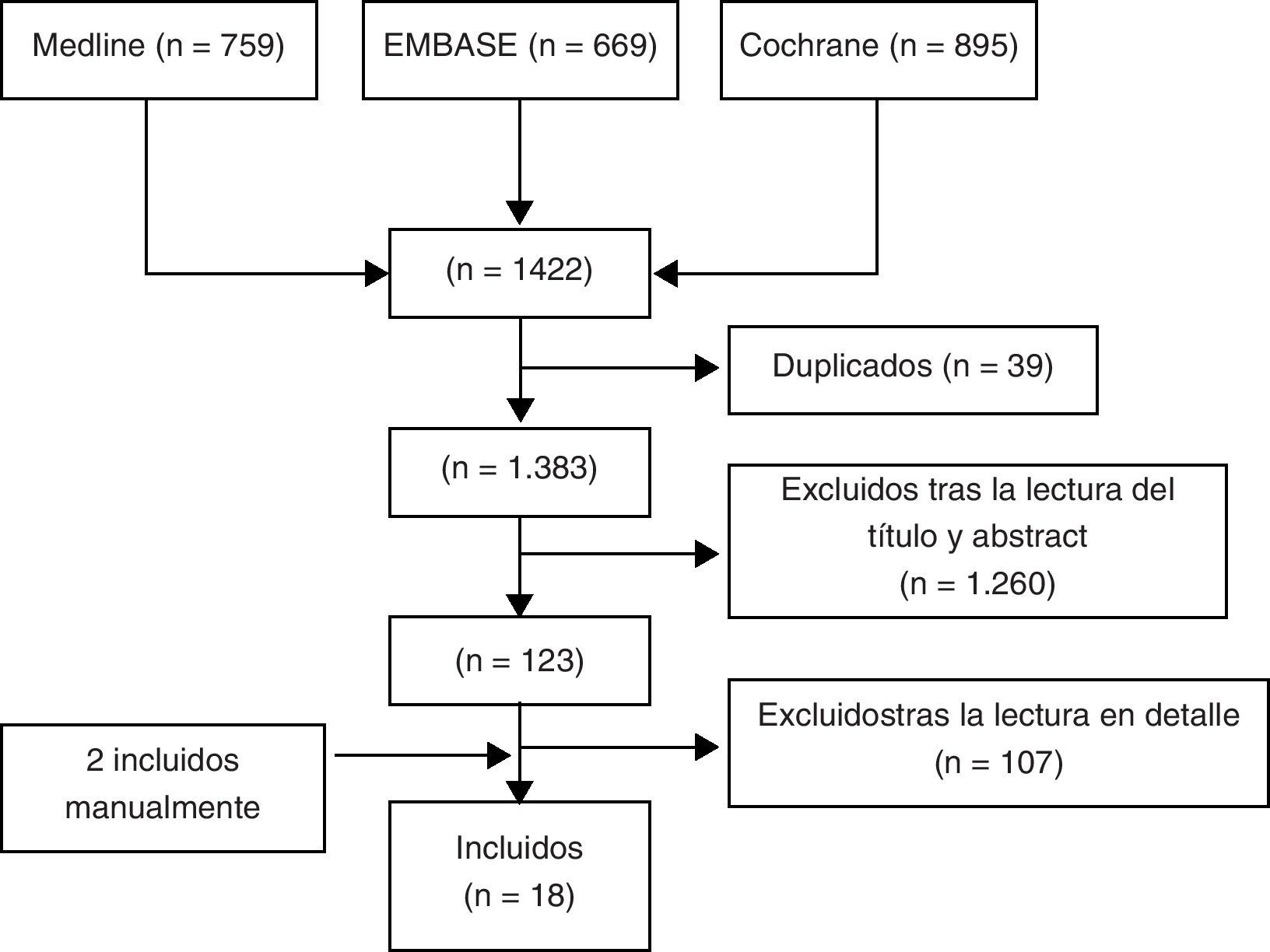
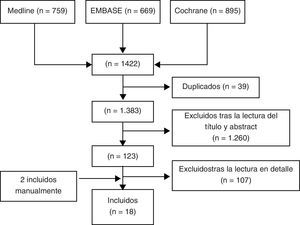
ResultadosSe identificaron un total de 1.422 artículos, de los que finalmente se incluyeron 18 (fig. 1). En la tabla II mostramos los estudios excluidos y los motivos de exclusión (disponible en la versión electrónica de este artículo). De los 18 artículos seleccionados podemos diferenciar 8 RS9,10,12–17 (véase la tabla 1), 7 ECA doble ciego y controlados18–24 y un EC abierto25 (tabla 2) y 2 metaanálisis de ECA de alendronato5 y risedronato6 (tabla 3). La mayoría de los estudios son de buena calidad y estudiaron el uso de BF en mujeres de mediana edad con OP.
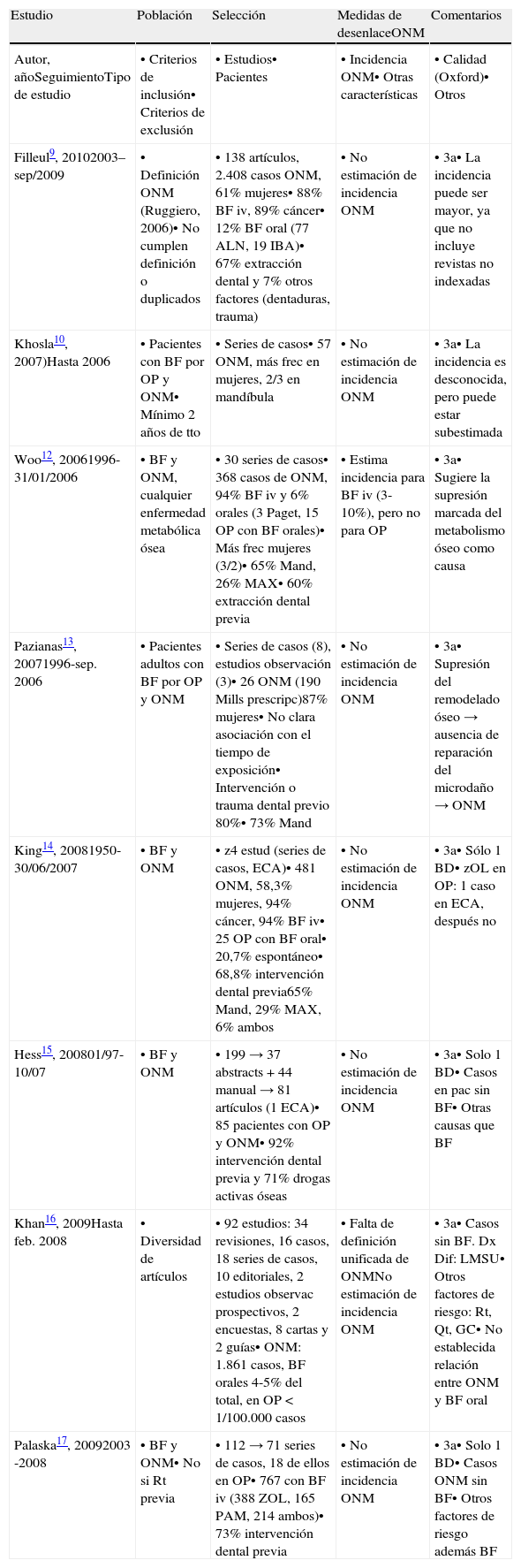
Artículos seleccionados. Revisiones sistemáticas
| Estudio | Población | Selección | Medidas de desenlaceONM | Comentarios |
| Autor, añoSeguimientoTipo de estudio | • Criterios de inclusión• Criterios de exclusión | • Estudios• Pacientes | • Incidencia ONM• Otras características | • Calidad (Oxford)• Otros |
| Filleul9, 20102003–sep/2009 | • Definición ONM (Ruggiero, 2006)• No cumplen definición o duplicados | • 138 artículos, 2.408 casos ONM, 61% mujeres• 88% BF iv, 89% cáncer• 12% BF oral (77 ALN, 19 IBA)• 67% extracción dental y 7% otros factores (dentaduras, trauma) | • No estimación de incidencia ONM | • 3a• La incidencia puede ser mayor, ya que no incluye revistas no indexadas |
| Khosla10, 2007)Hasta 2006 | • Pacientes con BF por OP y ONM• Mínimo 2 años de tto | • Series de casos• 57 ONM, más frec en mujeres, 2/3 en mandíbula | • No estimación de incidencia ONM | • 3a• La incidencia es desconocida, pero puede estar subestimada |
| Woo12, 20061996-31/01/2006 | • BF y ONM, cualquier enfermedad metabólica ósea | • 30 series de casos• 368 casos de ONM, 94% BF iv y 6% orales (3 Paget, 15 OP con BF orales)• Más frec mujeres (3/2)• 65% Mand, 26% MAX• 60% extracción dental previa | • Estima incidencia para BF iv (3-10%), pero no para OP | • 3a• Sugiere la supresión marcada del metabolismo óseo como causa |
| Pazianas13, 20071996-sep. 2006 | • Pacientes adultos con BF por OP y ONM | • Series de casos (8), estudios observación (3)• 26 ONM (190 Mills prescripc)87% mujeres• No clara asociación con el tiempo de exposición• Intervención o trauma dental previo 80%• 73% Mand | • No estimación de incidencia ONM | • 3a• Supresión del remodelado óseo→ausencia de reparación del microdaño→ONM |
| King14, 20081950-30/06/2007 | • BF y ONM | • z4 estud (series de casos, ECA)• 481 ONM, 58,3% mujeres, 94% cáncer, 94% BF iv• 25 OP con BF oral• 20,7% espontáneo• 68,8% intervención dental previa65% Mand, 29% MAX, 6% ambos | • No estimación de incidencia ONM | • 3a• Sólo 1 BD• zOL en OP: 1 caso en ECA, después no |
| Hess15, 200801/97-10/07 | • BF y ONM | • 199→37 abstracts+44 manual→81 artículos (1 ECA)• 85 pacientes con OP y ONM• 92% intervención dental previa y 71% drogas activas óseas | • No estimación de incidencia ONM | • 3a• Solo 1 BD• Casos en pac sin BF• Otras causas que BF |
| Khan16, 2009Hasta feb. 2008 | • Diversidad de artículos | • 92 estudios: 34 revisiones, 16 casos, 18 series de casos, 10 editoriales, 2 estudios observac prospectivos, 2 encuestas, 8 cartas y 2 guías• ONM: 1.861 casos, BF orales 4-5% del total, en OP<1/100.000 casos | • Falta de definición unificada de ONMNo estimación de incidencia ONM | • 3a• Casos sin BF. Dx Dif: LMSU• Otros factores de riesgo: Rt, Qt, GC• No establecida relación entre ONM y BF oral |
| Palaska17, 20092003 -2008 | • BF y ONM• No si Rt previa | • 112→71 series de casos, 18 de ellos en OP• 767 con BF iv (388 ZOL, 165 PAM, 214 ambos)• 73% intervención dental previa | • No estimación de incidencia ONM | • 3a• Solo 1 BD• Casos ONM sin BF• Otros factores de riesgo además BF |
ONM: osteonecrosis de mandíbula; OP: osteoporosis; BF: bisfosfonatos; iv: intravenoso; tto: tratamiento; frec: frecuente; Mand: mandíbula; MAX: maxilar; ECA: ensayo clínico aleatorizado; Rt: radioterapia; Qt: quimioterapia; GC: glucocorticoides; ZOL: ácido zolendrónico; ALN: alendronato; IBA: ibandronato; iv: intravenoso; PAM: pamidronato.
Artículos seleccionados. Ensayos clínicos controlados
| Estudio | Población | Intervención | Medidas de desenlaceONM | Comentarios |
| Autor, añoSeguimientoTipo de estudio | • Criterios de inclusión• Criterios de exclusión | • Estudios• Pacientes | • Incidencia ONM• Otras características | • Calidad (Oxford)• Otros |
| Black18, 200660 mesesECA doble ciego placebo control | • 1.099 mujeres con OP, edad media 73 años±5 | • ALN 10mg/día• ALN 5mg/día• Placebo• Cointervención: calcio+vit. D | • No casos de ONM | • 1b |
| Voskaridou19, 200612 mesesECA doble ciego placebo control | • 66, 66% mujeres, edad media 44 años ± 11• Pacientes con talasemia y OP | • ZOL iv 4mg/6m• ZOL iv 4mg/3m• Placebo• Cointervención: calcio | • No casos de ONM | • 2a |
| Black20, 200736 mesesECA doble ciego placebo control | • 7.765 (3.889 ZOL), mujeres posmenop y OP edad media 73 años±5 | • ZOL iv 5mg/12 mes• Placebo• Cointervención: calcio+vit. D | • ZOL: 1 caso (0,000026%)• PLB: 1 caso (0,000026%) | • 1b• 7 casos ON cad o rod, 4 ZOL y 3 en placebo |
| Lyles21, 200760 mesesECA doble ciego placebo control | • 2.127, 76% mujeres, edad media 74 años ± 9, con fract cadera < 90 días, sin tto con ranelato o flúor previo | • ZOL iv 5mg/12m• Placebo• Cointervenciones calcio+vit. D | • No casos de ONM | • 2c |
| Eisman22, 200824 mesesECA doble ciego placebo control | • 1.395 mujeres posmenop y OP, edad media 66 años ± 6 | • IBN iv 2mg/2m• IBN iv 3mg/3m• IBN vo 2,5mg/día• Placebo | • No casos de ONM en 1.089 pacientes con IBN durante 2 años | • 2c |
| Reid23, 2009^p12 mesesECA doble ciego placebo control | • 545, 68% mujeres, edad media 53 años±14 en tto con corticoides | • ZOL iv 5mg/12m• RIS vo 5mg/día• Placebo• Cointervención: calcio+vit. D | • No casos de ONM | • 1b |
| Orwoll24, 201012 mesesECA doble ciego placebo control | • 135 hombres con OP sin tto, edad media 64 años±11• Estratificación por testosterona | • IBN oral 150mg/mes• Placebo | • No casos de ONM | • 2c |
| Jeffcoat25, 200636 mesesEC abierto | • 50 mujeres posmenop y OP que precisan implantes dentales (220) | • ALN 70mg/sem• RIS 35mg/semPlacebo | • No casos de ONM ni diferencias en la pérdida de implantes | • Jadad 1 |
ONM: osteonecrosis de mandíbula; OP: osteoporosis; mg: miligramo; m: mes; iv: intravenoso; vo: vía oral; tto: tratamiento; frec: frecuente; vit. D: vitamina D; ECA: ensayo clínico aleatorizado; ZOL: ácido zolendrónico; ALN: alendronato; IBA: ibandronato; RIS: risedronato; PLB: placebo; cad: cadera; rod: rodilla; fract: fractura; tto: tratamiento.
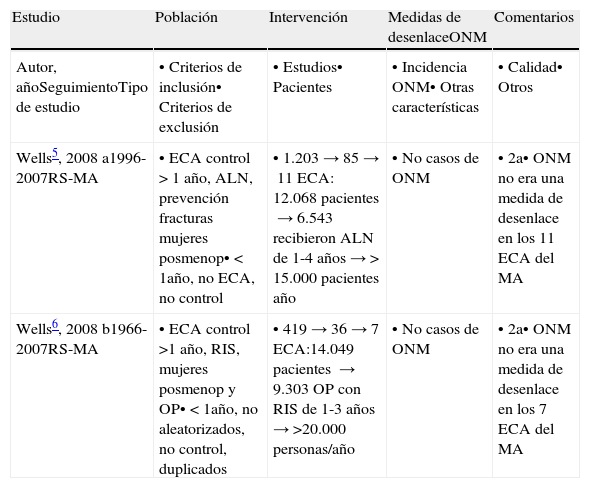
Artículos seleccionados. Metaanálisis
| Estudio | Población | Intervención | Medidas de desenlaceONM | Comentarios |
| Autor, añoSeguimientoTipo de estudio | • Criterios de inclusión• Criterios de exclusión | • Estudios• Pacientes | • Incidencia ONM• Otras características | • Calidad• Otros |
| Wells5, 2008 a1996-2007RS-MA | • ECA control > 1 año, ALN, prevención fracturas mujeres posmenop• < 1año, no ECA, no control | • 1.203→85→11 ECA: 12.068 pacientes→6.543 recibieron ALN de 1-4 años→> 15.000 pacientes año | • No casos de ONM | • 2a• ONM no era una medida de desenlace en los 11 ECA del MA |
| Wells6, 2008 b1966-2007RS-MA | • ECA control >1 año, RIS, mujeres posmenop y OP• < 1año, no aleatorizados, no control, duplicados | • 419→36→7 ECA:14.049 pacientes →9.303 OP con RIS de 1-3 años→>20.000 personas/año | • No casos de ONM | • 2a• ONM no era una medida de desenlace en los 7 ECA del MA |
ONM: osteonecrosis de mandíbula; OP: osteoporosis; BF: bisfosfonatos; MA: metaanálisis; ALN: alendronato.
En relación con las RS incluidas, una de ellas12 identificó, hasta enero del 2006, 368 casos de ONM de los que 15 (4%) ocurrieron en pacientes con OP tratados con BF orales. Otra13, basada en una extensa búsqueda de casos, series de casos y estudios observacionales en pacientes tratados con BF para la OP exclusivamente, desde el 2003 hasta septiembre del 2006, identificó 26 casos de ONM en 11 estudios, lo que refleja una incidencia muy baja de ONM frente a las 190 millones de prescripciones de BF estimadas para la OP. Los pacientes fueron mayoritariamente mujeres (87%), con una edad muy variable (39-83), y por lo general presentaban un antecedente de intervención o trauma dental (80%).
En 2007 se publicó un informe de la American Society for Bone and Mineral Research (ASBMR) sobre ONM asociada a BF en el que se presentó una revisión sistemática de ONM en pacientes con OP tratados con BF por vía oral, que aportó un total de 57 casos, la mayoría con BF por vía intravenosa (iv)10. En dicho informe sugirieron que la incidencia real podría ser mayor que las publicadas hasta ahora, debido a factores de confusión.
Durante los siguientes años, se produjo un incremento progresivo de comunicaciones de ONM en pacientes que recibían BF para el tratamiento de la OP. Hasta septiembre del 2009, otra revisión9 encontró 2.408 casos de ONM asociada a BF, de los que 178 correspondían a pacientes con OP.
Sobre la base de los resultados de estas RS9,10,12–17, se considera que en menos del 25% la ONM aparece de forma espontánea, localizándose con mayor frecuencia en mandíbula (65-70%), pudiendo afectar simultáneamente a ambos huesos (5-10%). Los factores que se asociaron a su aparición fueron principalmente las intervenciones dentales y, en menor medida, prótesis dentales defectuosas, traumatismos, exostosis ósea, tratamientos farmacológicos (corticoides), etc. Para algunos estudios no existió una clara dependencia del tiempo de exposición13, pero otros reflejaron un tiempo mínimo de 2 años y un tiempo medio de 4,6 años de exposición a BF, para el desarrollo de ONM10,17. Alrededor del 80% de los pacientes eran mayores de 60 años y predominantemente del sexo femenino13. No se ha comunicado ningún caso de ONM asociada al uso de ranelato de estroncio en la OP.
Ensayos clínicos controladosSolo algunos de los ensayos clínicos más recientes hacen referencia a la osteonecrosis maxilar como posible acontecimiento adverso del tratamiento de la OP con BF. En general, son ensayos clínicos de eficacia y seguridad de al menos 1 año de duración. Por su frecuencia y el volumen de pacientes incluidos, cabe destacar los realizados con zoledronato. El tratamiento durante 5 años con zoledronato 5mg iv anual vs. placebo en 2.127 pacientes mayores de 50 años que habían presentado una fractura de cadera en los últimos 3 meses no aportó ningún caso de ONM21. Tampoco se comunicó ningún caso de ONM, a pesar de que se realizó una vigilancia activa, en 66 pacientes con talasemia y OP tratados durante 1 año con 2 pautas diferentes de zoledronato iv (4mg/6 meses o cada 3 meses) vs. placebo19, ni en 545 pacientes con OP por glucocorticoides tratados durante un año con una dosis de 5mg de zoledronato iv vs. 5mg de risedronato oral23. Finalmente, tampoco se produjo ninguna comunicación espontánea en un ECA realizado en 7.765 mujeres entre 65 y 89 años, con OP posmenopáusica, que estudiaba la eficacia y la seguridad de zoledronato iv 5mg anual vs. placebo20. La ocurrencia de ONM no fue una variable principal de estudio, pero con el estudio en marcha se decidió valorar de forma objetiva e independiente los acontecimientos adversos maxilofaciales para identificar una posible asociación. Tras la revisión de la base de datos de acontecimientos adversos, se identificó a 101 pacientes en el grupo de zoledrónico y 127 pacientes en el grupo de placebo que tenían potenciales eventos adversos maxilofaciales que cumplían los criterios para una investigación y ulterior adjudicación a ONM. El comité independiente de adjudicación, formado por 5 especialistas experimentados resolvió que 2 pacientes (uno de cada grupo de tratamiento) tenían una lesión que cumplía con los criterios de la definición de ONM. En ambos casos se produjo un retraso en la curación tras una manipulación quirúrgica26.
La ONM tampoco fue una variable principal en ninguno de los ECA con ibandronato y en 2 de ellos se menciona que no hubo comunicación de ningún caso de ONM. Uno de ellos comparó 2 pautas intermitentes iv con la pauta oral diaria de ibandronato durante 2 años, en 1.395 mujeres entre 55 y 80 años con OP posmenopáusica22 y el otro la eficacia y seguridad de ibandronato (150mg vo mensual) frente a placebo en varones jóvenes y sanos con OP24.
El estudio FLEX18 comparó el efecto de continuar o suspender el tratamiento en 1.099 mujeres que habían sido tratadas con alendronato en el estudio FIT durante 5 años. A pesar de que un número importante de mujeres recibió tratamiento con alendronato durante muchos años, no se recibió ninguna comunicación de ONM. Entre las mujeres que suspendieron el tratamiento a los 5 años y las que continuaron hasta los 10 años, no hubo diferencias en la ocurrencia de ONM.
En la mayoría de casos de ONM descritos en pacientes con OP tratados con BF, los pacientes habían sido sometidos a intervenciones dentales de diferente índole. En un ensayo clínico abierto se comparó el resultado de 220 implantes dentales colocados en 50 mujeres con OP posmenopáusicas25. La mitad recibió tratamiento con BF semanales (alendronato 70mg o risedronato 35mg) y la otra mitad no recibió tratamiento. Los criterios de valoración principal fueron la pérdida de implantes y la ocurrencia de ONM. No hubo ningún caso de ONM ni diferencias en la pérdida de implantes.
MetaanálisisFinalmente, tampoco se encontró ningún caso de ONM asociada a BF en los metaanálisis de los ensayos clínicos controlados, de al menos un año de duración para el tratamiento de mujeres con OP posmenopáusica con alendronato y risedronato17,18.
DiscusiónSe han descrito casos de ONM en personas tratadas con BF y, más recientemente, con denosumab. También se han descrito en individuos que nunca han tomado estos fármacos.
Inicialmente, los casos fueron descritos en pacientes con enfermedades neoplásicas que habían recibido grandes dosis de BF por vía iv. La comunicación creciente de casos de ONM en pacientes con OP tratados con BF durante los últimos años, generó alarma en la comunidad científica y en la población general. Ante la escasez de evidencia científica en un tema tan controvertido, diferentes sociedades científicas han publicado recomendaciones basadas en las opiniones de expertos27,28.
No se conoce la incidencia exacta y fiable de ONM en la población general. En los pacientes que reciben BF para tratar la OP, las estimaciones oscilan, según la ASBMR10, entre menos de un caso por cada 100.000 pacientes y año de tratamiento con BF, extraídas de la vigilancia epidemiológica y de un estudio retrospectivo alemán, y ≥ un caso por 10.000 habitantes, de un estudio australiano con muchas limitaciones metodológicas realizado por encuesta postal. Cuando se realizaron la mayoría de los ECA de los BF vo en OP, la ONM no se asociaba a los BF, por lo que no se recogieron casos compatibles. Por el contrario, en los estudios realizados con ácido zoledrónico en OP posmenopáusica y OP inducida por corticoides se recogieron los casos posibles de ONM. Solo en el estudio de OP posmenopáusica (HORIZON) se recogieron 2 casos de ONM, uno en cada grupo de tratamiento (placebo y ácido zoledrónico), por lo que se concluyó que el ácido zoledrónico a las dosis que se utiliza para el tratamiento de la OP (5mg iv anual) no incrementa el riesgo de ONM21. Dos amplios estudios de casos y controles, bien diseñados, tampoco observaron asociación entre el uso de BF vo y el riesgo de ONM29,30.
Se conocen diferentes mecanismos potenciales, pero la fisiopatología de la ONM aún no está clara31. Algunos datos apoyan la relación dosis-respuesta entre ONM y BF. La dosis altas de BF, la potencia antirresortiva y la duración del tratamiento se relacionan con la aparición de ONM. De hecho, la incidencia estimada es mucho mayor en pacientes que reciben BF iv a dosis altas por patologías malignas (1-10%) que en los pacientes tratados con BF (vo o iv) por OP, aunque no se puede descartar que factores relacionados con las neoplasias contribuyan al desarrollo de la ONM. La aparición de nuevos casos de ONM con otro potente inhibidor de la resorción ósea como denosumab hace pensar que la supresión del recambio óseo desempeñe un papel relevante en esta complicación. De acuerdo con Compston31, múltiples factores de riesgo locales y sistémicos parecen estar implicados en la patogénesis de la ONM asociada a BF, pero se desconoce la contribución exacta de cada uno. En esta RS, hemos podido constatar que la ONM en pacientes con OP en tratamiento con BF, se localiza con mayor frecuencia en mandíbula y que en la mayoría de los casos su aparición se asoció a intervenciones dentales previas. En algunos estudios no se encontró una clara dependencia del tiempo de exposición, pero en otros se estableció un tiempo mínimo de 2 años de exposición a BF para el desarrollo de ONM. Diferentes sociedades científicas consideran que los pacientes que llevan < 3 años con BF para OP pueden someterse a tratamientos dentales sin un riesgo elevado de desarrollar ONM10,27,28. Finalmente, la mayoría de los pacientes que desarrollaron ONM eran mayores de 60 años y predominantemente del sexo femenino, y tenían enfermedades y tratamientos concomitantes.
En esta RS, limitada a otras RS y ensayos clínicos que tuvieran la ONM como medida de resultado, no hemos encontrado evidencia suficiente para afirmar que los BF vo ni vi utilizados exclusivamente para el tratamiento de la OP confieran un riesgo significativo de ONM al paciente (nivel de evidencia 2a, grado de recomendación B). No obstante, debemos tener en cuenta que, por lo general, los pacientes incluidos en los ensayos clínicos no representan a la población general, ya que suelen tener menos comorbilidad y menos tratamientos concomitantes que esta.
Hasta septiembre de 2009 se han publicado 178 casos de ONM. Seguramente, no están todos los casos ocurridos ni son ONM todos los publicados. En cualquier caso, la incidencia comunicada en pacientes que reciben BF es muy baja en comparación con la prevalencia de OP, con el riesgo de fracturas y con el volumen de prescripciones de BF.
En resumen, la utilización correcta de los BF en pacientes con riesgo elevado de fractura hasta la fecha parece ofrecer una relación riesgo/beneficio favorable al uso de BF en esta población. Aún queda por definir, la duración óptima del tratamiento, teniendo en cuenta que la incidencia de la ONM parece relacionarse con la duración del tratamiento y que el fármaco acumulado en el hueso (hasta 12 años) mantiene su capacidad antirresortiva.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.