Actualizar el estudio de la asociación entre obesidad y respuesta al tratamiento en artritis psoriásica.
MétodosActualización de una revisión sistemática previa, incluyendo ensayos clínicos aleatorizados, estudios longitudinales y casos-control en artritis psoriásica en los que se evaluase obesidad como predictor de eficacia o toxicidad. Los riesgos de sesgos se evaluaron con escalas validadas. Se realizó metaanálisis de los resultados de estudios con variables de desenlace y medidas del peso similares.
ResultadosSe incluyeron 21 estudios (6 ensayos clínicos aleatorizados, 6 estudios longitudinales, 7 registros y un caso-control), de calidad en general moderada. El riesgo de no respuesta ACR20 si el peso es≥100kg se estimó en OR=1,42 (1-2,08) y el de retirar el tratamiento en una OR de 1,60 (IC 95%: 1,34-1,92).
ConclusionesParece existir un mayor riesgo de retirada del tratamiento por ineficacia y dificultad para conseguir remisión en pacientes con artritis psoriásica si son obesos.
To update the study of the association between obesity and treatment response in psoriatic arthritis.
MethodsUpdating a systematic review of clinical trials, prospective or retrospective longitudinal studies and case-control studies in psoriatic arthritis in which obesity was assessed as a predictor of efficacy or toxicity. Risks of bias were assessed with validated scales. A meta-analysis of the results of studies with similar outcome variables and weight measurements was performed.
ResultsTwenty-one studies were included (6 review of clinical trials, 6 longitudinal studies, 7 registers and one case-control studie), with moderate quality. The risk of achieving an ACR20 response if weight≥100kg was estimated at OR=1.42 (1-2.08) and that of withdrawing treatment in an OR of 1.60 (95% CI: 1.34 - 1.92).
ConclusionsThere seems to be a greater risk of withdrawal of treatment due to inefficacy and difficulty in achieving remission in patients with psoriatic arthritis if they are obese.
Más de la mitad de los pacientes con artritis psoriásica (APs) presenta al menos una comorbilidad asociada, con su consecuente impacto negativo sobre la enfermedad y la calidad de vida1,2. El reconocimiento y tratamiento de las comorbilidades es fundamental para tratar de forma segura y efectiva a los pacientes con APs, ya que estas comorbilidades a menudo tienen implicaciones no solo en la función y la calidad de vida, sino también en las decisiones terapéuticas3–6. La asociación de comorbilidades dificulta en muchas ocasiones el tratamiento de la enfermedad de base y condiciona una menor supervivencia1,7,8.
Entre estas comorbilidades, en la APs destacan la obesidad y el síndrome metabólico y sus complicaciones; esto es, diabetes, hígado graso, hipertensión y eventos cardiovasculares9,10. La asociación entre obesidad e inflamación está bien estudiada y se debe a que el tejido adiposo produce factores proinflamatorios, las adipocinas, que podrían influir en el desarrollo y la gravedad de la enfermedad inflamatoria11,12. Según Bhole et al. los porcentajes de obesidad en pacientes con APs (n=644), psoriasis (n=448), artritis reumatoide (n=350) y la población general, son del 37, 29, 27 y 18% respectivamente13. Por otro lado, el tratamiento con inhibidores del factor de necrosis tumoral-alfa (TNFα) se ha asociado con un aumento de peso, tanto en pacientes con psoriasis como en APs14, lo que debe ser tenido en cuenta en el seguimiento de estos pacientes.
En una revisión previa habíamos descrito que la obesidad y el síndrome metabólico podrían tener un efecto negativo sobre la actividad de la APs, tanto en términos de ausencia de remisión como de imposibilidad de lograr una actividad mínima o supervivencia del fármaco15. También identificamos un estudio, realizado por Schmajuk et al.16, que intentaba responder a la pregunta de si la obesidad se asociaba a mayor toxicidad hepática por metotrexato. Sin embargo, esta revisión previa se basaba solo en 7 estudios muy heterogéneos, sobre todo en la medida de la respuesta, y dejaba pendiente de confirmar si la obesidad se asocia a otros tipos de toxicidad. Desde esa revisión hasta ahora, se han publicado varios estudios que podrían ayudar a entender mejor este problema. De este modo, el objetivo de esta revisión sistemática es actualizar la revisión realizada 2015 y estudiar la asociación entre obesidad y toxicidad o fallo de respuesta en pacientes con APs.
MétodosSe replicó la estrategia de búsqueda de la revisión previa en las bases de datos Medline (vía PubMed) y Embase hasta mayo de 2018, con una ampliación posterior de la búsqueda para añadir nuevos términos. Para la construcción de la pregunta se siguió la estrategia PICO (P: artritis psoriásica y obesidad; I: fármacos con indicación aprobada en el momento actual para APs; O: toxicidad específica o general, supervivencia del fármaco, remisión u otros criterios de respuesta indicados en cada estudio de manera específica). Las estrategias de búsqueda utilizadas se encuentran disponibles como material adicional (tabla suplementaria-estrategias).
Se establecieron los siguientes criterios de selección de los estudios: 1) todos los pacientes debían tener APs o existir un análisis diferenciado de pacientes con APs; 2) el efecto del factor obesidad, o en su defecto, del índice de masa corporal (IMC), se debía haber estudiado como factor predictor principal o secundario; 3) el desenlace (variable principal) debería ser toxicidad, sea esta específica o en general: hepatotoxicidad (aumento enzimas, fibrosis, cirrosis, hepatocarcinoma por hígado graso no alcohólico debido a síndrome metabólico), resistencia a la insulina, dislipidemia, hipertensión arterial, hiperuricemia, o respuesta al tratamiento, en términos de algún desenlace validado en APs (supervivencia o retención del fármaco, remisión, minimal disease activity (mínima actividad de la enfermedad, MAE), criterios de respuesta, disminución en escalas o función); y 4) el estudio debía ser un ensayo clínico, un estudio longitudinal prospectivo o retrospectivo o un caso-control, pero no se aceptaban series de casos o estudios transversales. Se excluyeron estudios en los que solo se midiera la respuesta en piel.
Todas las citas resultantes de las búsquedas se introdujeron en el programa EndNote® para facilitar su gestión. Una revisora (TO) realizó el cribado por título y abstract y mantuvo para revisión detallada todos aquellos que ofrecían dudas de si cumplían o no criterios de selección. En caso de duda consultó con los otros revisores.
De los artículos revisados en detalle, se recogieron todos los datos de la descripción de la muestra y el objetivo del estudio, el diseño y duración del seguimiento, los fármacos empleados, la definición de obesidad y las variables utilizadas y su medida. De los estudios excluidos tras revisión detallada se recogió el motivo de exclusión.
Para la evaluación de los riesgos de sesgos de los estudios se utilizó la escala sugerida por Cochrane para los ensayos clínicos17 y la escala de Newcastle-Ottawa para los estudios observacionales18.
Se realizó un análisis cualitativo de la información recogida por tipo de estudio y población estudiada, por calidad y por resultados específicos. Se llevó a cabo además un metaanálisis con modelos de efectos aleatorios. Dada la heterogeneidad de las medidas de eficacia presentadas, se extrajeron resultados como valores absolutos y se calculó en odds ratio (OR) y los intervalos de confianza (IC). La heterogeneidad de calculó mediante la prueba estadística de I2. Para poder explicar la heterogeneidad, se realizaron análisis de sensibilidad cuando fue necesario.
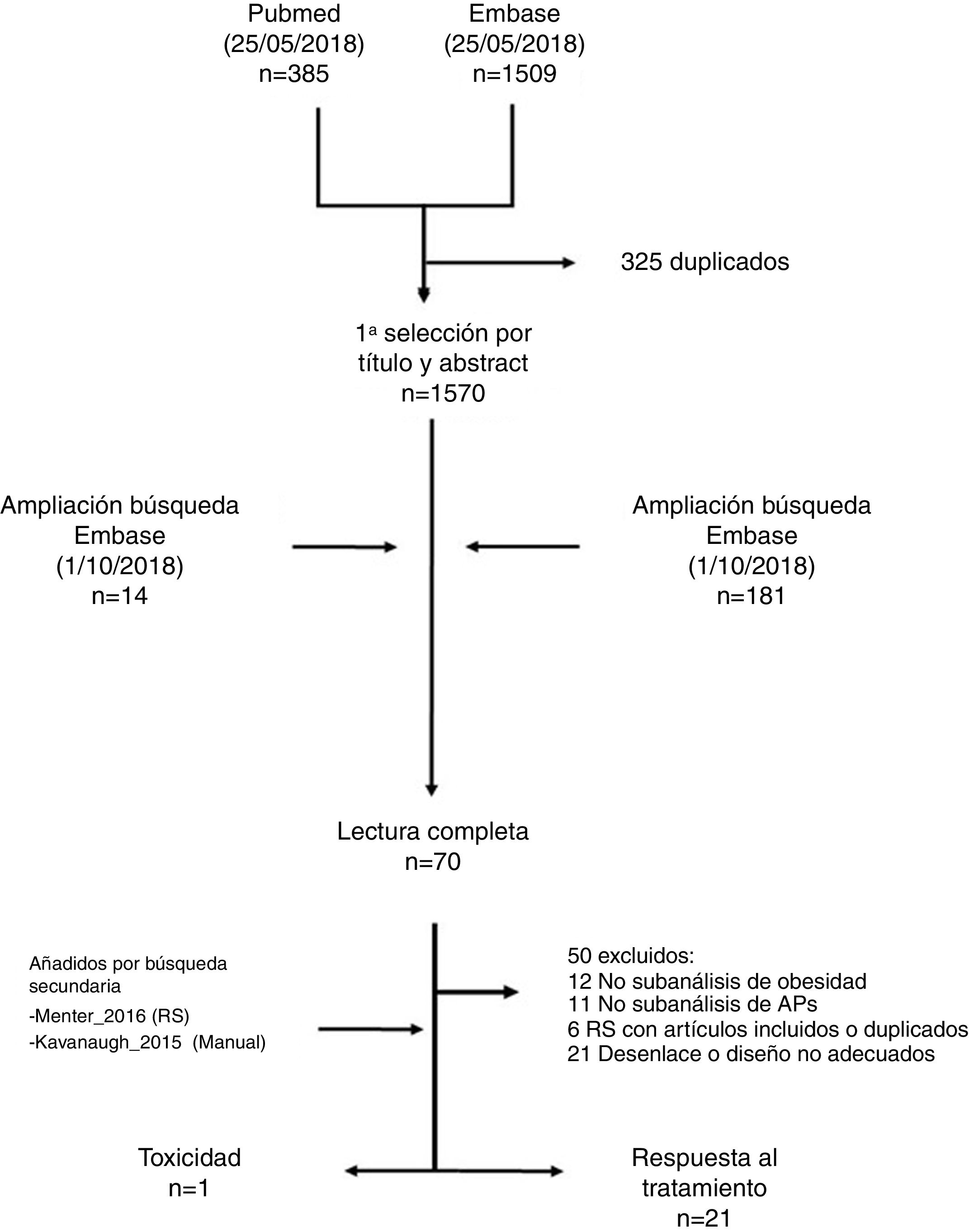
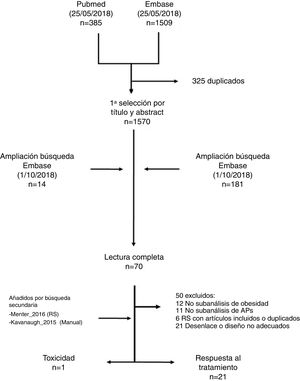
ResultadosLa estrategia de búsqueda identificó 1.894 títulos (fig. 1). La mayoría de los artículos se descartaron por título y abstract, quedando finalmente 70 para su lectura completa. Tras la lectura en detalle se añadieron 2 estudios más de forma manual (uno incluido en una de las revisiones sistemáticas obtenida por la estrategia19 y otro por conocimiento de uno de los autores20). Finalmente se incluyeron 22 estudios, de los que 21 se describen en la tabla de evidencia (tabla 1) y la tabla de resultados (tabla 2). Una de las referencias arrojadas por la búsqueda fue un abstract21, que se sustituyó por otra referencia indexada que no había entrado en la búsqueda inicial22. Se ha excluido de la descripción el único estudio encontrado que evaluaba la toxicidad, puesto que ya había sido incluido en la revisión previa15,16. Además, uno de los artículos previamente incluidos en la revisión del 2016, el de Cassano et al.23, se descartó en esta actualización por no medir el desenlace en términos de actividad de la APs, tan solo de la psoriasis. Los estudios excluidos y sus motivos de exclusión están disponibles en una tabla en el material adicional (tabla suplementaria-excluidos).
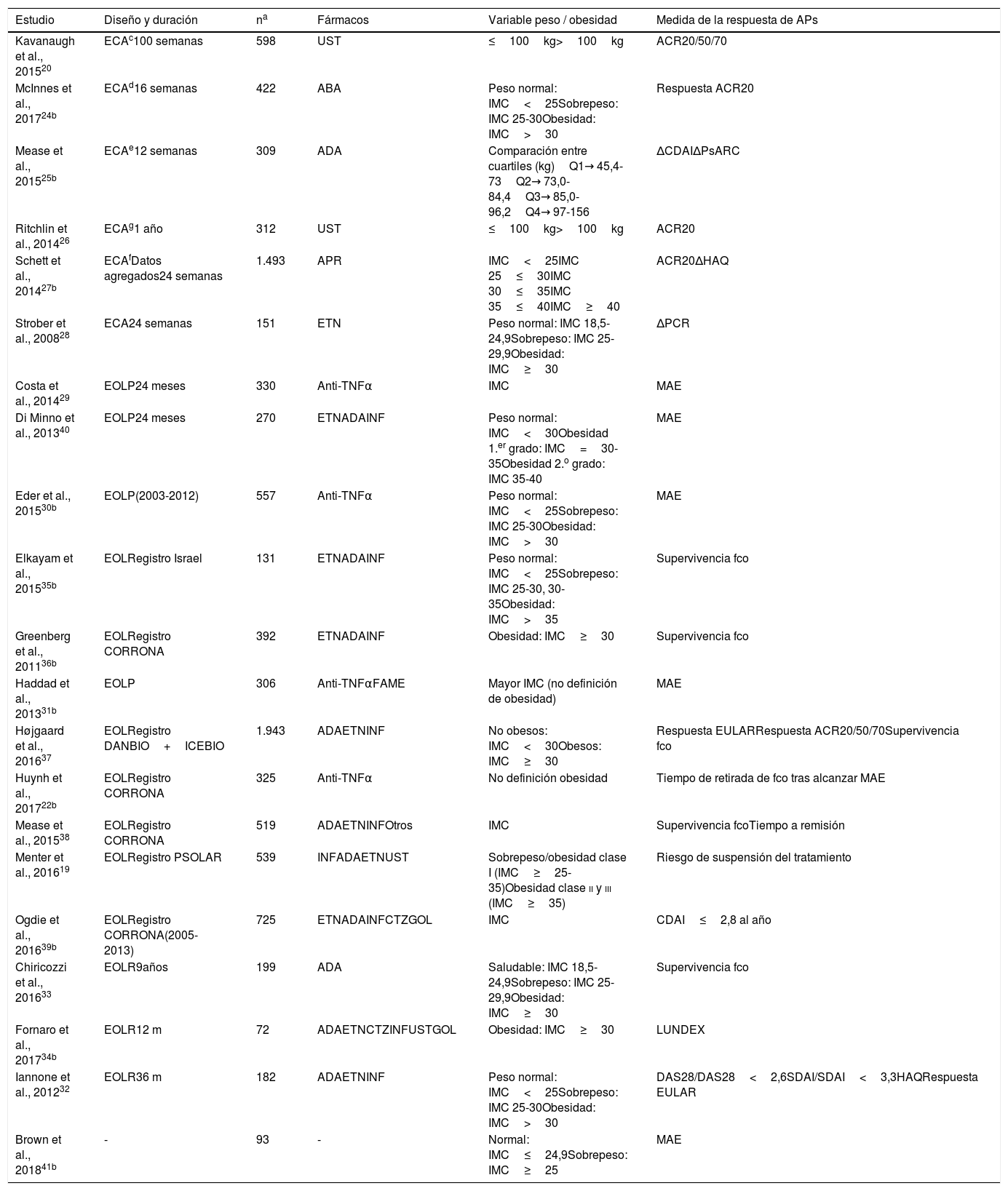
Tabla de evidencia. Descripción de los estudios incluidos que analizan la asociación de obesidad con respuesta
| Estudio | Diseño y duración | na | Fármacos | Variable peso / obesidad | Medida de la respuesta de APs |
|---|---|---|---|---|---|
| Kavanaugh et al., 201520 | ECAc100 semanas | 598 | UST | ≤100kg>100kg | ACR20/50/70 |
| McInnes et al., 201724b | ECAd16 semanas | 422 | ABA | Peso normal: IMC<25Sobrepeso: IMC 25-30Obesidad: IMC>30 | Respuesta ACR20 |
| Mease et al., 201525b | ECAe12 semanas | 309 | ADA | Comparación entre cuartiles (kg)Q1→ 45,4-73Q2→ 73,0-84,4Q3→ 85,0-96,2Q4→ 97-156 | ΔCDAIΔPsARC |
| Ritchlin et al., 201426 | ECAg1 año | 312 | UST | ≤100kg>100kg | ACR20 |
| Schett et al., 201427b | ECAfDatos agregados24 semanas | 1.493 | APR | IMC<25IMC 25≤30IMC 30≤35IMC 35≤40IMC≥40 | ACR20ΔHAQ |
| Strober et al., 200828 | ECA24 semanas | 151 | ETN | Peso normal: IMC 18,5-24,9Sobrepeso: IMC 25-29,9Obesidad: IMC≥30 | ΔPCR |
| Costa et al., 201429 | EOLP24 meses | 330 | Anti-TNFα | IMC | MAE |
| Di Minno et al., 201340 | EOLP24 meses | 270 | ETNADAINF | Peso normal: IMC<30Obesidad 1.er grado: IMC=30-35Obesidad 2.o grado: IMC 35-40 | MAE |
| Eder et al., 201530b | EOLP(2003-2012) | 557 | Anti-TNFα | Peso normal: IMC<25Sobrepeso: IMC 25-30Obesidad: IMC>30 | MAE |
| Elkayam et al., 201535b | EOLRegistro Israel | 131 | ETNADAINF | Peso normal: IMC<25Sobrepeso: IMC 25-30, 30-35Obesidad: IMC>35 | Supervivencia fco |
| Greenberg et al., 201136b | EOLRegistro CORRONA | 392 | ETNADAINF | Obesidad: IMC≥30 | Supervivencia fco |
| Haddad et al., 201331b | EOLP | 306 | Anti-TNFαFAME | Mayor IMC (no definición de obesidad) | MAE |
| Højgaard et al., 201637 | EOLRegistro DANBIO+ICEBIO | 1.943 | ADAETNINF | No obesos: IMC<30Obesos: IMC≥30 | Respuesta EULARRespuesta ACR20/50/70Supervivencia fco |
| Huynh et al., 201722b | EOLRegistro CORRONA | 325 | Anti-TNFα | No definición obesidad | Tiempo de retirada de fco tras alcanzar MAE |
| Mease et al., 201538 | EOLRegistro CORRONA | 519 | ADAETNINFOtros | IMC | Supervivencia fcoTiempo a remisión |
| Menter et al., 201619 | EOLRegistro PSOLAR | 539 | INFADAETNUST | Sobrepeso/obesidad clase I (IMC≥25-35)Obesidad clase ii y iii (IMC≥35) | Riesgo de suspensión del tratamiento |
| Ogdie et al., 201639b | EOLRegistro CORRONA(2005-2013) | 725 | ETNADAINFCTZGOL | IMC | CDAI≤2,8 al año |
| Chiricozzi et al., 201633 | EOLR9años | 199 | ADA | Saludable: IMC 18,5-24,9Sobrepeso: IMC 25-29,9Obesidad: IMC≥30 | Supervivencia fco |
| Fornaro et al., 201734b | EOLR12 m | 72 | ADAETNCTZINFUSTGOL | Obesidad: IMC≥30 | LUNDEX |
| Iannone et al., 201232 | EOLR36 m | 182 | ADAETNINF | Peso normal: IMC<25Sobrepeso: IMC 25-30Obesidad: IMC>30 | DAS28/DAS28<2,6SDAI/SDAI<3,3HAQRespuesta EULAR |
| Brown et al., 201841b | - | 93 | - | Normal: IMC≤24,9Sobrepeso: IMC≥25 | MAE |
ABA: abatacept; ADA: adalimumab; APR: apremilast; APs: artritis psoriásica; CDAI: Clinical Disease Activity Index; CTZ: certolizumab pegol; DAS: Disease Activity Score; ECA: ensayo clínico aleatorizado; EOLP: estudio observacional longitudinal prospectivo; EOLR: estudio observacional longitudinal retrospectivo; ETN: etanercept; FAME: fármacos modificadores de la enfermedad; fco: fármaco; GOL: golimumab; HAQ: Health Assessment Questionnaire; IMC: índice de masa corporal; INF: infliximab; MAE: mínima actividad de la enfermedad; PsARC: Psoriatic Arthritis Response Criteria; SDAI: Simple Disease Activity Index; TNF: factor de necrosis tumoral; UST: ustekinumab.
Resultados de los estudios individuales sobre la asociación entre obesidad y eficacia de los tratamientos en artritis psoriásica
| Autores, año | Medida de desenlace | Resultados en relación con la asociación a obesidad/IMC |
|---|---|---|
| Kavanaugh et al., 201520 | -ACR20/50/70 | ACR 20• ≤100kg• PBO→ UST: 65,7%• UST 45mg: 61,5%• UST 90mg: 63,5%• >100kg• PBO→ UST: 53,3%• UST 45mg: 41,9%• UST 90mg: 64,1%ACR 50• ≤100kg• PBO→ UST: 37,3%• UST 45mg: 40,7%• UST 90mg: 47,4%• >100kg• PBO→ UST: 37,2%• UST 45mg: 32,6%• UST 90mg: 41%ACR 70• ≤100kg• PBO→ UST: 21,6%• UST 45mg: 26,7%• UST 90mg: 23,4%• >100kg• PBO→ UST: 9,3%• UST 45mg: 18,6%• UST 90mg: 17,9% |
| McInnes et al., 201724 | -ACR20 | ACR20=no diferencia significativa entre obesos/sobrepeso y no obesos-Obesos+sobrepeso vs. peso normal o bajo peso• ABA→ OR: 1,215 (0,437; 3,378), p=0,7087 vs. 0,446 (0,162; 1,228), p=0,1181• PBO → OR: 0,554 (0,189; 1,624), p=0,2811 vs. 0,460 (0,166; 1,271), p=0,1343 |
| Mease et al., 201525 | -CDAI-PsARC | ΔCDAI-Q1→ −10,89 (−16; −5,78)-Q2→ −10,74 (−15,42; −6,06)-Q3→ −8,05 (−14,26; −1,83)-Q4→ −10,97 (−16,61; −5,34)ΔPsARC-Q1→ 0,3522 (0,1451;0,5594)-Q2→ 0,4163 (0,2082; 0,6243)-Q 3→ 0,3387 (0,1350; 0,5424)-Q4→ 0,2962 (0,0870; 0,5054) |
| Ritchlin et al., 201426 | -ACR20 | ACR20• PBO∘ ≤100kg=23%∘ >100kg=13,3%• UST 45mg∘ ≤100kg=43,2%∘ >100kg=44,8%• UST 90mg∘ ≤100kg=46,6%∘ >100kg=38,7% |
| Schett et al., 201427 | -ACR20-ΔHAQ | PBO vs. APR20 vs. APR30-ACR 20 según peso basal• <70 (n=336): 20,6 vs. 31,5 vs. 36,4%• 70≤85 (n=454): 21,2 vs. 28,7 vs. 34,6%• 85≤100 (n=391): 17,1 vs. 29,3 vs. 37,2%• ≥100 (n=311): 15,6 vs. 40,7 vs. 41,5%-ACR20 según IMC basal• <25 (n=339): 21,4 vs. 34,2 vs. 35,3%• 25≤30 (n=496): 15,8 vs. 27,6 vs. 38,8%• 30≤35 (n=351): 22,4 vs. 38,9 vs. 34,5%• 35≤40 (n=198): 15,2 vs. 23,8 vs. 36,2%• ≥40 (n=107): 17,5 vs. 39,5 vs. 44,8%PBO vs. APR 20 vs. APR 30-HAQ según peso basal• <70 (n=324): −0,047 vs. −0,128 vs. −0,168%• 70≤85 (n=434): −0,134 vs. −0,182 vs. −0,239• 85≤100 (n=383): −0,053 vs. −0,122 vs. −0,225• ≥100 (n=297): −0,016 vs. −0,224 vs. −0,202-HAQ según IMC basal• <25 (n=330): −0,052 vs. −0,164 vs. −0,183• 25≤30 (n=474): −0,092 vs. −0,180 vs. −0,237• 30≤35 (n=343): −0,095 vs. −0,135 vs. −0,239• 35≤40 (n=189): −0,014 vs. −0,108 vs. −0,168• ≥40 (n=102): −0,031 vs. −0,267 vs. −0,165 |
| Strober et al., 200828 | -ΔPCR• Semana 12∘ IMC normal: PBO=3,1 (0,1-10,1) vs. ETN=3,6 (−3,4; 14,9)∘ IMC sobrepeso: PBO=0,5 (−7,2-44,9) vs. ETN=2,2 (−0,1; 17,0)∘ IMC obesidad: PBO=−0,5 (−8,3-3,4) vs. ETN=2,7 (−0,7; 47,3)• Semana 24∘ IMC normal: PBO=7,1 (0,7-13,8) vs. ETN=2,3 (−2,3, 17,9)∘ IMC sobrepeso: PBO=2,6 (−3,3-45,1) vs. ETN=1,3 (−2,6, 15,1)∘ IMC obesidad: PBO=1,6 (−3,4-11,6) vs. ETN=2,5 (−8,7, 49,5)-Coeficiente β (IMC basal)=−0,05 (−0,07; −0,02); p<0,001 | |
| Costa et al., 201429 | -MAE | IMC>30kg/m2→ OR=1,29 (1,03-1,64); p=0,029 |
| Di Minno et al., 201340 | -MAE | - No MAE vs. MAE• Obesos=110 (64%) vs. 25 (25,5%); p<0,001• Obesidad 1.er grado=84 (48,8%) vs. 16 (16,3%); p<0,001• Obesidad 2.o grado=26 (15,1%) vs. 9 (9,2%); p<0,001-Riesgo de no alcanzar MAE (12 meses)• HR si obesidad=4,90 (3,04-7,87); p<0,001• HR si obesidad 1.er grado → HR=3,98 (1,96-8,06); p<0,01• HR si obesidad 2.o grado → HR=5,40 (3,09-9,43); p<0,01-Riesgo de probabilidad de mantener MAR a los 24 meses→ HR=2,04 (1,01-3,61); p=0,014 |
| Eder et al., 201530 | -MAE durante al menos un año | IMC 25-30 → OR=0,64; p=0,001IMC>30 → OR=0,52; p=0,0001 |
| Elkayam et al., 201535 | -Supervivencia fco | ↑IMC → menor supervivencia (datos no mostrados) |
| Greenberg et al., 201136 | -Supervivencia fco | -Riesgo de interrupción en IMC>30: HR ajustada=1,52 (1,08-2,1); p=0,017-Supervivencia fco 18 meses IMC<30 vs. IMC>30: 80 vs. 63%-Dosis fija de anti-TNFα tiene más riesgo de suspensión que dosis ajustada al peso: HR ajustada 1,3 (0,9-2,1); p=0,140 |
| Haddad et al., 201331 | -MAE | Los pacientes que no alcanzaron MAE>IMC basal (31,6 vs. 28,5); p=0,02 |
| Højgaard et al., 201651 | -Respuesta EULAR y ACR | En obesos• Buena respuesta EULAR→ OR=0,75 (0,50; 1,15)• Respuesta EULAR buena/moderada → OR=0,47 (0,30; 0,74); p<0,05• Respuesta ACR20→ OR=0,65 (0,40; 1,06)• Respuesta ACR50 → OR=0,71 (0,42; 1,18)• Respuesta ACR70 → OR=0,80 (0,43; 1,48)Supervivencia (para todos los pacientes)• Análisis univariante: IMC≥30kg/m2→ HR=1,37 (1,18; 1,58)• Análisis multivariante: IMC≥30kg/m2→ HR=1,64 (1,32; 2,03) |
| Huynh et al., 201722 | -Tiempo de retirada de fco tras alcanzar MAE | Sobrepeso u obesidad no afectaron significativamente a la pérdida de control de la enfermedad (datos no mostrados) |
| Mease et al., 201538 | -Supervivencia fco-Tiempo a remisión | -Supervivencia anti-TNF• IMC → HR=1,030; p=0,01, Multivariante: HR=1,011; p=0,44-Tiempo a remisión• IMC → HR=0,940; p<0,001, Multivariante: HR=0,955; p<0,001 |
| Menter et al., 201619 | -Riesgo de suspensión del tratamiento | -Primera línea de tratamiento• Sobrepeso/obesidad clase i (25≤IMC<35 vs.<25) → HR=0,599 (0,138-2,609); p=0,4951• Obesidad clase ii-iii (IMC≥35 vs.<25) → HR=1,232 (0,258-5,885); p=0,7938-Segunda línea de tratamiento• Sobrepeso/obesidad clase i (25≤IMC<35 vs.<25) → HR=1,753 (0,645-4,765); p=0,2713• Obesidad clase ii-iii (IMC ≥35 vs.<25) → HR=1,422 (0,473-4,279); p=0,5306-Tercera línea de tratamiento• Sobrepeso/obesidad clase i (25 ≤ IMC<35 vs.<25) → HR=1,026 (0,326-3,231); p=0,9651• Obesidad clase ii-iii (IMC≥35 vs.<25) → HR=1,003 (0,285-3,533); p=0,9967 |
| Odgie et al., 201639 | -CDAI≤2,8 | IMC → OR=0,95 (0,92-0,98) |
| Chiricozzi et al.,201633 | -Supervivencia fco | -IMC 25-30 vs.<25→ OR=0,91 (0,50; 1,68); p=0,773-IMC>30 vs.<25 → OR=0,53 (0,22; 1,23); p=0,136 |
| Fornaro et al.,201734 | -LUNDEX | -Obesos vs. no obesos-Primer año: 16 vs. 66%-Segundo año=10,5 vs. 74,9%-Tercer año=5,9 vs. 81,8% |
| Iannone et al., 201232 | -HAQ-DAS28-SDAI-DAS28<2,6 (%)-SDAI<3,3 (%)-Respuesta EULAR | Peso normal vs. sobrepeso vs. obesidadHAQ=0,79 (±0,9) vs. 0,47 (±0,8) vs. 0,81 (±0,8); p=0,06DAS28=3,1 (±1,6) vs. 2,9 (±1,6) vs. 3,2 (±1,5); p=0,42SDAI=14,2 (±13) vs. 11,6 (±12) vs. 13,0 (±12); p=0,44DAS28<2,6=44 vs. 46 vs. 37%; p=0,31SDAI<3,3=21 vs. 38 vs. 21%; p=0,07Respuesta EULAR=61,5 vs. 63,8 vs. 62,8%; p=0,05 |
| Brown et al.,201841 | -MAE | Sobrepeso →OR=2,99; p=0,04 |
ABA: abatacept; APR: apremilast; CDAI: Clinical Disease Activity Index; DAS: Disease Activity Score; ETN: etanercept; fco: fármaco; HAQ: Health Assessment Questionnaire; HR: hazard ratio; IMC: índice de masa corporal; MAE: mínima actividad de la enfermedad; OR: odds ratio; PBO: placebo; PsARC: Psoriatic Arthritis Response Criteria; SDAI: Simple Disease Activity Index; TNF: factor de necrosis tumoral; UST: ustekinumab.
De los estudios que investigaron la asociación de obesidad con eficacia, 6 eran ensayos clínicos20,24–28 y 14 estudios observacionales, de los cuales, 3 eran longitudinales prospectivos29–31, 3 retrospectivos32–34, 7 analizaron datos de registros19,22,35–39 y otro era un caso-control40 (el trabajo de Brown et al.41 no describe el tipo de diseño utilizado y no se puede identificar claramente).
De los ensayos clínicos analizados, la mitad de ellos tiene una adecuada descripción de la selección y del método de aleatorización, sin embargo, casi todos tienen riesgos de sesgo en la detección y abandonos durante el seguimiento. Entre los estudios observacionales incluidos, muchos de ellos fueron trabajos enviados a congresos, por lo que los datos incluidos son muy limitados. Para un análisis más en detalle de los sesgos, consultar la tabla en el material adicional (tabla suplementaria -sesgos).
La población estudiada en todos los trabajos incluía a pacientes con APs activa y distintos grados de IMC y en mayor medida estaban tratados con anti-TNFα, salvo en 6 trabajos, donde también se incluyeron pacientes tratados con ustekinumab19,20,26,34, abatacept24 y apremilast27. La definición de obesidad utilizada fue el IMC>30kg/m2, salvo en uno de ellos22, donde no se definía. En algunos ensayos se añadía una categorización por>100kg. Las variables de desenlace más estudiadas fueron la eficacia terapéutica y el tiempo de supervivencia del fármaco. La medida de desenlace más utilizada fue la MAE, pero también se emplearon los índices de respuesta EULAR y ACR, o el impacto sobre índices funcionales, como el Health Assessment Questionnaire (HAQ).
Salvo el trabajo de Huynh et al.22, donde no se encontró relación entre la pérdida de control de la enfermedad y el sobrepeso o la obesidad; el resto de los trabajos que analizaban la MAE mostraron que esta se consigue más difícilmente y con menor duración de la remisión en presencia de obesidad o sobrepeso.
En relación con los estudios que evaluaron la supervivencia del fármaco, todos encontraron diferencias asociadas a sobrepeso, excepto el trabajo de Chiricozzi et al.33, que no encontró diferencias en la supervivencia del fármaco entre obesos y no obesos (se trata de un estudio retrospectivo unicéntrico, por lo que los datos deben interpretarse con precaución). Los trabajos de Greenberg et al.36 y Højgaard et al.37 determinaron que la obesidad era un factor de riesgo para una tasa de retención más baja, aunque no claramente por efectos adversos.
Dos estudios evaluaron la respuesta en términos de cambio en el HAQ. Iannone et al.32 encontraron que el porcentaje de pacientes que conseguía una mejoría significativa en la capacidad funcional era similar entre las distintas categorías de peso (el 44% en el grupo de pacientes con peso normal, el 53% en los que tenían sobrepeso y el 50% en los obesos). En el trabajo de Schett et al.27 la dosis de 30mg de apremilast se asocia con mejoría en el HAQ-DI en la semana 16, significativa frente a placebo, pero no especifica si existen diferencias entre los grupos con distintos valores en el IMC.
Como ya se ha comentado, solo un estudio evaluaba la toxicidad16. Este estudio, que ya se había incluido y detallado en la revisión previa, es un estudio observacional retrospectivo de pacientes con enfermedad psoriásica en el que se observa que los pacientes obesos en tratamiento con metotrexato tienen una tendencia al aumento moderado de transaminasas. Para este trabajo se decidió no realizar ningún análisis adicional del mismo, y se remite al lector a los resultados de la revisión previa15.
MetaanálisisNo se pudieron combinar los resultados de todos los artículos incluidos por la variabilidad en la intervención y en las medidas de resultados. Las medidas de eficacia que se pudieron metaanalizar fueron la respuesta ACR20 y la retención del tratamiento.
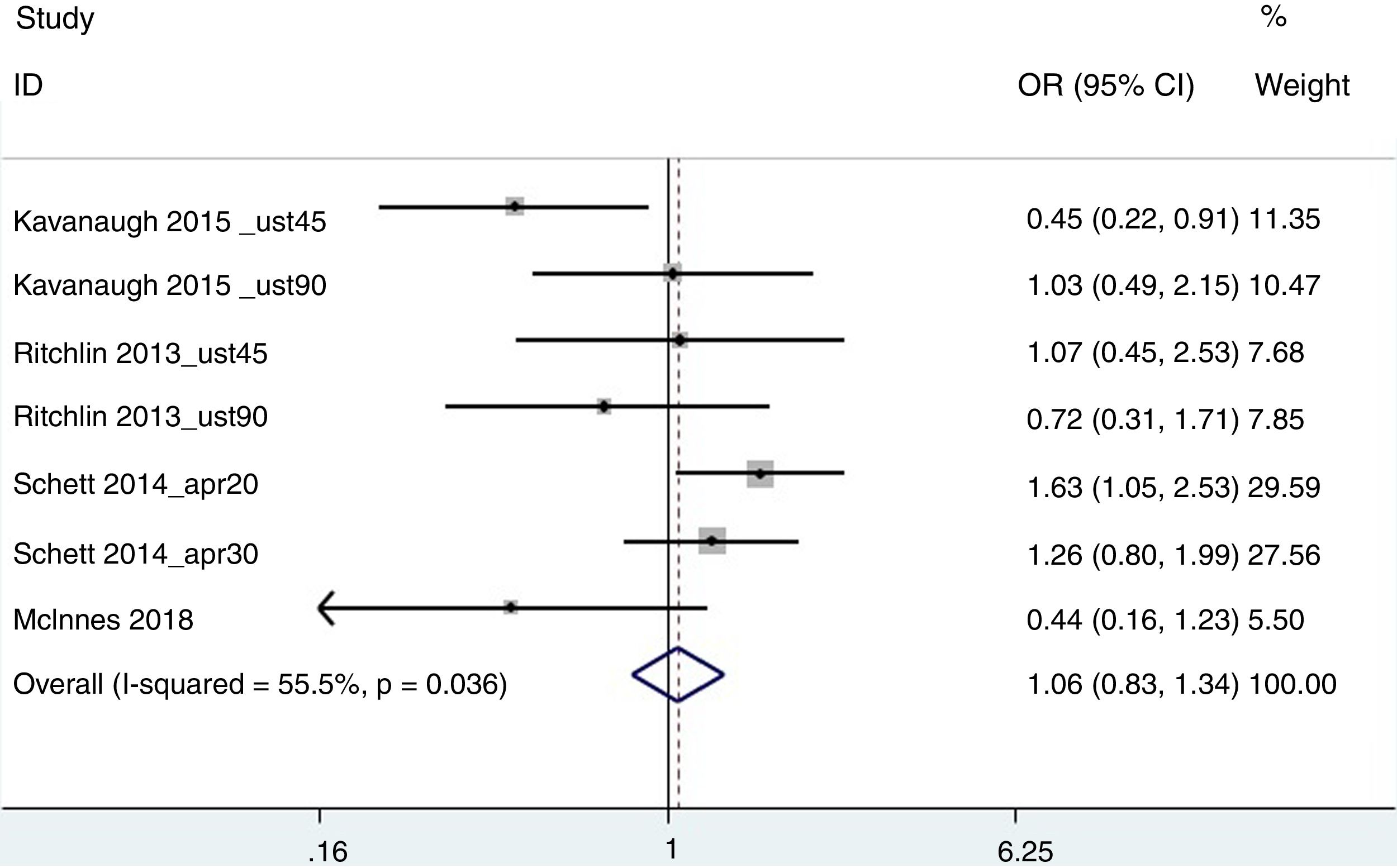
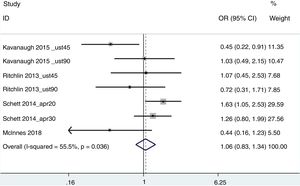
ACR20Para esta estimación agregada, se incluyeron los estudios de Kavanaugh et al.20 (ustekinumab en dosis de 45 y 90mg), Ritchlin et al.26 (ustekinumab en dosis de 45 y 90mg), Schett et al.27 (apremilast en dosis de 20 y 30mg) y McInnes et al.24 (abatacept 125mg). Se utilizó el peso de los pacientes como medida de obesidad, estableciendo 2 grupos: <100kg y ≥100kg. El resultado de no respuesta fue de OR=0,95 (IC 95% 0,74-1,20), con una heterogeneidad del 55,5% (fig. 2). Eliminando del análisis el trabajo de Schett et al. (ya que era el trabajo que tenía una mayor variabilidad, probablemente por tratarse de un abstract de datos agregados de 3 ensayos clínicos distintos), el resultado fue de OR=1,42 (1-2,08), con una I2 del 6,2%.
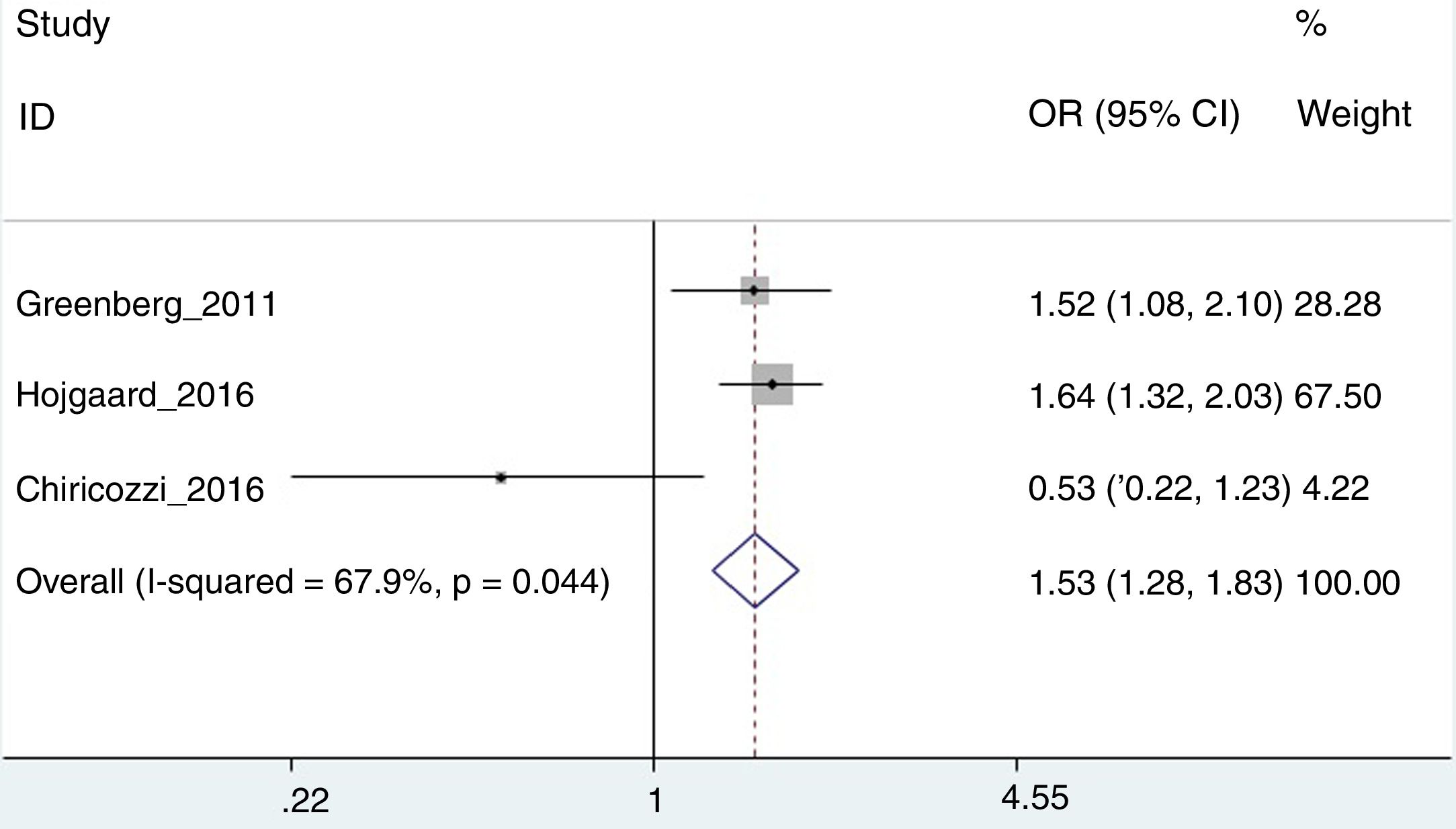
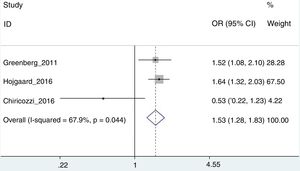
Riesgo de interrupción del tratamientoPara este análisis, solo se pudieron utilizar los trabajos de Greenberg et al.42, Højgaard et al.37 y Chiricozzi et al.33, con una OR agregada de 1,53 (IC 95%: 1,28-1,82; I2=67,9%) (fig. 3). En este caso, el estudio de Chiricozzi et al. era el que estaba provocando una mayor heterogeneidad (creemos que debido a varios factores, entre ellos, el que se trate de un trabajo prospectivo). Al retirar del análisis este trabajo, obtenemos una mayor homogeneidad, con una OR de 1,60 (IC 95%: 1,34-1,92; I2=0%).
DiscusiónA pesar de que la heterogeneidad de los trabajos obtenidos en esta revisión sistemática es alta, lo que dificulta su análisis en conjunto, sí parece existir una relación entre el riesgo de fracaso al tratamiento y la obesidad en pacientes con APs. Esto es así, sobre todo, con los anti-TNF, y a las dosis habitualmente indicadas por ficha técnica para el tratamiento de la APs (que han sido los más estudiados), resultando muy difícil extrapolar resultados a otras dianas moleculares, aunque parece que el efecto del ustekinumab20,26 y el abatacept24, a la dosis indicada habitualmente por ficha técnica, podría no modificarse con relación al peso. Según los resultados obtenidos, la relación entre el fármaco y la obesidad parece independiente tanto de la vía de administración como de la pauta seguida. Los resultados del metaanálisis indican que no existen diferencias para establecer asociación entre alcanzar la respuesta ACR20 con ustekinumab o abatacept y pesar más de 100kg o menos. En este punto es importante destacar que en la ficha técnica del ustekinumab se establece que los pacientes con un peso>de 100kg pueden utilizar una dosis de 90mg43 (avalado por estudios de farmacocinética44). En la ficha técnica del golimumab45 también se advierte que en pacientes de más de 100kg, se puede plantear un aumento de dosis, de no conseguir los resultados esperados (no existen datos definitivos que apoyen esta afirmación).
Estos hallazgos señalan el impacto negativo de la obesidad en la respuesta al tratamiento de los pacientes con APs, situando la obesidad como factor pronóstico negativo, que puede inducir un efecto «modificador» del tratamiento que debería tenerse en cuenta tanto en la práctica clínica (y la prescripción del tratamiento) como en el diseño de los estudios.
La obesidad es un estado de inflamación crónica de bajo grado a través del aumento sistémico y paracrino en los niveles de citocinas, quimiocinas y adipocinas46. Además de tener un impacto directo sobre la inflamación, la obesidad también puede modificar la farmacocinética de los fármacos anti-TNF y otros agentes biológicos. Los estudios farmacocinéticos realizados en los anti-TNF han identificado la obesidad como un factor de riesgo asociado a un aumento del aclaramiento del fármaco, lo que se traduce en una semivida más corta y en concentraciones más bajas de fármaco en suero47–49. Recientemente se han conocido los resultados de un trabajo observacional prospectivo50 en pacientes con espondiloartritis axial, en el que la respuesta a fármacos anti-TNF (considerando respuesta un cambio en el BASDAI≥2), estaría modificada en función de la obesidad y el uso de FAME. Este dato puede ser en la práctica clínica muy relevante a la hora de considerar el sobrepeso en las espondiloartritis como una comorbilidad asociada relevante.
Solo un trabajó16 analizó la relación entre tratamiento, efectos adversos y su relación con la obesidad. Schmajuk et al.16 encontraron que los pacientes obesos en tratamiento con metotrexato tenían un riesgo mayor de elevación de transaminasas, en probable relación con un hígado graso de base. Es importante destacar la falta de trabajos que evalúen el efecto de la obesidad en la toxicidad farmacológica en los pacientes con APs, lo que pone de relevancia la necesidad de profundizar en esta relación y sus posibles consecuencias. Esto es de especial interés, dada la elevada prevalencia de obesidad y la relación de esta con el hígado graso, que repercute en el metabolismo de los fármacos entre los pacientes con APs13.
En los estudios que analizaron la supervivencia del fármaco, se encontró que la retirada del fármaco se realizaba generalmente por la ineficacia33,36,37,40, más que por la aparición de efectos adversos, lo que refuerza la idea de que los paciente con obesidad tienen un alto riesgo de fracaso al tratamiento. Esto se ve reforzado por los resultados del metaanálisis, donde los pacientes con obesidad tenían hasta 2 veces más de riesgo de retirada del tratamiento.
Otros estudios que analizan el efecto de la pérdida de peso sobre el tratamiento (y no directamente el efecto de la obesidad o del IMC sobre el tratamiento, que es el objeto de este trabajo), arrojan la idea de que una pérdida de peso puede ayudar a conseguir la MAE51,52 y descensos en la actividad, evaluados por DAS2853. Esto apoya la idea de que la obesidad en la APs es un factor de mal pronóstico y que tiene un papel importante sobre la eficacia de los distintos tratamientos.
Es imprescindible realizar más investigaciones para determinar el efecto del peso sobre el HAQ, dada la escasez de datos encontrados sobre la relación entre obesidad, respuesta al tratamiento y su efecto sobre la capacidad funcional.
Del mismo modo, el trabajo intenta evaluar la influencia del sobrepeso en la eficacia y supervivencia de las diferentes moléculas en el tratamiento de al APs; en ningún caso se plantea evaluar la eficacia de estas moléculas en el tratamiento de la enfermedad ni comparar los distintos tratamiento entre ellos (a falta de estudios head to head, no parece haber diferencias de eficacia entre ellas, aunque abatacept54 y apremilast20,55, parecen numéricamente inferiores).
Este trabajo no está exento de limitaciones. Por una parte se ha centrado en la perspectiva articular, sin considerar la parte cutánea, donde por otra parte ya se encontró la relación del sobrepeso con la gravedad de la enfermedad56. Existe una base fisiopatológica que asocia menores niveles de anti-TNF en los pacientes con sobrepeso, lo que podría explicar la menor supervivencia del fármaco en el tiempo, al menos a la dosis habitualmente administrada. Sin embargo, no se puede descartar que este efecto pudiera ser dosis dependiente. Otra limitación de este trabajo es el hecho de que se hayan incluido estudios con distintos diseños, lo que dificulta la comparación de la información. También se debe tener en cuenta que se ha intentado utilizar el IMC para medida de obesidad, sin embargo, eso no siempre ha sido posible, por lo que en algunas ocasiones se ha empleado como punto de corte un peso>100kg.
Además los datos encontrados no valoran la obtención de la respuesta ACR50, que sería un índice clínicamente significativo, encontrando cambios en la respuesta ACR20, que pueden no reflejar cambios relevantes en los pacientes.
A la luz de estos resultados, es necesario estudiar mejor el papel de la obesidad en la APs realizando más estudios y de mejor calidad, pero convendría tener en cuenta a la hora de prescribir un tratamiento que la obesidad puede precisar de una intervención terapéutica específica, no solo mediante el ajuste de la dosificación de la terapia biológica, sino también tratando directamente la obesidad en estos pacientes, idealmente desde un abordaje multidisciplinar.
FinanciaciónMK Media, S.L. facilitó económicamente la realización de esta revisión. Ningún laboratorio farmacéutico ha intervenido en el diseño o interpretación del estudio.
Conflicto de interesesT.O. no recibe honorarios de ninguna compañía farmacéutica que pudiera beneficiarse de los resultados de esta revisión; no obstante, trabaja para InMusc, que realiza servicios de consultoría metodológica para, entre otros clientes, compañías farmacéuticas, incluidas Abbvie, BMS, MSD, Novartis, Pfizer, Roche, Sanofi Aventis y UCB Pharma; J.G. ha recibido becas para asistir a congresos y actividades formativas, ha obtenido honorarios por consultorías científicas y ha recibido honorarios por conferencias y por participación en programas educativos de las siguientes empresas: Roche, MSD, Pfizer, AbbVie, Janssen Cilag, UCB Pharma, Novartis y Celgene; E.G. refiere haber recibido becas para asistir a congresos y actividades formativas, y honorarios por ponencias y programas educativos de Lilly, AbbVie, UCB Pharma, Roche, MSD, Pfizer, Novartis, Celgene y Janssen.