Determinar la efectividad y la incidencia de eventos adversos graves del tocilizumab (TCZ) en una cohorte de pacientes costarricenses con artritis reumatoide (AR)
Pacientes y métodosSe realizó un análisis retrospectivo de 45 pacientes con AR, refractarios al uso previo de fármacos modificadores de la enfermedad reumática (FAME), que utilizaron TCZ a una dosis inicial de 4mg/kg intravenoso (IV) cada 4 semanas en asociación con metotrexato o leflunomida. La medida de efectividad fue la incidencia de remisión clínica, determinada cada 3 meses y definida por un puntaje de actividad de la enfermedad en 28 articulaciones con velocidad de sedimentación globular (DAS28-VSG) menor de 2,6. La seguridad del fármaco se evaluó mediante la tasa de incidencia de eventos adversos severos. Se realizó un modelo de regresión logística uni- y multivariado para determinar las variables asociadas con la probabilidad de remisión a los 3 meses de iniciado el tratamiento.
ResultadosA los 3 meses de tratamiento un total de 22 pacientes (48,9%; intervalo de Confianza [IC] del 95%: 34,3-63,5%) alcanzaron remisión, en tanto que a los 12 meses de terapia con TCZ el valor aumentó a 34 pacientes (75%; IC 95%: 62,3-87,6%). Un total de 18 pacientes (40%; IC 95%: 25,7-54,3%) requirieron aumento de dosis del TCZ de 4 a 8mg/kg ante la ausencia de remisión. La tasa de incidencia de eventos adversos severos fue de 0,98 por 100 pacientes/año, correspondiendo todos ellos a cuadros infecciosos que resolvieron sin ningún desenlace fatal. Solo el DAS28-VSG inicial se asoció de forma independiente con la probabilidad de remisión a los 3 meses.
ConclusionesEl uso de TCZ IV a una dosis inicial de 4mg/kg en pacientes costarricenses con AR es efectivo y seguro en la práctica clínica.
To determine the effectiveness and the incidence of severe adverse events in a cohort of Costa Rican patients with Rheumatoid Arthritis (RA) treated with intravenous (IV) tocilizumab (TCZ).
Patients and methodsA retrospective analysis was carried out in 45 patients that were unresponsive to disease-modifying antirheumatic drugs (DMARDs). The study included patients who received IV TCZ every 4 weeks (4mg/kg) along with methotrexate or leflunomide. Effectiveness was measured through the incidence of clinical remission according to a disease activity score - erythrocyte sedimentation rate (DAS28-ESR) less than 2.6. Safety was assessed by the incidence rate of serious adverse events. An univariate and multivariate logistic regression analysis was performed to assess the association of potential variables with the probability of achieving remission during the first 3 months of TCZ therapy.
ResultsDuring the 3rd month of TCZ therapy, a total of 22 patients (48.9%; 95% Confidence Interval (CI) 34.3-63.5%) achieved remission. The cumulative incidence of patients with remission at month 12 was 75.0% (n=34) (95% CI: 62.3-87.6%). A total of 18 patients (40%; 95% CI: 25.7-54.3%) were switched to a 8mg/kg dose due to the absence of remission. The incidence rate of serious adverse events was .98 per 100 patients/year, all of them due to infectious diseases with no fatal events reported. Only basal DAS28-ESR was associated with the probability of achieving remission at month 3.
ConclusionsIV TCZ (4mg/kg) is an effective and safe treatment for RA patients in a clinical setting in Costa Rica.
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica sistémica que afecta predominantemente las articulaciones, generando daño y consecuente compromiso funcional del paciente, siendo en algunos casos irreversible1. El tratamiento de la AR incluye el uso de bajas dosis de prednisona y antiinflamatorios no esteroideos (AINE), en conjunto con fármacos modificadores de la enfermedad reumática (FAME), los cuales han demostrado mejorar la funcionalidad física y retardar el daño articular1. Pese a que la incorporación de terapias biológicas y sintéticas contra el factor de necrosis tumoral, células B o células T ha generado mayores tasas de respuesta clínica, de un 30 a un 40% de los pacientes fallan al alcanzar y mantener una respuesta clínica mayor según los criterios del American College of Rheumatology (ACR), o una buena respuesta según los criterios definidos por la European League Against Rheumatism (EULAR)2,3. Estas limitantes han llevado al desarrollo de nuevos fármacos como el tocilizumab (TCZ). Este medicamento es un anticuerpo monoclonal humanizado que inhibe la actividad de la interleucina 6 (IL-6) al evitar la unión de dicha citoquina con su receptor, bloqueando las vías de activación clásica, de transeñalización y de transpresentación4. El TCZ ha demostrado en diferentes ensayos clínicos5–7 seguridad y eficacia al reducir las concentraciones de proteínas de fase aguda, la sintomatología inflamatoria y la progresión del daño articular, cuando es empleado como monoterapia8.
El TCZ ha demostrado en varios ensayos clínicos5–11 ser un fármaco seguro y eficaz en el tratamiento de la AR, ya que logra reducir las concentraciones de proteínas de fase aguda, la sintomatología inflamatoria y la progresión del daño articular en pacientes expuestos10 o no11 al tratamiento previo con FAME biológicos. Además, la eficacia del TCZ ha sido comprobada tanto en la administración subcutánea como intravenosa (IV)9 y en diversos esquemas de monoterapia8 o de tratamiento combinado7. Actualmente el TCZ está aprobado en el tratamiento de la AR con respuesta inadecuada al uso previo de FAME biológicos o sintéticos12. A pesar de la demostrada eficacia y seguridad del TCZ en los ensayos clínicos supracitados, la mayoría de estos no incluyeron una proporción significativa de pacientes de origen latinoamericano. Recientes estudios han señalado diferencias étnicas en la evolución y respuesta al tratamiento de los pacientes con AR, los cuales han reportado que los individuos de origen hispano presentan tasas más altas de actividad de la enfermedad y menores tasas de remisión clínica13,14. Por lo tanto, este estudio se planteó con el objetivo de evaluar la efectividad del TCZ IV en pacientes costarricenses con AR refractarios al uso previo de FAME sintéticos o biológicos, en un contexto de práctica clínica usual y optimización de la posología al utilizar 4mg/kg cada 4 semanas como dosis inicial.
Pacientes y métodosSe realizó un estudio retrospectivo analítico de registros médicos en el Hospital Rafael Ángel Calderón Guardia, San José, Costa Rica (Caja Costarricense de Seguro Social). El análisis incluyó a toda la población de pacientes con AR que fue tratada desde que el fármaco estuvo disponible en Costa Rica (enero de 2013) hasta diciembre de 2016. Se incluyó a los sujetos mayores de 18 años con diagnóstico de AR de acuerdo con los criterios de ACR/EULAR 2010, que recibieron el tratamiento con TCZ durante al menos un año durante el período de estudio. La indicación para el tratamiento con TCZ fue la refractariedad al uso de FAME (metotrexato, leflunomida, sulfasalazina o hidroxicloroquina, en esquemas de combinación y a la máxima dosis descrita para cada medicamento), definida por un puntaje de actividad de la enfermedad en 28 articulaciones con velocidad de sedimentación globular (DAS28-VSG) mayor que 5,1.
Se excluyó a los pacientes con otras enfermedades reumatológicas o inflamatorias distintas de la AR, así como a los pacientes con un seguimiento menor de 12 meses. Las variables de interés se recolectaron del expediente clínico e incluyeron la edad, el sexo, el tabaquismo, la presencia de comorbilidades, la edad al diagnóstico y la duración de la AR, el tiempo entre el diagnóstico de AR y el inicio de TCZ y el uso de FAME. La dosis empleada de TCZ (IV) fue de 4mg/kg cada 4 semanas, el cual se empleó en asociación con metotrexato y/o leflunomida según criterio del médico tratante. En caso de documentarse falla de respuesta durante el período de seguimiento, definida como DAS28 mayor de 2,6, la dosis de TCZ se modificó a 8mg/kg cada 4 semanas por vía IV. Los pacientes fueron valorados por el médico reumatólogo al menos cada 3 meses. La efectividad del TCZ se determinó mediante los criterios EULAR según el cambio en la puntuación del DAS28-VSG, evaluado cada 3 meses. Los pacientes fueron clasificados de acuerdo con la respuesta obtenida con el uso de TCZ en remisión (DAS28-VSG<2,6), actividad baja (2,6<DAS28-VSG<3,2), actividad moderada (3,2<DAS28-VSG<5,1) y actividad severa (>5,1). La seguridad del fármaco fue evaluada mediante la incidencia de eventos adversos severos ocurridos durante el total de seguimiento de los pacientes analizados. Se definió un evento adverso como severo cuando este requiriera la hospitalización del paciente, el uso de tratamiento antibiótico IV o la muerte.
El estudio fue aprobado por el Comité Ético Científico de la Caja Costarricense de Seguro Social y se apegó a las buenas prácticas clínicas.
Análisis estadísticoLas variables continuas se expresan como medias y desviación estándar. Las variables categóricas, como frecuencias absolutas y porcentajes. Se calculó para cada variable de efectividad y seguridad el intervalo de confianza del 95% (IC 95%). Se comparó el valor de DAS28-VSG al ingreso del estudio y en la semana 52 mediante la prueba de t-Student para datos pareados, comprobándose previamente los supuestos estadísticos de normalidad y homocedasticidad. Se realizó un modelo de regresión logística univariado y multivariado para identificar las variables asociadas a remisión (según una puntuación de DAS28-VSG<2,6) a los 3 meses como variable binaria dependiente. El análisis se llevó a cabo con la totalidad de los pacientes que completaron el período de seguimiento previsto (análisis «por protocolo»). Un valor de p menor de 0,05 se consideró estadísticamente significativo. El análisis se realizó con el programa estadístico SPSS 21.0 para Mac (Chicago, Estados Unidos).
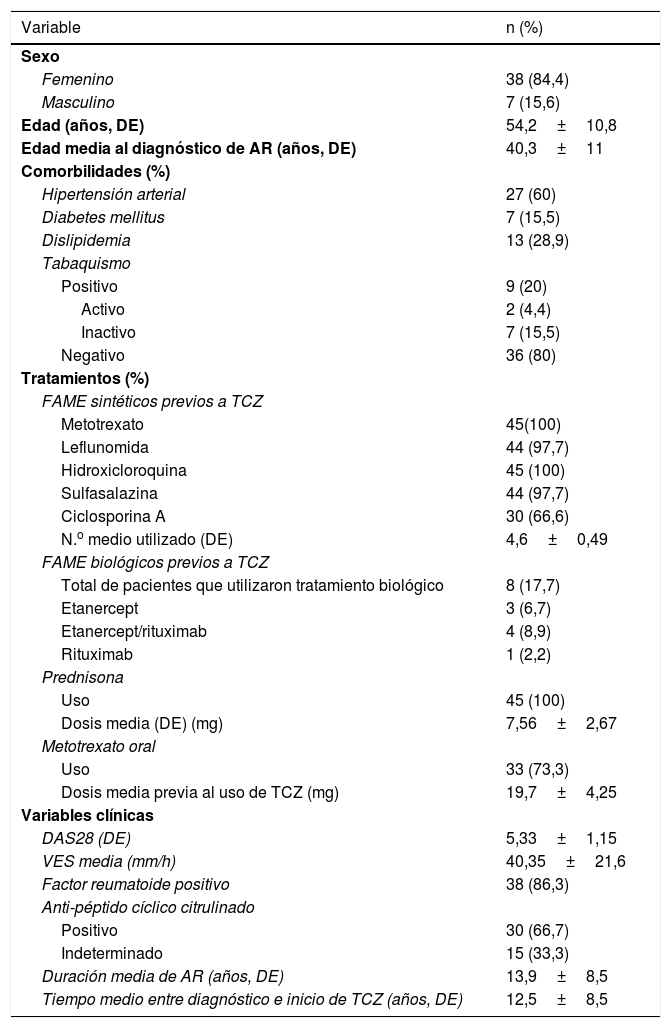
ResultadosCaracterísticas de los pacientesDurante el período de estudio se identificaron 45 pacientes que emplearon el medicamento TCZ por vía IV y que cumplieron los criterios de inclusión. Las características generales de los pacientes incluidos se resumen en la tabla 1. La mayoría de pacientes eran mujeres con positividad serológica del factor reumatoide y del anti-péptido cíclico citrulinado.
Características clínicas de los pacientes incluidos
| Variable | n (%) |
|---|---|
| Sexo | |
| Femenino | 38 (84,4) |
| Masculino | 7 (15,6) |
| Edad (años, DE) | 54,2±10,8 |
| Edad media al diagnóstico de AR (años, DE) | 40,3±11 |
| Comorbilidades (%) | |
| Hipertensión arterial | 27 (60) |
| Diabetes mellitus | 7 (15,5) |
| Dislipidemia | 13 (28,9) |
| Tabaquismo | |
| Positivo | 9 (20) |
| Activo | 2 (4,4) |
| Inactivo | 7 (15,5) |
| Negativo | 36 (80) |
| Tratamientos (%) | |
| FAME sintéticos previos a TCZ | |
| Metotrexato | 45(100) |
| Leflunomida | 44 (97,7) |
| Hidroxicloroquina | 45 (100) |
| Sulfasalazina | 44 (97,7) |
| Ciclosporina A | 30 (66,6) |
| N.o medio utilizado (DE) | 4,6±0,49 |
| FAME biológicos previos a TCZ | |
| Total de pacientes que utilizaron tratamiento biológico | 8 (17,7) |
| Etanercept | 3 (6,7) |
| Etanercept/rituximab | 4 (8,9) |
| Rituximab | 1 (2,2) |
| Prednisona | |
| Uso | 45 (100) |
| Dosis media (DE) (mg) | 7,56±2,67 |
| Metotrexato oral | |
| Uso | 33 (73,3) |
| Dosis media previa al uso de TCZ (mg) | 19,7±4,25 |
| Variables clínicas | |
| DAS28 (DE) | 5,33±1,15 |
| VES media (mm/h) | 40,35±21,6 |
| Factor reumatoide positivo | 38 (86,3) |
| Anti-péptido cíclico citrulinado | |
| Positivo | 30 (66,7) |
| Indeterminado | 15 (33,3) |
| Duración media de AR (años, DE) | 13,9±8,5 |
| Tiempo medio entre diagnóstico e inicio de TCZ (años, DE) | 12,5±8,5 |
AR: artritis reumatoide; DAS28: actividad de la enfermedad en 28 articulaciones; DE: desviación estándar; FAME: fármacos modificadores de la enfermedad reumática; TCZ: tocilizumab; VES: velocidad de eritrosedimentación.
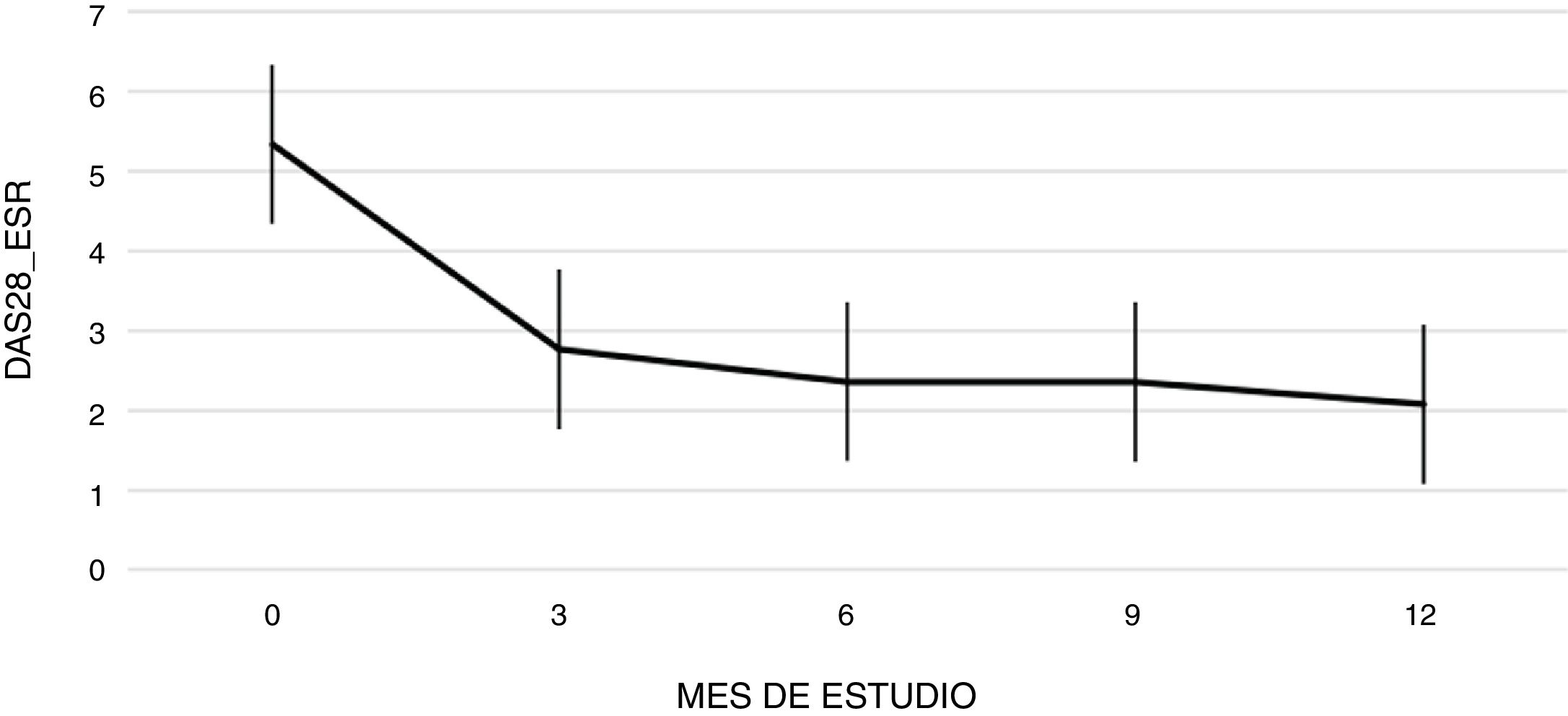
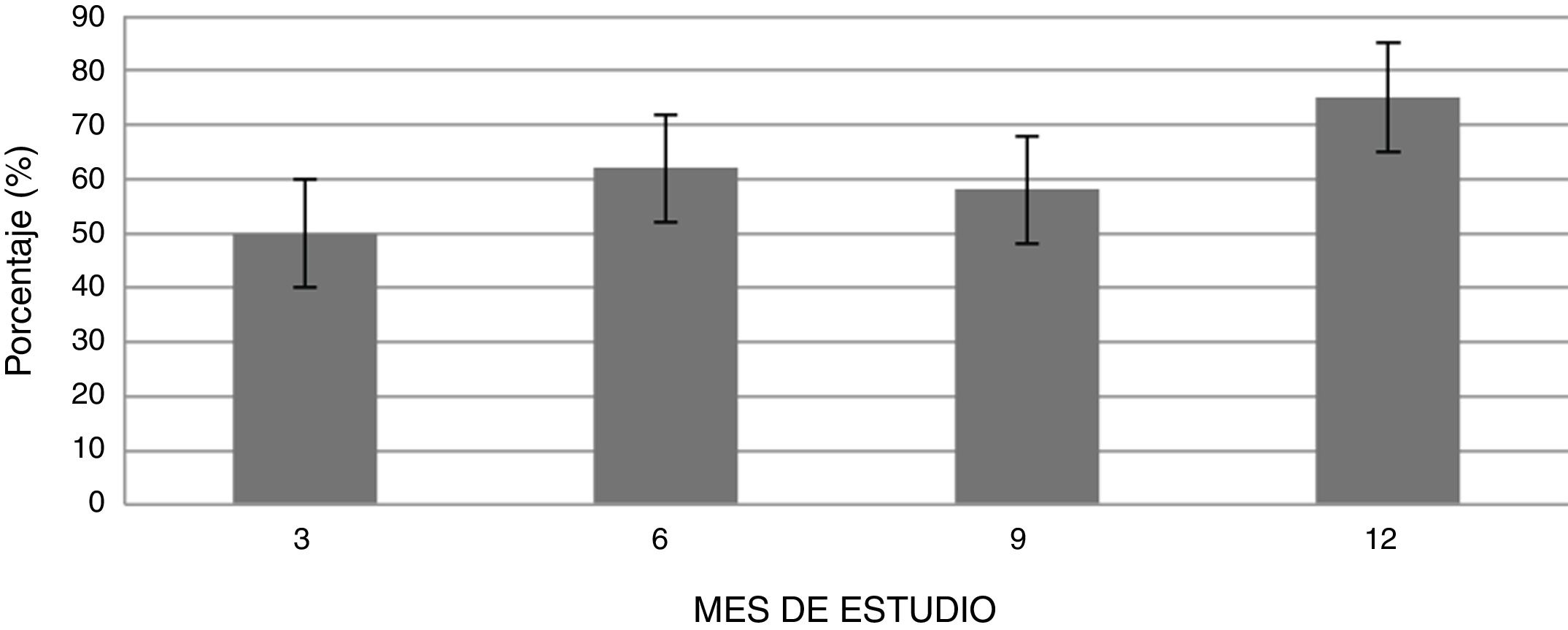
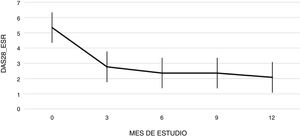
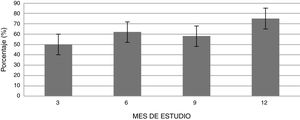
La figura 1 muestra la evolución temporal del DAS28-VSG durante las 52 semanas de seguimiento clínico. De acuerdo con los valores de DAS28-VSG, a los 3 meses de iniciado el tratamiento, un total de 22 pacientes (48,9%; IC 95%: 34,3-63,5%) alcanzaron remisión, valor que aumentó progresivamente a los 6 y 12 meses de seguimiento en donde la proporción de pacientes con remisión fue del 62% (IC 95%: 47,8-76,2%) (n=28) y del 75% (IC 95%: 62,3-87,6%) (n=34), respectivamente (fig. 2). Se detectó una diferencia estadísticamente significativa entre el valor DAS28-VSG medio inicial y el obtenido a las 52 semanas (5,33 vs. 2,18; p<0,001). El porcentaje de remisión a los 3 meses no fue significativamente distinto entre el subgrupo de pacientes que habían recibido un tratamiento biológico previo y aquellos pacientes näive a la terapia biológica (71,4% vs. 45,5%; respectivamente; p=0,20).
De acuerdo con los criterios de respuesta EULAR, al tercer mes de tratamiento, 22 pacientes (48,9%) obtuvieron buena respuesta, 18 pacientes (40%) respuesta moderada y solo 5 pacientes (11,1%) no respondieron a la terapia. Un total de 18 pacientes (40%; IC 95%: 25,7-54,3%) requirieron aumento de dosis del fármaco a 8mg/kg, lo cual ocurrió en el mes 6,5±4,48 de iniciado el TCZ. Con el aumento de dosis, solo 2 pacientes presentaron fallo persistente al tratamiento.
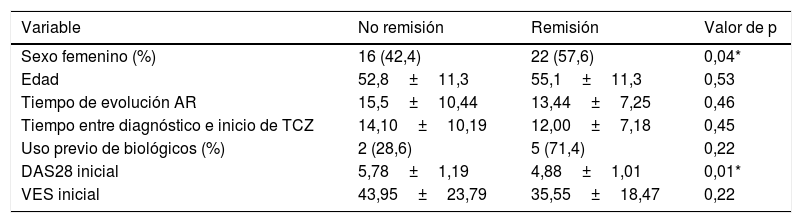
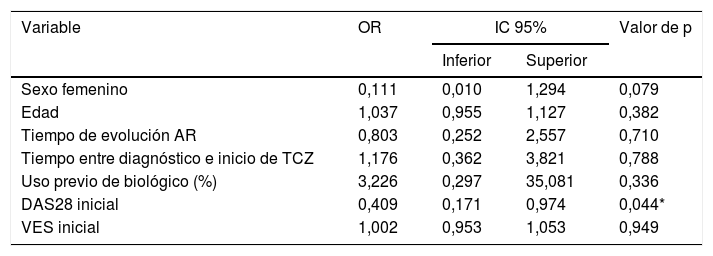
El análisis univariado y multivariado de los potenciales determinantes de remisión al tercer mes de tratamiento (de acuerdo con el valor de DAS28-VSG<2,6) se muestra en las tablas 2 y 3. Si bien el sexo femenino se asoció a mayor probabilidad de remisión en el análisis univariado, únicamente el DAS28-VSG basal se asoció de forma independiente a la probabilidad de remisión a los 3 meses después del análisis multivariado ajustado por las otras variables confusoras.
Análisis univariado de potenciales variables predictivas de remisión (DAS28<2,6) a los 3 meses
| Variable | No remisión | Remisión | Valor de p |
|---|---|---|---|
| Sexo femenino (%) | 16 (42,4) | 22 (57,6) | 0,04* |
| Edad | 52,8±11,3 | 55,1±11,3 | 0,53 |
| Tiempo de evolución AR | 15,5±10,44 | 13,44±7,25 | 0,46 |
| Tiempo entre diagnóstico e inicio de TCZ | 14,10±10,19 | 12,00±7,18 | 0,45 |
| Uso previo de biológicos (%) | 2 (28,6) | 5 (71,4) | 0,22 |
| DAS28 inicial | 5,78±1,19 | 4,88±1,01 | 0,01* |
| VES inicial | 43,95±23,79 | 35,55±18,47 | 0,22 |
DAS28: actividad de la enfermedad en 28 articulaciones; TCZ: tocilizumab; VES: velocidad de eritrosedimentación.
Análisis multivariado de potenciales variables predictivas de remisión (DAS28<2,6) a los 3 meses
| Variable | OR | IC 95% | Valor de p | |
|---|---|---|---|---|
| Inferior | Superior | |||
| Sexo femenino | 0,111 | 0,010 | 1,294 | 0,079 |
| Edad | 1,037 | 0,955 | 1,127 | 0,382 |
| Tiempo de evolución AR | 0,803 | 0,252 | 2,557 | 0,710 |
| Tiempo entre diagnóstico e inicio de TCZ | 1,176 | 0,362 | 3,821 | 0,788 |
| Uso previo de biológico (%) | 3,226 | 0,297 | 35,081 | 0,336 |
| DAS28 inicial | 0,409 | 0,171 | 0,974 | 0,044* |
| VES inicial | 1,002 | 0,953 | 1,053 | 0,949 |
DAS28: actividad de la enfermedad en 28 articulaciones; IC: intervalo de confianza; OR: odds ratio; TCZ: tocilizumab; VES: velocidad de eritrosedimentación.
Durante el total del período de seguimiento (mediana de seguimiento: 12 meses), se contabilizaron 6 eventos infecciosos severos que afectaron a 4 pacientes, para una incidencia acumulada del 8,8% (IC 95%: 0,05-17,1%) y una tasa de incidencia de 0,98 eventos por cada 100 pacientes/año. Específicamente se diagnosticaron 3 eventos de neumonía adquirida en la comunidad, 2 infecciones complicadas del tracto urinario y una gangrena de Fournier. Ninguna de estas complicaciones produjo un desenlace fatal y todos los casos se resolvieron con el uso de terapia antibiótica.
DiscusiónEl presente estudio describe por primera vez los resultados de efectividad y seguridad del TCZ por vía IV con una dosis inicial de 4mg/kg cada 4 semanas en una población costarricense. El uso del TCZ se asoció a una reducción de los parámetros de actividad de la AR tanto por variables clínicas como analíticas. En concreto, la incidencia acumulada de remisión a los 6 meses fue del 62%, porcentaje muy superior al obtenido en el ensayo clínico publicado por Smolen et al., en el cual se reportó un porcentaje de remisión a los 6 meses del 13% al utilizar la misma dosis y vía de administración de TCZ que la empleada en este grupo de pacientes7. Si bien el objetivo del supracitado ensayo clínico no fue la remisión según DAS28-VSG, sino la ACR20, las diferencias en los porcentajes de remisión son muy amplias. Estas discrepancias pueden explicarse por las distintas características basales de los pacientes incluidos, siendo las principales diferencias el origen étnico y la presencia de pacientes más jóvenes y con mayor exposición a FAME en el presente estudio.
La tasa de remisión reportada a los 6 meses fue también superior a la descrita en un estudio observacional canadiense, en el cual se reportó un porcentaje de remisión del 36,3% al emplear TCZ (8mg/kg) como monoterapia o terapia combinada en un grupo de pacientes previamente tratados con algún FAME15. Sin embargo, otros autores han reportado tasas de remisión a los 6 meses más congruentes a las descritas en este estudio. En específico, las tasas de remisión, publicadas para una cohorte de pacientes españoles16, italianos17 y japoneses18, fueron del 75,5, 52,3 y 47,6%, respectivamente, aunque en tales escenarios se empleó una dosis de TCZ de 8mg/kg.
A pesar de que algunos estudios farmacológicos han demostrado que la farmacocinética del TCZ no se ve afectada por la etnicidad ni por las condiciones inflamatorias de la AR19, la variabilidad observada en la respuesta farmacológica al TCZ en distintas poblaciones hace suponer la existencia de una distribución no uniforme de ciertas variables predictivas entre los grupos analizados, como por ejemplo la edad, el tiempo de evolución de la AR y el DAS28-VSG al inicio del tratamiento. En concreto, varios autores coinciden al identificar las edades tempranas y un DAS28-VSG inicial bajo como factores predictivos de respuesta al TCZ. Pers et al. describieron que los pacientes de menor edad presentaban mejores tasas de respuesta al TCZ en comparación con individuos añosos20. Por su parte, Narváez et al. reportaron que un puntaje elevado de DAS28-VSG al inicio de la terapia con el agente biológico se asoció a la falla de remisión temprana con el uso de TCZ IV21. En congruencia con tales reportes, nuestros hallazgos identificaron como única variable independiente asociada a la falla de remisión el DAS28-VSG basal. La identificación de esta variable pronóstica es de utilidad clínica ya que podría seleccionar un grupo de pacientes en los que el inicio de una dosis de 4mg/kg no sea el abordaje más recomendado. Otras variables predictivas recientemente descritas son las altas concentraciones basales de IL-6 y los bajos niveles del receptor soluble de esta citoquina, los cuales permiten identificar a un subgrupo de pacientes con especial beneficio de esta terapia22.
Este estudio reporta la experiencia de un grupo de pacientes de origen étnico distinto al estudiado en los ensayos clínicos que demostraron la eficacia y seguridad del TCZ IV18. Este hallazgo es de relevancia por cuanto estudios epidemiológicos recientes han demostrado que la población hispana se caracteriza por tener altos índices de actividad de AR y menores tasas de respuesta clínica en contextos similares, en relación con el estatus socioeconómico bajo y el difícil acceso a los servicios de salud de este grupo étnico, en comparación con otras poblaciones de países desarrollados23.
Sin embargo, el presente estudio demuestra que a pesar de estos factores socioculturales, el uso del TCZ confiere respuestas de efectividad similares o superiores a las descritas en otras poblaciones de países industrializados.
Pocos estudios han publicado la efectividad clínica de una dosis inicial de 4mg/kg de TCZ por vía IV. Aunque algunos ensayos clínicos han reportado que esta dosis puede ser inferior a la administración de 8mg/kg cada 4 semanas7,24, los datos del presente análisis demuestran que este abordaje puede ser efectivo cuando se emplea como dosis inicial en pacientes con fallo previo a FAME sintéticos. Además, otros ensayos clínicos no han evidenciado estas diferencias en la eficacia del TCZ de acuerdo con la dosis empleada6. No obstante, los hallazgos de este estudio observacional deben ser confirmados de forma prospectiva y sustentados a partir de evidencia científica derivada de ensayos clínicos que comparen ambas dosis de TCZ en busca de un esquema óptimo que maximice la relación coste-efectividad, sobre todo en poblaciones con limitado acceso a recursos económicos. Además, un seguimiento más prolongado de esta cohorte de pacientes será de particular utilidad clínica para conocer los efectos a largo plazo de la dosificación empleada del TCZ.
En términos de seguridad se encontró un comportamiento semejante al descrito en otros estudios de farmacovigilancia. Por ejemplo, Morel et al.25 describieron una cohorte francesa de casi 1.500 pacientes en la que los pacientes con AR y expuestos a TCZ presentaron una mayoría de complicaciones infecciosas severas que ocurrieron en vía aérea inferior y en tejidos blandos (35 y 32% del total de eventos infecciosos documentados), con una tasa de incidencia de 4,7/100 pacientes/año.
Los hallazgos de este estudio deben ser interpretados con cautela debido al carácter retrospectivo y al diseño no controlado del mismo, con lo cual se pudo incurrir en sesgos de selección. Además, el tamaño muestral y el carácter unicéntrico del análisis disminuyen la validez externa de los hallazgos. Otra limitante de este estudio fue la ausencia de la determinación de otras variables de respuesta al fármaco como escalas de funcionalidad y calidad de vida, las cuales no fueron rutinariamente empleadas en la práctica clínica del centro hospitalario estudiado. La omisión de estas variables pudo haber dejado fuera del análisis otros factores que han sido relacionados con la efectividad del TCZ, como por ejemplo las variables psicosociales, la depresión y la fatiga26.
Sin embargo, pese a las anteriores limitaciones, los resultados obtenidos son alentadores por cuanto demuestran la efectividad de una dosis optimizada en un contexto clínico usual. Además, pese a que se empleó un análisis «por protocolo», no ocurrió ninguna pérdida de los pacientes durante el seguimiento, por lo que este tipo de análisis no introdujo sesgos de información en los resultados del estudio.
En conclusión, el presente estudio demuestra la efectividad y seguridad del TCZ IV (4mg/kg cada 4 semanas) en un grupo particular de individuos costarricenses, a la vez que sugiere la utilidad de un esquema de dosificación optimizado que pueda significar una reducción de los costos asociados al tratamiento de los pacientes con AR.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesA Ramos-Esquivel ha participado en Advisory Boards de Roche, Bayer, Stein y Astrazeneca.
M. Cordero-Alfaro no presenta conflictos de interés.
C. León-Céspedes no presenta conflictos de interés.