Actualizar las recomendaciones sobre osteoporosis (OP) de la Sociedad Española de Reumatología (SER) basadas en la mejor evidencia posible.
MétodosSe creó un panel formado por nueve reumatólogos expertos en OP previamente seleccionados por la SER mediante una convocatoria abierta. Las fases del trabajo fueron: identificación de las áreas claves para la actualización del consenso anterior, análisis y síntesis de la evidencia científica (utilizando los niveles de evidencia del SIGN) y formulación de recomendaciones a partir de esta evidencia y de técnicas de consenso.
ResultadosEsta revisión de las recomendaciones comporta una actualización en la evaluación diagnóstica de la OP y de su tratamiento. Propone unos criterios para considerar alto riesgo de fractura y unas indicaciones para iniciar tratamiento. Las recomendaciones abordan también cuestiones relativas a la seguridad de los tratamientos y al manejo de situaciones especiales como las enfermedades inflamatorias y el tratamiento con glucocorticoides.
ConclusionesSe presenta la actualización de las recomendaciones SER sobre OP.
To update the recommendations on osteoporosis (OP) of the Spanish Society of Rheumatology (SER) based on the best possible evidence.
MethodsA panel of nine expert rheumatologists in OP was created, previously selected by the SER through an open call. The phases of the work were: identification of the key areas for updating the previous consensus, analysis and synthesis of the scientific evidence (using the SIGN levels of evidence) and formulation of recommendations based on this evidence and consensus techniques.
ResultsThis revision of the recommendations implies an update in the diagnostic evaluation and treatment of OP. It proposes some criteria to consider the high risk of fracture and some indications to start treatment. The recommendations also address issues related to the safety of treatments and the management of special situations such as inflammatory diseases and treatment with glucocorticoids.
ConclusionsWe present an update of SER recommendations on OP.
La osteoporosis (OP) es una enfermedad esquelética difusa caracterizada por una disminución generalizada de la resistencia ósea que predispone a un mayor riesgo de fracturas por fragilidad.
En España y en otros países la incidencia de fractura por fragilidad está aumentando debido fundamentalmente a una mayor esperanza de vida1. Un estudio determinó que 2,4 millones de españoles (1,9 millones de mujeres y 0,5 de varones) mayores de 50años padecían OP en el año 20102, y como consecuencia de esta se produjeron 204.000 nuevas fracturas y se gastaron 2.842 millones de euros (el 2,8% del gasto sanitario en España)3. Para el año 2025 se estima un aumento de la incidencia de fracturas del 40% y un aumento de los costes del 30%3.
En los últimos años se han producido avances en el diagnóstico y tratamiento de la OP; sin embargo, solo una minoría de pacientes con alto riesgo de fractura son evaluados y tratados adecuadamente conforme a las recomendaciones de las guías de práctica clínica4.
En el presente documento se exponen las recomendaciones de la Sociedad Española de Reumatología (SER) sobre OP que actualizan las anteriores de 20115. Estas recomendaciones pretenden servir de ayuda en la toma de decisiones en el manejo de la OP posmenopáusica y las OP secundarias (glucocorticoides, enfermedades inflamatorias, OP del varón y otras formas clínicas).
MetodologíaDiseñoEn este proyecto se ha utilizado una síntesis cualitativa de la evidencia científica y técnicas de consenso que recogen el acuerdo de expertos en base a su experiencia clínica y la evidencia científica.
Fases del procesoEn el desarrollo del documento de Recomendaciones se han seguido una serie de pasos que se describen a continuación:
- 1.
Creación del grupo de trabajo. La elaboración del documento se inició con la constitución de un panel de expertos formado por 9 reumatólogos miembros de la SER. Fueron elegidos mediante una convocatoria abierta a todos los socios de la SER. La Comisión de Guías de Práctica Clínica (GPC) y Recomendaciones de la SER valoró el currículum vitae de todos los solicitantes de acuerdo a criterios objetivos de aportación al conocimiento de la OP; se tuvieron en cuenta publicaciones en revistas de impacto en los últimos 5años. La coordinación de los aspectos clínicos y metodológicos fue realizada, respectivamente, por uno de estos reumatólogos como investigador principal (IP) y una especialista en metodología, técnico de la Unidad de Investigación de la SER.
- 2.
Identificación de las áreas clavespara la actualización del consenso anterior. Todos los miembros del grupo de trabajo participaron en las tareas de dar estructura al documento, así como establecer los contenidos y aspectos claves. Primero se identificaron las preguntas clínicas de investigación que podrían tener más impacto para ofrecer información sobre el manejo de la OP: diagnóstico, evaluación, prevención, tratamiento y situaciones especiales. Después se fijaron cuáles de ellas precisaban responderse mediante formulación de pregunta PICO (paciente, intervención, comparación, outcome o resultado). Se definió también la metodología a seguir en el proceso de elaboración de las recomendaciones.
- 3.
Búsqueda bibliográfica. Para responder a las preguntas clínicas no PICO se realizó una búsqueda de revisiones sistemáticas (RS) y GPC actualizadas en MEDLINE y fuentes especializadas en guías. El resto de las preguntas clínicas se reformularon en cuatro preguntas con formato PICO. Para responder a las preguntas PICO se diseñó una estrategia de búsqueda y se realizó una revisión de la evidencia científica de estudios publicados hasta mayo de 2017. Se utilizaron las bases de datos: PubMed (MEDLINE), EMBASE y Cochrane Library (Wiley Online). Se completó el proceso con una búsqueda manual de referencias, pósteres y resúmenes de congresos que los revisores y expertos consideraron de interés.
- 4.
Análisis y síntesis de la evidencia científica. Las RS y GPC identificadas para las preguntas no PICO fueron evaluadas por la coordinadora metodológica. Se acordó que solamente las de calidad alta serían consideradas aptas para su incorporación como fuente de evidencia. Dos reumatólogos, del grupo de trabajo de revisores de la evidencia de la SER, se encargaron de revisar sistemáticamente la evidencia científica disponible para las preguntas PICO. Tras la lectura crítica del texto completo de los estudios seleccionados para cada revisión, elaboraron un resumen mediante el uso de un formulario homogeneizado incluyendo tablas y texto para describir la metodología, los resultados y la calidad de cada estudio. Se detallaron los motivos de exclusión de los artículos no incluidos en la selección. Se evaluó el nivel global de la evidencia científica utilizando los niveles de evidencia del Scottish Intercollegiate Guidelines Network (SIGN) (ver anexo 1).
- 5.
Formulación de recomendaciones. Finalizada la lectura crítica, el IP y los componentes del panel de expertos procedieron a la formulación de recomendaciones específicas basadas en la evidencia científica disponible. Esta formulación se ha basado en la «evaluación formal» o «juicio razonado», resumiendo previamente la evidencia para cada una de las preguntas clínicas. Se tuvieron en cuenta también la calidad, la cantidad y la consistencia de la evidencia científica, la generalidad de los resultados, su aplicabilidad y su impacto clínico. Para la formulación de las recomendaciones se utilizaron dos rondas de consenso; primero, con el sistema de consenso de «juicio razonado», todos los expertos redactaron y discutieron las recomendaciones; después, en presencia del metodólogo, mediante la técnica modificada de consenso nominal, se consensuó el grado de acuerdo de los expertos con la redacción de cada una de las recomendaciones. Se estableció que había alto grado de consenso cuando el porcentaje de expertos que estuvieron de acuerdo con la redacción de la recomendación fue del 75% o superior. El acuerdo se valoró mediante respuesta dicotómica (sí: de acuerdo con el enunciado; no: en desacuerdo con el enunciado). La graduación de las recomendaciones se ha realizado con el sistema SIGN (ver anexo 1). Las recomendaciones se han dividido en cuatro áreas principales: diagnóstico y evaluación, tratamiento, situaciones especiales y nuevos tratamientos.
- 6.
Exposición pública. El borrador de este documento de Recomendaciones SER fue sometido a un proceso de exposición pública por parte de socios miembros de la SER y de distintos grupos de interés (industria farmacéutica, otras sociedades científicas y asociaciones de pacientes) con objeto de recoger la valoración y su argumentación científica de la metodología y las recomendaciones. La información completa de este proceso se encuentra en un anexo en la página web de la SER (www.ser.es), en el apartado de Investigación y Recomendaciones SER.
El documento recoge todas las recomendaciones formuladas subdivididas en las diferentes áreas ya referidas. A partir de las recomendaciones se han elaborado algoritmos de manejo que presentan de forma resumida la aproximación al tratamiento de la OP.
ResultadosEl total de recomendaciones formuladas sobre OP es de 28 (tabla 1).
Recomendaciones SER sobre osteoporosis
| Recomendaciones | GR | GA |
|---|---|---|
| Diagnóstico y evaluación | ||
| Recomendación: Se recomienda que la evaluación del riesgo de fractura por fragilidad no se base exclusivamente en la medición de la DMO sino teniendo en cuenta además factores de riesgo clínicos | B | 100% |
| Recomendación: Se recomienda la utilización de la herramienta FRAX®, con o sin DMO, para evaluar el riesgo de fractura | √ | 78% |
| Recomendación: Se recomienda clasificar a los pacientes como alto riesgo de fractura cuando el riesgo cuantificado por FRAX® para fractura de cadera sea ≥3% | √ | 100% |
| Recomendación: Para clasificar a los pacientes como alto riesgo mediante el FRAX® para fractura principal se sugiere utilizar el umbral ≥10% sin DMO o ≥7,5% con DMO | √ | 78% |
| Recomendación: Se recomienda realizar una densitometría en los siguientes casos: | D | |
| 1. Fractura por fragilidad | 100% | |
| 2. Presencia de dos o más factores de riesgo elevado de fractura | 100% | |
| 3. FRAX® para fractura principal ≥5% | 78% | |
| 4. Tratamiento con fármacos inhibidores de aromatasa, antiandrógenos y glucocorticoides | 100% | |
| 5. Enfermedades asociadas a OP secundaria | 100% | |
| Recomendación: Se recomienda realizar un estudio analítico básico para descartar causas secundarias de osteoporosis | √ | 100% |
| Recomendación: El empleo rutinario de los marcadores de recambio óseo no está establecido; sin embargo, podrían considerarse en la evaluación inicial y en el seguimiento de los pacientes con osteoporosis | B | 89% |
| Recomendación: Se recomienda valorar la presencia de fracturas vertebrales en el paciente con riesgo alto de fractura o con osteoporosis cuando se objetiva cifosis o pérdida de altura significativa y ante una dorsalgia o lumbalgia de inicio reciente | D | 100% |
| Tratamiento | ||
| Recomendación: Entre las medidas de prevención primaria y secundaria de osteoporosis y de fractura se recomienda un estilo de vida saludable, incluyendo dieta equilibrada y ejercicio físico regular, evitar el tabaco, limitar el consumo de alcohol e implementar medidas para la prevención de caídas | √ | 100% |
| Recomendación: Se recomienda una ingesta diaria de calcio entre 1.000 y 1.200mg y que proceda en su mayor parte de la dieta habitual | D | 100% |
| Recomendación: Se recomienda la toma diaria de 800UI de vitaminaD en los siguientes casos: | D | 100% |
| 1. Pacientes con osteoporosis | ||
| 2. Personas mayores de 65 años con riesgo de fractura | ||
| 3. Personas con déficit de vitamina D | ||
| 4. Personas con una exposición solar limitada | ||
| 5. Personas con un aporte de calcio inadecuado (menos de 700-800mg diarios) | ||
| Recomendación: Se recomienda iniciar tratamiento farmacológico para reducir el riesgo de fractura osteoporótica en las siguientes situaciones: | √ | |
| 1. Fractura por fragilidad de vértebra o cadera en pacientes >50años | 100% | |
| 2. Otras fracturas por fragilidad en pacientes >50años y baja masa ósea (T-score <−1DE) | 89% | |
| 3. OP definida por T-score ≤−2,5DE en columna, cuello de fémur o cadera, valorando siempre la edad, las cifras de DMO y otros factores de riesgo | 100% | |
| 4. Pacientes con riesgo elevado de fractura de cadera según FRAX® con DMO ≥3% | 100% | |
| 5. Varones en tratamiento de privación androgénica y T-score ≤−2,5DE | 100% | |
| 6. Mujeres en tratamiento con inhibidores de aromatasa y T-score ≤−2DE o con un T-score <−1,5DE y un factor de riesgo adicional, o bien con ≥2factores de riesgo sin DMO | 78% | |
| 7. Pacientes que van a recibir glucocorticoides durante más de 3meses en los siguientes casos: a)dosis inicial ≥30mg/día de prednisona; b)mujeres posmenopáusicas y varones >50años con dosis ≥5mg/día y fractura previa por fragilidad o T-score ≤−1,5DE o riesgo elevado de fractura: FRAX® para cadera ≥3% o para fractura principal ≥10% sin DMO o ≥7,5% con DMO | 100% | |
| Recomendación: A la hora de elegir el tratamiento, entre otros factores, se recomienda tener en consideración: | √ | 100% |
| 1. La eficacia y la seguridad de los fármacos | ||
| 2. La relación coste/efectividad | ||
| 3. El valor de la DMO | ||
| 4. La presencia de fracturas, en particular vertebrales o fracturas múltiples por fragilidad | ||
| 5. Los tratamientos previos y la adherencia a los mismos | ||
| 6. La edad | ||
| 7. Las comorbilidades y polimedicación | ||
| 8. Las limitaciones para la administración por vía oral | ||
| Recomendación: Se recomienda reevaluar el riesgo de fractura tras 5años de tratamiento con bisfosfonatos orales o tras 3años de tratamiento con ácido zoledrónico | D | 100% |
| Recomendación: Cuando se suspenda el tratamiento con denosumab debería contemplarse un tratamiento alternativo para la osteoporosis | D | 100% |
| Recomendación: En pacientes con alto riesgo de fractura, como aquellos con fractura previa por fragilidad, o con T-score de fémur proximal <−2,5DE, no se recomienda discontinuar el tratamiento de la osteoporosis | D | 89% |
| Recomendación: Se recomienda una valoración clínica periódica para comprobar el cumplimiento y la eficacia del tratamiento, la incidencia de fracturas y la posible aparición de efectos adversos | √ | 100% |
| Recomendación: Si al paciente con OP se le indica algún procedimiento odontológico invasivo (exodoncia o implante) se aconseja posponer el inicio del tratamiento antirresortivo hasta la cicatrización completa de la herida quirúrgica | D | 100% |
| Recomendación: En pacientes tratados con antirresortivos a los que se vaya a realizar un procedimiento dental no se recomienda interrumpir el tratamiento con BF ni con denosumab. Si existen otros factores adicionales de riesgo de osteonecrosis de los maxilares o el procedimiento quirúrgico va a ser extenso se puede considerar una suspensión temporal del tratamiento con BF | D | 78% |
| Recomendación: En pacientes con alto riesgo de fractura y tratamiento prolongado con bisfosfonatos (>5años para los orales o >3años para los intravenosos) se recomienda no suspender el tratamiento, ya que el riesgo de fractura atípica de fémur es muy bajo y los beneficios en reducción de fracturas superan en gran manera el riesgo de fractura atípica | D | 100% |
| Situaciones especiales | ||
| Recomendación: Se recomienda que todos los pacientes ≥50años con fractura reciente por fragilidad sean evaluados de forma sistemática para prevenir nuevas fracturas | D | 100% |
| Recomendación: El tratamiento de elección de la fractura vertebral aguda consiste en reposo, analgesia en escalada rápida para controlar el dolor y, en caso necesario, la utilización de ortesis | √ | 100% |
| Recomendación: Se recomiendan la vertebroplastia y la cifoplastia para el tratamiento de la fractura vertebral únicamente en casos de dolor grave refractario a la escalera analgésica de la OMS, incluyendo opiáceos | D | 100% |
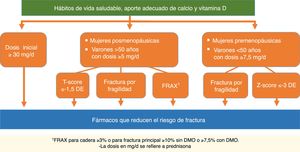
| Recomendación: En pacientes que reciben o van a recibir tratamiento con glucocorticoides debe evaluarse el riesgo de fractura y valorar iniciar tratamiento para la osteoporosis lo antes posible | D | 100% |
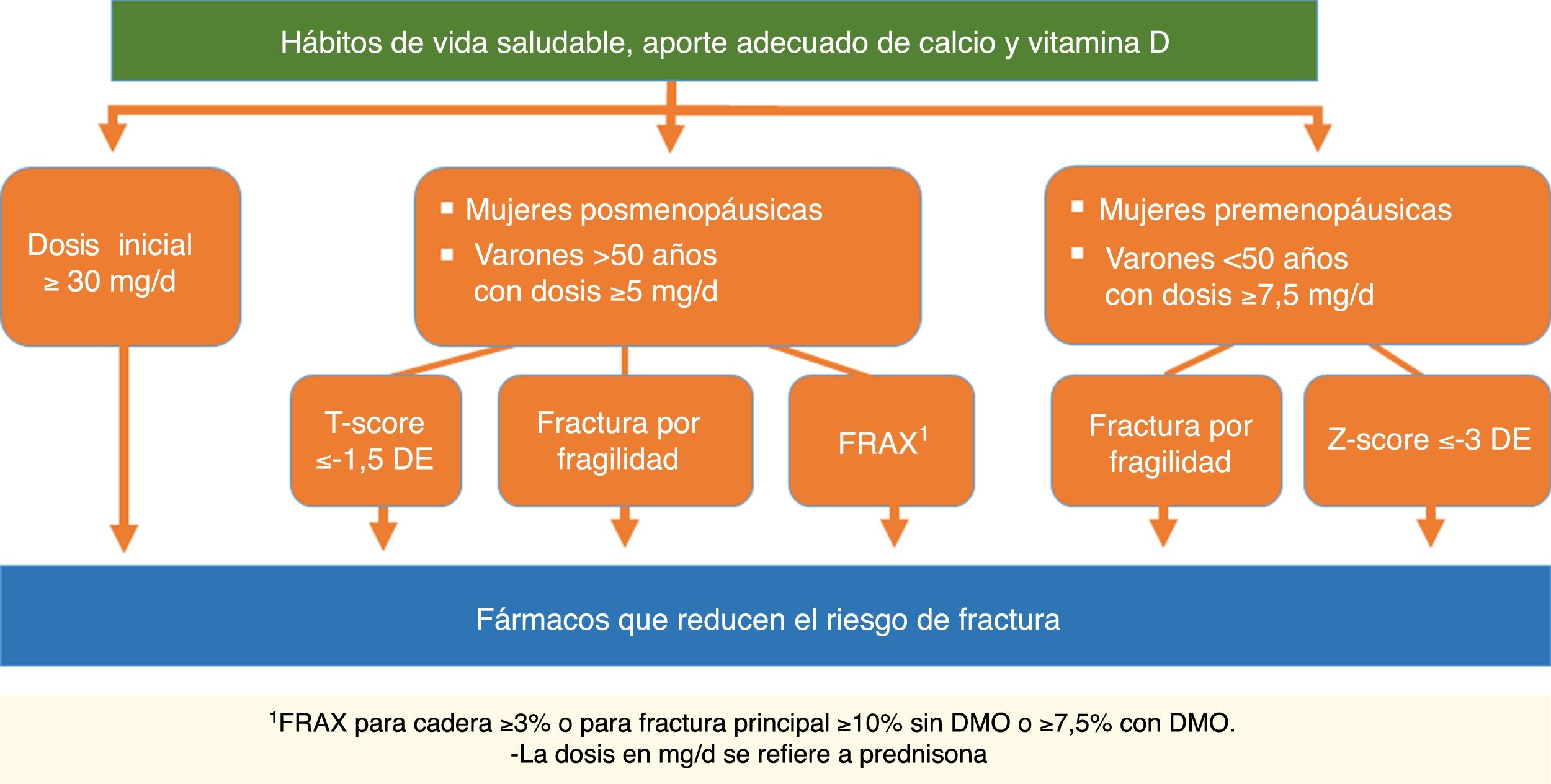
| Recomendación: Se recomienda iniciar tratamiento farmacológico para prevenir la OP en pacientes que van a recibir glucocorticoides durante más de 3meses en los siguientes casos: | D | |
| 1. Pacientes con dosis inicial ≥30mg/día de prednisona. En estos casos se recomienda iniciar tratamiento para la OP de forma inmediata | 100% | |
| 2. Mujeres posmenopáusicas y varones >50años con dosis de prednisona ≥5mg/día que además presenten alguna de las siguientes condiciones: | 100% | |
| a) Fractura previa por fragilidad | 89% | |
| b) Baja DMO (T-score ≤−1,5DE en columna o cadera) | 78% | |
| c) Riesgo elevado de fractura: FRAX® para cadera ≥3% o para fractura principal ≥10% sin DMO o ≥7,5% con DMO | 100% | |
| 3.Mujeres premenopáusicas y varones <50años y dosis ≥7,5mg/día de prednisona que además presenten alguna de las siguientes condiciones: | 78% | |
| a) Fractura previa por fragilidad | 78% | |
| b) Baja DMO (Z-score ≤−3DE) | ||
| Recomendación: Se aconseja evaluar el riesgo de fractura y considerar la realización de DXA en pacientes con artritis reumatoide, lupus eritematoso sistémico y espondilitis anquilosante, particularmente en mayores de 50años y en los tratados con glucocorticoides o con enfermedad severa o evolucionada | √ | 100% |
| Recomendación: Se recomienda el estudio de causas de osteoporosis secundaria en todos los varones con baja masa ósea o fractura por fragilidad | D | 100% |
| Recomendación: Se recomienda realizar un estudio de causas de osteoporosis secundaria en todas las mujeres premenopáusicas con baja masa ósea o con fractura por fragilidad | √ | 100% |
DMO: densidad mineral ósea; FRAX®: Fracture Risk Assessment; GA: grado de acuerdo; GR: grado de recomendación (ver anexo 1).
La OP es una enfermedad esquelética difusa caracterizada por una disminución de la resistencia ósea que predispone a un mayor riesgo de fracturas por fragilidad. El concepto «resistencia ósea» engloba factores relacionados tanto con la densidad mineral ósea (DMO) como con la calidad del tejido óseo6.
Se considera fractura por fragilidad la ocasionada por un traumatismo de bajo impacto. Una caída, estando de pie o sentado, estaría incluida en este concepto. Las fracturas más frecuentes y relevantes son las del fémur proximal, de la columna vertebral y del antebrazo distal7.
Se define OP en cualquiera de las siguientes circunstancias:
- a)
T-score en columna lumbar, cuello femoral o cadera total ≤−2,5DE.
- b)
Fractura femoral por fragilidad, independientemente del valor de la DMO, en mujeres posmenopáusicas y en varones >50años.
- c)
Fractura por fragilidad de vértebra, húmero proximal o pelvis en mujeres posmenopáusicas y en varones >50años, si se constata una DMO baja (T-score <−1,0DE).
La definición conceptual de OP de la Organización Mundial de la Salud (OMS) está basada únicamente en los resultados de la DMO. Un individuo tiene OP si el T-score en columna lumbar, cuello femoral o cadera total es igual o inferior a −2,5 desviaciones estándar (DE) respecto al pico de masa ósea poblacional8,9.
En la práctica clínica habitual esta definición es poco operativa debido a que muchas fracturas por fragilidad se producen en pacientes con un T-score >−2,5DE. Es por ello que la National Bone Health Alliance ha propuesto considerar el diagnóstico de OP en mujeres posmenopáusicas y en varones >50años con fractura femoral por fragilidad, independientemente del valor de la DMO, así como ante una fractura de bajo impacto vertebral, del húmero proximal o de la pelvis, si se constata un T-score <−1,0DE10. Hay dudas respecto a la fractura del antebrazo, que en algunos casos podría incluirse según la edad o el mecanismo de la fractura. Los autores incluyen también como diagnóstico de OP para población americana un riesgo cuantificado con el Fracture Risk Assessment (FRAX®) para fractura principal ≥20% (húmero proximal, antebrazo, cadera o fractura vertebral clínica) o un riesgo de fractura de fémur ≥3%10.
A la vista de las recomendaciones de estos grupos de expertos y según la experiencia clínica, el panel de expertos considera adecuado incluir en el diagnóstico de OP a las mujeres posmenopáusicas y a los varones >50años con fractura por fragilidad de fémur (independientemente de DMO), así como la fractura vertebral, de húmero o de pelvis, si se acompaña de baja masa ósea (GA: 89%).
Factores de riesgo de fracturaEl objetivo principal en el manejo de la OP es la prevención de fracturas, por lo cual es prioritario identificar a los individuos con mayor riesgo de presentarlas11.
En la tabla 2 se describen los factores de riesgo (FR) elevados de fractura (riesgo relativo ≥2) y los FR moderados (riesgo relativo 1-2)5.
Factores de riesgo clínicos de fractura
| Riesgo elevado (riesgo relativo ≥2) |
| Edad mayor de 65 años |
| Bajo peso: índice de masa corporal <20kg/m2 |
| Antecedente personal de fractura por fragilidad |
| Antecedente materno de fractura de fémur |
| Glucocorticoides (>5 mg/día de prednisona o equivalente durante >3meses) |
| Más de 2 caídas en el último año |
| Riesgo moderado (riesgo relativo entre 1 y 2) |
| Tabaquismo activo |
| Consumo de >3unidades diarias de alcohola |
| Menopausia precoz (<45 años), amenorrea primaria y secundaria, hipogonadismo en el varón |
| Enfermedades que pueden reducir la DMO: artritis reumatoide y otras artropatías inflamatorias, patología intestinal inflamatoria, celiaquía, malabsorción, hepatopatías, hiperparatiroidismo, hipertiroidismo, anorexia y bulimia, trasplante de órgano sólido, etc. |
| Fármacos con capacidad de reducir la DMO / aumentar el riesgo de fracturas: hidantoínas, antirretrovirales, anticomiciales, inhibidores de aromatasa, privación androgénica, etc. |
| Trastornos relacionados con las caídas: trastornos de la visión, enfermedades neurológicas (ictus, Parkinson), empleo de psicofármacos |
Algunos factores de riesgo, como la edad, el antecedente de fractura y el empleo de glucocorticoides, entre otros, contribuyen al riesgo de fractura independientemente de la DMO. Los pacientes con una fractura reciente tienen un riesgo especialmente alto de sufrir una nueva fractura11.
Recientemente se ha propuesto el término «riesgo inminente de fractura» para referirse a los pacientes con un riesgo elevado a corto plazo, como son aquellos con una fractura reciente, ancianos frágiles con caídas frecuentes o los pacientes tratados con glucocorticoides a dosis elevadas12,13.
Recomendación:Se recomienda que la evaluación del riesgo de fractura por fragilidad no se base exclusivamente en la medición de la DMO sino teniendo en cuenta además factores de riesgo clínicos (GR: B; GA: 100%).
La combinación de la DMO con FR clínicos proporciona la mejor estimación del riesgo de fractura14,15. Este hecho ha fomentado el desarrollo de herramientas de cálculo del riesgo de fractura capaces de integrar múltiples factores. Entre ellas la más popular y ampliamente utilizada es el FRAX®9.
Evaluación del riesgo de fracturaRecomendación:Se recomienda la utilización de la herramienta FRAX®, con o sin DMO, para evaluar el riesgo de fractura (GR: √; GA: 78%).
El FRAX® calcula la probabilidad de presentar una fractura principal (incluye cadera, vertebral clínica, húmero y antebrazo) o una fractura de cadera en los siguientes 10años, incluyendo o no el valor de la DMO. Cuando se incluye la DMO en la herramienta FRAX® la predicción del riesgo de fractura es más exacta y fiable16,17.
Las limitaciones del FRAX® vienen determinadas, fundamentalmente, por deficiencias en los datos a partir de los que fue calculado. Así, el FRAX® no tiene en cuenta el factor dosis-respuesta para varios FR, no considera la DMO lumbar, obvia el mayor riesgo de fractura en los pacientes con una fractura reciente y no recoge las caídas9,16-18.?
La versión española del FRAX® infraestima el riesgo de fractura principal19. Sin embargo, la aplicación de un algoritmo de decisión con umbrales de indicación de densitometría ósea (DXA) y de tratamiento basados en FRAX® se ha demostrado coste-efectiva respecto a la utilización exclusiva del T-score −2,5DE20. A pesar de las limitaciones, la versión actual del FRAX® español puede ayudar a clasificar mejor a los pacientes en función del riesgo de fractura.
Recomendación:Se recomienda clasificar a los pacientes como alto riesgo de fractura cuando el riesgo cuantificado por FRAX®para fractura de cadera sea ≥3% (GR: √; GA: 100%).
Recomendación:Para clasificar a los pacientes como alto riesgo mediante el FRAX®para fractura principal se sugiere utilizar el umbral ≥10% sin DMO o ≥7,5% con DMO (GR: √; GA: 78%).
La validez del FRAX® español ha sido analizada en dos cohortes prospectivas, y en ambas infraestima el riesgo de fractura principal. La relación entre fracturas observadas y fracturas esperadas fue de 2,2 en el estudio FRIDEX20 y de 1,5 en el estudio ECOSAP21. Sin embargo, la estimación del FRAX® español para fractura de cadera parece adecuada. Un grupo de trabajo ha estimado los umbrales del FRAX® en población española20,22,23 definiendo alto riesgo de fractura principal un FRAX®, con o sin DMO, ≥7,5% y riesgo intermedio entre el 5 y el 7,5%. Se trata de un único estudio que define umbrales de riesgo en nuestro país, y cuenta con limitaciones metodológicas como no estar validado en otras regiones diferentes de Cataluña, incluir solo un 8,9% de sujetos con riesgo intermedio y un 8,5% con riesgo alto de fractura, además de existir solapamiento en el intervalo de confianza del umbral de alto riesgo. En este sentido, el panel considera que una mujer de unos 70años con fractura previa (equivale aproximadamente a un FRAX® español para fractura principal sin DMO del 10%) es un ejemplo de riesgo elevado de fractura.
Dada la escasa evidencia y el poco grado de acuerdo a la hora de clasificar al paciente como alto riesgo de fractura basado en el FRAX®, el panel de expertos ha acordado considerar riesgo elevado de fractura un FRAX® ≥3% para fractura de cadera. Hasta no disponer de más estudios sobre los umbrales de FRAX® y/o de posicionamientos oficiales de alcance nacional, el panel de expertos también considera como riesgo elevado de fractura un FRAX® para fractura principal ≥10% sin DMO o bien ≥7,5% con DMO.
El panel de expertos también ha considerado como alto riesgo de fractura, sin llegar a un grado de acuerdo aceptable (GA: 55%), la asociación de dos o más FR elevados. En caso de no utilizar la herramienta FRAX®, la presencia de dos factores de riesgo elevado puede servir como un punto de partida para evaluar la DMO.
Densitometría óseaLa técnica de elección, hoy día, para medir la DMO es la absorciometría de fuente dual de rayosX, o DXA6,10,11. La medición se realiza en la columna lumbar y el fémur proximal (cuello de fémur y cadera total). Según los expertos, la medición mediante DXA del tercio distal del antebrazo solo debería realizarse cuando no sea factible la medición en la columna lumbar o en el fémur proximal y/o en patologías concretas como el hiperparatiroidismo24.
La DXA tiene una alta especificidad para la predicción del riesgo de fractura, pero una baja sensibilidad. El riesgo aumenta de manera exponencial a medida que desciende la DMO25. No obstante, la mayoría de las fracturas por fragilidad se producen en pacientes con T-score por encima de −2,5DE. Por otra parte, los estudios realizados en pacientes diagnosticados de OP mediante DXA y sin otros FR de fractura concluyen que podría ser adecuado estimar el riesgo mediante FRAX® antes de valorar el tratamiento26,27.
Diferentes grupos de expertos coinciden en señalar que la DMO determinada en esqueleto periférico mediante DXA de falange y calcáneo y la técnica de ultrasonidos de calcáneo pueden ser útiles para predecir el riesgo de fractura, pero no para el diagnóstico de OP28,29.
Indicaciones de la densitometría óseaLos criterios para solicitar una DXA varían ampliamente a nivel nacional e internacional. La mayoría de las guías internacionales sobre OP recomiendan la valoración de la DMO en mujeres posmenopáusicas ≥65años, independientemente de otros FR30-32. Existe controversia respecto a la edad de cribado en varones. La National Osteoporosis Foundation (NOF) y la International Society for Clinical Densitometry (ISCD) recomiendan la medición en varones ≥70años, mientras que la guía canadiense sitúa el umbral en ≥65años31.
Según las conclusiones de un estudio transversal cuyo objetivo era evaluar los criterios de indicación de DXA en mujeres posmenopáusicas españolas basados en la herramienta FRAX®, la indicación de la prueba debe basarse en criterios clínicos que permitan seleccionar a pacientes en los que su evaluación resulte más eficiente33. Los autores concluyen que la estrategia debería iniciarse con la estimación del riesgo de fractura según los FR clínicos, y en este escenario podría ser útil la utilización del FRAX®33.
Basándose en las recomendaciones internacionalmente aceptadas sobre las indicaciones de la DXA, el panel de expertos considera que sus principales aplicaciones en la práctica clínica son: diagnóstico de OP, valoración del riesgo de fractura, valoración de tratamiento y monitorización de la respuesta al tratamiento.
En pacientes con un riesgo inminente de fractura la realización de una DXA no debe retrasar el inicio del tratamiento. Así, los pacientes con alto riesgo de fractura pueden ser tratados sin necesidad de practicar una DXA, aunque parece oportuno conocer la DMO basal para evaluar más adelante la eficacia del tratamiento. El panel de expertos coincide en que cuando el riesgo de fractura es bajo no se debería realizar una DXA, y que no se debería recomendar realizar una DXA a todas las mujeres en la menopausia.
Recomendación:Se recomienda realizar una densitometría en los siguientes casos (GR: D):
- 1.
Fractura por fragilidad (GA: 100%).
- 2.
Presencia de dos o más factores de riesgo elevado de fractura (GA: 100%).
- 3.
FRAX®para fractura principal ≥5% (GA: 78%).
- 4.
Tratamiento con fármacos inhibidores de aromatasa, antiandrógenos y glucocorticoides (GA: 100%).
- 5.
Enfermedades asociadas a OP secundaria (GA: 100%).
Basándose en estos estudios internacionales, el panel de expertos ha considerado la utilización del FRAX® sin DMO como evaluación inicial del riesgo de fractura. Cuando el riesgo calculado mediante el FRAX® español, sin DMO, para fractura principal sea ≥5% se aconseja realizar DXA34. Por lo tanto, se aboga por no realizar DXA en los pacientes de bajo riesgo.
El panel también considera realizar la medición de la DMO, independientemente de la edad, en población que presenta FR para fracturas por fragilidad como son: fractura previa por fragilidad, mujeres que inician tratamiento con inhibidores de la aromatasa por cáncer de mama35, varones tratados con terapia de privación androgénica por cáncer de próstata y pacientes tratados con glucocorticoides. La reciente guía del American College of Rheumatology (ACR) para prevención y tratamiento de la OP por glucocorticoides recomienda realizar DXA en pacientes que inician un tratamiento crónico con glucocorticoides en los siguientes casos: 1)adultos <40años si existe antecedente de fractura o algún FR alto de fractura, y 2)adultos ≥40años en todos los casos y calcular el FRAX® con DMO36. Las guías de oncología y de la International Osteoporosis Foundation (IOF) aconsejan la DXA para decidir si se inicia tratamiento para la OP en mujeres que reciben inhibidores de aromatasa35 y en varones en terapia de privación androgénica37.
En casos de fractura reciente por fragilidad o tratamiento con dosis altas de glucocorticoides, los estudios concluyen que la realización de una DXA no debe retrasar el inicio del tratamiento para prevenir nuevas fracturas12,13.
Otros pacientes candidatos a DXA por presentar riesgo elevado de OP y fractura por fragilidad son los que padecen enfermedades asociadas a OP secundaria, como las artropatías inflamatorias crónicas, la enfermedad inflamatoria intestinal, los síndromes de malabsorción intestinal, la hepatopatía crónica o la enfermedad renal crónica avanzada. En estos casos el panel considera razonable la evaluación de la DMO para poder instaurar medidas de prevención y tratamiento adecuadas a cada paciente.
Trabecular Bone ScoreEl Trabecular Bone Score (TBS) es un análisis de la textura ósea obtenida mediante la DXA que evalúa parámetros relacionados con la microarquitectura ósea de la columna lumbar y que se correlaciona bien con la tomografía computarizada38,39. Valores bajos de TBS están asociados con un aumento del riesgo de fractura osteoporótica principal, con independencia de la DMO38. La combinación de TBS y DMO lumbar incrementa la predicción del riesgo de desarrollar fracturas39. Además, la introducción del TBS en el algoritmo FRAX® permite ajustar mejor la predicción de desarrollar futuras fracturas38,40,41. Por ello, según los estudios, el TBS podría ser una herramienta adicional para la valoración del riesgo de fractura en pacientes con OP38-40 y en algunas causas de OP secundaria (diabetes, hiperparatiroidismo, glucocorticoides). Sin embargo, su utilidad en la monitorización de la respuesta terapéutica aún no está establecida38.
En resumen, el panel de expertos considera que aunque el TBS podría tener algunas ventajas en la valoración del riesgo de fractura, se necesitan más estudios para recomendar su uso en la práctica clínica.
AnalíticaRecomendación:Se recomienda realizar un estudio analítico básico para descartar causas secundarias de osteoporosis (GR: √; GA: 100%).
Las pruebas de laboratorio básicas para identificar OP secundarias y realizar el diagnóstico diferencial con otras enfermedades óseas incluyen30,42,43: hemograma, calcio y fosfato séricos, fosfatasa alcalina, proteinograma, albúmina, creatinina, pruebas de función hepática, calciuria y 25-hidroxivitaminaD.
Diferentes sociedades científicas30,42,43 han elaborado documentos con las siguientes recomendaciones:
Se realizarán pruebas adicionales si hay sospecha de un proceso asociado:
- 1.
PTH (hiperparatiroidismo primario o secundario).
- 2.
TSH (hipertiroidismo).
- 3.
Inmunoelectroforesis (mieloma).
- 4.
Anticuerpos antitransglutaminasa (celiaquía).
- 5.
Cortisol urinario (Cushing).
- 6.
Triptasa sérica (mastocitosis).
- 7.
Estudio de hormonas sexuales (personas jóvenes).
- 8.
Estudio genético (osteogénesis imperfecta, hipofosfatasia y otras).
Recomendación:El empleo rutinario de los marcadores de recambio óseo no está establecido; sin embargo, podrían considerarse en la evaluación inicial y en el seguimiento de los pacientes con osteoporosis (GR: B; GA: 89%).
Las reducciones de mayor magnitud en los marcadores de recambio óseo (MRO) se asocian de forma significativa a reducciones más marcadas en el riesgo de fractura no-vertebral44, y los cambios iniciales en un marcador de formación predicen la eficacia de los bisfosfonatos (BF) en la reducción del riesgo de fractura vertebral45. Sin embargo, no hay suficiente evidencia para concluir que los MRO sean capaces de identificar una reducción del riesgo de fractura de forma inequívoca46.
La mayoría de GPC recomiendan considerar el uso de MRO en la evaluación inicial y en el seguimiento, como una prueba adicional. En la evaluación inicial, los niveles elevados pueden predecir una pérdida más rápida de masa ósea y un riesgo más elevado de fractura. Pero su principal indicación está en el seguimiento, ya que pueden contribuir a evaluar la adherencia y la eficacia del tratamiento, así como contribuir a monitorizar la duración de las vacaciones terapéuticas30,42,43,47. Los grupos de expertos internacionales concluyen que son necesarias más investigaciones antes de poder hacer una recomendación basada en la evidencia43. En conclusión, aunque no está establecido el uso de los marcadores de recambio óseo de forma rutinaria, el panel de expertos sugiere que podrían aportar información adicional en la evaluación inicial y en el seguimiento del paciente con OP.
Los dos principales MRO séricos de referencia que recomiendan utilizar la IOF y la International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) son el propéptido N-terminal del procolágeno tipoI (PINP), un marcador de formación, y el telopéptido carboxilo-terminal del colágeno tipoI (CTX), un marcador de resorción48.
Cribado de fractura vertebralRecomendación:Se recomienda valorar la presencia de fracturas vertebrales en el paciente con riesgo alto de fractura o con osteoporosis, cuando se objetiva cifosis o pérdida de altura significativa y ante una dorsalgia o lumbalgia de inicio reciente (GR: D; GA: 100%).
Las radiografías de columna torácica y lumbar (centradas en T7 y L3, respectivamente) son el método de elección para el diagnóstico de una fractura vertebral. Suele ser suficiente una proyección lateral, minimizando así la radiación que recibe el paciente49. Son útiles en la evaluación inicial de todo paciente diagnosticado de OP cuando se objetiva una significativa pérdida de altura o una alteración de la estática relevante (especialmente cifosis torácica) y ante el dolor dorsolumbar de inicio reciente con o sin antecedente de traumatismo50 en un paciente con riesgo de OP o de fractura. La pérdida de altura que se asocia de manera significativa con la presencia de fracturas vertebrales no está definida, variando entre 2cm respecto a una medición en años previos a 4cm de pérdida histórica o desde la juventud30,51. La presencia de una fractura vertebral, así como su número y el grado de severidad, son indicadores muy relevantes del riesgo de nuevas fracturas vertebrales y no vertebrales, incluidas las de cadera52.
Así, el panel de expertos ha considerado que se debe valorar la presencia de fracturas vertebrales en la evaluación del paciente con OP o con riesgo alto de fractura cuando se objetiva cifosis o pérdida de altura significativa y ante clínica de fractura vertebral. Algunos equipos de DXA también permiten objetivar fracturas mediante el Vertebral Fracture Assessment (VFA).
TratamientoMedidas no farmacológicasRecomendación:Entre las medidas de prevención primaria y secundaria de osteoporosis y de fractura se recomienda un estilo de vida saludable, incluyendo dieta equilibrada y ejercicio físico regular, evitar el tabaco, limitar el consumo de alcohol e implementar medidas para la prevención de caídas (GR: √; GA: 100%).
En varios estudios se concluye que el mantenimiento de hábitos de vida saludables constituye la primera medida para prevenir la OP y evitar las fracturas53-57. Así, existe evidencia de que el ejercicio tiene efecto, aunque modesto, en la reducción de fracturas y en la prevención de caídas57. En la tabla 3 se presenta un resumen de las medidas más importantes a tener en cuenta.
Principales hábitos de vida saludable53-57
| Cubrir las necesidades nutritivas con una dieta saludable que incluya una ingesta adecuada de proteínas (0,8g por kilo de peso corporal), calcio, frutas y vegetales |
| Limitar la ingesta de cafeína |
| Exposición solar con prudencia |
| Evitar el consumo de tabaco y limitar la ingesta de alcohol a menos de 3 unidades/díaa |
| Fomentar la actividad física con ejercicio regular tanto de carga del propio peso (ejemplo: caminar, bailar, practicar taichí 30-40min por sesión) como con fortalecimiento muscular y postural, 3-4días por semana |
* Una unidad de alcohol equivale a 200ml de cerveza o 100ml de vino o 25ml de un licor.
Los estudios muestran que la adopción de medidas para la prevención de caídas, en las que se incluyen programas de ejercicios y actuaciones sobre la seguridad del entorno y el minimizar el uso de fármacos como hipnóticos, diuréticos, antihipertensivos y otros que empeoren el equilibrio, contribuyen también tanto en la prevención primaria como en la secundaria de fractura por fragilidad57,58.
Por el contrario, se desaconsejan los ejercicios que conlleven gran esfuerzo o que sean bruscos, así como los que implican la flexión o los giros repetidos del tronco y los abdominales.
En cuanto a medidas específicas para el paciente con cifosis, los estudios han mostrado la efectividad de los ejercicios, así como del entrenamiento de la fuerza muscular y el equilibrio59.
La efectividad de los protectores de cadera en la prevención de fracturas no es concluyente, y la adherencia a su uso es muy baja60. Finalmente, las plataformas vibratorias no han demostrado eficacia de manera consistente61.
Calcio y vitamina DRecomendación:Se recomienda una ingesta diaria de calcio entre 1.000 y 1.200mg y que proceda en su mayor parte de la dieta habitual (GR: D; GA: 100%).
Recomendación:Se recomienda la toma diaria de 800UI de vitaminaD en los siguientes casos (GR: D; GA: 100%):
- 1.
Pacientes con osteoporosis.
- 2.
Personas mayores de 65 años con riesgo de fractura.
- 3.
Personas con déficit de vitamina D.
- 4.
Personas con una exposición solar limitada.
- 5.
Personas con un aporte de calcio inadecuado (menos de 700-800mg diarios).
Los estudios coinciden en la necesidad de asegurar un aporte adecuado de calcio como aspecto fundamental en cualquier programa de tratamiento de la OP47. Así, en los pacientes en tratamiento farmacológico para la OP se deben utilizar suplementos de calcio y vitaminaD porque prácticamente todos los ensayos clínicos que han demostrado eficacia de los fármacos antiosteoporóticos incluyen de forma rutinaria suplementos de calcio y colecalciferol (vitaminaD3). Cuando el aporte de calcio de la dieta es insuficiente, se aconsejan suplementos de calcio y vitaminaD. En mujeres posmenopáusicas con OP los grupos de expertos internacionales aconsejan 800-1.200mg/día de calcio y 800UI/día de vitaminaD62,63.
En prevención primaria se aconseja una ingesta diaria de calcio de 1.000-1.200mg para mujeres >50años y hombres >70años, preferiblemente con la dieta, y 1.000mg/día de calcio en mujeres <50años y hombres entre 51 y 70años.
Algunos alimentos son ricos en calcio, como los lácteos (leche, queso, yogur), los pescados azules en conserva, las judías y las almendras. Un listado de alimentos y una calculadora en línea están disponibles en la página de la IOF64,65. Si se emplean suplementos, los expertos aconsejan tener en cuenta que la dosis óptima para la absorción del calcio se sitúa en 500mg de calcio, por lo que si se administran dosis mayores han de tomarse de manera fraccionada66.
En cuanto a los posibles efectos secundarios de los suplementos de calcio, destacan por su frecuencia el estreñimiento y las molestias dispépticas. Se ha señalado un aumento del riesgo de nefrolitiasis (RR1,17) en el estudio Women's Health Initiative67, achacado a la dieta rica en calcio de las mujeres estudiadas. Sin embargo, una revisión sistemática concluyó que los suplementos de calcio en el tratamiento de la OP, solos o en combinación con otro tipo de tratamiento, no aumentan de manera significativa el riesgo de nefrolitiasis o de cólico renal68. Existe controversia acerca del posible aumento del riesgo cardiovascular asociado a los suplementos de calcio, particularmente si se excede la dosis máxima recomendada. La evidencia disponible sugiere que una ingesta diaria total de calcio (obtenida sumando la ingesta dietética más los suplementos) inferior a 2.000mg no aumenta el riesgo cardiovascular69,70.
Respecto a la vitamina D, en pacientes con OP la conclusión de los expertos es la de mantener concentraciones séricas mínimas de 25-hidroxi-colecalciferol (calcidiol) de 30ng/ml. Por lo tanto, se recomienda medir los niveles de calcidiol en pacientes con riesgo de insuficiencia de vitaminaD y en pacientes con OP. Dado el papel fundamental de la luz solar como fuente de vitaminaD, se aconseja una exposición solar de 10 a 15min al día62,63. Cuando sea necesario, se aconsejan suplementos de vitaminaD con una dosis entre 800 y 2.000UI/día dependiendo de los niveles basales. En los pacientes con hepatopatías, síndromes de malabsorción, tratamiento con anticomiciales u otras situaciones en las que pueda verse comprometida la 25 hidroxilación de la vitaminaD, se recomienda la administración del metabolito calcidiol.
La evidencia científica actual permite afirmar que ni aumentar el calcio dietético ni tomar suplementos de calcio de forma aislada protege frente a la aparición de fracturas71,72. Tampoco la vitaminaD administrada en monoterapia es eficaz en la reducción de fracturas por fragilidad en personas ancianas no institucionalizadas72,73. Los suplementos de calcio y vitaminaD han mostrado eficacia en población >65años institucionalizada reduciendo el riesgo de fractura no vertebral y de forma más marginal de fractura de cadera72,74. Este efecto depende en gran parte de la dosis de vitaminaD (≥800UI diarias) y es más evidente a mayor edad y niveles más bajos de vitaminaD72. Los suplementos de calcio y vitaminaD no disminuyen el riesgo de fractura vertebral72.
La eficacia de los suplementos de calcio y vitaminaD en población >65años no institucionalizada (residentes en la comunidad) es cuestionable, como lo evidencian el elevado número necesario para tratar (NNT) para prevenir una fractura en esta población con bajo riesgo74 y los resultados de un metaanálisis reciente75.
Existen datos contradictorios sobre la eficacia de la vitaminaD en la prevención de caídas. Algunos resultados indican que los suplementos de vitaminaD, con y sin calcio, serían eficaces en la prevención de caídas76, especialmente en ancianos con déficit de vitaminaD77. Otros estudios no demuestran este efecto beneficioso de la vitaminaD78, e incluso la administración de dosis altas anuales podría aumentar el riesgo de caídas79.
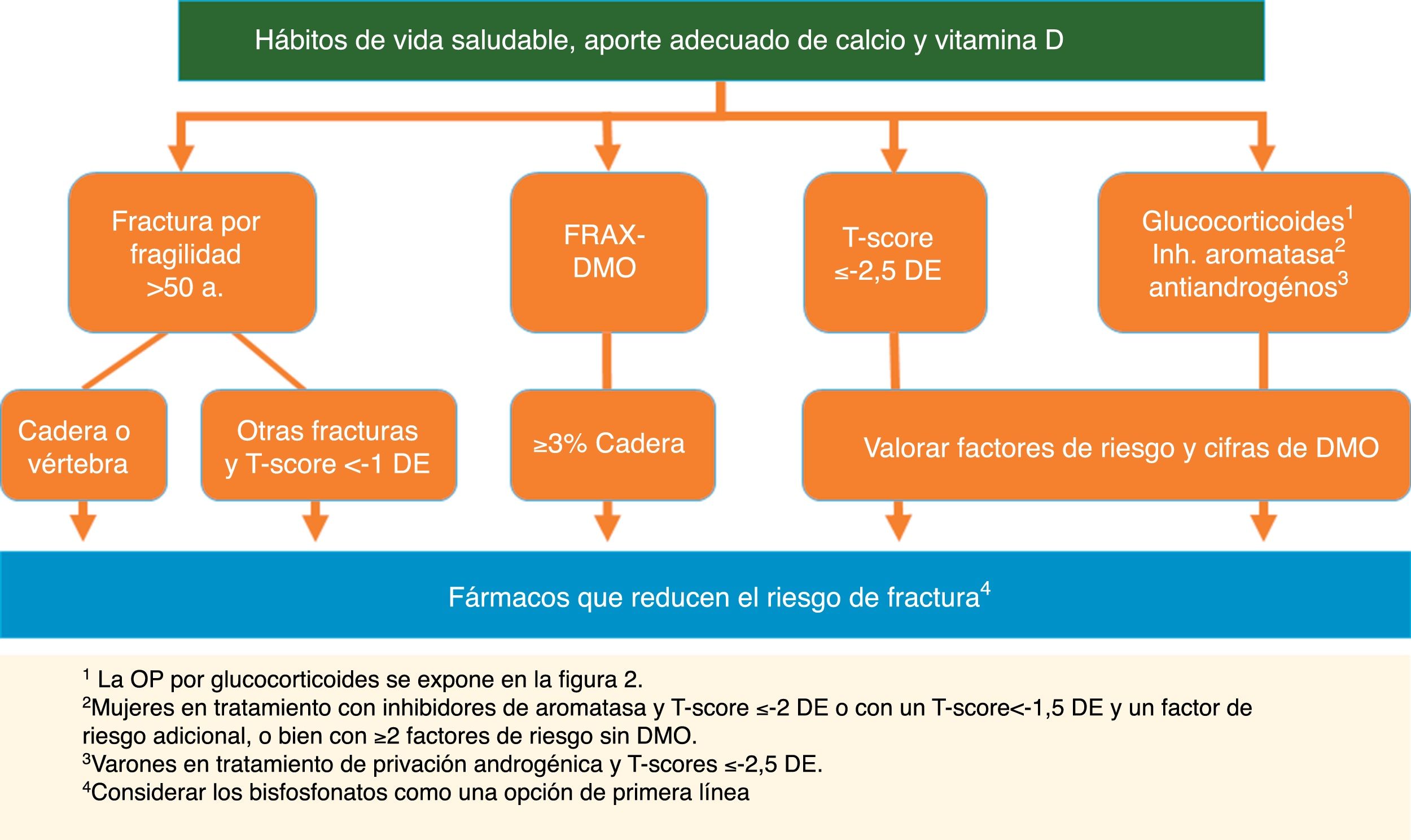
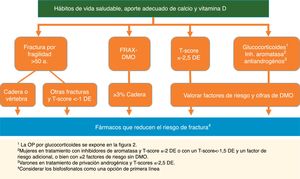
Tratamiento para prevenir fracturasRecomendación:Se recomienda iniciar tratamiento farmacológico para reducir el riesgo de fractura osteoporótica en las siguientes situaciones (GR: √):
- 1.
Fractura por fragilidad de vértebra o cadera en pacientes >50años (GA: 100%).
- 2.
Otras fracturas por fragilidad en pacientes >50años y baja masa ósea (T-score <−1DE) (GA: 89%).
- 3.
OP definida por T-score ≤−2,5 DE en columna, cuello de fémur o cadera total, valorando siempre la edad, las cifras de DMO y otros factores de riesgo (GA: 100%).
- 4.
Pacientes con riesgo elevado de fractura de cadera según FRAX®con DMO ≥3% (GA: 100%).
- 5.
Varones en tratamiento de privación androgénica y T-score≤−2,5DE (GA: 100%).
- 6.
Mujeres en tratamiento con inhibidores de aromatasa y T-score ≤−2 o con un T-score <−1,5DE y un factor de riesgo adicional, o bien con ≥2factores de riesgo sin DMO (GA: 100%).
- 7.
Pacientes en tratamiento con glucocorticoides y: a)dosis inicial ≥30mg/día de prednisona; b)mujeres posmenopáusicas y varones >50años con dosis ≥5mg/día y fractura previa por fragilidad o T-score ≤−1,5DE o riesgo elevado de fractura: FRAX®para cadera ≥3% o para fractura principal ≥10% sin DMO o ≥7,5% con DMO (GA: 78%).
Los fármacos utilizados para el tratamiento de la OP han mostrado ser más eficaces tanto en pacientes con alto riesgo de fractura como en aquellos con una fractura existente, o con un T-score ≤−2,5DE80.
Las recomendaciones de la NOF y otros grupos de expertos respaldan el uso de FRAX® para seleccionar candidatos para el tratamiento, incluyendo los casos sin OP mediante DXA30,80.
Así, el panel considera que está indicado el tratamiento en pacientes con fractura por fragilidad, OP por DXA T-score ≤−2,5DE, riesgo elevado de fractura (FRAX® para fractura de cadera con DMO ≥3%)23,34 y en subgrupos de pacientes que toman glucocorticoides, inhibidores de la aromatasa35 o antiandrógenos37. Las circunstancias específicas donde deberá valorarse el tratamiento antifractura osteoporótica se comentan en detalle en otros apartados.
En relación con los pacientes con fractura por fragilidad, la NOF recomienda tratar a todas las fracturas de cadera y vértebra, mientras que el resto de las fracturas se tratarían en función del resultado de DXA y del riesgo de nueva fractura calculado mediante el FRAX®30.
Respecto a la valoración de tratamiento en base al resultado de la DXA con un T-score ≤−2,5DE, el panel quiere resaltar que en estos casos deben también tenerse en cuenta los factores de riesgo clínicos y el FRAX® en la toma de decisiones.
La profilaxis y el tratamiento de la OP inducida por glucocorticoides se tratan en un capítulo aparte.
Varias guías internacionales, incluyendo las de oncología, aconsejan indicación de tratamiento para la OP en las mujeres que reciben inhibidores de aromatasa y un T-score menor o igual a −2DE o con un T-score <−1,5DE con un factor de riesgo adicional, o con ≥2factores de riesgo sin DMO35. Para los varones en terapia de privación androgénica, la IOF sitúa el umbral para tratar OP en un T-score de −2,5DE o un riesgo de fractura elevado por FRAX®37 (fig. 1).
Elección del tratamiento antifracturaRecomendación:A la hora de elegir el tratamiento, entre otros factores, se recomienda tener en consideración (GR: √; GA: 100%):
- 1.
La eficacia y seguridad de los fármacos.
- 2.
La relación coste/efectividad.
- 3.
El valor de la DMO.
- 4.
La presencia de fracturas, en particular vertebrales o fracturas múltiples por fragilidad.
- 5.
Los tratamientos previos y la adherencia a los mismos.
- 6.
La edad.
- 7.
Las comorbilidades y la polimedicación.
- 8.
Las limitaciones para la administración por vía oral.
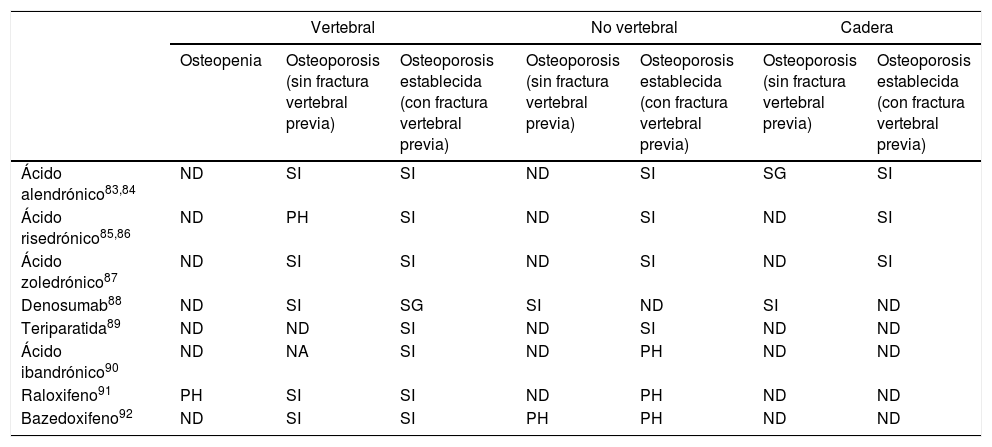
El objetivo final del tratamiento de la OP es la prevención de las fracturas. En la tabla 3 se expone la eficacia en prevención primaria y secundaria de fractura vertebral y no vertebral de los fármacos empleados en España81-94.
En los principales estudios realizados con fármacos en pacientes que tenían solo osteopenia sin fractura prevalente (prevención primaria) no se ha demostrado reducción de fracturas en el desenlace primario.
En prevención primaria de fractura en pacientes con OP, los fármacos que han demostrado reducción de fractura vertebral son: ácido alendrónico, ácido zoledrónico, raloxifeno, bazedoxifeno y denosumab, mientras que denosumab también reduce la fractura no vertebral y de cadera en este grupo.
En pacientes con OP y fractura vertebral, ácido alendrónico, ácido risedrónico y ácido zoledrónico reducen nuevas fracturas vertebrales, no vertebrales y de cadera, mientras que teriparatida reduce las fracturas vertebrales y no vertebrales y denosumab reduce las fracturas vertebrales. Por su parte, ácido ibandrónico, raloxifeno y bazedoxifeno reducen las fracturas vertebrales en pacientes con fractura previa81-94. Respecto a la fractura de antebrazo, el ácido alendrónico demostró en un metaanálisis reducción significativa de nuevas fracturas de muñeca en pacientes con fractura vertebral previa81.
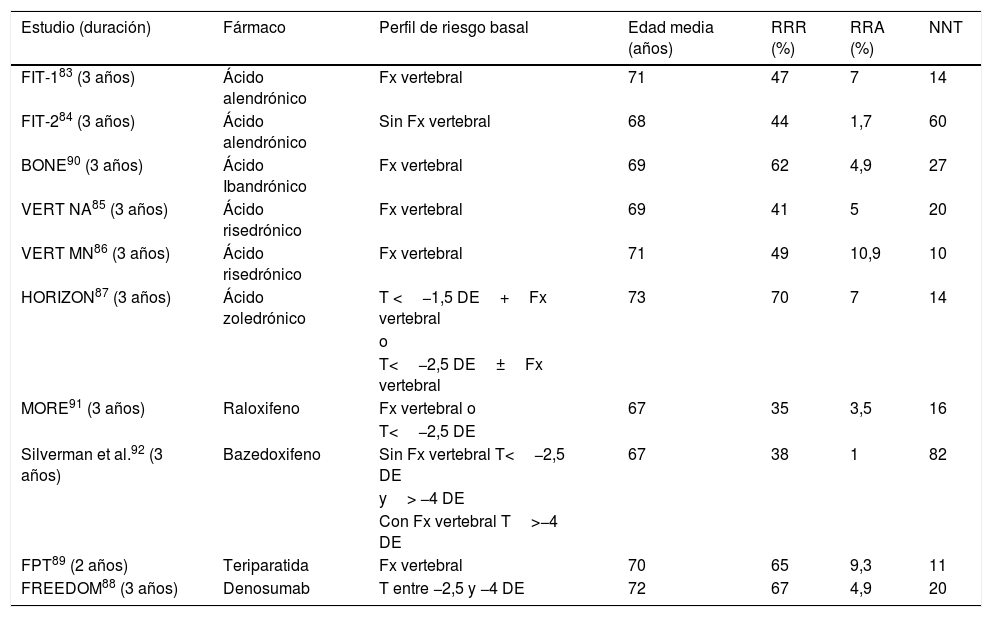
En las tablas 4-7 se expone en detalle la reducción de riesgo de distintas fracturas en los estudios publicados83-94.
Eficacia de los fármacos para reducir la fractura vertebral, no vertebral y de cadera
| Vertebral | No vertebral | Cadera | |||||
|---|---|---|---|---|---|---|---|
| Osteopenia | Osteoporosis (sin fractura vertebral previa) | Osteoporosis establecida (con fractura vertebral previa) | Osteoporosis (sin fractura vertebral previa) | Osteoporosis establecida (con fractura vertebral previa) | Osteoporosis (sin fractura vertebral previa) | Osteoporosis establecida (con fractura vertebral previa) | |
| Ácido alendrónico83,84 | ND | SI | SI | ND | SI | SG | SI |
| Ácido risedrónico85,86 | ND | PH | SI | ND | SI | ND | SI |
| Ácido zoledrónico87 | ND | SI | SI | ND | SI | ND | SI |
| Denosumab88 | ND | SI | SG | SI | ND | SI | ND |
| Teriparatida89 | ND | ND | SI | ND | SI | ND | ND |
| Ácido ibandrónico90 | ND | NA | SI | ND | PH | ND | ND |
| Raloxifeno91 | PH | SI | SI | ND | PH | ND | ND |
| Bazedoxifeno92 | ND | SI | SI | PH | PH | ND | ND |
ND: no demostrado; PH: análisis por subgrupos post hoc (diseñado después de conocer los resultados del ensayo); SG: análisis por subgrupos diseñado antes de conocer los resultados del ensayo; SI: análisis ITT (intención de tratar).
Eficacia de los tratamientos para reducir fractura vertebral. Estudios de referencia utilizados para la aprobación de cada fármaco
| Estudio (duración) | Fármaco | Perfil de riesgo basal | Edad media (años) | RRR (%) | RRA (%) | NNT |
|---|---|---|---|---|---|---|
| FIT-183 (3 años) | Ácido alendrónico | Fx vertebral | 71 | 47 | 7 | 14 |
| FIT-284 (3 años) | Ácido alendrónico | Sin Fx vertebral | 68 | 44 | 1,7 | 60 |
| BONE90 (3 años) | Ácido Ibandrónico | Fx vertebral | 69 | 62 | 4,9 | 27 |
| VERT NA85 (3 años) | Ácido risedrónico | Fx vertebral | 69 | 41 | 5 | 20 |
| VERT MN86 (3 años) | Ácido risedrónico | Fx vertebral | 71 | 49 | 10,9 | 10 |
| HORIZON87 (3 años) | Ácido zoledrónico | T <−1,5 DE+Fx vertebral | 73 | 70 | 7 | 14 |
| o | ||||||
| T<−2,5 DE±Fx vertebral | ||||||
| MORE91 (3 años) | Raloxifeno | Fx vertebral o | 67 | 35 | 3,5 | 16 |
| T<−2,5 DE | ||||||
| Silverman et al.92 (3 años) | Bazedoxifeno | Sin Fx vertebral T<−2,5 DE | 67 | 38 | 1 | 82 |
| y> −4 DE | ||||||
| Con Fx vertebral T>−4 DE | ||||||
| FPT89 (2 años) | Teriparatida | Fx vertebral | 70 | 65 | 9,3 | 11 |
| FREEDOM88 (3 años) | Denosumab | T entre −2,5 y −4 DE | 72 | 67 | 4,9 | 20 |
DE: desviación estándar; Fx: fractura; NNT: número necesario para tratar; RRA: reducción riesgo absoluto; RRR: reducción riesgo relativo; T: T-score.
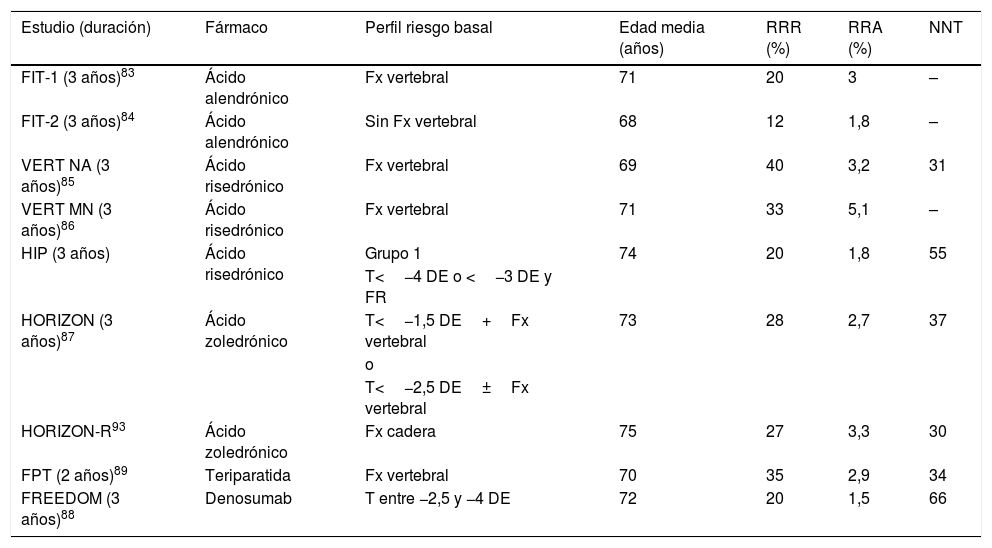
Eficacia de los tratamientos para reducir fractura no vertebral. Estudios de referencia utilizados para la aprobación de cada fármaco
| Estudio (duración) | Fármaco | Perfil riesgo basal | Edad media (años) | RRR (%) | RRA (%) | NNT |
|---|---|---|---|---|---|---|
| FIT-1 (3 años)83 | Ácido alendrónico | Fx vertebral | 71 | 20 | 3 | – |
| FIT-2 (3 años)84 | Ácido alendrónico | Sin Fx vertebral | 68 | 12 | 1,8 | – |
| VERT NA (3 años)85 | Ácido risedrónico | Fx vertebral | 69 | 40 | 3,2 | 31 |
| VERT MN (3 años)86 | Ácido risedrónico | Fx vertebral | 71 | 33 | 5,1 | – |
| HIP (3 años) | Ácido risedrónico | Grupo 1 | 74 | 20 | 1,8 | 55 |
| T<−4 DE o <−3 DE y FR | ||||||
| HORIZON (3 años)87 | Ácido zoledrónico | T<−1,5 DE+Fx vertebral | 73 | 28 | 2,7 | 37 |
| o | ||||||
| T<−2,5 DE±Fx vertebral | ||||||
| HORIZON-R93 | Ácido zoledrónico | Fx cadera | 75 | 27 | 3,3 | 30 |
| FPT (2 años)89 | Teriparatida | Fx vertebral | 70 | 35 | 2,9 | 34 |
| FREEDOM (3 años)88 | Denosumab | T entre −2,5 y −4 DE | 72 | 20 | 1,5 | 66 |
DE: desviación estándar; FR: factor de riesgo; Fx: fractura; NNT: número necesario para tratar; RRA: reducción riesgo absoluto; RRR: reducción riesgo relativo; T: T-score.
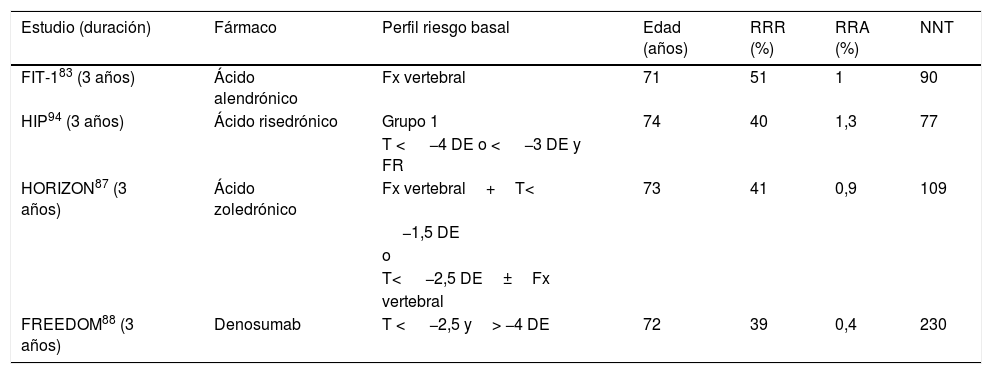
Eficacia de los tratamientos para reducir fractura de cadera. Estudios de referencia utilizados para la aprobación de cada fármaco
| Estudio (duración) | Fármaco | Perfil riesgo basal | Edad (años) | RRR (%) | RRA (%) | NNT |
|---|---|---|---|---|---|---|
| FIT-183 (3 años) | Ácido alendrónico | Fx vertebral | 71 | 51 | 1 | 90 |
| HIP94 (3 años) | Ácido risedrónico | Grupo 1 | 74 | 40 | 1,3 | 77 |
| T < −4 DE o < −3 DE y FR | ||||||
| HORIZON87 (3 años) | Ácido zoledrónico | Fx vertebral+T< | 73 | 41 | 0,9 | 109 |
| −1,5 DE | ||||||
| o | ||||||
| T< −2,5 DE±Fx | ||||||
| vertebral | ||||||
| FREEDOM88 (3 años) | Denosumab | T < −2,5 y> −4 DE | 72 | 39 | 0,4 | 230 |
DE: desviación estándar; FR: factor de riesgo; Fx: fractura; NNT: número necesario para tratar; RRA: reducción riesgo absoluto; RRR: reducción riesgo relativo; T: T-score.
En pacientes con al menos dos fracturas vertebrales moderadas o al menos una severa, teriparatida fue significativamente más eficaz que ácido risedrónico a la hora de reducir nuevas fracturas vertebrales morfométricas y clínicas tras 24meses de tratamiento. No se observaron diferencias significativas en la incidencia de nuevas fracturas no vertebrales95.
En estas recomendaciones no se ha incluido el ranelato de estroncio, por haberse suspendido su comercialización, ni la calcitonina, por tener limitación en ficha técnica en la indicación y duración del tratamiento. Por otra parte, la terapia con estrógenos reduce las fracturas vertebrales y de cadera, pero actualmente no se emplea por su perfil riesgo/beneficio desfavorable y existir tratamientos más seguros.
Se han de tener en cuenta los siguientes aspectos a la hora de integrar en la práctica clínica los resultados de los ensayos: 1)el perfil de paciente incluido es de mujer posmenopáusica con un nivel de riesgo basal alto por edad y presencia de fracturas previas; 2)las poblaciones de los ensayos son diferentes entre sí, por lo cual no se pueden comparar entre ellas de manera directa; 3)los estudios se han llevado a cabo con suplementos de calcio y/o vitaminaD, y 4)la adherencia real al tratamiento es más baja que la reportada en los ensayos. En cualquier caso, el tratamiento debe ser individualizado teniendo en cuenta las circunstancias de cada paciente.
Otro aspecto a tener en cuenta es la relación coste/efectividad del tratamiento. Los estudios llevados a cabo en otros países fijan el umbral de FRAX® para fractura principal, para que el tratamiento resulte coste-efectivo, en el 8,8% (Portugal)96, el 13,8% (Suiza)97 y el 10-15% (Grecia)98. Para el cálculo se tuvo en cuenta el coste del ácido alendrónico (Portugal y Suiza) y el coste promedio del tratamiento para OP (Grecia). Cuando se eligieron otros fármacos distintos del ácido alendrónico, el umbral de FRAX® para resultar coste efectivo fue más elevado96-98. A pesar de que no existen estudios de coste-efectividad para España basados en el riesgo de fractura, el panel de expertos aconseja tener en cuenta los BF como una opción de primera línea en el tratamiento de la OP.
El panel de expertos considera, por tanto, que en la elección del tratamiento para prevenir fracturas debe tenerse en cuenta la eficacia y la seguridad de los fármacos, la relación coste/efectividad, las cifras de DMO, la presencia de fractura previa (localización, número y antigüedad) y las limitaciones para la administración por vía oral. Otros factores que también deben tenerse en cuenta en la decisión son los tratamientos previos y la adherencia a los mismos, las comorbilidades y las preferencias del paciente. Así, en los pacientes con varias fracturas, intolerancia oral, demencia, malabsorción y mala adherencia se puede contemplar el uso de la terapia parenteral.
Terapia secuencial y combinadaEl riesgo de complicaciones a largo plazo de los tratamientos para la OP99-101 y el aumento del riesgo de fractura tras la suspensión de los mismos102,103 obliga en muchas ocasiones a plantear una estrategia secuencial de tratamiento.
Aunque actualmente no se dispone de resultados sobre reducción de fracturas con el tratamiento secuencial104,105, la secuencia osteoformador (teriparatida) seguida de antirresortivo (denosumab o BF)104-106 es la más eficaz en términos de ganancia de DMO. Teriparatida seguida de denosumab parece más eficaz que teriparatida seguida de BF107.
La administración de teriparatida después de antirresortivo también es eficaz, aunque su efecto anabólico puede verse ralentizado (menor cambio en los marcadores óseos y menor aumento de la DMO)108, y en el caso de administrarse después de denosumab se ha descrito una pérdida de DMO inicial en cadera106. El tratamiento secuencial con romosozumab seguido de antirresortivo se comenta en el apartado de nuevos tratamientos.
Sobre el empleo de un antirresortivo después de otro antirresortivo existe poca información, especialmente si el primero se ha administrado durante años. Una revisión de 11 estudios prospectivos de pacientes tratados previamente con ácido alendrónico o risedrónico mostró que el cambio a ranelato de estroncio o denosumab consiguió un incremento adicional de la DMO109. Sin embargo, tampoco se dispone de datos en reducción de fracturas109. En uno de los trabajos, denosumab demostró incrementos de DMO en pacientes que habían sido tratados con ácido zoledrónico110.
Hay estudios que muestran mayor eficacia de la terapia combinada (osteoformador y antirresortivo) frente a la monoterapia. La combinación de ácido zoledrónico y teriparatida se ha asociado con un mayor incremento de la DMO femoral al año de tratamiento comparado con teriparatida en monoterapia104,111. La asociación de denosumab y teriparatida se ha asociado con mayor incremento de DMO en columna lumbar y fémur proximal, comparado con ambos fármacos en monoterapia112; sin embargo, no hay evidencia en reducción de fracturas con dichas combinaciones. Tras la revisión de la literatura, el panel concluye que el tratamiento combinado (osteoformador más antirresortivo) no parece ser una opción a recomendar de forma generalizada, aunque su uso podría estar justificado en casos muy seleccionados de OP grave.
Duración del tratamientoLa OP es una enfermedad crónica, con lo que el tratamiento deberá mantenerse de forma indefinida o al menos durante varios años. Sin embargo, no existe una duración máxima recomendada para cada uno de los fármacos que se utilicen42,100.
Los fármacos antirresortivos (moduladores selectivos del receptor estrogénico SERM, BF y denosumab) por lo general reducen el riesgo de fractura a partir de los 12-18meses88,91,113 y no tienen una duración máxima aprobada.
En el caso de los BF, su eficacia, en términos de DMO y reducción del riesgo de fractura, se mantiene como mínimo hasta los 3años de tratamiento114,115. Algunos estudios muestran que a partir del 4.° o 5.° año la DMO aumenta discretamente o se mantiene estable, y aumenta el riesgo de algunas complicaciones, por lo que tras 5años de tratamiento con BF orales o 3años con ácido zoledrónico es recomendable valorar el riesgo/beneficio de continuar el tratamiento116. Los grupos de expertos coinciden en recomendar mantener el tratamiento (hasta 10años los BF orales o hasta 6años ácido zoledrónico) en pacientes con alto riesgo de fractura (fracturas previas o durante el tratamiento, edad >75años o T-score ≤−2,5DE en cuello de fémur o cadera total)42,100,117,118.
Denosumab produce un aumento progresivo de la DMO durante al menos 10años de tratamiento, manteniendo su eficacia antifractura a lo largo del tiempo119. Aunque no hay consenso sobre la duración de dicho tratamiento, algunos autores indican que podría establecerse según un objetivo predefinido (estrategia treat-to-target), es decir, tras alcanzar un determinado valor de DMO120. Sin embargo, no debería suspenderse el tratamiento con denosumab sin instaurar otro tratamiento para la OP (ver el apartado «Suspensión o interrupción del tratamiento»).
Aunque hay datos de eficacia y seguridad de los SERM (raloxifeno y bazedoxifeno) hasta 8años, la duración máxima del tratamiento está condicionada por el riesgo de complicaciones como tromboembolismo, más frecuentes en pacientes mayores de 70años121.
En cuanto a los pacientes que reciben glucocorticoides, inhibidores de aromatasa o terapia de privación androgénica, el panel de expertos considera que el tratamiento antirresortivo debería mantenerse al menos mientras el paciente reciba el fármaco inductor de OP (ver «Osteoporosis por glucocorticoides»).
Teriparatida ha demostrado reducir el riesgo de fractura tras 6-12meses de iniciado el tratamiento. No obstante, para conseguir una máxima eficacia del mismo, tanto en hueso trabecular como cortical, diversos grupos de expertos coinciden en que es recomendable mantenerlo durante 2años, que es el período máximo aprobado42,100,108.
Suspensión o interrupción del tratamientoRecomendación:Se recomienda reevaluar el riesgo de fractura tras 5años de tratamiento con bisfosfonatos orales o tras 3años de tratamiento con ácido zoledrónico (GR: D; GA: 100%).
Recomendación:Cuando se suspenda el tratamiento con denosumab debería contemplarse un tratamiento alternativo para la osteoporosis (GR: D; GA: 100%).
Recomendación:En pacientes con alto riesgo de fractura como aquellos con fractura previa por fragilidad, o con T-score de fémur proximal <−2,5DE, no se recomienda discontinuar el tratamiento de la osteoporosis (GR: D; GA: 89%).
El tratamiento de la OP implica que el paciente va a recibir medicación durante años, si bien en algunos casos es posible realizar interrupciones. Las llamadas «vacaciones terapéuticas» son una estrategia de interrupción temporal del tratamiento con BF para reducir la aparición de efectos adversos, debido a que estos se acumulan en el tejido óseo y mantienen su efecto incluso años después de ser suspendidos115,122-124. Este efecto residual no se observa con otros fármacos como SERM, denosumab o teriparatida.
Aunque la decisión de interrumpir el tratamiento con BF debe ser individualizada, los consensos de expertos aconsejan reevaluar el tratamiento en pacientes con bajo riesgo de fractura y que no han presentado fracturas incidentes tras 5años de tratamiento con BF orales o 3años con ácido zoledrónico100. La duración de esta interrupción es desconocida y ha llegado a estimarse entre 2-3años, dependiendo del BF utilizado100,125. Aunque la evidencia es escasa, los cambios en la DMO y en los marcadores de recambio óseo podrían ayudar en la toma de decisiones100.
La mayoría de las guías internacionales aconsejan no suspender el tratamiento con BF en pacientes con alto riesgo de fractura, como serían aquellos con fractura previa por fragilidad, un bajo T-score en cadera o en los que presentan alguna fractura por fragilidad a lo largo del tratamiento100,126,127. Respecto al valor de la DMO capaz de predecir un riesgo alto de fractura al suspender el tratamiento, el análisis post hoc de los estudios FLEX y HORIZON lo sitúan en un T-score femoral <−2,5DE122,124. En caso de prolongar el tratamiento con BF, parece razonable reevaluar tras otros 5años de tratamiento con BF orales o 3años con ácido zoledrónico100,126.
Según diferentes sociedades científicas y grupos de expertos, el concepto de suspensión del tratamiento no debe aplicarse a otros fármacos como denosumab, ya que su retirada puede conllevar un aumento de remodelado óseo, con descenso de la DMO y un incremento del riesgo de fractura, incluyendo fracturas múltiples tras su suspensión127-130. Por este motivo, concluyen que si se decide suspender por algún motivo el tratamiento con denosumab, se debe contemplar siempre un tratamiento alternativo128. El panel de expertos, a pesar de las escasas evidencias sobre las consecuencias de la suspensión de denosumab y de la eficacia del tratamiento alternativo, recomienda que cuando se suspenda el tratamiento con denosumab debe contemplarse un tratamiento alternativo para la OP.
Seguimiento, monitorización y adherenciaRecomendación:Se recomienda una valoración clínica periódica para comprobar el cumplimiento y la eficacia del tratamiento, la incidencia de fracturas y la posible aparición de efectos adversos (GR: √; GA: 100%).
AdherenciaLa baja adherencia al tratamiento de la OP es un problema frecuente, de manera que tras 12meses de tratamiento menos de la mitad de los pacientes mantienen la terapia indicada131. Además, la baja adherencia se asocia a un incremento del riesgo de fractura132.
Se ha estudiado la eficacia de diferentes medidas para mejorar la adherencia, como llamadas de teléfono o reuniones con pacientes, pero ninguna de ellas parece ser realmente efectiva133. En una revisión sistemática de 20 estudios se observó que la simplificación de la posología, la prescripción electrónica y la intervención del farmacéutico mejoraron la adherencia o la persistencia al tratamiento de la OP. La educación del paciente ha demostrado su efectividad en varios estudios, pero no en todos, mientras que la monitorización y la supervisión no tuvieron impacto significativo en la adherencia134. Por otra parte, las unidades Fracture Liaison Service (FLS) de prevención secundaria de fractura han comunicado una adherencia >70% a 1-2años, lo cual se relaciona en parte con la labor educativa realizada por la enfermera135,136.
Los MRO podrían ayudar al seguimiento y a la adherencia. La IOF y la European Calcified Tissue Society (ECTS), en un grupo de trabajo constituido para analizar la utilidad de los MRO en la adherencia a BF orales, recomendó medir PINP y CTX al inicio del tratamiento y a los 3meses, para verificar una disminución superior al cambio mínimo significativo del MRO137. El mismo grupo de trabajo considera un cambio significativo una disminución mayor del 38% para PINP y mayor del 56% para CTX, mientras que la ausencia de cambio sugiere la conveniencia de una reevaluación para identificar problemas con el tratamiento, principalmente baja adherencia137. En un metaanálisis de 6estudios que evaluó la eficacia de los MRO para mejorar la adherencia al tratamiento, el cumplimiento fue en promedio elevado, por lo que resultó difícil valorar la repercusión del acto de informar de los resultados de los MRO46. En el metaanálisis se destacaba un estudio que observó una mejor persistencia si se informaba al paciente de su respuesta al tratamiento (HR para discontinuación 0,71; IC95%: 0,53-0,95), mientras que informar de mala respuesta al fármaco la disminuyó (HR para discontinuación 2,22; IC95%: 1,27-3,89)138. Así, el refuerzo usando los resultados de los MRO influye en la persistencia, dependiendo de la respuesta del MRO.
MonitorizaciónLa monitorización del tratamiento de la OP incluye las determinaciones analíticas y la DXA, además de preguntar al paciente por la aparición de nuevas fracturas. Algunos estudios concluyen que los marcadores de remodelado óseo pueden ser útiles para monitorizar de forma precoz el cumplimiento y la respuesta al tratamiento139, pero el panel de expertos considera que no puede recomendarse su determinación sistemática en el seguimiento de los pacientes. El panel recomienda monitorizar la respuesta al tratamiento mediante DXA central, teniendo en cuenta las características del paciente.
No hay estudios controlados y de calidad sobre la frecuencia con que se debe repetir la medición de la DMO durante el tratamiento140. La posible variación en la DMO con los tratamientos actuales se produce lentamente y suele ser de pequeña magnitud. Dado el riesgo de error de medición de la DXA, los expertos internacionales concluyen que la medición debería realizarse cuando el cambio esperado sea igual o superior a la diferencia mínima significativa32. Por este motivo, en general, no se aconseja repetir la medición de la DMO antes de 2-3años5,141. Otras guías aconsejan alargar este plazo a 3años para ácido zoledrónico y hasta 5años para los BF orales126,142,143. En situaciones de muy alto riesgo de fractura5, en tratamiento con dosis altas de glucocorticoides o si se sospecha fracaso terapéutico, como ante una nueva fractura, el plazo para repetir la DXA podría acortarse144. El objetivo es detectar a los pacientes que, a pesar del tratamiento, sufren un descenso significativo de la DMO. También se aconseja realizar una DXA al planear la suspensión temporal de un fármaco por «vacaciones terapéuticas»124. Aunque los mayores cambios en la DMO se detectan en la columna lumbar, es útil monitorizar también la cadera, pues es menos dependiente de artefactos provocados por cambios degenerativos.
Algunos autores proponen utilizar en la OP una estrategia treat-to-target en la que el objetivo sea alcanzar un determinado valor del T-score (por ejemplo, T-score: −2,5DE) o de DMO. En este supuesto, la monitorización de la DMO permitiría conocer si se ha alcanzado el objetivo terapéutico. Sin embargo, no todos los fármacos conducen a una mejora de la DMO proporcional a la reducción del riesgo de fractura, por lo que está por definir el valor real de esta estrategia en la práctica clínica117.
La determinación del TBS proporciona información sobre los cambios que el tratamiento produce sobre la microarquitectura ósea145, pero no hay datos suficientes para recomendar su utilización en el seguimiento clínico.
Fracaso terapéuticoLa definición de fracaso terapéutico en el tratamiento de la OP es un tema complejo, y no existen criterios establecidos. Los consensos de expertos aconsejan sobre la conveniencia de asegurar que la adherencia al tratamiento sea correcta, confirmar un aporte adecuado de calcio y vitaminaD y excluir causas de OP secundaria. Por lo que respecta a fallo al tratamiento, después de un año de tratamiento con algún fármaco antiosteoporótico, un grupo de expertos internacionales propone los siguientes criterios de valoración de cambio de tratamiento144:
- 1.
Incidencia de dos o más fracturas por fragilidad durante el tratamiento.
- 2.
Incidencia de una fractura por fragilidad junto con uno de los siguientes factores:
- -
Pérdida significativa de DMO (>5% en columna lumbar o >4% en fémur proximal).
- -
Ausencia de cambios significativos en los MRO (disminución de PINP o CTX >25% con el tratamiento antirresortivo, o incremento >25% con el tratamiento osteoformador, a los 6 meses).
- 3.
Ausencia de cambios significativos en los MRO junto con una pérdida significativa de DMO.
En general, los fármacos aprobados para el tratamiento de la OP son seguros y presentan una buena tolerabilidad146. Los BF orales pueden ocasionar una serie de efectos adversos digestivos (pirosis, dispepsia, esofagitis, disfagia o dolor abdominal) y oculares (conjuntivitis, uveítis anterior), de intensidad leve en la mayoría de los casos, que desaparecen al retirar el fármaco. Tras la primera infusión de ácido zoledrónico se ha descrito un cuadro de origen no aclarado que se caracteriza por fiebre, mialgias y dolores óseos y se produce en el 20 y el 30% de los pacientes. En las infusiones siguientes el cuadro tiende a desaparecer. Este efecto puede también ocurrir, aunque rara vez, con los BF orales.
El tratamiento con BF no aumenta el riesgo cardiovascular. Por otra parte, no se ha demostrado una asociación entre el desarrollo de fibrilación auricular y el tratamiento con BF orales. En un estudio se observó un aumento del riesgo de fibrilación auricular con el uso de ácido zoledrónico por vía intravenosa147. Se han publicado casos aislados de cáncer de esófago en pacientes con BF orales, aunque los estudios más recientes no han confirmado esta relación148. El dolor osteomuscular, el daño renal y la hepatotoxicidad por BF son excepcionales y rara vez ocasionarán la retirada del fármaco149. No se aconseja la utilización de BF en pacientes con filtrado glomerular <30ml/min, dado que no se dispone de estudios que hayan demostrado reducción de fracturas en estos pacientes y, por el contrario, incrementan el riesgo de deterioro de una osteodistrofia de bajo remodelado.
El denosumab, en la pauta aprobada para el tratamiento de la OP, es un fármaco en general bien tolerado. Se ha observado una mayor incidencia de infecciones, sobre todo cutáneas88 y urinarias150, aunque su incidencia global es muy baja151. Por otro lado, dada su estructura, no se elimina por el riñón, lo que constituye una ventaja en pacientes con enfermedad renal, en los que se debe vigilar un mayor riesgo de hipocalcemia. Al igual que con los BF, no se debe utilizar denosumab si existe sospecha clínica o evidencia histomorfométrica de osteodistrofia de bajo remodelado.
Las reacciones adversas a teriparatida en general no son graves. Son frecuentes los dolores musculares, los calambres y los mareos. El tratamiento con teriparatida puede elevar la calcemia y la calciuria, por lo que se aconseja determinar los niveles de calcio en sangre y orina antes de iniciar el tratamiento.
En los últimos años han aparecido complicaciones que se han asociado al tratamiento prolongado con antirresortivos (BF y denosumab) y que han generado incertidumbre acerca de su seguridad. La importancia relativa de estos raros efectos adversos (osteonecrosis de los maxilares y fractura atípica de fémur) en el tratamiento de la OP es un tema de gran controversia.
El temor de los pacientes a sufrir estas complicaciones puede ser un impedimento para la adherencia y el cumplimiento terapéutico, aunque el balance beneficio-riesgo de mantener el tratamiento es muy favorable para los pacientes con riesgo alto de fractura. A continuación se realiza un breve análisis de ambas complicaciones basadas en las revisiones sistemáticas realizadas como parte de la elaboración de este documento.
Osteonecrosis de los maxilaresRecomendación:Si al paciente con OP se le indica algún procedimiento odontológico invasivo (exodoncia o implante) se aconseja posponer el inicio del tratamiento antirresortivo hasta la cicatrización completa de la herida quirúrgica (GR: D; GA: 100%).
Recomendación:En pacientes tratados con antirresortivos a los que se vaya a realizar un procedimiento dental no se recomienda interrumpir el tratamiento con BF ni con denosumab. Si existen otros factores adicionales de riesgo de osteonecrosis de los maxilares o el procedimiento quirúrgico va a ser extenso, se puede considerar una suspensión temporal del tratamiento con BF (GR: D; GA: 78%).
La osteonecrosis de los maxilares se ha asociado al uso prolongado de BF o denosumab, aunque su incidencia en pacientes con OP es muy baja (entre 1/10.000 y 1/100.000)152-154.
Según los resultados de una revisión previa, publicada en 2013, sobre los BF la evidencia disponible es escasa y de baja calidad154. No hay datos suficientes para afirmar que los BF por vía oral o intravenosa utilizados para el tratamiento de la OP confieran un riesgo significativo de osteonecrosis de los maxilares. No hay suficientes estudios que hayan evaluado el papel del denosumab en el desarrollo de osteonecrosis de los maxilares (nivel de evidencia3)152,153. Algunos factores sistémicos, como el tratamiento previo con BF o las extracciones dentales, se asocian con el desarrollo de osteonecrosis de los maxilares en pacientes tratados con denosumab (nivel de evidencia3)153.
Varias asociaciones médicas han publicado recomendaciones para reducir el riesgo de esta complicación. En general las guías incluyen en sus propuestas una correcta higiene dental y revisión por un odontólogo si se objetiva una mala salud dental. Si se prevé realizar algún procedimiento odontológico invasivo (exodoncia o implante) se aconseja posponer el inicio del tratamiento hasta la cicatrización completa de la herida quirúrgica155. Se ha sugerido el uso de umbrales del marcador CTX para evaluar el riesgo basal de osteonecrosis de los maxilares. Sin embargo, las evidencias disponibles no avalan su utilización156.
Existe cierta controversia sobre la actitud a seguir en los pacientes que ya están tomando BF o denosumab. La mayoría de las guías aconsejan en pacientes no oncológicos no suspender el tratamiento antirresortivo. En 2011, la Guía de la American Dental Association reconocía que el riesgo de osteonecrosis de los maxilares es muy bajo en pacientes con OP, por lo que no era necesario suspender un BF oral antes de un procedimiento dental157. No obstante, y según las recomendaciones elaboradas por un panel internacional de expertos, en los pacientes que van a ser sometidos a una cirugía oral extensa y con factores de riesgo asociados (diabetes, enfermedad periodontal, inmunodeficiencias, tabaquismo), el juicio clínico puede aconsejar suspender temporalmente el tratamiento155. En esta situación, y dado que al retirar denosumab se produce un aumento de remodelado óseo y del riesgo de aparición de fracturas vertebrales múltiples, el panel considera que no se debe interrumpir el tratamiento con denosumab.
Durante el tratamiento de la OP, los procedimientos dentales invasivos deben realizarse después de considerar en detalle su necesidad. En el caso de denosumab, y si es posible, se debe evitar la cirugía en periodos cercanos a la administración del fármaco158. En esta situación debe evitarse una prolongación innecesaria de la suspensión, sobre todo en pacientes tratados con denosumab. En caso de un evento adverso relevante como la osteonecrosis de los maxilares, y aunque no hay evidencia científica que demuestre que la retirada del fármaco vaya a mejorar la evolución del proceso, el mismo documento considera que parece prudente suspenderlo y valorar la indicación de fármacos con diferente mecanismo de acción155.
Fractura atípica de fémurRecomendación:En pacientes con alto riesgo de fractura y tratamiento prolongado con bisfosfonatos (>5años para los orales o >3años para los intravenosos) se recomienda no suspender el tratamiento, ya que el riesgo de fractura atípica de fémur es muy bajo y los beneficios en reducción de fracturas superan en gran manera el riesgo de fractura atípica (GR: D; GA: 100%).
La fractura atípica de fémur es una complicación potencial del tratamiento prolongado con BF o denosumab, aunque su incidencia real es muy baja.
Según la definición propuesta por la American Society for Bone and Mineral Research (ASBMR)159, la fractura atípica de fémur se localiza entre el trocánter menor y la cresta supracondílea, debiendo presentar al menos 4 de los siguientes 5 criterios mayores: 1)traumatismo mínimo o ausente; 2)origen de la fractura en la cortical externa y orientada en sentido transversal u oblicuo; 3)sin conminución o, si existe, debe ser mínima; 4)engrosamiento perióstico o endóstico de la cortical externa, localizado, y 5)afectación de la cortical del lado externo (fractura incompleta) o de ambas corticales (fractura completa). Los criterios menores no son imprescindibles para el diagnóstico, pero lo refuerzan: a)grosor cortical aumentado de forma difusa en diáfisis femorales; b)dolor en muslos o regiones inguinales, previo a la fractura; c)fractura bilateral de características similares, y d)retraso en la consolidación.
Además del tratamiento prolongado con antirresortivos, la fractura atípica de fémur también se ha asociado con algunas comorbilidades o con la toma de medicamentos como inhibidores de la bomba de protones o glucocorticoides.
Según los resultados de una revisión previa de 2011, la incidencia de fractura atípica de fémur era muy baja y no se pudo constatar un aumento significativo del riesgo de fractura atípica de fémur en pacientes con OP tratados con BF. Desde entonces se han publicado varios estudios de poca calidad que muestran una incidencia de fractura atípica de fémur muy baja. En 2 de los 3 metaanálisis publicados160,161, basados en ensayos clínicos aleatorizados (ECA), estudios de cohortes y de casos y controles, con un elevado grado de solapamiento, se demostró un aumento significativo del riesgo de fractura subtrocantérea o diafisaria con el uso de BF que oscila entre 1,70 y 1,99, aunque con un alto nivel de heterogeneidad. En un tercer metaanálisis que únicamente exploraba ácido alendrónico162, el riesgo relativo de fractura atípica de fémur con este fármaco fue de 3,23 (IC95%: 0,88-11,84), aunque las diferencias no fueron significativas. Cuando se realizó un análisis estratificado con los estudios que evalúan el efecto del ácido alendrónico durante 5años, la heterogeneidad no era significativa. Utilizando un modelo de efectos fijos, el riesgo relativo fue 2,55 (IC95%: 2,26-2,88), concluyéndose que el ácido alendrónico no incrementa el riesgo de fractura atípica de fémur a corto plazo, pero sí a largo plazo (>5años)162.
Una reciente revisión sistemática162 concluye que la incidencia de fractura atípica de fémur asociada a BF es muy baja, pero que el riesgo relativo (RR) aumenta con el uso prolongado (sobre todo si es superior a 3años). Según los autores, los beneficios de los BF en la reducción de fracturas OP superan en gran manera el riesgo de fractura atípica de fémur. Como limitaciones, se destaca que casi todos los estudios eran retrospectivos y con una duración variable (4-9años), limitando la interpretación de la exposición a largo plazo.
En cuanto a los ECA163,164, se han comunicado casos aislados de fractura atípica de fémur, pero estos estudios presentan limitaciones relevantes, como la corta duración de los mismos, la no inclusión de este desenlace como variable principal o las pérdidas en el seguimiento, que impiden obtener resultados fiables. Si analizamos estudios observacionales165,166, la incidencia y el riesgo absoluto de fractura atípica de fémur en los pacientes tratados con BF se mueven en tasas muy bajas (entre 10,8 y 19,1 por 100.000 pacientes-año).
La incidencia de fractura atípica de fémur llega a representar el 0,3% sobre el total de fracturas de fémur o el 5% sobre el total de fracturas subtrocantéreas/diafisarias. Las mujeres representan el 80% de todas las fracturas diafisarias y el 95% de las fracturas atípicas de fémur, con un riesgo relativo superior a los hombres. Los resultados de recientes trabajos de revisión y metaanálisis sugieren una relación beneficio/riesgo favorable a mantener el tratamiento hasta 10años con antirresortivos.
En lo que concierne al denosumab, los resultados de la revisión sistemática sobre el riesgo de fractura atípica de fémur vienen muy limitados por la escasez de estudios de alta calidad. Los estudios incluidos fueron un ECA147, dos estudios de seguimiento167,168 y un estudio de cohortes169.
Según los estudios observacionales, el tratamiento con denosumab a largo plazo (entre 7 y 10años) se asocia con una nula168 o muy baja incidencia de fractura atípica de fémur (0,8 por 10.000 pacientes-año)167. En un ensayo clínico de mujeres posmenopáusicas con OP que cambiaron de BF a denosumab no se pudo demostrar que los raros casos de fractura atípica de fémur que aparecieron de forma temprana puedan ser atribuibles al uso del denosumab, sino que parecen derivarse del uso previo de BF160.
Aunque se han descrito casos de fractura atípica de fémur en pacientes tratados con denosumab, el panel de expertos ha decidido no hacer una recomendación específica sobre el riesgo de fractura atípica de fémur con denosumab dada la escasa evidencia, necesitándose estudios con mayor número de casos y a más largo plazo.
Para reducir el impacto clínico de la fractura atípica de fémur, en los pacientes que siguen un tratamiento prolongado con BF o denosumab se debe prestar atención a la aparición de dolor en los muslos. En estos casos se recomienda realizar radiografías para detectar fractura de estrés o engrosamiento cortical e identificar precozmente la fractura atípica de fémur. Puede ser útil la realización de una resonancia magnética o una gammagrafía ósea para confirmar el diagnóstico.
El tratamiento de una fractura atípica de fémur es quirúrgico. Ante esta complicación, los estudios concluyen en retirar el tratamiento antirresortivo, tratar el dolor, asegurar un aporte adecuado de calcio y vitaminaD y valorar la indicación de un fármaco con un mecanismo de acción diferente170. No hay estudios controlados sobre la eficacia de teriparatida en pacientes que han sufrido una fractura atípica de fémur. En una serie corta de casos, el tratamiento con teriparatida aumentó la masa ósea y los marcadores del remodelado óseo, aunque sin efecto consistente en la consolidación de la fractura170.
Situaciones especialesFractura por fragilidadRecomendación:Se recomienda que todos los pacientes ≥50años con fractura reciente por fragilidad sean evaluados de forma sistemática para prevenir nuevas fracturas (GR: D; GA: 100%).
Los pacientes con fractura por fragilidad tienen un aumento significativo del riesgo de nuevas fracturas. Sin embargo, es habitual que menos del 25% inicie tratamiento para OP después de la fractura4. Recientemente se ha introducido el término «riesgo inminente de fractura» para referirse a pacientes con fractura reciente, ancianos frágiles con frecuentes caídas y pacientes que inician glucocorticoides a dosis elevadas12.
De acuerdo con las recomendaciones EULAR171, el panel de expertos sugiere que todos los pacientes con fractura osteoporótica reciente de edad ≥50años deben ser evaluados de forma sistemática para prevenir nuevas fracturas.
El modelo FLS, o Unidad de Fractura, parece ser el más efectivo172 en términos de evaluación e inicio de tratamiento, además de ser coste-efectivo173 y de existir experiencias positivas en nuestro país136. El elemento central de una Unidad de Fractura es el coordinador (en España, habitualmente, un médico experto en metabolismo óseo), que cuenta con la colaboración estrecha de una enfermera especializada. Las claves del éxito de la Unidad de Fractura son: a)la identificación de todos los casos, habitualmente a partir del listado de urgencias y de los pacientes ingresados; b)el estudio de los pacientes, incluyendo identificación de factores de riesgo, DXA y analítica; c)los consejos de la enfermera sobre medidas no farmacológicas y adherencia a la medicación; d)el inicio precoz de un tratamiento antifractura, y e)la realización de un informe con indicaciones precisas para el médico de atención primaria.
En pacientes con fractura por fragilidad el panel de expertos concluye que sería útil evaluar los factores de riesgo de fractura y de caídas e identificar OP secundaria. Se aconseja la realización de DXA y valorar la presencia de fracturas vertebrales.
Fractura vertebralRecomendación:El tratamiento de elección de la fractura vertebral aguda consiste en reposo, analgesia en escalada rápida para controlar el dolor y, en caso necesario, la utilización de ortesis (GR: √; GA: 100%).
La fractura vertebral aguda puede provocar dolor y discapacidad grave, que se pueden prolongar durante varios meses174. Las medidas generales que han demostrado utilidad y acortan el periodo de recuperación son el reposo en cama (durante unos 4días o menos) y los analgésicos en escalada rápida (incluyendo la utilización de opiáceos potentes si es necesario)175.
Las ortesis (corsé rígido o semirrígido) son útiles durante el episodio agudo como coadyuvantes del tratamiento analgésico, pues ayudan a inmovilizar la fractura, reducir la carga y mejorar la alineación espinal en los pacientes que las toleran. El tipo de ortesis dependerá de la localización de la fractura. No es aconsejable su utilización prolongada. No se ha demostrado que disminuyan la incidencia de nuevas fracturas176.
En pacientes con dolor persistente y de gran intensidad (escala visual analógica [EVA] ≥7), tras 4-6semanas de tratamiento con las medidas anteriores, algunos estudios concluyen que se puede considerar la realización de infiltraciones facetarias o ablación por radiofrecuencia de la rama medial177, antes de plantearse una vertebroplastia o cifoplastia. Según otros estudios, en la fase subaguda y crónica sería beneficiosa la terapia física mediante técnicas aplicadas de calor, ultrasonidos o hidroterapia y el inicio progresivo de un programa de ejercicios de potenciación de la musculatura paravertebral y toracoabdominal178. Los ejercicios con carga de peso y entrenamiento del equilibrio previenen las caídas y las fracturas y mejoran la calidad de vida del paciente59,176.
Vertebroplastia y cifoplastia¿En qué casos estarían indicadas la vertebroplastia y la cifoplastia?
Recomendación:Se recomiendan la vertebroplastia y la cifoplastia para el tratamiento de la fractura vertebral únicamente en casos de dolor grave refractario a la escalera analgésica de la OMS, incluyendo opiáceos (GR: D; GA: 100%).
Las revisiones sistemáticas de la eficacia clínica de la vertebroplastia en pacientes con fracturas por OP, con dolor refractario al tratamiento analgésico, concluyen que en ensayos abiertos la vertebroplastia tiene mejores resultados que un tratamiento analgésico óptimo en la mejoría de la calidad de vida y reducción del dolor y la discapacidad179,180. Sin embargo, en ensayos doble ciego no hay evidencia de que la vertebroplastia sea superior al placebo con anestesia local. Así, al mes, el dolor promedio, según EVA, fue de 5puntos en el grupo placebo y de 4,3puntos en el grupo de vertebroplastia, con una reducción absoluta del dolor del 7% y una reducción relativa del 10%179. La evidencia de su eficacia clínica no es consistente. Las complicaciones asociadas al procedimiento son raras, pero pueden ser graves. Por otra parte, no se puede determinar con certeza si la vertebroplastia conduce a un aumento del riesgo de nuevas fracturas en vértebras adyacentes179,180.
Las revisiones sistemáticas de la eficacia clínica de la cifoplastia concluyeron que en estudios abiertos tiene mejores resultados que el tratamiento conservador en la mejoría de la calidad de vida y la reducción del dolor y discapacidad, pero que la evidencia de su eficacia clínica no es consistente al no disponer de estudios doble ciego comparados con placebo179,181.
La disminución del dolor asociada a la cifoplastia, analizada mediante EVA, comparada con tratamiento conservador, fue de −1,82 a los 30días, de −1,45 a los 3meses y de −1,48 a los 6meses, pero de −0,84 y −0,69 a los 12 y 24meses, respectivamente181. Los autores concluyen que la vertebroplastia y la cifoplastia podrían mejorar la calidad de vida y reducir el dolor en las fracturas vertebrales refractarias al tratamiento analgésico, con un dudoso aumento de la incidencia de nuevas fracturas en las vértebras adyacentes. No hay, por lo tanto, suficiente evidencia para su recomendación en la práctica clínica habitual.
Osteoporosis por glucocorticoidesRecomendación:En pacientes que reciben o van a recibir tratamiento con glucocorticoides debe evaluarse el riesgo de fractura y valorar iniciar tratamiento para la osteoporosis lo antes posible (GR: D; GA: 100%) (fig. 2).
Recomendación:Se recomienda iniciar tratamiento farmacológico para prevenir la OP en pacientes que van a recibir glucocorticoides durante más de 3meses en los siguientes casos (GR: D):
- 1.
Pacientes con dosis inicial ≥30mg/día de prednisona. En estos casos se recomienda iniciar tratamiento para la OP de forma inmediata (GA: 100%).
- 2.
Mujeres posmenopáusicas y varones >50años con dosis de prednisona ≥5mg/día que además presenten alguna de las siguientes condiciones:
- a)
Fractura previa por fragilidad (GA: 100%).
- b)
Baja DMO (T-score ≤−1,5DE en columna o cadera) (GA: 89%).
- c)
Riesgo elevado de fractura: FRAX®para cadera ≥3% o para fractura principal ≥10% sin DMO o ≥7,5% con DMO (GA: 78%).
- 3.
Mujeres premenopáusicas y varones <50años y dosis ≥7,5mg/día de prednisona que además presenten alguna de las siguientes condiciones:
- a)
Fractura previa por fragilidad (GA: 100%).
- b)
Baja DMO (Z-score ≤−3 DE) (GA: 78%).
La OP inducida por glucocorticoides es la causa más frecuente de OP secundaria, y se asocia a la presencia de fracturas hasta en un 30-50% de casos182. El riesgo de fractura depende de factores como la edad, la DMO previa, las dosis diaria y acumulada de glucocorticoides y la enfermedad subyacente. La pérdida de DMO es rápida, sobre todo en los 6-12 primeros meses, incluso con dosis bajas de glucocorticoides, siendo el hueso trabecular el más afectado182. Según los estudios, las fracturas asociadas al tratamiento con glucocorticoides aparecen con DMO no excesivamente baja, debido a que los glucocorticoides afectan sobre todo a la microarquitectura ósea, por lo que el TBS y el FRAX® ajustado con TBS podrían tener cierta utilidad adicional en la evaluación del riesgo de estos pacientes183. No obstante, la aplicación del FRAX® en la OP por glucocorticoides tiene ciertas limitaciones e infraestima el riesgo real de fractura, ya que no ajusta por dosis diaria, dosis acumulada ni duración del tratamiento.
Las recomendaciones del ACR consideran que en pacientes que reciben o van a recibir tratamiento con glucocorticoides debe evaluarse el riesgo de fractura (preferentemente utilizando FRAX®) y valorar iniciar tratamiento lo antes posible. Además, habría que utilizar medidas preventivas generales de OP en todos los pacientes como hábitos de vida osteosaludables y dieta (ver apartado de tratamiento con medidas no farmacológicas, calcio y vitaminaD). Asimismo, se debe utilizar la dosis más baja posible de glucocorticoides y durante el menor tiempo necesario, recurriendo si es preciso al uso de inmunosupresores36.
En pacientes con pauta intermitente de corticoides y que alcancen una dosis acumulada de prednisona >5g/año o en aquellos con pérdidas anuales de DMO superiores al 10% el panel de expertos considera que también estaría indicado tratamiento para la OP.
Las mujeres premenopáusicas o los varones <50años tienen menos riesgo de fractura, lo que, unido a que en esta población se dispone de menos datos de eficacia y de seguridad de los tratamientos para la OP, hace que las indicaciones de tratamiento sean más restrictivas.
El tratamiento farmacológico de elección lo constituyen los BF orales (ácido risedrónico y ácido alendrónico) o el ácido zoledrónico intravenoso, ya que estabilizan o incrementan la DMO y reducen el riesgo de fracturas vertebrales en comparación con los grupos control184. Según las fichas técnicas, los fármacos que actualmente tienen indicación en la OP por glucocorticoides en España son teriparatida, ácido risedrónico y ácido zoledrónico.
En mujeres con OP establecida, teriparatida ha demostrado ser más eficaz que el ácido risedrónico en la reducción de fracturas vertebrales y de fracturas clínicas, independientemente de haber recibido tratamiento previo con BF185. De hecho, teriparatida ha mostrado superioridad frente al ácido alendrónico tanto en ganancia de DMO como en reducción de fracturas vertebrales morfométricas, en mujeres premenopáusicas, posmenopáusicas y varones tratados con glucocorticoides tras 18meses de seguimiento186. Por este motivo, el panel de expertos considera que en pacientes de alto riesgo o en los refractarios o que presenten contraindicación al tratamiento antirresortivo podría valorarse el tratamiento con teriparatida47.
En pacientes que inician o ya reciben glucocorticoides, la administración de denosumab durante 12meses ha demostrado un aumento en la DMO significativamente mayor que con ácido risedrónico187, por lo que la European Medicines Agency (EMA) ha recomendado añadir en la ficha técnica de denosumab una nueva indicación: el tratamiento de la pérdida de DMO asociada al empleo prolongado de glucocorticoides en pacientes adultos con riesgo elevado de fractura.
Según las recomendaciones de grupos internacionales, el tratamiento elegido debe mantenerse tanto como dure la terapia con glucocorticoides y al menos 6meses después de suspender el glucocorticoide, salvo que existan fracturas, en cuyo caso se continuará36.
Enfermedades reumáticas inflamatorias y sistémicasRecomendación:Se aconseja evaluar el riesgo de fractura y considerar la realización de DXA en pacientes con artritis reumatoide, lupus eritematoso sistémico y espondilitis anquilosante, particularmente en mayores de 50años y en los tratados con glucocorticoides o con enfermedad severa o evolucionada (GR: √; GA: 100%).
Los pacientes con artritis reumatoide, lupus eritematoso sistémico y espondilitis anquilosante presentan un mayor riesgo de OP y/o fracturas188-194. En un estudio se ha comunicado un incremento del riesgo de fracturas tanto en artritis psoriásica como en psoriasis severa195. Las conclusiones de algunos estudios en pacientes con artritis reumatoide aconsejan el cribado de fractura por fragilidad y la realización de DXA, en especial en pacientes >50años y en aquellos con enfermedad severa o evolucionada o tratados con glucocorticoides188,189. Asimismo, varios documentos de consenso sobre el manejo de las comorbilidades en artritis reumatoide, artritis psoriásica y lupus eritematoso sistémico aconsejan realizar una adecuada profilaxis de la OP196-198. En relación con los tratamientos antifractura, se emplean todos los fármacos aprobados para la OP. En el caso de denosumab, los datos de seguridad son limitados en pacientes tratados con agentes biológicos para su enfermedad de base, aunque según los resultados de algunos estudios no parece existir un perfil de seguridad diferente al de la OP posmenopáusica199.
Osteoporosis del varónRecomendación:Se recomienda el estudio de causas de osteoporosis secundaria en todos los varones con baja masa ósea o fractura por fragilidad (GR: D; GA: 100%).
En diferentes estudios se observa que la OP del varón está infradiagnosticada200. De hecho, se calcula que un tercio de las fracturas de cadera a nivel mundial se producen en varones, especialmente después de los 70años. Asimismo, la mortalidad tras una fractura de cadera (más del 37% en el primer año) es mayor que la que ocurre en mujeres201. Además, en el varón es más frecuente la OP secundaria, por lo que los estudios concluyen en la conveniencia de realizar una evaluación clínica adecuada y rigurosa para su exclusión de forma sistemática. Las causas y factores de riesgo más frecuentes de OP del varón son el hipogonadismo, el consumo de alcohol, el tabaco y los glucocorticoides. La valoración del riesgo de fractura en el varón incluiría los factores de riesgo clínico, la existencia de fracturas previas y la medición de la DMO por DXA (si estuviera indicada) con el fin de estratificar mejor a los pacientes susceptibles de tratamiento202. En cuanto a la DXA, se utilizan los mismos valores de referencia en varones que en mujeres203.
Respecto a las medidas de prevención no farmacológicas, se pueden considerar las mismas que para la OP de la mujer. Con respecto al tratamiento hormonal, no hay datos de eficacia en reducción de fracturas del tratamiento con testosterona, por lo que según los expertos solo está indicada en varones con hipogonadismo sintomático, aconsejándose además asociar otro tratamiento antiosteoporótico204. Los fármacos que han demostrado mejoría de la DMO y disminución del riesgo de fractura vertebral, tanto en varones eugonadales como en hipogonadales, son los BF orales (ácido alendrónico y ácido risedrónico)205,206, el ácido zoledrónico (el único que lo estableció como objetivo primario)207 y la teriparatida208,209. El denosumab también está aprobado en varones con elevado riesgo de fractura y para disminuir la pérdida de DMO en el paciente con carcinoma de próstata en tratamiento de privación androgénica210. Todos estos fármacos, excepto el ácido alendrónico, tienen la indicación en España para OP del varón.
Osteoporosis en la mujer premenopáusicaRecomendación:Se recomienda realizar un estudio de causas de osteoporosis secundaria en todas las mujeres premenopáusicas con baja masa ósea medida por DXA o con fractura por fragilidad (GR: √; GA: 100%).
Según diferentes sociedades científicas y grupos de expertos, en la mujer premenopáusica se debería realizar DXA en caso de fracturas por fragilidad y/o factores de riesgo asociados a pérdida de masa ósea42,211. En este grupo de pacientes habría que utilizar el Z-score (que compara con individuos de la misma edad y sexo) en lugar del T-score42,211,212. Así, se considera «masa ósea baja» cuando el Z-score es inferior a −2DE211. La presencia de fracturas por fragilidad, particularmente asociadas a una masa ósea baja, permite establecer el diagnóstico de OP en la mujer premenopáusica212.
Considerando que más del 50% de mujeres premenopáusicas con OP presentan una OP secundaria212,213, los expertos recomiendan realizar un estudio exhaustivo para descartar una causa subyacente212,213, siendo las más frecuentes las siguientes: tratamiento con glucocorticoides, déficit estrogénico, enfermedades por malabsorción y la OP asociada al embarazo o lactancia212. Las formas idiopáticas son frecuentes en la mujer premenopáusica y pueden asociarse a hipercalciuria y a antecedentes familiares de OP213.
El abordaje terapéutico en la mujer premenopáusica incluye optimizar la ingesta de calcio y vitaminaD, ejercicio físico regular, suspender el consumo de tabaco y limitar el consumo de alcohol y tratar la causa subyacente212. Para los expertos en OP premenopáusica, los fármacos antiosteoporóticos específicos (BF, teriparatida, denosumab) se considerarán en pacientes con fractura por fragilidad o determinadas causas secundarias como el tratamiento con glucocorticoides213. Los fármacos que se han estudiado en la OP premenopáusica son los BF (ácido alendrónico y ácido risedrónico) y teriparatida212. Según los expertos, en mujeres jóvenes se debe actuar con cierta cautela con la administración de BF, dada su larga retención en el tejido óseo, particularmente en las mujeres que desean un futuro embarazo. También se concluye que ninguno de estos fármacos debería utilizarse en el embarazo (BF y teriparatida están en la categoríaC según la FDA)214,215. Por lo que respecta a los SERM, parece razonable evitar su uso en mujeres premenopáusicas, mientras que denosumab solo tiene indicación en OP posmenopáusica (según la FDA: categoríaX en embarazo)212.
Algunos expertos sugieren que en mujeres fértiles deberían indicarse medidas anticonceptivas en caso de iniciar cualquier tratamiento antiosteoporótico213.
Otras situaciones especiales: enfermedad renal, hepática y problemas digestivosEnfermedad renal crónicaEn pacientes con enfermedad renal crónica (ERC) deben tenerse en cuenta ciertos aspectos diferenciales con la OP posmenopáusica: 1)la DXA no discrimina el tipo de enfermedad ósea subyacente, y 2)se debería excluir la osteodistrofia renal, en particular la enfermedad ósea adinámica (osteodistrofia con remodelado muy bajo) en dializados crónicos, ya que contraindica el uso de antirresortivos. Los niveles de PTH <120pg/ml con fosfatasa alcalina baja sugieren la presencia de enfermedad ósea adinámica216.
Por lo que respecta a la insuficiencia de vitamina D en la ERC, en estadios 3-5D, los expertos consideran la utilización de estrategias terapéuticas similares a las aceptadas para la población general.
En relación con los tratamientos antifractura, para los pacientes en estadios 1-2 y filtrado >35ml/min, su empleo es globalmente similar a los pacientes sin ERC217,218.
La ficha técnica de los fármacos indica que los BF, la teriparatida y el raloxifeno no se recomiendan cuando el filtrado es <30ml/min (<35ml/min para ácido alendrónico y ácido zoledrónico). Sin embargo, hay algunos estudios post hoc realizados con ácido risedrónico219 y raloxifeno220,221 en pacientes con filtrado glomerular entre 15 y 30ml/min (estadio4) en los que estos fármacos han mostrado eficacia y seguridad. No obstante, hay que tener en cuenta la limitada evidencia de este tipo de estudios post hoc. Bazedoxifeno no se ha evaluado suficientemente en pacientes con filtrado <30ml/min. Denosumab no precisa ajuste de dosis en insuficiencia renal, pero el riesgo de hipocalcemia es más elevado, por lo que se aconseja optimizar los suplementos de calcio y vitaminaD. La evidencia de su seguridad en pacientes con ERC estadio4 y en hemodiálisis está también limitada por tratarse de estudios post hoc con un número de pacientes limitado222.
Enfermedad hepática crónicaSegún los expertos, el manejo de los pacientes con enfermedad hepática crónica incluye la valoración de factores que propician la pérdida ósea y el aumento del riesgo de fractura como malnutrición, déficit de vitaminaD, intensidad de la colestasis, glucocorticoides e hipogonadismo. Los estudios farmacológicos de reducción de fracturas en pacientes con enfermedad hepática son limitados, no existiendo contraindicaciones para el empleo de BF, los cuales aumentan la DMO223. No existe suficiente experiencia con otros tratamientos.
Enfermedades digestivasLos estudios concluyen que en el manejo de pacientes con enfermedad celiaca, enfermedad inflamatoria intestinal y cirugía bariátrica deben considerarse la malabsorción y la malnutrición (valorar suplementos de calcio y vitaminaD), además del uso de glucocorticoides. En la enfermedad inflamatoria intestinal los BF reducen el riesgo de fractura vertebral224.
Según ficha técnica, los BF orales están contraindicados en pacientes con anomalías esofágicas y otros factores que retrasen el vaciamiento, como la estenosis y la acalasia. El panel de expertos considera que cuando la terapia antirresortiva oral esté contraindicada, se prevea ineficaz por malabsorción grave o no se tolere, podría considerarse el tratamiento por vía parenteral47.
Nuevos tratamientosActualmente se encuentran en fase avanzada de desarrollo clínico dos nuevos fármacos para el tratamiento de la OP: romosozumab y abaloparatida.
Romosozumab es un anticuerpo monoclonal IgG2 humanizado que se une y bloquea la esclerostina. Administrado por vía subcutánea mensual durante un año, seguido por denosumab o por ácido alendrónico durante un año adicional, mostró una reducción significativa de la incidencia de nuevas fracturas vertebrales y no vertebrales225,226. En uno de los estudios se observó un incremento en la incidencia de eventos adversos cardiovasculares graves con respecto al ácido alendrónico226, lo que ha motivado un requerimiento por parte de la US Food and Drug Administration (FDA) de aportar los resultados de estudios adicionales.
Abaloparatida es un péptido sintético que activa el receptor tipo1 de la PTH, aprobado por la FDA en 2017 y rechazado por la EMA en 2018. En administración subcutánea diaria obtuvo una reducción significativa de la incidencia de fracturas vertebrales y no vertebrales frente a placebo, sin diferencias frente a teriparatida227. El perfil de seguridad y tolerabilidad fue similar al de teriparatida, aunque con una menor incidencia de hipercalcemia.
ConclusiónComo se ha señalado en la introducción, el objetivo de este documento ha sido la puesta al día de los nuevos avances en los distintos aspectos de la OP relacionados con la práctica clínica: diagnóstico, valoración, tratamiento y seguimiento.
El documento se apoya en una revisión crítica del consenso previo5 y está basado en la mejor evidencia científica disponible y en la experiencia clínica de expertos. Esta ha sido una tarea conjunta entre los miembros del panel y la Unidad de Investigación de la SER que, junto con revisores de la SER, ha efectuado un amplio trabajo de revisión sistemática sobre distintos temas de interés y ha proporcionado la rigurosidad científica necesaria para poder efectuar las recomendaciones con su grado de evidencia y también el grado de consenso de las mismas, para proporcionar al lector la valoración más objetiva de estas recomendaciones.
En la evaluación diagnóstica este documento incorpora la nueva definición de OP, que incluye a pacientes con fractura por fragilidad y baja masa ósea, el concepto de riesgo inminente de fractura, así como la utilidad del TBS.
Con respecto al tratamiento, se expone de forma resumida la efectividad de cada fármaco para prevención de fracturas, así como algunos criterios de elección como el coste-efectividad, la existencia de múltiples fracturas o las limitaciones para emplear la vía oral. Entre los miembros del panel se ha valorado la posibilidad de incluir un algoritmo amplio de decisión de tratamiento, sin llegar a un acuerdo.
Los revisores de la SER, por su parte, han actualizado la osteonecrosis de maxilar y la fractura atípica de fémur. Las situaciones especiales se han mantenido respecto a las recomendaciones de 2011, añadiendo la OP de los reumatismos inflamatorios y unas pinceladas de las precauciones que deben tenerse en cuenta en pacientes con enfermedad renal y problemas gastrointestinales y hepáticos. Finalmente, se ha incluido un apartado sobre los nuevos tratamientos (romosozumab y abaloparatida).
Debemos destacar de estas recomendaciones que la valoración del riesgo de fractura y de la indicación de tratamiento han sido los temas que han presentado más debate entre los miembros del panel. Se ha aceptado por unanimidad la utilidad del FRAX® para fractura de cadera considerando el umbral del 3%, mientras que el grado de acuerdo para fractura principal ha sido algo inferior. En el documento se expone el porqué de esta discrepancia, básicamente derivado de la ausencia de suficientes estudios sobre la calibración del FRAX® para población española.
Para concluir, podemos decir que las recomendaciones de este documento constituyen un marco base de consulta en el manejo de la OP. Son normas generales que precisan la individualización de cada caso, y este es el papel que debemos asumir como profesionales.
Conflicto de interesesAntonio Naranjo Hernández ha recibido financiación de Amgen, Lilly y FAES para la asistencia a cursos/congresos, honorarios de Amgen en concepto de ponencias y ha recibido becas de FHOEMO-Amgen y Lilly para contratar personal y dotar de equipos informáticos el servicio.
María Pilar Aguado Acín ha recibido financiación de Lilly para la asistencia a congresos; honorarios de Alexion, Faes, Lilly y de Rubió en concepto de ponencias; y ha recibido financiación para la realización de programas educativos en la Unidad de Reumatología.
Luis Arboleya Rodríguez ha recibido financiación de Janssen-Cilag, Lácer y Lilly para la asistencia a congresos y ha recibido honorarios de Pfizer y Lilly en concepto de ponencias.
Enrique Casado Burgos ha recibido financiación de Amgen, Lilly, FAES, Gebro, Italfármaco y Rubió para la asistencia a cursos/congresos y honorarios en concepto de ponencias.
Santos Castañeda Sanz ha recibido financiación de Amgen para la asistencia a cursos/congresos; honorarios de Lilly en concepto de ponencias; y ha recibido ayuda económica de Amgen en concepto de consultoría para compañías farmacéuticas u otras tecnologías y en concepto de realización de programas educativos o cursos.
Jordi Fiter Areste ha recibido financiación de Novartis, Roche, MSD, Amgen, Lilly, Menarini, UCB y Pfizer para la asistencia a cursos/congresos; honorarios de Amgen-Ferrer, Roche, Menarini y Amgen en conceptos de ponencias; y ha recibido financiación de UCB por participar en una investigación.
Laia Gifre Sala ha recibido financiación de Lilly para la asistencia a congresos; honorarios de Lilly, Amgen y FAES Farma en concepto de ponencias; y ha recibido financiación de Alexion para proyectos de investigación.
Carmen Gómez Vaquero ha recibido financiación de Abbie, Amgen, Bristol, Lilly, Menarini, MSD, Pfizer, Procter Gamble, Roche, Sandoz, Servier, UCB para la asistencia a cursos/congresos; honorarios de Abbie, Amgen, Lilly, MSD, Pierre Fabré, Roche y UCB en concepto de ponencias; financiación de Lilly para la realización de programas educativos o cursos; financiación de Novartis, Amgen y Lilly por participar en una investigación; ayuda económica de Nycomed Pharma en concepto de consultoría para compañías farmacéuticas u otras tecnologías; y ha recibido financiación de Lilly para programas educativos o cursos para la unidad.
Núria Guañabens Gay ha recibido financiación de Amgen y Lilly para asistencia a cursos/congresos, en concepto de ponencias y en concepto de realización de programas educativos o cursos; financiación de Amgen por participar en una investigación; y ha recibido ayuda económica de Lilly, Amgen, UCB y Alexion en concepto de consultoría para compañías farmacéuticas.
El grupo de expertos del presente trabajo quiere manifestar su agradecimiento a Mercedes Guerra Rodríguez, documentalista de la SER, por su colaboración en las estrategias de búsqueda de la evidencia y a la Dra. Hye Sang Park por su colaboración en las revisiones de los informes de RS. También quieren agradecer al Dr. Federico Diaz González, director de la Unidad de Investigación de la SER, por su participación en la revisión del manuscrito final y por contribuir a preservar la independencia de este documento.
| Niveles de evidencia | |
|---|---|
| 1++ | Metaanálisis de alta calidad, revisiones sistemáticas de ensayos clínicos o ensayos clínicos de alta calidad con muy poco riesgo de sesgo |
| 1+ | Metaanálisis bien realizados, revisiones sistemáticas de ensayos clínicos o ensayos clínicos bien realizados con poco riesgo de sesgos |
| 1− | Metaanálisis, revisiones sistemáticas de ensayos clínicos o ensayos clínicos con alto riesgo de sesgos |
| 2++ | Revisiones sistemáticas de alta calidad de estudios de cohortes o de casos y controles. Estudios de cohortes o de casos y controles con riesgo muy bajo de sesgo y con alta probabilidad de establecer una relación causal |
| 2+ | Estudios de cohortes o de casos y controles bien realizados con bajo riesgo de sesgo y con una moderada probabilidad de establecer una relación causal |
| 2− | Estudios de cohortes o de casos y controles con alto riesgo de sesgo y riesgo significativo de que la relación no sea causal |
| 3 | Estudios no analíticos, como informes de casos y series de casos |
| 4 | Opinión de expertos |
| Grados de recomendación | |
|---|---|
| A | Al menos un metaanálisis, revisión sistemática o ensayo clínico clasificado como 1++ y directamente aplicable a la población diana de la guía; o un volumen de evidencia científica compuesto por estudios clasificados como 1+ y con gran concordancia entre ellos |
| B | Un volumen de evidencia científica compuesta por estudios clasificados como 2++, directamente aplicable a la población diana de la guía y que demuestran gran concordancia entre ellos; o evidencia científica extrapolada desde estudios clasificados como 1++ o 1+ |
| C | Un volumen de evidencia científica compuesta por estudios clasificados como 2+ directamente aplicable a la población diana de la guía y que demuestran gran consistencia entre ellos; o evidencia científica extrapolada desde estudios clasificados como 2++ |
| D | Evidencia científica de nivel 3 o 4; o evidencia científica extrapolada desde estudios clasificados como 2+ |
Los estudios clasificados como 1− y 2− no deberían usarse para la elaboración de recomendaciones por su alta posibilidad de sesgo.
| Buena práctica clínicaa | |
|---|---|
| √ | Práctica recomendada basada en la experiencia clínica y el consenso del equipo redactor |
En ocasiones el grupo elaborador se percata de algún aspecto práctico importante sobre el que se quiere hacer énfasis y para el cual no existe, probablemente, ninguna evidencia que lo soporte. En general, estos casos tienen que ver con algún aspecto del tratamiento considerado buena práctica clínica y que nadie cuestionaría habitualmente. Estos aspectos son valorados como puntos de buena práctica clínica. Estos mensajes no son una alternativa a las recomendaciones basadas en la evidencia, sino que deben considerarse únicamente cuando no existe otra manera de destacar dicho aspecto.