Determinar la positividad y la correlación clínica de los anticuerpos contra el citoplasma del neutrófilo (ANCA), teniendo en cuenta la interferencia de los anticuerpos antinucleares (ANA).
Material y métodoSe realizó un estudio prospectivo en el Laboratorio de Inmunología del Centro Nacional de Genética Médica de Cuba durante un año. Se incluyó a 267 pacientes con indicación de ANCA. Las determinaciones de ANCA a diferentes puntos de corte y de ANA se realizaron mediante inmunofluorescencia indirecta. Los anticuerpos antiproteinasa 3 y antimieloperoxidasa fueron determinados mediante ELISA.
ResultadosNuestro estudio mostró que la mayor positividad de ANCA fue vista en pacientes con vasculitis asociadas a ANCA, artritis reumatoidea y lupus eritematoso sistémico. Fue superior la presencia de ANCA sin especificidad por la proteinasa 3 o la mieloperoxidasa en pacientes con ANA y se observó poca relación entre el patrón perinuclear confirmado en formalina y la presencia de anticuerpos frente a la mieloperoxidasa. Los mayores valores de sensibilidad y especificidad para el diagnóstico de las vasculitis se alcanzaron para la determinación de ANCA mediante inmunofluorescencia indirecta a un valor de corte de 1/80 y confirmando la especificidad antigénica mediante ELISA.
ConclusionesLos ANCA pueden estar presentes en un amplio número de enfermedades asociadas a estados inflamatorios y autoinmunes en la población estudiada. Su determinación mediante inmunofluorescencia indirecta seguida de la determinación mediante ELISA tiene gran valor para el diagnóstico de las vasculitis. La determinación de anticuerpos antimieloperoxidasa tiene mayor utilidad que el ensayo en láminas de formalina cuando hay ANA.
To determine positivity and clinical correlation of anti-neutrophil cytoplasmic antibodies (ANCA), taking into account the interference of antinuclear antibodies (ANA).
Material and methodsA prospective study was conducted in the Laboratory of Immunology of the National Cuban Center of Medical Genetic during one year. Two hounded sixty-seven patients with indication for ANCA determination were included. ANCA and ANA determinations with different cut off points and assays were determined by indirect immunofluorescense. Anti proteinase 3 and antimyeloperoxidase antibodies were determined by ELISA.
ResultsMost positivity for ANCA was seen in patients with ANCA associated, primary small-vessel vasculitides, rheumatoid arthritis and systemic lupus erythematosus. Presence of ANCA without positivity for proteinase 3 and myeloperoxidase was higher in patients with ANA and little relation was observed between the perinuclear pattern confirmed in formalin and specificity by myeloperoxidase. Highest sensibility and specificity values for vasculitides diagnostic were achieved by ANCA determination using indirect immunofluorescense with a cut off 1/80 and confirming antigenic specificities with ELISA.
ConclusionANCA can be present in a great number of chronic inflammatory or autoimmune disorders in the population studied. This determination using indirect immunofluorescence and following by ELISA had a great value for vasculitis diagnosis. Anti mieloperoxidasa assay has a higher utility than the formalin assay when ANA is present.
Los anticuerpos contra el citoplasma de los neutrófilos (ANCA) son un grupo de autoanticuerpos dirigidos frente a constituyentes citoplasmáticos de neutrófilos y monocitos. Constituyen una prueba diagnóstica de las vasculitis de pequeños vasos asociadas a ANCA (VAA) que incluyen la granulomatosis con poliangeítis (GPA), la poliangeítis microscópica (PAM), la granulomatosis eosinofílica con poliangeítis (GEPA) y la vasculitis limitada al riñón1.
La determinación de ANCA se realiza a través de la inmunofluorescencia indirecta (IFI) a partir de neutrófilos fijados en láminas portaobjetos y la positividad de la fluorescencia se debe confirmar por el ensayo de inmunoabsorción ligado a enzima (enzyme-linked immunosorbent assay [ELISA]) para determinar la especificidad antigénica, aunque algunos autores plantean que la utilización simultánea de ambos métodos ha demostrado mayor valor diagnóstico2.
Existen 2 patrones principales de fluorescencia según el objetivo de los ANCA. El patrón citoplasmático (cANCA) se refiere al patrón con el que se tiñe el citoplasma bajo el microscopio inmunofluorescente cuando los neutrófilos son fijados con etanol o acetona. El antígeno principal de cANCA es la proteinasa 3 (PR3). El patrón perinuclear (pANCA) se refiere al patrón de tinción de los neutrófilos, que ocurre solamente cuando son fijados en etanol o acetona, que permeabilizan la membrana de los gránulos citoplasmáticos, y permite que las proteínas altamente catiónicas como la mieloperoxidasa (MPO) salgan y se unan a la membrana nuclear cargada negativamente. Cuando los neutrófilos son fijados en formalina, este patrón pANCA se observa como cANCA porque se reduce el efecto de atracción de las proteínas catiónicas hacia el núcleo1–3.
Más del 90% de los pacientes con GPA típica activa poseen anticuerpos identificables contra la PR3, con una sensibilidad del 28 a 92%, dependiendo de la expresión de la enfermedad, y una especificidad del 80 al 100%; mientras que entre el 80 y el 70% de los pacientes con PAM y entre el 70 y el 85% de los pacientes con GEPA poseen anticuerpos identificables contra la MPO4,5.
Se ha confirmado que el patrón pANCA puede observarse cuando los anticuerpos reaccionan con otros antígenos diferentes a la MPO, denominándose patrón pANCA atípico. El patrón con fluorescencia perinuclear sin extensión nuclear también es conocido como pANCA atípico6,7.
Algunos autores han planteado además la existencia del patrón cANCA atípico que combina la fluorescencia perinuclear con extensión nuclear y la fluorescencia citoplasmática. Este patrón se puede producir por la interferencia de anticuerpos antinucleares (ANA)6,7.
De ahí la importancia de la determinación de ANA simultánea a la determinación de ANCA, aunque existen pocos estudios de prevalencia de los patrones de ANCA por IFI en distintas enfermedades, diferenciando la presencia o no de ANA.
Los patrones atípicos pueden tener especificidades antigénicas contra componentes nucleares, citosólicos o granulares y entre ellos se encuentran la elastasa, catepsina G, incrementador de la permeabilidad bactericida (BPI), betaglucoronidasa, lisozima, lactoferrina, catalasa, alfa enolasa, actina, histonas, entre otros7,8.
Algunos autores plantean la utilidad de los ANCA no solo para diagnosticar las VAA, sino también para diagnosticar y evaluar el pronóstico de otros desórdenes inflamatorios o autoinmunes, donde el patrón de IFI asociado se describe usualmente como pANCA, aunque se han presentado patrones cANCA o atípicos1,7,9,10. También se ha descrito la positividad de los ANCA en enfermedades infecciosas y trastornos hematológicos malignos1,11,12.
El objetivo de este trabajo fue determinar la positividad y la correlación clínica de los ANCA, teniendo en cuenta la interferencia de los ANA, en los pacientes atendidos en el Laboratorio de Inmunología del Centro Nacional de Genética Médica (CNGM) de Cuba en el año 2012.
Material y métodoSe realizó un estudio prospectivo con los pacientes remitidos al Laboratorio de Inmunología del CNGM de Cuba en el año 2012.
PacientesLa muestra estuvo constituida por 267 pacientes con indicación de ANCA: 35 con sospecha de lupus eritematoso sistémico (LES), 60 con LES confirmado, 17 con sospecha de VAA, 13 con VAA, 91 con artritis reumatoidea (AR), 10 con hepatitis virales, 14 con esclerodermia, 8 con enfermedad mixta del tejido conectivo, 4 con síndrome de Sjögren, 5 con hepatitis autoinmune (HAI) tipo i, 3 con colitis ulcerativa (CU), 3 con fenómeno de Raynaud, 2 con dermatomiositis, uno con cirrosis biliar primaria y uno con espondiloartropatía. El diagnóstico de las VAA se realizó según los criterios establecidos por la conferencia de Chapell Hill13–15. El diagnóstico del resto de los pacientes se realizó por los clínicos e inmunólogos según los criterios establecidos para cada enfermedad.
MétodoLa determinación de ANA se realizó mediante la técnica de IFI, considerando la positividad a partir de 1/80 y utilizando un ensayo comercial (ORGENTEC, Alemania). La determinación de los ANCA se realizó mediante IFI sobre neutrófilos humanos fijados en etanol y formalina, considerando la positividad a partir de 1/2016 y las determinaciones de anticuerpos anti-PR3 y anti-MPO se realizaron mediante ELISA (ORGENTEC, Alemania) a los pacientes que presentaron positividad de ANCA mediante IFI, tomando como valor de corte 5 UI/mL. Se distinguieron 2 patrones de IFI: cANCA (fluorescencia citoplasmática), pANCA (fluorescencia perinuclear con y sin extensión nuclear). Las muestras positivas para ANCA fueron tituladas mediante IFI. Se consideró como título la mayor dilución a la que se observó nítidamente el patrón de ANCA. Se determinó la sensibilidad y especificidad de la determinación de ANCA mediante IFI utilizando diferentes puntos de corte y confirmando las especificidades antigénicas mediante ELISA.
Para el análisis estadístico se utilizaron los programas Statistica 7.0 y EPIDAT 3.1. Para el análisis de la influencia de la positividad del ANA en la determinación de ANCA, se calculó el estadígrafo χ2 y se estimó la odds ratio (OR) como magnitud de asociación con su respectivo intervalo de confianza al 95%. Los diferentes puntos de corte se compararon en términos de capacidad de discriminación, mediante el área bajo la curva (ABC) de las curvas de características operacionales del receptor (receiver operating characteristic curve [curvas ROC]).
Para el desarrollo de la investigación se cumplieron los principios enunciados en la Declaración de Helsinki de la Asociación Médica Mundial, que establece los principios éticos para las investigaciones médicas en seres humanos17. El trabajo fue aprobado por el Comité de Ética del CNGM.
El consentimiento informado de participación fue entregado a los pacientes en la consulta, con tiempo suficiente para decidir su participación y antes de las extracciones de sangre.
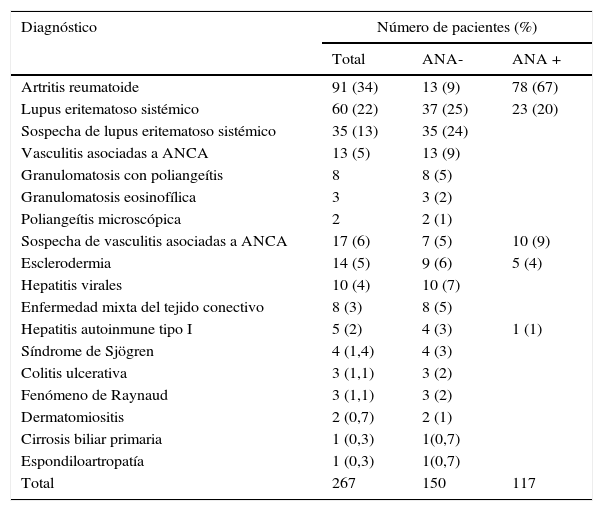
ResultadosLa edad media de los pacientes incluidos en el estudio fue 40 años, en un rango de 1 a 75 años. Solamente el 17% de los pacientes tuvieron una edad igual o mayor a 60 años. El 73% de los pacientes (195) fueron del sexo femenino y del total de pacientes incluidos el 56% (150) fueron negativos de ANA (tabla 1).
Número de pacientes incluidos en el estudio con positividad de anticuerpos antinucleares
| Diagnóstico | Número de pacientes (%) | ||
|---|---|---|---|
| Total | ANA- | ANA + | |
| Artritis reumatoide | 91 (34) | 13 (9) | 78 (67) |
| Lupus eritematoso sistémico | 60 (22) | 37 (25) | 23 (20) |
| Sospecha de lupus eritematoso sistémico | 35 (13) | 35 (24) | |
| Vasculitis asociadas a ANCA | 13 (5) | 13 (9) | |
| Granulomatosis con poliangeítis | 8 | 8 (5) | |
| Granulomatosis eosinofílica | 3 | 3 (2) | |
| Poliangeítis microscópica | 2 | 2 (1) | |
| Sospecha de vasculitis asociadas a ANCA | 17 (6) | 7 (5) | 10 (9) |
| Esclerodermia | 14 (5) | 9 (6) | 5 (4) |
| Hepatitis virales | 10 (4) | 10 (7) | |
| Enfermedad mixta del tejido conectivo | 8 (3) | 8 (5) | |
| Hepatitis autoinmune tipo I | 5 (2) | 4 (3) | 1 (1) |
| Síndrome de Sjögren | 4 (1,4) | 4 (3) | |
| Colitis ulcerativa | 3 (1,1) | 3 (2) | |
| Fenómeno de Raynaud | 3 (1,1) | 3 (2) | |
| Dermatomiositis | 2 (0,7) | 2 (1) | |
| Cirrosis biliar primaria | 1 (0,3) | 1(0,7) | |
| Espondiloartropatía | 1 (0,3) | 1(0,7) | |
| Total | 267 | 150 | 117 |
ANA-: ausencia de anticuerpos antinucleares; ANA+: presencia de anticuerpos antinucleares; ANCA: anticuerpos contra el citoplasma del neutrófilo.
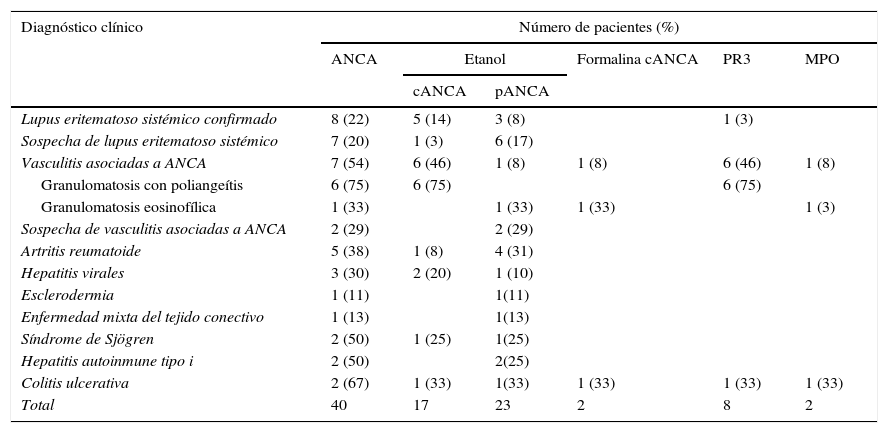
De los 150 pacientes negativos de ANA, 40 (27%) presentaron ANCA por IFI y de ellos 10 pacientes (25%) presentaron anticuerpos anti-PR3 y anti-MPO (tabla 2). En este grupo de pacientes los anticuerpos anti-PR3 correspondieron a un patrón cANCA y todos los anticuerpos anti-MPO correspondieron a un patrón pANCA positivo en formalina.
Positividad de anticuerpos contra el citoplasma del neutrófilo teniendo en cuenta el diagnóstico clínico de los pacientes sin anticuerpos antinucleares
| Diagnóstico clínico | Número de pacientes (%) | |||||
|---|---|---|---|---|---|---|
| ANCA | Etanol | Formalina cANCA | PR3 | MPO | ||
| cANCA | pANCA | |||||
| Lupus eritematoso sistémico confirmado | 8 (22) | 5 (14) | 3 (8) | 1 (3) | ||
| Sospecha de lupus eritematoso sistémico | 7 (20) | 1 (3) | 6 (17) | |||
| Vasculitis asociadas a ANCA | 7 (54) | 6 (46) | 1 (8) | 1 (8) | 6 (46) | 1 (8) |
| Granulomatosis con poliangeítis | 6 (75) | 6 (75) | 6 (75) | |||
| Granulomatosis eosinofílica | 1 (33) | 1 (33) | 1 (33) | 1 (3) | ||
| Sospecha de vasculitis asociadas a ANCA | 2 (29) | 2 (29) | ||||
| Artritis reumatoide | 5 (38) | 1 (8) | 4 (31) | |||
| Hepatitis virales | 3 (30) | 2 (20) | 1 (10) | |||
| Esclerodermia | 1 (11) | 1(11) | ||||
| Enfermedad mixta del tejido conectivo | 1 (13) | 1(13) | ||||
| Síndrome de Sjögren | 2 (50) | 1 (25) | 1(25) | |||
| Hepatitis autoinmune tipo i | 2 (50) | 2(25) | ||||
| Colitis ulcerativa | 2 (67) | 1 (33) | 1(33) | 1 (33) | 1 (33) | 1 (33) |
| Total | 40 | 17 | 23 | 2 | 8 | 2 |
ANCA: anticuerpos anticitoplasma del neutrófilo; cANCA: patrón citoplasmático de anticuerpos contra el citoplasma del neutrófil; MPO: mieloperoxidasa;pANCA: patrón perinuclear de anticuerpos contra el citoplasma del neutrófilo; PR3: proteinasa 3.
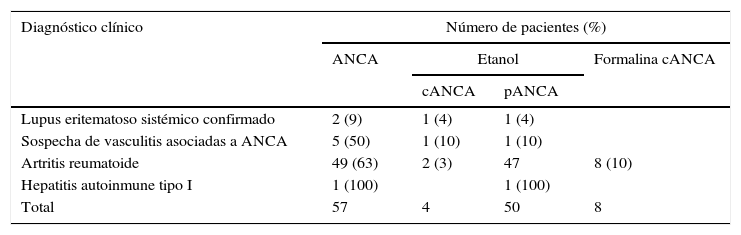
De los 117 pacientes positivos de ANA, 57 (49%) presentaron ANCA por IFI. Todos estos pacientes positivos de ANCA por IFI fueron negativos de anticuerpos anti-PR3 y anti-MPO. De 51 patrones pANCA obtenidos, 6 resultaron positivos en formalina y no se asociaron a anticuerpos anti-MPO (tabla 3).
Positividad de anticuerpos contra el citoplasma del neutrófilo teniendo en cuenta el diagnóstico clínico de los pacientes con anticuerpos antinucleares
| Diagnóstico clínico | Número de pacientes (%) | |||
|---|---|---|---|---|
| ANCA | Etanol | Formalina cANCA | ||
| cANCA | pANCA | |||
| Lupus eritematoso sistémico confirmado | 2 (9) | 1 (4) | 1 (4) | |
| Sospecha de vasculitis asociadas a ANCA | 5 (50) | 1 (10) | 1 (10) | |
| Artritis reumatoide | 49 (63) | 2 (3) | 47 | 8 (10) |
| Hepatitis autoinmune tipo I | 1 (100) | 1 (100) | ||
| Total | 57 | 4 | 50 | 8 |
ANCA: anticuerpos anticitoplasma del neutrófilo; cANCA: patrón citoplasmático de anticuerpos contra el citoplasma del neutrófilo; pANCA: patrón perinuclear de anticuerpos contra el citoplasma del neutrófilo.
En este estudio se encontró que es mayor la probabilidad de encontrar ANCA determinados mediante el ensayo de IFI sin especificidad antigénica frente a MPO o PR3 cuando el ANA es positivo (OR=3,8; IC 95%; [2,15-6,71]).
Como se muestra en la tabla 2, la mayor positividad de ANCA con respecto al total de pacientes estudiados negativos de ANA en cada enfermedad correspondió a los pacientes con: CU, VAA, síndrome de Sjögren, HAI tipo I, AR, hepatitis infecciosas y LES. La presencia del patrón pANCA fue mayor que el patrón cANCA y se observó en todas las enfermedades donde se detectaron estos anticuerpos a excepción de la GPA. El patrón cANCA estuvo presente en el LES, VAA, AR, hepatitis infecciosas, síndrome de Sjögren y CU.
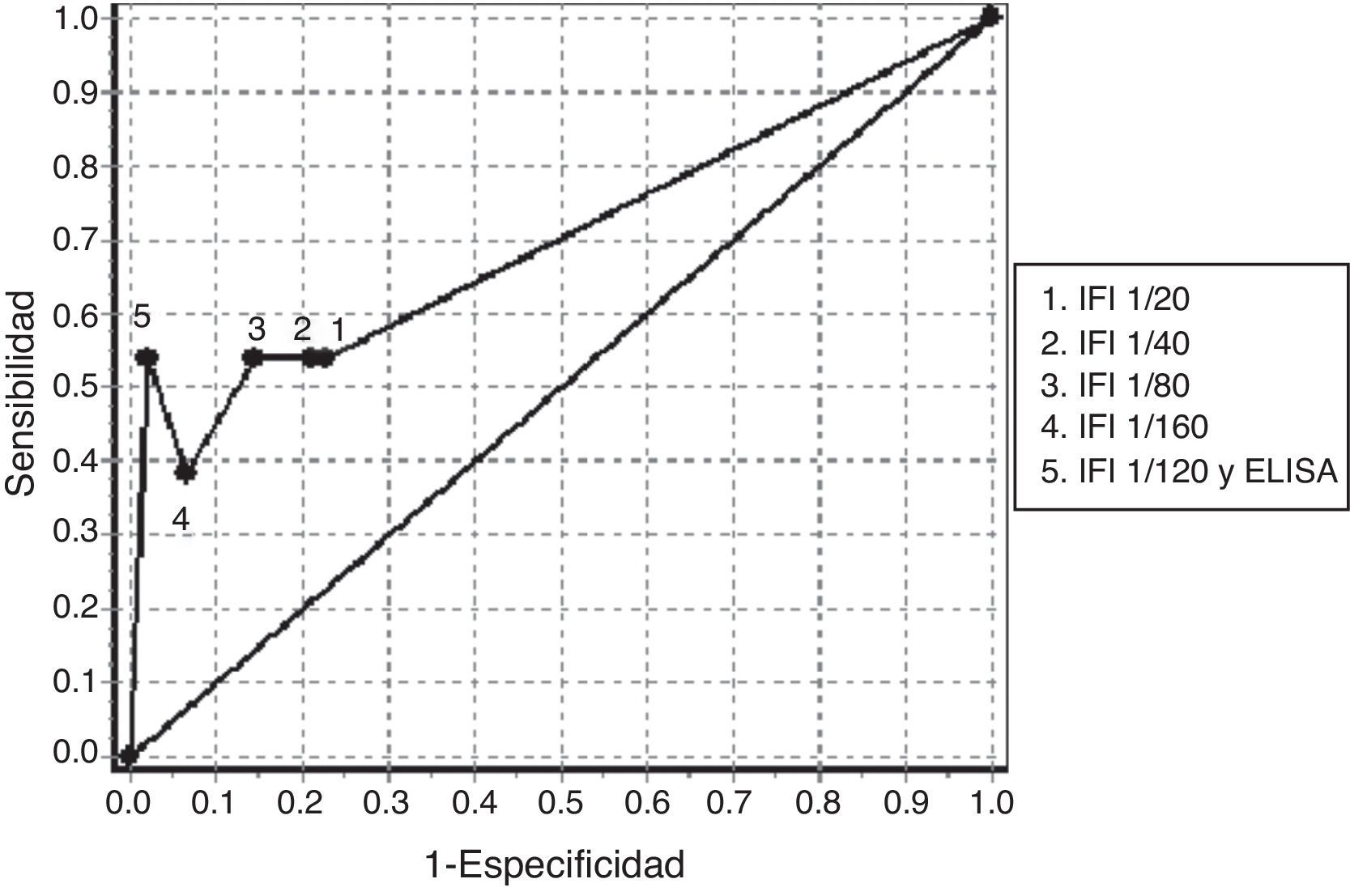
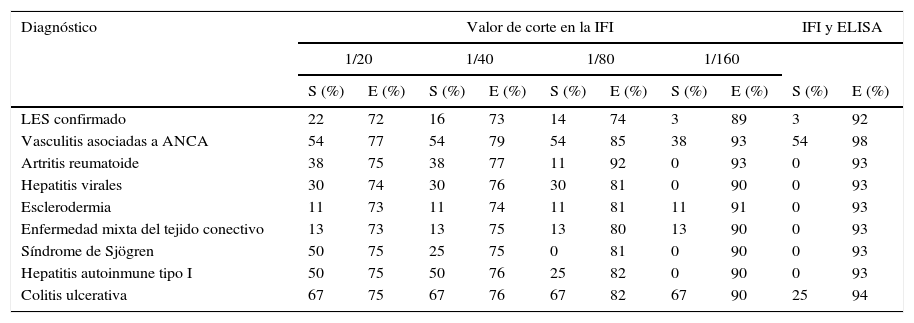
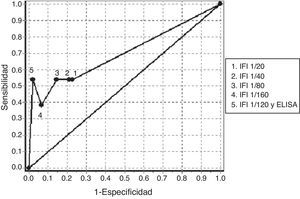
En la tabla 4 podemos observar los resultados de sensibilidad y especificidad a diferentes valores de corte obtenidos con la determinación de ANCA mediante IFI en el grupo de pacientes negativos de ANA. El ABC de las curvas ROC para la determinación de ANCA en el diagnóstico de las VAA fue 0,7016 (fig. 1). El mejor balance de sensibilidad y especificidad se obtuvo para los pacientes con diagnóstico de VAA utilizando con valor de corte 1/80. La utilización de la determinación de ANCA mediante IFI y la confirmación de especificidades anti-PR3 o anti-MPO mediante ELISA según el patrón de inmunofluorescencia, solamente mostró valor diagnóstico para este grupo de enfermedades.
Valores de sensibilidad y especificidad obtenidos a diferentes puntos de corte con la determinación de anticuerpos contra el citoplasma del neutrófilo en pacientes negativos de anticuerpos antinucleares
| Diagnóstico | Valor de corte en la IFI | IFI y ELISA | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1/20 | 1/40 | 1/80 | 1/160 | |||||||
| S (%) | E (%) | S (%) | E (%) | S (%) | E (%) | S (%) | E (%) | S (%) | E (%) | |
| LES confirmado | 22 | 72 | 16 | 73 | 14 | 74 | 3 | 89 | 3 | 92 |
| Vasculitis asociadas a ANCA | 54 | 77 | 54 | 79 | 54 | 85 | 38 | 93 | 54 | 98 |
| Artritis reumatoide | 38 | 75 | 38 | 77 | 11 | 92 | 0 | 93 | 0 | 93 |
| Hepatitis virales | 30 | 74 | 30 | 76 | 30 | 81 | 0 | 90 | 0 | 93 |
| Esclerodermia | 11 | 73 | 11 | 74 | 11 | 81 | 11 | 91 | 0 | 93 |
| Enfermedad mixta del tejido conectivo | 13 | 73 | 13 | 75 | 13 | 80 | 13 | 90 | 0 | 93 |
| Síndrome de Sjögren | 50 | 75 | 25 | 75 | 0 | 81 | 0 | 90 | 0 | 93 |
| Hepatitis autoinmune tipo I | 50 | 75 | 50 | 76 | 25 | 82 | 0 | 90 | 0 | 93 |
| Colitis ulcerativa | 67 | 75 | 67 | 76 | 67 | 82 | 67 | 90 | 25 | 94 |
ANCA: anticuerpos anticitoplasma del neutrófilo; E: especificidad; ELISA: ensayo de inmunoabsorción ligado a enzima; IFI: inmunofluorescencia indirecta; LES: lupus eritematoso sistémico; S: sensibilidad.
Curva ROC obtenida con la determinación de anticuerpos contra el citoplasma del neutrófilo mediante IFI a diferentes puntos de corte y con la confirmación de especificidades antigénicas mediante ELISA en los pacientes negativos de anticuerpos antinucleares.
ELISA: ensayo de inmunoabsorción ligado a enzima; IFI: inmunofluorescencia indirecta.
Los valores de anticuerpos anti-PR3 y anti-MPO no fueron superiores a 10 UI/mL en todos los casos positivos, no pudiéndose establecer comparaciones a diferentes puntos de corte.
DiscusiónLa mayoría de los pacientes incluidos en el estudio, negativos de ANA y positivos de ANCA, fueron del sexo femenino. Esto concuerda con la mayor incidencia de enfermedades autoinmunes en este sexo1.
La presencia de ANA fue observada en un gran número de los pacientes incluidos en el estudio, lo cual coincide con lo planteado en la literatura para este tipo de enfermedades (tabla 1)18. Es bien conocido que estos anticuerpos están en más del 95% de los pacientes con LES19.
Es importante destacar que la mayoría de los pacientes con LES e indicación de ANCA fueron negativos de ANA a un título de 1/80, aunque no son todos los pacientes con diagnóstico de LES, ya que un grupo grande de pacientes con este diagnóstico atendidos en esta institución no fueron incluidos en el estudio por no tener indicación de ANCA. Todos estos pacientes con LES considerados negativos de ANA presentaron estos anticuerpos a títulos inferiores a 1/80. Consideramos que en estudios posteriores se debe estudiar el valor de corte para la determinación de ANA en estos pacientes así como el buen empleo de los criterios diagnósticos para la remisión de pacientes al laboratorio de inmunología.
Los resultados obtenidos en los pacientes con ANA demuestran que la presencia de ANCA puede ser debida a la presencia de anticuerpos contra antígenos diferentes a PR3 y MPO, o a la interferencia de los ANA en la técnica de IFI. Hubiera sido de mucha utilidad en estos pacientes determinar la presencia de ANCA mediante ELISA contra otros antígenos además de PR3 y MPO.
Algunos autores combinan la técnica de IFI con neutrófilos fijados en etanol seguida de la técnica con los neutrófilos fijados en formalina, porque plantean que en esta última la fluorescencia tiende a desaparecer cuando la positividad en etanol se produce por interferencia del ANA o cuando existen antígenos diferentes a la MPO3,6,7.
La concordancia del ensayo de confirmación en formalina con respecto al ELISA de determinación de anticuerpos anti-MPO fue menor en los pacientes con presencia de ANA. Un grupo de estos pacientes con patrón pANCA fueron negativos de anticuerpos anti-MPO y, al confirmar estos patrones en láminas de formalina, se obtuvo un patrón cANCA en formalina. Esto demuestra que el ensayo en láminas de formalina no siempre permite identificar si la positividad de ANCA en etanol es debida a la presencia de anticuerpos contra la MPO.
Por otra parte, en un estudio realizado por Pollock et al., para evaluar la utilización del ensayo en láminas de formalina para confirmar el patrón pANCA en etanol, se demostró la limitación de esta técnica en comparación con la mayoría de los ELISA MPO6.
En nuestra opinión, ante la presencia de ANA, la determinación de ANCA mediante IFI en láminas de formalina no brinda mucha información.
Algunos autores solo definen el patrón pANCA en etanol que desaparece en formalina como positivo de ANCA para antígenos diferentes a la MPO, si la determinación de ANA es negativa20.
Los resultados obtenidos en el Laboratorio de Inmunología del CNGM muestran la gran cantidad de entidades clinicopatológicas con presencia de ANCA (tablas 2 y 3). Las enfermedades con mayor positividad de ANCA encontradas en este estudio coinciden en gran medida con enfermedades reportadas en la literatura: CU (60 a 80%), HAI tipo I (85 a 95%), LES (70%), AR sin ANA (20 a 30%), la esclerodermia, el síndrome de Sjögren, la polimiositis/dermatomiositis, la artritis crónica juvenil, la artritis reactiva, la colangitis esclerosante primaria y la glomerulonefritis rápidamente progresiva (GNRP) pauci-inmune7,9,20,21.
En los pacientes con LES y AR, la positividad del patrón atípico sin especificidad de anticuerpos contra MPO que observamos en nuestro estudio coincide con otros trabajos, donde se asocian patrones pANCA atípicos con especificidades antigénicas contra la lactoferrina7,10,22.
En nuestro estudio un grupo de pacientes con LES tuvieron patrón cANCA aunque en su mayoría sin anticuerpos anti-PR3 (tabla 2). En la literatura comúnmente no se asocia esta enfermedad con el patrón cANCA. Para futuros estudios sería de mucha utilidad la determinación en estos casos de diferentes especificidades antigénicas mediante ELISA.
En los pacientes con AR negativos de ANA, la mayor parte de los patrones obtenidos por IFI fueron pANCA sin anticuerpos anti-MPO (tabla 2). La literatura plantea la presencia de ANCA en la AR, generalmente un patrón pANCA atípico que se asocia a anticuerpos antilactoferrina, aunque también pudieran presentarse anticuerpos contra BPI que se asocian a un patrón cANCA3,10,22.
En los pacientes con HAI tipo I negativos de ANA se obtuvo un patrón pANCA (tabla 2). En la literatura se reporta la presencia de ANCA en estos pacientes20.
En los pacientes con CU se observó positividad de anticuerpos anti-PR3 y anti-MPO (tabla 2). Aunque no se han encontrado estudios en la literatura similares, algunos autores plantean la presencia de ANCA frente a PR3 debido a las respuestas policlonales de células B durante la inflamación sistémica asociada con autoinmunidad, malignidad y, en particular, con las infecciones23.
En los pacientes con síndrome de Sjögren observamos los patrones cANCA y pANCA (tabla 2). La presencia de ANCA se ha descrito en estos pacientes asociada a los patrones pANCA o atípico, habitualmente sin reactividad frente a la PR3 ni frente a la MPO. También se ha informado que pueden aparecer anticuerpos contra la catepsina G que se asocian a un patrón pANCA10.
El análisis de sensibilidad y especificidad obtenido para la determinación de ANCA mediante IFI, cuando se utiliza un valor de corte superior a 1/80, es similar al obtenido en otros estudios en pacientes con VAA. El resultado obtenido en la determinación por IFI seguida de la confirmación por ELISA también coincide con lo planteado en la literatura (tabla 4, fig. 1)4,5.
El hecho de que estos anticuerpos presentes en altos títulos en pacientes sin VAA cuando se determinan mediante IFI no sean reactivos a la PR3 y la MPO ratifica el uso del ELISA en conjunto con la técnica de IFI para establecer un mejor diagnóstico.
Se demostró que los ANCA pueden estar presentes en un amplio número de enfermedades asociadas a estados inflamatorios y autoinmunes además de las VAA, habitualmente sin reactividad frente a PR3 y MPO. Aunque el patrón pANCA fue el más observado en los pacientes sin VAA, es importante tener en cuenta la presencia del patrón cANCA, sobre todo en pacientes con LES en la población estudiada.
La determinación de ANCA mediante IFI mantiene su utilidad en los pacientes negativos de ANA, sobre todo cuando se obtienen títulos iguales o superiores a 1/80, seguida de la determinación de anticuerpos anti-PR3 y anti-MPO mediante ELISA. La utilidad del ensayo de IFI en láminas de formalina es inferior a la determinación de anticuerpos anti-MPO mediante ELISA cuando hay presencia de ANA.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.