El síndrome de pulmón encogido (SPE) y el derrame pleural (DP) son manifestaciones infrecuentes en el síndrome de Sjögren primario (SSp)1,2. Presentamos el caso de una paciente con estas manifestaciones como comienzo de SSp.
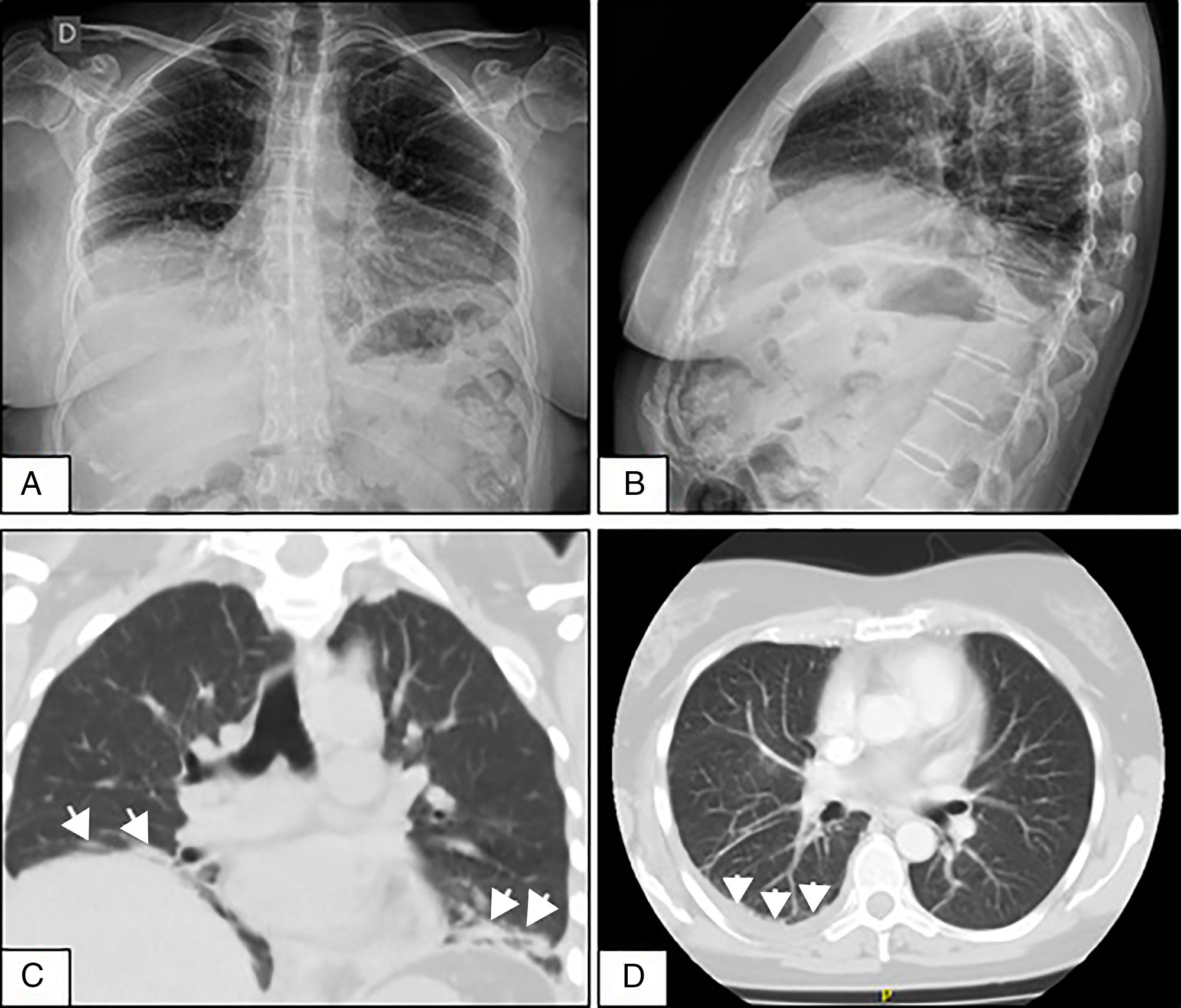
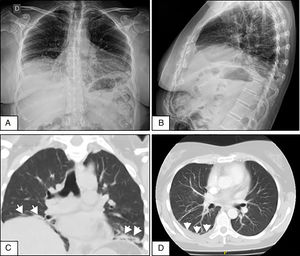
Mujer de 50 años que consultó por disnea de medianos esfuerzos de 4 semanas, dolor pleurítico derecho y síntomas constitucionales. Dos semanas previas a la admisión se le realizó radiografía de tórax en la que se evidenció DP leve, sin alteraciones en los volúmenes pulmonares. Se descartó proceso infeccioso y tumoral. Por persistencia de síntomas se repitió radiografía de tórax en la que se evidenció elevación de ambos hemidiafragmas y atelectasias laminares bibasales (figs. 1A y B). Se realizó tomografía y angiotomografía de tórax que confirmaron atelectasias, DP derecho, sin infiltrados ni embolia pulmonar (figs. 1C y D). En radioscopia (sniff test) se observó disminución en la excursión diafragmática bilateral. Se realizó toracocentesis, líquido compatible con exudado. Se objetivó restricción severa y disminución de presiones inspiratoria y espiratoria máximas. La difusión de monóxido de carbono se encontró disminuida. En el test de caminata de 6minutos mostró caída de 5 puntos en la saturación de oxígeno a los 2minutos. Inicialmente negó síntomas sicca. Se evidenció leucocitosis leve, eritrosedimentación elevada, hipergammaglobulinemia policlonal y serologías virales negativas. Se decidió iniciar prednisona 20mg/día hasta disponer de resultados inmunológicos. Los ANA-Hep2, anti-ENA, anti-Ro/SS-A, anti-La/SS-B, anti-ADN y crioglobulinas fueron negativos, complemento normal y factor reumatoide positivo a título bajo. Al mes manifestó xerostomía y xeroftalmia que persistieron por más de 3 meses. Cumplió 4 de 6 criterios clasificatorios americano-europeos 2002 para SSp (síntomas orales y oculares, test de Schirmer menor a 5mm a los 5minutos, puntuación de 6 en la escala de Bijsterveld en tinción con rosa de Bengala y biopsia de glándulas salivales menores con sialoadenitis linfocítica grado 4 de Chisholm y Mason)3. Se diagnosticó SPE en SSp con índice de actividad (ESSDAI)4 de 5. En su evolución presentó vasculitis cutánea linfocítica y polineuropatía sensitivomotora axonal. Cumplió tratamiento con azatioprina 150mg/día y prednisona 40mg/día, con respuesta incompleta y desarrollo de pancitopenia. Se rotó a micofenolato mofetil con respuesta hematológica y cutánea, pero deterioro neurológico y pulmonar (ESSDAI 15). Se administraron 2 dosis de 1g de rituximab cada 15 días y budesonide inhalado. Al mes ESSDAI de 7 y a los 3 meses mejoría de los síntomas respiratorios, normalización de test de caminata, restricción moderada en espirometría, ausencia de derrame pleural, pero persistencia de elevación diafragmática. El índice de daño acumulado de la enfermedad fue de 7 (Sjögren's Syndrome Disease Damage Index)5.
A y B. Radiografías de tórax de frente y perfil que evidencian elevación de ambos hemidiafragmas y atelectasias laminares bibasales. C. Corte coronal de tomografía de tórax sin contraste que demuestra elevación diafragmática y atelectasias subsegmentarias (flechas) en ambas bases pulmonares. D. Tomografía axial computarizada de tórax con contraste que muestra derrame pleural escaso en la base pulmonar derecha (flechas).
Las manifestaciones extraglandulares pueden ocurrir hasta en el 50% de los pacientes con SSp y solo un 11% presenta compromiso pulmonar4. La traqueítis, bronquitis y bronquiolitis, junto a las intersticiopatías (neumonía intersticial no específica, neumonía intersticial usual, neumonía intersticial linfocítica) constituyen las manifestaciones más frecuentes4,6.
El SPE es una manifestación excepcional en SSp1,7. Se han comunicado 2 casos previos en la literatura (tabla 1)1,8. Se caracteriza por volúmenes pulmonares disminuidos, elevación diafragmática, fisiología restrictiva y ausencia de afectación parenquimatosa1,7–9. Suele presentarse con disnea de esfuerzo, ortopnea y/o dolor pleurítico8,9. Se han postulado distintos mecanismos fisiopatogénicos para explicar la disfunción diafragmática: miositis, fibrosis, neuropatía frénica y/o intercostal o una combinación8,9. La radioscopia con sniff test y el ultrasonido pueden evidenciar el compromiso dinámico de la función diafragmática. En la radiografía y tomografía torácicas se puede evidenciar disminución de volúmenes pulmonares y atelectasias1,8–11. Se reportó baja mortalidad atribuible al SPE, pero provoca elevada morbilidad y mejoría funcional en solo el 20%9,10. No existe tratamiento estandarizado por su baja prevalencia1,7–11. Se informó buena respuesta a prednisona 30-40mg/día, en combinación con azatioprina o ciclofosfamida en casos graves7–11. Hay publicaciones de mejoría con rituximab en 2 pacientes con lupus y en una paciente con SSp1,7–9..Hay reportes de discreto beneficio con B2-agonistas y teofilina9.
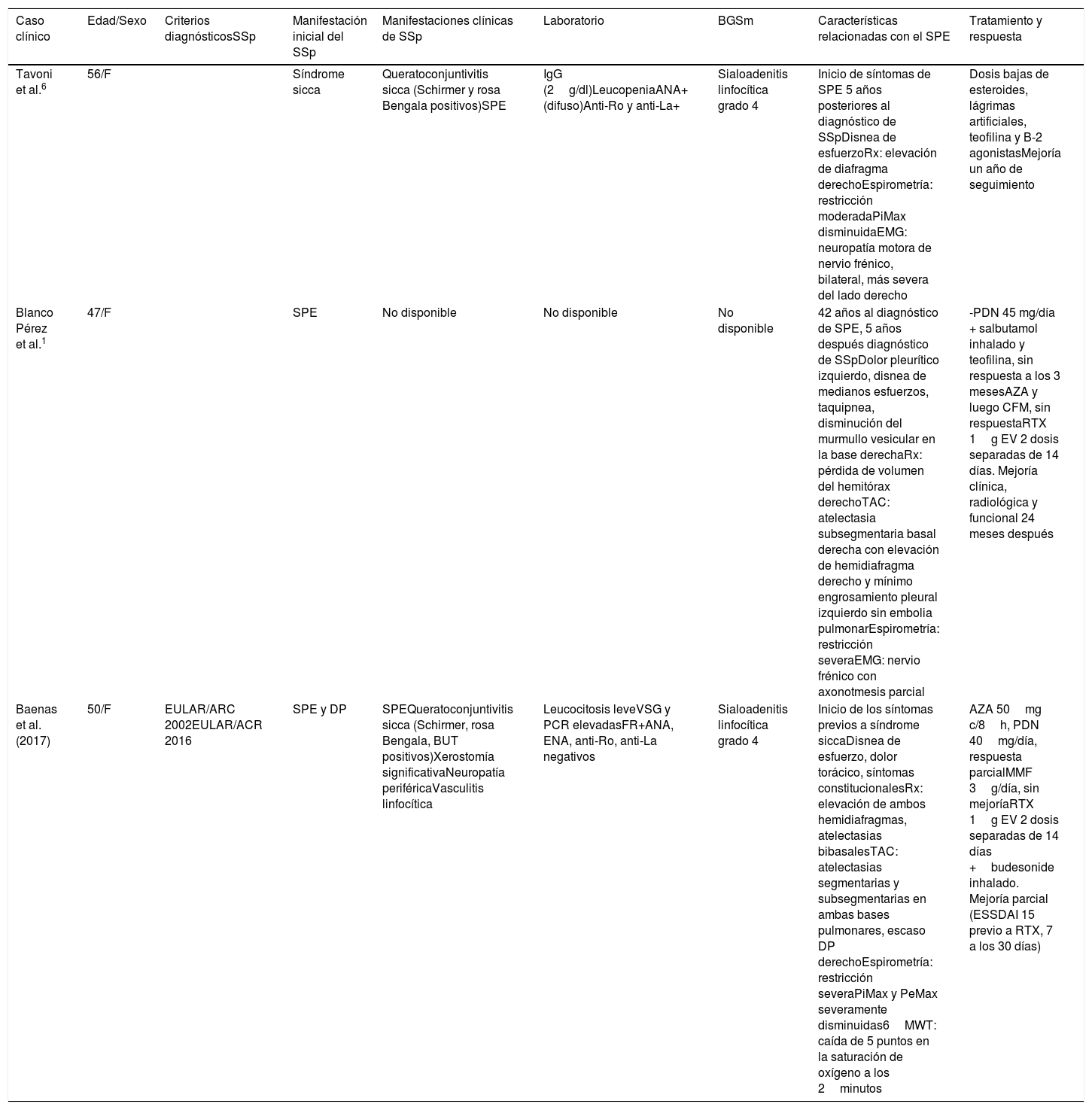
Características clínicas, funcionales e imagenológicas de los pacientes con síndrome de pulmón encogido asociado a síndrome de Sjögren
| Caso clínico | Edad/Sexo | Criterios diagnósticosSSp | Manifestación inicial del SSp | Manifestaciones clínicas de SSp | Laboratorio | BGSm | Características relacionadas con el SPE | Tratamiento y respuesta |
|---|---|---|---|---|---|---|---|---|
| Tavoni et al.6 | 56/F | Síndrome sicca | Queratoconjuntivitis sicca (Schirmer y rosa Bengala positivos)SPE | IgG (2g/dl)LeucopeniaANA+ (difuso)Anti-Ro y anti-La+ | Sialoadenitis linfocítica grado 4 | Inicio de síntomas de SPE 5 años posteriores al diagnóstico de SSpDisnea de esfuerzoRx: elevación de diafragma derechoEspirometría: restricción moderadaPiMax disminuidaEMG: neuropatía motora de nervio frénico, bilateral, más severa del lado derecho | Dosis bajas de esteroides, lágrimas artificiales, teofilina y B-2 agonistasMejoría un año de seguimiento | |
| Blanco Pérez et al.1 | 47/F | SPE | No disponible | No disponible | No disponible | 42 años al diagnóstico de SPE, 5 años después diagnóstico de SSpDolor pleurítico izquierdo, disnea de medianos esfuerzos, taquipnea, disminución del murmullo vesicular en la base derechaRx: pérdida de volumen del hemitórax derechoTAC: atelectasia subsegmentaria basal derecha con elevación de hemidiafragma derecho y mínimo engrosamiento pleural izquierdo sin embolia pulmonarEspirometría: restricción severaEMG: nervio frénico con axonotmesis parcial | -PDN 45 mg/día + salbutamol inhalado y teofilina, sin respuesta a los 3 mesesAZA y luego CFM, sin respuestaRTX 1g EV 2 dosis separadas de 14 días. Mejoría clínica, radiológica y funcional 24 meses después | |
| Baenas et al.(2017) | 50/F | EULAR/ARC 2002EULAR/ACR 2016 | SPE y DP | SPEQueratoconjuntivitis sicca (Schirmer, rosa Bengala, BUT positivos)Xerostomía significativaNeuropatía periféricaVasculitis linfocítica | Leucocitosis leveVSG y PCR elevadasFR+ANA, ENA, anti-Ro, anti-La negativos | Sialoadenitis linfocítica grado 4 | Inicio de los síntomas previos a síndrome siccaDisnea de esfuerzo, dolor torácico, síntomas constitucionalesRx: elevación de ambos hemidiafragmas, atelectasias bibasalesTAC: atelectasias segmentarias y subsegmentarias en ambas bases pulmonares, escaso DP derechoEspirometría: restricción severaPiMax y PeMax severamente disminuidas6MWT: caída de 5 puntos en la saturación de oxígeno a los 2minutos | AZA 50mg c/8h, PDN 40mg/día, respuesta parcialMMF 3g/día, sin mejoríaRTX 1g EV 2 dosis separadas de 14 días +budesonide inhalado. Mejoría parcial (ESSDAI 15 previo a RTX, 7 a los 30 días) |
ANA: anticuerpos antinucleares; AZA: azatioprina; BUT: break up time (tiempo de rotura de lágrima); BGSm: biopsia de glándulas salivales menores; CFM: ciclofosfamida; DP: derrame pleural; EMG: electromiograma; F: femenino; FR: factor reumatoideo; IgG: inmunoglobulina G; MMF: micofenolato mofetilo; 6MWT: test de caminata a los 6minutos; PDN: prednisona; PeMax: presión espiratoria máxima; PiMax: presión inspiratoria máxima; RTX: rituximab; Rx: radiografía; SPE: síndrome de pulmón encogido; SSp: síndrome de Sjögren primario; TAC: tomografía axial de tórax; VSG: velocidad de sedimentación globular.
El DP también es infrecuente en Sjögren (1-5,7%), y generalmente asociado a otra enfermedad autoinmune o insuficiencia cardíaca2. El DP asociado a SSp puede ser uni o bilateral, con menos de 11.000 células y exudados con predominio mononuclear2. Llamativamente en nuestra paciente se objetivó exudado a predominio polimorfonuclear. A pesar de que el DP puede asociarse a SPE nuestra paciente presentó DP previamente al SPE, por lo que asociamos este hallazgo con su enfermedad autoinmune. El DP asociado a SSp generalmente mejora con dosis bajas de glucocorticoides2.
A pesar de que el SPE y el DP son manifestaciones infrecuentes en SSp, deben ser tenidos en cuenta dentro de las manifestaciones extraglandulares de la enfermedad. Este caso ilustra también la posibilidad de que el SSp pueda presentarse con manifestaciones sistémicas antes de la aparición de la típica sintomatología del síndrome sicca.