Analizar el efecto de polimorfismos de nucleótido único (SNPs) de la metilen-tetrahidrofolatorreductasa (MTHFR; rs1801131 y rs1801133), el transportador de membrana que une ATP B1 (ABCB1; rs1045642), la aicartransformilasa/IMP ciclohidrolasa (ATIC; rs2372536) y la folilpoliglutamatosintetasa (FPGS; rs1544105) en la toxicidad hepática y medular de metotrexato (MTX).
Pacientes y métodosSe analizaron 1.415 visitas (732 con MTX, 683 sin MTX) de 350 pacientes del Princesa Early Arthritis Register Longytudinal study. El genotipo de los diferentes SNP se determinó mediante sondas TaqMan (Applied Biosystems). Se realizaron análisis multivariables mediante modelos lineales generalizados en los que las variables dependientes fueron los niveles séricos de transaminasa glutámico-pirúvica (toxicidad hepática), leucocitos, plaquetas o hemoglobina (toxicidad hematológica) y se ajustaron por variables clínicas (actividad de la enfermedad, etc.), analíticas (función renal, etc.), sociodemográficas (edad, sexo, etc.) y las variantes genéticas de MTHFR, ABCB1, ATIC y FPGS. También se analizaron las variables que influyeron en las dosis de MTX administradas a lo largo del seguimiento.
ResultadosCuando recibían MTX los portadores del genotipo CC del SNP rs1045642 de ABCB1 presentaron niveles significativamente mayores de GPT (7,1±2,0U/l; p<0,001). Los portadores de al menos un alelo G de rs1544105 en FPGS presentaron niveles significativamente menores de leucocitos (−0,67±0,32; 0,038), hemoglobina (−0,34±0,11g/dl; p=0,002) y de plaquetas (−11,8±4,7; p=0,012). La presencia del alelo G de rs1544105 (FPGS) y T de rs1801133 (MTHFR) se asoció, de forma aditiva y significativa, al uso de menores dosis de MTX.
DiscusiónNuestros datos sugieren que variantes genéticas de las enzimas FGPS y MTHFR, y del transportador ABCB1, podrían ayudar a detectar pacientes con mayor riesgo de toxicidad por MTX.
To analyze the effect of single nucleotide polymorphisms (SNPs) with well-known functional impact of methylenetetrahydrofolatereductase (MTHFR; rs1801131 and rs1801133), the membrane transporter ABCB1 (rs1045642), the AICAR transformylase/IMP cyclohydrolase (ATIC; rs2372536) and folyl-polyglutamatesynthetase (FPGS; rs1544105), on liver and bone marrow toxicity of methotrexate (MTX).
Patients and methodsWe analyzed 1415 visits from 350 patients of the PEARL (Princesa Early Arthritis Register Longitudinal) study: (732 with MTX, 683 without MTX). The different SNPs were genotyped using specific TaqMan probes (Applied Biosystems). Multivariate analyzes were performed using generalized linear models in which the dependent variables were the levels of serum alanine aminotransferase (liver toxicity), leukocytes, platelets or hemoglobin (hematologic toxicity) and adjusted for clinical variables (disease activity, etc.), analytical (renal function, etc.), sociodemographic (age, sex, etc.) and genetic variants of MTHFR, ABCB1, ATIC and FPGS. The effect of these variables on the MTX doses prescribed throughout follow-up was also analyzed through multivariate analysis nested by visit and patient.
ResultsWhen taking MTX, those patients carrying the CC genotype of rs1045642 in ABCB1 showed significantly higher GPT levels (7.1±2.0 U/L; P<.001). Carrying at least one G allele of rs1544105 in FPGS was associated with lower leukocyte (−0.67±0.32; 0.038), hemoglobin (−0.34±0.11g/dL; P=.002), and platelet (−11.8±4.7; P=.012) levels. The presence of the G allele of rs1544105 in FPGS, and the T allele of rs1801133 in MTHFR, was significantly associated with the use of lower doses of MTX.
DiscussionOur data suggest that genotyping functional variants in FGPS and MTHFR enzymes and the transporter ABCB1 could help to identify patients with increased risk of MTX toxicity.
El metotrexato (MTX) sigue siendo una piedra angular del tratamiento de la artritis reumatoide (AR), y las principales guías para el manejo de la enfermedad lo recomiendan como terapia de inicio y como soporte clave del tratamiento con terapias biológicas1–3. No es de extrañar que en un estudio observacional internacional reciente, COMORA (Comorbidities in RA), hasta el 89% de los pacientes reciben tratamiento con MTX o lo han recibido a lo largo de su enfermedad4. En España los estudios EMECAR (Estudio de Morbilidad y Expresión Clínica de la Artritis Reumatoide) o emARII, realizados en los últimos 10 años, revelan que MTX fue el fármaco inicial de elección en el 55% de los casos, y entre el 60% y el 64% recibía este fármaco modificador de la enfermedad, bien en monoterapia o en combinación5,6. A pesar de su amplio uso y una extensa investigación sobre este fármaco, el mecanismo de acción del MTX en la AR no está perfectamente establecido. Aunque el fármaco inhibe diferentes vías metabólicas relacionadas con el ácido fólico (fig. 1), los datos disponibles sugieren que los suplementos con ácido fólico repercuten más en la toxicidad del MTX que en su eficacia7. Así, se ha comprobado una gran susceptibilidad individual tanto en su efecto inmunomodulador como en su toxicidad, que obliga a la suspensión del tratamiento hasta en una cuarta parte de los pacientes8. Esto lleva a que, aun siendo el fármaco modificador de la enfermedad sintético con mayor supervivencia, menos del 55% de los pacientes lo mantienen más allá de 8 años9.
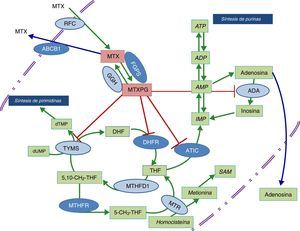
Esquema de las vías metabólicas en las que está implicado el ácido fólico y enzimas sobre las que actúa metotrexato.
Los óvalos de color azul oscuro indican las enzimas que han sido estudiadas. Las enzimas a las que llegan las líneas rojas se refieren a las que son inhibidas por los poliglutamatos de metotrexato.
ABCB1: transportador que une ATP B1; ADA: deaminasa de adenosina; ADP: bifosfato de adenosina; AMP: monofosfato de adenosina; ATIC: AICAR transformilasa/IMP ciclohidrolasa; ATP: trifosfato de adenosina; DHFR: dihidrofolato reductasa; FPGS: folilpoliglutamato sintetasa; GGH: gamma glutamil hidrolasa; IMP: monofosfato de inositol; MTHFD1: 5-10-metilentetrahidrofolato deshidrogenasa 1; MTHFR: metilentetrahidrofolato reductasa; MTR: metionina reductasa; MTX: metotrexato; MTXPG: poliglutamatos de metotrexato; RFC: transportador de folato reducido; SAM: s-adenosil-l-metionina; TYMS: timidilato sintetasa.
Dado que el tratamiento precoz en AR ha demostrado ser básico en la consecución de un óptimo control de la enfermedad, sería de gran utilidad disponer de biomarcadores que permitieran predecir qué individuos van a presentar toxicidad que impida alcanzar dosis terapéuticas plenas de MTX. El estudio de variantes genéticas en enzimas de las rutas metabólicas en las que participa el ácido fólico ha sido un tema de interés que ha llevado a la realización de múltiples estudios para tratar de predecir la respuesta o toxicidad a MTX, aunque la información obtenida hasta ahora, en pacientes con enfermedad reumática inflamatoria, no es concluyente10. El objetivo de este estudio es analizar el efecto de variantes genéticas en la metilen-tetrahidrofolatorreductasa (MTHFR; rs1801131 y rs1801133), el transportador de membrana que une ATP B1 (ABCB1; rs1045642), la aicartransformilasa/IMP ciclohidrolasa (ATIC;rs2372536) y la folilpoliglutamatosintetasa (FPGS; rs1544105), cuya función se ilustra en el esquema de la figura 1, en la toxicidad relacionada con el fármaco en pacientes con artritis de reciente comienzo (ARC) expuestos a MTX.
ABCB1 pertenece a la súper-familia ATP-binding cassette que se encarga del transporte hacia el exterior de la membrana citoplasmática de múltiples moléculas, entre ellas los citotóxicos. En concreto, el SNP rs1045642 consiste en un cambio de una C por T en el exón 26 del gen del trasportador ABCB111. Esta sustitución provoca inestabilidad del mARN y se ha asociado a una disminución de la expresión y, por tanto, de la función de ABCB1, acompañándose de mayores niveles tisulares de diversos fármacos11. En el caso de MTHFR, el SNP rs1801133 supone un cambio de una C por T en el exón 4, que conlleva el cambio de una alanina por valina en la posición 222 de la proteína, mientras que el SNP rs1801131 supone el cambio de A por C en el exón 7, provocando el cambio de un glutámico por alanina en la posición 429 de la proteína. En ambos casos esto supone una mayor termolabilidad de la enzima y menor actividad funcional. Respecto a rs1544105 es un cambio de G por A en la región promotora del gen de FPGS que se ha relacionado con menores niveles de mARN de esta enzima12. El SNP rs2372536 en ATIC supone un cambio de C por G en el exón 5, que conlleva el cambio de una treonina por serina en la posición 116 de la proteína13. Esta información previa sobre la repercusión funcional de estas variantes genéticas llevó a su selección para el presente estudio que se planificó en 2008.
Pacientes y métodosPacientesSe han utilizado los datos del estudio Princesa Early Arthritis Register Longitudinal Study (PEARL), en el que se reclutan pacientes que presentan una o más articulaciones inflamadas durante al menos 4 semanas y una evolución menor de un año. El registro comenzó en septiembre de 2001 y continúa en la actualidad. El protocolo del estudio fue revisado y aprobado por el Comité de Ética de la Investigación Clínica del Hospital Universitario La Princesa, y todos los pacientes participantes firman un consentimiento informado en el momento de su inclusión en el registro.
De todos los individuos incluidos en la base de datos se han utilizado aquellos que, a los 2 años de seguimiento, cumplen criterios de AR ACR 198714, y aquellos considerados artritis indiferenciada (AI)15 tras excluirse otras causas de artropatía inflamatoria, como artritis microcristalinas, artritis sépticas, espondiloartritis y otras enfermedades del tejido conectivo. La fecha de corte para el análisis de los datos fue septiembre de 2014.
MétodosEn PEARL se recogen de forma protocolizada datos demográficos y clínicos que incluyen el recuento de 28 articulaciones dolorosas y tumefactas, la valoración global de la enfermedad por parte del médico y del paciente mediante escala analógica visual y la versión española del cuestionario HAQ para la evaluación del estado de salud16. También se recogen datos analíticos como las cifras de leucocitos, hemoglobina (Hb), plaquetas y de la transaminasa glutámico-pirúvica (GPT), realizados según la técnica habitual en los servicios de hematología y bioquímica de nuestro centro, la velocidad de sedimentación glomerular (determinada por método de Westergren), la proteína C reactiva ([PCR] determinada por nefelometría), el factor reumatoide (determinado por nefelometría, positivo si >20U/ml), los anticuerpos antipéptido cíclico citrulinado (determinado por ELISA, Euro-Diagnostica Immunoscan RA; positivo >50IU/ml), así como el tratamiento recibido en cada visita (tabla 1 del anexo 1 [disponible on line]). La actividad de la enfermedad se estima mediante el DAS2817.
La extracción de ADN se realizó, en todos los pacientes del estudio, mediante procedimientos estándar (QIAamp DNA Blood Mini Kit, Qiagen). Se estudiaron los SNPs rs1801131 y rs1801133 de la MTHFR, rs1045642 del transportador de membrana ABCB1, rs2372536 de la ATIC y rs1544105 de la FPGS, mediante los kits de sondas TaqMan C___1202883_20, C____850486_20, C___7586657_20, C__16218146_10 y C___8342611_10 respectivamente (Applied Biosystems, Foster City, California, EE. UU.). Las muestras se genotiparon mediante PCR en tiempo real en un termociclador StepOne Plus Real-Time PCR (Applied Biosystems) siguiendo las instrucciones del fabricante. La asignación del genotipo se realizó con el software SDS (version 2.3, Applied Biosystems). Se incluyeron muestras duplicadas y controles negativos para comprobar la precisión del genotipado. Se estimó una precisión mayor del 99%.
Análisis estadísticoCon el fin de excluir consideraciones subjetivas, tanto del médico como del paciente, se restringió el estudio de la toxicidad de MTX a su efecto sobre variables analíticas que se usan rutinariamente para evaluar la toxicidad hepática y medular de MTX: GPT, leucocitos, plaquetas y Hb. Para cada una de ellas se estudió la asociación con diferentes variables sociodemográficas, clínicas, de la enfermedad y genéticas. Posteriormente, para cada una de las 4 variables dependientes se llevó a cabo un análisis multivariable mediante modelos lineales generalizados usando el comando «glm» de Stata12 (StataCorp, College Station, TX, EE. UU.) en las visitas en las que los pacientes estaban tomando MTX. Es decir, que se analizó qué ocurría en cada una de las visitas en las que el paciente había recibido MTX. De promedio se analizaron 2,8 visitas por paciente. El ajuste de los modelos multivariables se realizó incluyendo inicialmente todas aquellas variables con niveles de significación p<0,15 en el análisis bivariable y, posteriormente, se fueron excluyendo todas aquellas variables con p>0,15 o, en el caso de las variables categóricas, aquellas en las que todas sus categorías tuviesen p>0,15. Una vez establecido el mejor modelo multivariable para cada variable de desenlace de toxicidad, con las visitas en las que los pacientes recibieron MTX, ese mismo modelo se repitió en las visitas sin MTX. Dado que se han realizado comparaciones múltiples (GPT, Hb, leucocitos y plaquetas) se ajustó la significación estadística mediante el método de Bonferroni, estableciéndose en p<0,0125. Se realizó un análisis de sensibilidad usando modelos lineales generalizados anidados por paciente y visita con el comando xtgee de Stata, que proporcionó resultados muy similares (datos no mostrados).
Por otra parte, se realizó un análisis multivariable para determinar las variables que se asociaron con la dosis de MTX recibida en cada visita del seguimiento, usando el comando xtgee de Stata. El modelo se ajustó con la opción de correlación autorregresiva de primer nivel, de forma que solo se considerasen aquellas visitas de pacientes en los que se había recibido MTX durante al menos un año (2 visitas consecutivas), de forma que se hubiese podido alcanzar la máxima dosis tolerable. En este caso se estudiaron un promedio de 3,2 visitas por paciente. La obtención del modelo más ajustado se realizó como se ha descrito previamente. Además, una vez determinadas qué variantes genéticas eran relevantes en el análisis, se optó por un modelo aditivo de las mismas por ser el que mejor explicaba su contribución a las dosis de MTX utilizadas. En este análisis se estableció el nivel de significación en p<0,05.
ResultadosPacientesSe estudiaron un total de 350 pacientes: 248 con el diagnóstico de AR y 102 con el de AI. Los datos descriptivos basales se muestran en la tabla 1. Los pacientes que cumplieron criterios de AR presentaron de forma significativa mayor frecuencia de FR y anti-PCC, mayor nivel de DAS28 y HAQ, mayor número de plaquetas y mayores cifras de PCR, en comparación con aquellos diagnosticados de AI (tabla 1). Respecto al tratamiento 223 pacientes recibieron MTX en el grupo de AR (89%) y 43 en el grupo de AI (43%), con un total de 732 visitas en las que los pacientes recibieron este fármaco (tabla 1 del anexo 1 [disponible on line]).
Características basales de los pacientes
| AR n=248 | AI n=102 | Total n=350 | p* | |
|---|---|---|---|---|
| Sexo femenino n (%) | 201 (81,0) | 76 (74,5) | 277 (79,1) | 0,174 |
| Edad al inicio de la enfermedad (años; mediana [p25-p75]) | 54 (45-68) | 54 (39-66) | 54 (43-67) | 0,351 |
| FR positivo n (%) | 164 (66,1) | 17 (16,6) | 181 (51,7) | <0,001 |
| ACPA positivo n (%) | 152 (61,3) | 15 (14,7) | 167 (47,7) | <0,001 |
| DAS 28 (mediana [p25-p75]) | 4,8 (3,6-5,9) | 3,9 (3,0-4,8) | 4,5 (3,4-5,6) | <0,001 |
| PCR (mediana [p25-p75]) | 0,8 (0,3-1,8) | 0,5 (0,2-1,1) | 0,7 (0,2-1,6) | 0,006 |
| HAQ (mediana [p25-p75]) | 1,125 (0,5-1,75) | 0,75 (0,375-1,375) | 1 (0,5-1,625) | 0,003 |
| Leucocitos/mm3 (mediana [p25-p75]) | 7.400 (6.220-9.090) | 7.460 (6.030-9.480) | 7.420 (6.200-9.160) | 0,899 |
| GPT (U/ml) (mediana [p25-p75]) | 17 (13-23) | 19 (14-25) | 17 (13-23) | 0,038 |
| Plaquetas×1.000/mm3 (mediana [p25-p75]) | 281 (241-344) | 260 (203-301) | 275 (229-329) | <0,001 |
| Creatinina (mediana [p25-p75]) | 0,80 (0,70–0,95) | 0,80 (0,70-0,91) | 0,80 (0,70-0,95) | 0,949 |
| MTHFR (rs1801131) CC/CA/AA (% pacientes) | 8,3/35,9/55,8 | 6,2/43,3/50,5 | 7,7/38,5/54,3 | 0,422 |
| MTHFR (rs1801133) CC/CT/TT (% pacientes) | 39,7/45,6/14,8 | 32,6/43,9/23,5 | 37,6/45,1/17,3 | 0,137 |
| ABCB1 (rs1045642) TT/TC/CC (% pacientes) | 19,7/46,5/33,7 | 10,2/55,1/34,7 | 17,0/50,0/34,0 | 0,090 |
| ATIC (rs2372536) CC/CG/GG (% pacientes) | 39,9/48,5/11,6 | 49,5/35,0/15,4 | 42,7/44,6/12,7 | 0,080 |
| FPGS (rs1544105) GG/GA/AA (% pacientes) | 37,2/43,4/19,4 | 35,7/44,9/19,4 | 36,7/43,8/19,4 | 0,962 |
ABCB1: ATP-binding cassette B1; ACPA: anticuerpos anti péptido citrulinado; AI: artritis indiferenciada; AR: artritis reumatoide; ATIC: aicar transformilasa/IMP ciclohidrolasa.FPGS: folilpoliglutamato sintetasa; FR: factor reumatoide; GPT: transaminasa glutámico-pirúvica; HAQ: Health Assesment Questionnaire; MTHFR: metilén-tetrahidrofolatorreductasa; PCR: proteína C reactiva.
*Se consideró significación estadística si p<0,05.
En el análisis multivariable se observó que en las visitas en las que los pacientes recibían MTX, la edad, el sexo, el estado civil soltero y el índice de masa corporal mostraron una tendencia a menores niveles de GPT en las 2 primeras variables y a mayores niveles en las 2 restantes (tabla 2). Ajustando por estas variables de confusión, se comprobó que los pacientes homocigotos para el alelo C de la variante rs1045642 del transportador ABCB1 presentaban significativamente mayores niveles de GPT que aquellos portadores de, al menos, un alelo T (genotipos TT o CT [tabla 2]). Además se observó una tendencia, que no alcanzó la significación estadística, hacia que los pacientes portadores de, al menos, un alelo T del SNP rs1801133 de la MTHFR tuvieran mayores niveles de GPT (tabla 2). El resto de variantes genéticas no influyeron de forma significativa.
Análisis multivariable del efecto de diferentes variables sobre los niveles de la transaminasa glutámico-pirúvica en pacientes con artritis de inicio
| Variables | Visitas con MTX (n=607) | Visitas sin MTX (n=551) | ||
|---|---|---|---|---|
| Coef.±e.e. | p | Coef.±e.e. | p* | |
| Edad (años) | ||||
| <45 | Ref. | – | Ref. | – |
| 45-65 | 2,0±2,5 | 0,413 | 2,7±1,6 | 0,087 |
| >65 | −7,1±3,0 | 0,017 | −2,4±1,8 | 0,187 |
| Sexo | ||||
| Hombre | Ref. | – | Ref. | – |
| Mujer | −4,9±2,7 | 0,064 | −1,8±1,5 | 0,244 |
| E. civil | ||||
| Casado | Ref. | – | Ref. | – |
| Separado | 5,3±3,9 | 0,173 | 4,3±2,2 | 0,054 |
| Soltero | 5,9±2,5 | 0,018 | 1,0±1,6 | 0,537 |
| Viudo | 3,2±3,3 | 0,314 | −0,6±2,4 | 0,812 |
| IMC (kg/m2) | 0,5±0,2 | 0,023 | 0,25±0,14 | 0,072 |
| MTHFR (rs1801131) | ||||
| CC/CA/AA | N.I. | – | N.I. | – |
| MTHFR (rs1801133) | ||||
| CC | Ref. | – | Ref. | – |
| CT/TT | 3,2±2,0 | 0,108 | −0,3±1,3 | 0,818 |
| ABCB1 (rs1045642) | ||||
| TT/TC | Ref. | – | Ref. | – |
| CC | 7,1±2,0 | <0,001 | −0,3±1,4 | 0,845 |
| ATIC (rs2372536) | ||||
| CC/CG/GG | N.I. | – | N.I. | – |
| FPGS (rs1544105) | ||||
| GG/GA/AA | N.I. | – | N.I. | – |
ABCB1: ATP-binding cassette B1; ATIC: aicar transformilasa/IMP ciclohidrolasa; DAS28: Disease activity score de 28 articulaciones; FPGS: folilpoliglutamato sintetasa; GPT: transaminasa glutámico-pirúvica; IMC: índice de masa corporal; MTHFR: metilén-tetrahidrofolatorreductasa; MTX: metotrexato; N.I.: no incluido; n.s.: no significativo; Ref.: referencia.
*Se consideró significación estadística si p<0,0125 (véase la sección de Estadística para justificación).
En las visitas en las que los pacientes no recibían MTX solo el estado civil soltero y el índice de masa corporal mostraron una tendencia a mayores niveles de GPT (tabla 2).
Toxicidad hematológicaComo variables dependientes para el estudio de la toxicidad hematológica se utilizaron la hemoglobina, los leucocitos y la cifra de plaquetas.
LeucocitosTanto en el análisis de las visitas en las que los pacientes recibieron MTX (tabla 3), como en el realizado con las visitas en las que los pacientes no recibían MTX (tabla 2 del anexo 1 [disponible on line]), se observó que los fumadores activos, los varones, los pacientes de edad avanzada y el tratamiento con glucocorticoides se asociaron de forma significativa a mayores cifras de leucocitos. Ajustando por estas variables, en las visitas en las que los pacientes recibían tratamiento con MTX, se observó que ser portador de, al menos, un alelo G del SNP rs1544105 de la FPGS se asoció con una tendencia no significativa a cifras menores de leucocitos (tabla 3), mientras que esta tendencia desaparecía en el análisis de las visitas sin MTX (tabla 2 del anexo 1 [disponible on line]).
Análisis multivariable del efecto de diferentes factores sobre los niveles variables hematológicos en las visitas en las que pacientes con artritis de inicio se encuentran en tratamiento con metotrexato
| Leucocitos (×1.000/mm3) | Hemoglobina (g/dl) | Plaquetas (×1.000/mm3) | ||||
|---|---|---|---|---|---|---|
| N=673 visitas | N=588 visitas | N=659 visitas | ||||
| Coef.±e.e. | p | Coef.±e.e. | p | Coef.±e.e. | p* | |
| Edad (años) | ||||||
| <45 | Ref. | – | Ref. | – | Ref. | – |
| 45-65 | 0,14±0,31 | 0,641 | 0,26±0,10 | 0,011 | −2,9±5,7 | 0,609 |
| >65 | 0,79±0,34 | 0,021 | −0,01±0,11 | 0,922 | −19,7±6,1 | 0,001 |
| Sexo | ||||||
| Masculino | Ref. | – | Ref. | – | Ref. | – |
| Femenino | −1,5±0,33 | <0,001 | −1,1±0,11 | <0,001 | 17,6±6,2 | 0,004 |
| Tabaco | ||||||
| Nunca | Ref. | – | Ref. | – | N.I. | – |
| Ex-fumador | 0,29±0,34 | 0,390 | 0,34±0,12 | 0,003 | ||
| Actual | 1,06±0,32 | 0,001 | 0,42±0,11 | <0,001 | ||
| DAS28 | N.I. | – | −0,28±0,04 | <0,001 | 7,2±2,1 | <0,001 |
| Corticoides (mg) | 0,21±0,04 | <0,001 | N.I. | – | N.I. | – |
| MTHFR (rs1801131) | ||||||
| CC | N.I. | – | Ref. | – | N.I. | |
| CA/AA | −0,32±0,17 | 0,063 | – | |||
| MTHFR (rs1801133) | ||||||
| CC | N.I. | – | Ref. | – | N.I. | |
| CT/TT | −0,20±0,10 | 0,043 | – | |||
| ABCB1 (rs1045642) | ||||||
| TT/TC | ||||||
| CC | N.I. | – | N.I. | – | N.I. | – |
| ATIC (rs2372536) | ||||||
| CC/CG/GG | N.I. | – | N.I. | – | N.I. | – |
| FPGS (rs1544105) | ||||||
| AA | Ref. | – | Ref. | – | Ref. | – |
| GG/GA | −0,67±0,′32 | 0,038 | −0,34±0,11 | 0,002 | −11,8±4,7 | 0,012 |
ABCB1: ATP-binding cassette B1; ATIC: aicar transformilasa/IMP ciclohidrolasa; DAS28: Disease activity score de 28 articulaciones; FPGS: folilpoliglutamato sintetasa; GPT: transaminasa glutámico-pirúvica; IMC: índice de masa corporal; MTHFR: metilén-tetrahidrofolatorreductasa; MTX: metotrexato; N.I.: no incluido; n.s.: no significativo; Ref.: referencia.;
*Se consideró significación estadística si p<0,0125 (véase la sección de Estadística para justificación).
Los varones, fumadores activos y pacientes con menor estado de actividad de la artritis, presentaban niveles significativamente mayores de Hb, tanto en el análisis de visitas en las que los pacientes recibían MTX (tabla 3), como en aquellas en las que no lo tomaban (tabla 2 del anexo 1 [disponible on line]). Ajustando por estas variables, de nuevo se observó que los portadores de, al menos, un alelo G del SNP rs1544105 de la FPGS presentaron cifras significativamente menores de Hb (tabla 3). Además, aquellos individuos portadores de un alelo A de la MTHFR rs1801131 o uno T de la rs1801133, presentaron una tendencia que no alcanza la significación estadística hacia tener menores niveles de Hb (tabla 3). En los 3 SNP la asociación solo se detectó en las visitas en las que los pacientes tomaban MTX, mientras que no se encontró asociación significativa entre las diferentes variables genéticas y los niveles de Hb en las visitas en las que no tomaban MTX (tabla 2 del anexo 1 [disponible on line]).
PlaquetasLos pacientes con mayor actividad y de género femenino presentaron cifras más elevadas de plaquetas, aunque estas variables solo alcanzaron significación estadística en las visitas en las que los enfermos no recibían MTX (tabla 3). Ajustando por estas variables, la presencia del alelo G de la FPGS se asoció de forma significativa con un menor número de plaquetas tanto en las visitas con MTX como sin MTX (tabla 3).
Factores que influyen en las dosis de metotrexatoDado que el efecto observado de las variantes genéticas de la MTHFR, el ABCB1 y la FPGS no fue de una magnitud elevada, nos planteamos si esta situación podría estar relacionada con una modulación de la dosis de MTX por parte de los médicos prescriptores ante la presencia factores de riesgo ya reconocidos de toxicidad por MTX, o la constatación de datos de toxicidad en visitas intermedias no recogidas en el registro. Por ello se realizó un análisis multivariable en el cual se estudió la influencia de las variables genéticas de estas enzimas en la dosis empleada de MTX en cada visita.
Como era de esperar, los mayores de 65 años recibieron significativamente menores dosis de MTX, mientras que la presencia de anticuerpos antipéptido cíclico citrulinado y el sexo femenino se asociaron a una tendencia al uso de dosis más elevadas (tabla 4). Ajustando por estas variables de confusión se observó que existe una interacción del efecto de las variantes rs1801133 de la MTHFR y de la rs1544105 de la FPGS sobre la dosis prescrita de fármaco. Así, comparando con ser homocigotos de los alelos comunes de dichas variantes, se observó que la dosis de MTX disminuía de forma progresiva cuantos más alelos menores de dichas proteínas portaba el paciente (tabla 4).
Análisis multivariable de los factores que influyen en la dosis de metotrexato administrada a pacientes (n=208) con artritis de reciente comienzo
| Dosis MTX (mg/sem) | ||
|---|---|---|
| N=636 visitas | ||
| Coef.±e.e. | p* | |
| Edad (años) | ||
| <45 | Ref. | – |
| 45-65 | −0,17±0,54 | 0,753 |
| >65 | −2,05±0,61 | 0,001 |
| Sexo | ||
| Masculino | Ref. | – |
| Femenino | 1,17±0,60 | 0,051 |
| ACPA | ||
| Negativo | Ref. | – |
| Positivo | 0,86±0,4 | 0,060 |
| MTHFRa+FPGSb | ||
| CC AA (n=24) | Ref. | – |
| CC GA (n=38) | −1,28±0,84 | 0,131 |
| CC GG (n=19) | −2,03±0,98 | 0,040 |
| CT/TT AA (n=46) | −1,89±0,76 | 0,014 |
| CT/TT GA (n=57) | −1,71±0,77 | 0,026 |
| CT/TT GG (n=24) | −2,87±0,92 | 0,002 |
ACPA: anticuerpos anti-proteínas citrulinadas; Coef: coeficiente; e.e.: error estándar; MTX: metotrexato; n: número de pacientes; n.s.: no significativo; Ref.: referencia.
Nuestros datos sugieren que variantes genéticas funcionales de las proteínas ABCB1, FPGS y MTHFR se asocian a la presencia de mayor toxicidad y uso de menores dosis de MTX en pacientes con ARC. Estos datos son congruentes con la literatura previa, especialmente en el caso de la MTHFR, donde se dispone de mayor evidencia en el campo de la reumatología18,19, incluida la población española20–22. En pacientes con enfermedades inflamatorias reumatológicas el papel de ABCB1 y la FPGS ha sido menos estudiado, y se han enfocado principalmente a la eficacia de MTX y menos a la toxicidad10.
Un aspecto llamativo de nuestros resultados es el efecto diferencial en las variantes genéticas estudiadas, afectando principalmente a la toxicidad hepática los SNP rs1045642 del trasportador ABCB1 y rs1801133 de MTHFR, mientras que el SNPrs1544105 de la FPGS se ha asociado con la toxicidad hematológica. No hay estudios previos que investiguen la toxicidad diferencial de estas variantes genéticas en el campo de la reumatología, pues la mayoría de los estudios citados se han basado en variables dicotómicas de suspensión del fármaco por toxicidad, sin especificar la causa18–22.
En el caso de ABCB1, las células de los pacientes portadores del alelo menor de rs1045642 tendrían dificultad para eliminar el MTX y, consecuentemente, una mayor biodisponibilidad que podría explicar la mayor toxicidad observada. Es más, nuestros datos confirman el estudio de Gregers et al., que describieron una mayor toxicidad hepática en niños con leucemia linfoblástica aguda tratados con MTX cuando eran portadores homocigotos del genotipo CC de rs1045642 en ABCB1 frente a los portadores de los genotipos CT o TT23.
En el caso del SNP rs1801133 de MTHFR, la presencia del alelo infrecuente T se asocia con menor actividad funcional, que se estima en un 30% para los homocigotos TT y un 70% para los heterocigotos CT24. Además, esta variante genética se ha asociado a un aumento de los niveles de homocisteína y el correspondiente aumento del riesgo cardiovascular25. El aumento de homocisteína en pacientes con niveles bajos de actividad de la MTHFR se debe a que para que se catalice el paso de homocisteína a metionina se precisa 5-CH3-THF, que es generado a partir del 5-10-CH2-THF por la MTHFR (fig. 1). La relación con la toxicidad hepática vendría dada porque estos pacientes tendrían una menor producción de metionina y también de S-adenosil-metionina (fig. 1), que es de gran importancia en el metabolismo hepático26. Aunque nuestros datos solo han mostrado una tendencia a mayores niveles de GPT en los portadores de los genotipos CT y TT de rs1801133, estos datos están en concordancia con estudios previos que asocian esos genotipos con elevación de transaminasas27,28.
En lo que respecta a FGPS, como ya se ha mencionado, el alelo infrecuente A de rs1544105 se ha asociado a menores niveles de la enzima12 y diferencias en la eficacia de MTX, tanto en leucemias como en AR29. En relación con nuestros datos, la presencia del alelo ancestral G es la que se asocia con mayor toxicidad hematológica y requerimientos de menor dosis de MTX. Probablemente se relacione con una mayor eficacia en la poliglutamación del MTX y una mayor actividad de este sobre las vías de síntesis de purinas y pirimidinas (fig. 1), y por ello mayor toxicidad en las 3 series hematológicas.
La principal limitación de este estudio reside en que se ha realizado en una sola población de pacientes con ARC, y las prácticas locales en el uso de MTX pueden haber sesgado los resultados. Así, el médico prescriptor podría decidir no iniciar el fármaco en pacientes con un perfil que les predisponga a presentar toxicidad a priori, como son ancianos o pacientes con alcoholismo o hepatopatía previa, lo que podría infravalorar el efecto observado. Sin embargo, el hecho de que se hayan reproducido factores asociados a mayor toxicidad de MTX, como la obesidad para toxicidad hepática30, o que la asociación de los factores genéticos con alteraciones en las cifras de GPT, Hb, leucocitos o plaquetas aparezcan en las visitas en las que reciben los pacientes MTX, pero no en aquellas en las que no lo están tomando, confiere credibilidad al acercamiento propuesto en nuestro artículo.
También como limitación, resulta intrigante desconocer la razón por la que variantes genéticas de proteínas como ABCB1 y FPGS, que actúan en niveles comunes del manejo de MTX y ácido fólico, presentan repercusión diferente en cuanto a la toxicidad de MTX, hepática en la primera y hematológica en la segunda. Finalmente, debido a la organización en la recogida de muestras de PEARL, no se han podido determinar niveles de poliglutamatos de MTX intraeritrocitarios que podrían haber contribuido a un mejor conocimiento del efecto del SNP estudiado en FPGS.
Por último, la relevancia clínica del efecto observado puede ser menor del deseado, pues las variantes de ABCB1 y FPGS, que hemos observado asociadas a toxicidad de MTX, también se han relacionado con una mayor eficacia del fármaco10. No obstante, la combinación de genotipos que más podría limitar la dosis usada de MTX según nuestro estudio, ser homocigoto G de rs1544105 en FPGS y genotipos CT o TT de rs1801133 en MTHFR, ocurre en un 22% de los pacientes de nuestra población. En definitiva, el porcentaje de población que comparte los SNP que hemos estudiado no es desdeñable, y es posible que la determinación de variantes genéticas en ABCB1, MTHFR y FPGS pudieran ser de ayuda para determinar en qué pacientes con ARC debería usarse una dosis menor de MTX o sustituirlo por otros fármacos modificadores de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio ha sido realizado gracias a fondos de los proyectos RD12/0009/0017, PI11/00551, PI14/00442 y PIE13/00041 del Ministerio de Economía y Competitividad (Instituto de Salud Carlos III), cofinanciados por el Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesIG-A ha recibido en los últimos 5 años financiación para proyectos de investigación de BMS, Roche y UCB, así como pagos por asesoría y presentaciones científicas por parte de Abbvie, BMS, Lilly, Pfizer, Roche y UCB. IG-A y AMO son coinventores de la patente Prognostic method for autoimmune disorders through genotyping vasoactive intestinal peptide variants código PCT/ES2015/070182.
LS, AL, EG-L y PM-F declaran no tener conflicto de intereses en relación con este trabajo.
Agradecemos a todos los pacientes de PEARL su entusiasta y deseinteresada participación en el estudio. También queremos reconocer la colaboración de nuestra enfermera, Teresa Velasco, por su intensa implicación en la consulta de artritis de inicio, y la excelente labor técnica de Vanessa Centeno.