Introducción
Las espondiloartritis (EsP) constituyen un conjunto de enfermedades reumáticas que comparten diversas características inmunogenéticas, clínicas, radiológicas y evolutivas1. Se incluyen en este grupo la espondilitis anquilosante (EA), las artritis reactivas, la artritis psoriásica (APs), la artritis asociada a las enfermedades inflamatorias intestinales (enfermedad de Crohn y colitis ulcerosa), un subgrupo de la artritis crónica juvenil y pacientes con rasgos clínicos de espondiloartritis que cumplen los criterios del Grupo Europeo para el Estudio de las Espondiloartritis (ESSG)2 y/o los de Amor et al3, pero que no reúnen criterios de una entidad delimitada y se incluyen en el término de espondiloartritis indiferenciada; muchos de estos pacientes acabarán evolucionando hacia una espondiloartritis definida.
La prevalencia de las espondiloartritis en su conjunto es igual o incluso superior a la de la artritis reumatoide, con marcadas diferencias según la raza y el ámbito geográfico estudiados4,5. Muchos de los pacientes con EsP desarrollan una enfermedad discapacitante con deformidades articulares y/o anquilosis y deterioro de la calidad de vida a pesar del tratamiento6.
El tratamiento de la EA se basa fundamentalmente en el uso de fármacos antiinflamatorios no esteroideos (AINE) y terapia física, con una eficacia demostrada sobre todo en el control de los síntomas vertebrales7. Hay poca evidencia científica de que los denominados fármacos modificadores de enfermedad (FAME), como el metotrexato, la sulfasalazina, la leflunomida, las sales de oro, los antimaláricos, etc., sean eficaces en la EA. La sulfasalazina se ha demostrado efectiva en estudios controlados, aunque de forma modesta, en las manifestaciones periféricas de la EA8 y su utilidad en las formas axiales es controvertida9. Algunos FAME, como el metotrexato, la ciclosporina A, la sulfasalazina y la leflunomida, son eficaces en el tratamiento sintomático de las formas periféricas de la APs. No se ha demostrado, sin embargo, que estos tratamientos sean beneficiosos en la progresión del daño estructural de pacientes con EA o APs10.
Un número notable de pacientes con distintas formas de espondiloartritis no responde a los AINE y los FAME. Distintos estudios controlados en pacientes con EA y APs han demostrado el beneficio clínico de los agentes antagonistas del factor de necrosis tumoral alfa (TNF*): el receptor soluble del TNF*, etanercept11,12 y los anticuerpos monoclonales anti-TNF* infliximab13,14 y adalimumab15,16. Los tres fármacos están registrados actualmente para el tratamiento de EA y APs resistentes al tratamiento convencional.
El presente documento es la primera actualización del documento de consenso de la Sociedad Española de Reumatología sobre el uso de antagonistas del TNF* en las espondiloartritis, publicado hace 2 años17. Para llevar a cabo esta actualización, se ha efectuado una encuesta entre reumatólogos de la Sociedad Española de Reumatología acerca de la aplicabilidad del consenso anterior y una revisión sistemática de la literatura sobre las nuevas evidencias científicas de la terapia biológica en espondiloartritis, que ha sido la base para el posterior consenso entre los miembros del panel.
Este documento debe ser analizado como un conjunto de recomendaciones y no como una guía de práctica clínica en sentido estricto, y se pretende que sirva de referencia para todos los médicos especialistas en reumatología y profesionales con interés en el tratamiento de las EsP. En él se hace énfasis especial en la EA y en la APs, las dos enfermedades del grupo de las EsP, para las que está aprobado en España el uso de terapias biológicas; no obstante, las mismas recomendaciones pueden servir al resto de las EsP, teniendo en cuenta las características propias de cada paciente.
Agentes biológicos disponibles
Actualmente disponemos de tres antagonistas del TNF*: etanercept, infliximab y adalimumab, con indicación registrada tanto para la EA como para la APs. Las dosis recomendadas para la EA y la APs son:
Etanercept: 50 mg a la semana por vía subcutánea; en pacientes con EA la administración en dosis única semanal es igual de eficaz que la pauta inicialmente recomendada de 25 mg 2 veces por semana18.
Infliximab: 5 mg/kg de peso en infusión intravenosa cada 6-8 semanas.
Adalimumab19: 40 mg una vez cada 2 semanas por vía subcutánea.
Los tres agentes biológicos son efectivos en la EA y en la APs, pero no hay datos que avalen la superioridad de un antagonista del TNF* sobre otro, por lo que la elección concreta dependerá del criterio médico y las circunstancias particulares de cada paciente. Sin embargo, hay evidencia de efectos diferenciados en manifestaciones extraarticulares de las EsP como la uveítis o la enfermedad de Crohn, en las que los anticuerpos monoclonales parecen tener una mayor eficacia20. Además, por sus diferentes estructura y mecanismo de acción, la falta de respuesta a uno de los tres antagonistas no implica necesariamente la ineficacia de otro21. Por todo ello, los miembros del panel consideran que los tres agentes deben estar disponibles para la práctica terapéutica, sin ningún tipo de prioridad o jerarquía ajena a la de la propia evidencia científica.
En la EA, los antagonistas del TNF* se utilizan en monoterapia, sin necesidad de combinarlos con metotrexato o sulfasalazina. En la APs, el metotrexato es efectivo tanto en la afección articular como en la cutánea, y se puede considerar combinarlo con los antagonistas del TNF*, aunque no hay evidencia clara de que aumente la eficacia o disminuya la toxicidad de éstos22. Se ha publicado datos que indican que la terapia anti-TNF* puede ser eficaz en el tratamiento de pacientes con EsP que presentan amiloidosis secundaria23,24 o uveítis25 rebelde a la terapia convencional.
Dadas las características diferenciales, a veces relevantes, se analizarán de forma separada la EA (incluidas las EsP indiferenciadas axiales) y la APs.
Espondilitis anquilosante
Herramientas de evaluación y criterios de actividad de la enfermedad
En todos los pacientes con EA o EsP indiferenciada axial, debería evaluarse un conjunto mínimo de parámetros que permita cuantificar la actividad de la enfermedad. Dichos parámetros serían los siguientes (los cuestionarios correspondientes a estos instrumentos están disponibles en la página web de la SER: www.ser.es/practicaclinica/metrologia):
Cuestionario BASDAI (Bath Ankylosing Spondylitis Disease Activity Index)26. Se trata de un cuestionario autoaplicable que se basa en la valoración subjetiva del grado y la intensidad del dolor y la rigidez articular, medidas por escala visual analógica (EVA) o por escala visual numérica (EVN) (de 0 a 10 cm). El BASDAI se ha mostrado como el mejor instrumento validado para medir la actividad de la enfermedad de los pacientes con EA. Además, se ha comprobado su utilidad en otras espondiloartritis27, tanto en las formas axiales como en las periféricas.
Valoración general de la enfermedad por el paciente en EVA o en EVN (0 a 10 cm), que ha demostrado ser de gran utilidad en la evaluación de la respuesta terapéutica a agentes biológicos28.
Dolor raquídeo nocturno de naturaleza inflamatoria, igualmente en EVA o en EVN (0 a 10 cm).
Recuento de articulaciones tumefactas y dolorosas y de entesitis periférica, en el caso de enfermedad periférica.
Velocidad de sedimentación globular (VSG) y/o proteína C reactiva como marcador biológico de inflamación en todas las formas de EsP.
El panel considera también recomendable utilizar el índice BASFI (Bath Ankylosing Spondylitis Functional Index)29 como medida de capacidad funcional.
Como índices de metrología clínica, se recomienda recoger al menos el Schöber modificado, la expansión torácica, la distancia del occipucio a la pared y la flexión lateral del tronco.
Para la valoración del daño estructural, se considera útil hacer un seguimiento con técnicas de imagen (preferentemente radiología convencional) tanto en las formas axiales como en las periféricas de EsP.
Para las formas axiales, se acordó definir la enfermedad como activa si se cumplen los siguientes requisitos durante un período >= 3 meses: un BASDAI >= 4, junto con al menos uno de los siguientes: a) valoración general de la enfermedad por el paciente >= 4 cm; b) dolor raquídeo nocturno >= 4 cm, y c) elevación de reactantes de fase aguda (VSG y/o proteína C reactiva).
Para las formas periféricas, artritis y/o entesitis, los criterios de actividad, objetivo terapéutico, indicaciones de terapia biológica y valoración de respuesta al tratamiento serán, en general, los recogidos en el apartado correspondiente de la APs.
Objetivo terapéutico
El objetivo ideal del tratamiento en la EA es conseguir la remisión de la enfermedad. En su defecto, el objetivo es reducir al mínimo la actividad inflamatoria, de forma que conduzca a una mejoría significativa de los signos y síntomas tales como la inflamación articular, el dolor y la rigidez, tanto raquídea como periférica, y preserve la capacidad funcional manteniendo una buena calidad de vida. Obviamente, controlar el daño estructural sería otro objetivo deseable. Para mejorar el pronóstico de los pacientes, es imprescindible realizar un diagnóstico y un tratamiento lo más pronto posible.
El objetivo terapéutico deseable en la EA sería conseguir la menor actividad clínica posible, que idealmente correspondería a un índice BASDAI ¾ 2 y una valoración general de la enfermedad por el paciente < 2, lo que indicaría la práctica ausencia de dolor y rigidez articular. No obstante, se considera aceptables un BASDAI y una valoración general de la enfermedad por el paciente y del dolor axial nocturno < 4 cm en la EVA30.
La persistencia de actividad después de que el paciente se haya sometido a un tratamiento convencional correcto es testimonio de que la enfermedad no está adecuadamente controlada y se debe considerar un cambio de estrategia terapéutica, según las recomendaciones que se expondrá más adelante.
Indicaciones de terapia biológica en pacientes con EA
Antes de la utilización de terapia biológica en pacientes con EsP, es necesario instaurar un tratamiento correcto con AINE y/o antirreumáticos modificadores de enfermedad clásicos.
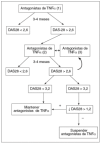
En la afección exclusivamente axial se debe utilizar al menos dos AINE con potencia antiinflamatoria demostrada durante un período conjunto mínimo de 3 meses a la dosis máxima recomendada o tolerada, excepto que haya evidencia de toxicidad o contraindicación de los AINE (fig. 1). Los inhibidores específicos de la ciclooxigenasa 2 (coxib) también son eficaces31.
Figura 1. Indicaciones de terapia biológica en las formas axiales de espondilitis anquilosante y artropatía psoriásica. Están indicados los antagonistas del factor de necrosis tumoral alfa (TNF*) si, tras el uso de al menos 2 antiinflamatorios no esteroideos (AINE) por un período de al menos 3 meses, persiste un BASDAI >= 4 junto con al menos uno de los siguientes: a) valoración general por el paciente (VGP) >= 4 cm; b) dolor nocturno (DN) >= 4 cm; c) elevación de los reactantes de fase aguda (RFA). Es fundamental en cualquier caso la opinión de un reumatólogo o médico experto en espondiloartritis.
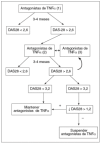
Cuando la afección sea periférica, además del tratamiento con AINE, debe haberse utilizado sulfasalazina a dosis de 2-3 g/día durante al menos 3 meses (fig. 2).
Figura 2. Indicaciones de terapia biológica en las formas periféricas de espondilitis anquilosante y artropatía psoriásica. En las formas periféricas de la EA, están indicados antagonistas del TNF si, a pesar de tratamiento con al menos 2 AINE, sulfasalazina y tratamientos locales, persisten durante más de 3 meses artritis, o entesitis, además de una VGP < 4 y/o una VSG/PCR elevados.
En las formas periféricas de APs, habría indicación de antagonistas del TNF si, a pesar del tratamiento con AINE y al menos uno de los FAME con demostrada eficacia en el tratamiento de esta indicación de APs (metotrexato, 20-25 mg/semana o máxima dosis tolerada; sulfasalazina, 2-3 g/día; leflunomida, 20 mg/día; ciclosporina A; 3-5 mg/kg/día), persiste durante más de 3 meses, en las formas oligoarticulares artritis o entesitis conforme a lo señalado anteriormente y en las poliarticulares un DAS 28 >= 3,2.
VGP: valoración global de la enfermedad por el paciente; RFA: reactantes de fasebaguda; SSZ: sulfasalazima; LFN: leflunomida; CSA: ciclosporina A.
En caso de entesitis, dactilitis, monoartritis u oligoartritis, se debe haber probado infiltraciones locales con glucocorticoides. Aunque no necesariamente, se recomienda, cuando sea posible, la sinovectomía isotópica en el caso de la monoartritis.
El tratamiento con agentes antagonistas del TNF* en EA estará indicado si a pesar de un tratamiento convencional correcto la enfermedad permanece activa según los criterios señalados previamente. Una afección radiológica extensa o la limitación absoluta de movilidad pero con criterios de actividad no excluyen la utilización de agentes biológicos. En cualquier caso, a la hora de establecer la indicación definitiva de terapia biológica, se considerará de máxima relevancia la opinión de un reumatólogo o de otro médico experto en EsP y en tratamientos biológicos.
En los pacientes previamente tratados, antes de considerar la terapia biológica se debe comprobar si habían recibido un tratamiento correcto de acuerdo con las dosis y pautas recomendadas en el apartado anterior y proceder según la situación en cada caso:
Si ha sido tratado correctamente y persisten criterios de actividad, se recomienda iniciar terapia con un antagonista del TNF*, según lo señalado previamente.
Si no ha sido tratado correctamente, antes de considerar terapia con antagonistas del TNF*, se recomienda completar o reiniciar el tratamiento siguiendo las pautas recomendadas.
En el caso particular de pacientes en que la EsP cumpla criterios de respuesta con un FAME concreto, éste se haya suspendido y la enfermedad se haya reactivado, se recomienda un nuevo ciclo de tratamiento con el FAME al que respondió previamente antes de considerar la terapia con antagonistas del TNF*.
Valoración de la respuesta terapéutica a agentes antagonistas del TNF*
Con el uso de antagonistas del TNF* en las EsP se persigue, como mínimo, la misma eficacia que con el tratamiento convencional, como ya se ha definido (objetivo terapéutico). No obstante, y dado que estos agentes representan el último escalón de la estrategia terapéutica, se puede considerar aceptables ciertos grados de actividad clínica, aunque no se logre el objetivo terapéutico deseable, siempre que se valore el riesgo/beneficio de este tipo de terapias.
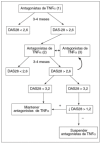
Se considerará que un paciente responde a terapias biológicas si tras 3 meses de tratamiento cumple el objetivo terapéutico o se produce una disminución del BASDAI del 50% (o una disminución de 2 puntos respecto a los valores previos al tratamiento) y una disminución del 50% (o de 2 puntos en las escalas analógicas) en al menos uno de los siguientes: valoración general de la enfermedad por el paciente (si previamente al tratamiento era > 4 cm), dolor axial nocturno (si previamente al tratamiento era > 4 cm) o reactantes de fase aguda (VSG y/o proteína C reactiva) (si antes del tratamiento estaban elevados) (fig. 3).
Figura 3. Valoración de la respuesta al tratamiento en las formas axiales de espondilitis anquilosante y artritis psoriásica. Se considera respuesta aceptable al tratamiento la disminución del BASDAI de al menos el 50% y una disminución del 50% en al menos uno de éstos: valoración general del paciente (VGP), dolor nocturno (DN) o reactantes de fase aguda (RFA), y en último caso se considera aceptable una disminución del 20% de estos parámetros. *: reducción.
Una vez iniciado el tratamiento con antagonistas del TNF* se evaluará la respuesta terapéutica a los 3-4 meses. Si con el agente utilizado se obtiene la respuesta clínica previamente reseñada, se continuará el tratamiento de forma indefinida realizando cada 3-4 meses las evaluaciones indicadas. Si a los 4 meses no hay respuesta según los criterios señalados o el paciente deja de responder después, se puede cambiar a otro antagonista del TNF*32. En el caso de infliximab podría valorarse la posibilidad de aplicar las infusiones cada 6 semanas, si es que se había comenzado con un régimen de cada 833.
Si no se ha alcanzado respuesta pero se observa una mejoría superior al 20% en el BASDAI y del 20% en la valoración de la enfermedad por el paciente (EVA), y dado que ya se habría utilizado las opciones terapéuticas más eficaces actualmente disponibles, el panel considera que se debe mantener el tratamiento con el agente biológico que el clínico considere de elección, salvo que alguno de los tratamientos no biológicos previamente utilizados hubiera sido más efectivo, en cuyo caso se recomienda valorar su reinstauración.
Artritis psoriásica
La APs es una enfermedad inflamatoria articular asociada a psoriasis en la que el factor reumatoide habitualmente es negativo. Desde el punto de vista de la afección articular, se han descrito 5 formas; sin embargo, clínicamente y a efectos prácticos, consideraremos dos grandes grupos de afección articular; las formas axiales y las periféricas, éstas a su vez subdivididas en oligoarticulares y poliarticulares. Además, en la APs, la afección de las entesis constituye una parte del espectro clínico de la enfermedad que se debe considerar al plantearse la evaluación de la enfermedad.
Herramientas de evaluación y criterios de actividad de la enfermedad
Para evaluar la actividad de la enfermedad en la APs, el panel recomienda un conjunto mínimo de parámetros, adaptados al tipo de afección articular predominante34,35.
Afección axial: aunque no existen medidas específicas de actividad desarrolladas para estos pacientes, por su similitud con la EA, se utilizarían los mismos criterios de evaluación (actividad y objetivo terapéutico) que en esa enfermedad.
En la afección periférica se recomienda las siguientes medidas:
Recuento de articulaciones dolorosas y tumefactas.
Evaluación general de la enfermedad por el paciente, en una EVA (0-10 cm) o EVN (0-10 cm).
Evaluación general de la enfermedad por el médico, en una EVA (0-10 cm) o EVN (0-10 cm).
Evaluación general del dolor, en una EVA (0-10 cm) o EVN (0-10 cm).
Reactantes de fase aguda, VSG y/o proteína C reactiva.
Función física. Se recomienda la utilización de cuestionarios como el HAQ, de ser posible con una frecuencia no inferior a dos veces al año.
Daño estructural, aunque no se especifica cuál es el mejor método para su evaluación, el panel cree útiles las radiografías de manos y pies o de cualquier otra articulación que esté afectada, una vez al año durante los primeros 3 o 4 años de evolución de la enfermedad.
Afección entesítica: se aconseja recoger el número y la localización. No existe actualmente ningún índice generalmente aceptado; sin embargo, el panel recomienda la utilización del índice MASES cuando se quiera utilizar alguno36.
Los criterios de actividad para las formas periféricas se han elaborado según la presencia de dos formas clásicas de presentación: formas poliarticulares y oligoarticulares-entesíticas. A fines prácticos y de evaluación, este panel considera la tenosinovitis y la dactilitis como áreas inflamadas con consideraciones similares a la artritis.
Formas poliarticulares: existen varios criterios de respuesta que se han usado en los ensayos clínicos para evaluar actividad y/o respuesta al tratamiento en pacientes con poliartritis psoriásica, entre los que se incluyen el PsARC (Psoriatic Arthritis Response Criteria), los criterios ACR20, 50 y 70 y el DAS2837. Ninguno se usa de forma habitual en la práctica clínica para valorar la respuesta de la APs. Aunque el DAS28 no evalúa articulaciones que pueden ser muy importantes en la APs como las IFD o las de los pies, el hecho de que se ha mostrado como el mejor índice para el seguimiento de APs en ensayos clínicos (los pacientes incluidos habitualmente tienen poliartritis psoriásicas), junto con la falta de criterios específicos para la APs y la familiaridad en su utilización por los reumatólogos para la valoración de la artritis reumatoide (AR), hace que el panel considere el DAS28 como la mejor opción para valorar las formas poliarticulares de la APs en la práctica clínica38. En este sentido, se ha acordado considerar para este tipo de artritis como criterio de actividad un DAS28 >= 3,2 durante un período >= 3 meses (fig. 2).
Formas oligoarticulares/entesitis (¾4 localizaciones): el panel acordó considerar como criterios de actividad la artritis y/o la entesitis en una o más localizaciones, junto con al menos uno de los siguientes: a) valoración del estado de la enfermedad por el paciente >= 4 cm;, b) elevación de los reactantes de fase aguda (VSG y/o proteína C reactiva) durante un período >= 3 meses.
Objetivo terapéutico
El objetivo ideal en la APs es lograr la remisión de la enfermedad, aunque tan sólo se alcanza en un pequeño porcentaje de los casos. Por lo tanto, el panel considera aceptable conseguir en los pacientes con afección poliarticular, como primer objetivo, un DAS28 < 2,6 (casi remisión) o, en su defecto, un DAS28 < 3,2 (baja actividad).
En las formas oligoarticulares, se podría considerar como objetivo deseable la desaparición completa de la inflamación o, en su defecto, el tratamiento debería conseguir como objetivo un número de articulaciones inflamadas < 3 además de una valoración general por el paciente < 4 y/o una VSG o proteína C reactiva en valores normales.
En pacientes con APs, incluso si se ha alcanzado el objetivo terapéutico, la constatación de progresión de la lesión radiológica articular y/o una sola articulación inflamada (rodilla, cadera, muñeca, hombro, etc.) o afección aislada de las interfalángicas distales, dactilitis y/o entesitis, que ocasione una marcada impotencia funcional o altere de forma importante la actividad laboral o profesional del paciente puede ser considerada como un fracaso del tratamiento y obligar a replantear la estrategia terapéutica.
De forma similar, en los pacientes que presentan una entesitis localizada o una dactilitis persistente o manifestaciones extraarticulares no controladas, tales como la uveítis anterior aguda de repetición y/o extensa afección cutánea, debería también replantearse el tratamiento.
Indicaciones de terapia biológica
Antes de la utilización de terapias biológicas, es necesario un tratamiento correcto con AINE y al menos un fármaco modificador de enfermedad con eficacia documentada en pacientes con formas periféricas de APs (fig. 2). Las dosis bajas de glucocorticoides orales pueden ser útiles en las formas poliarticulares. En las formas monoarticulares u oligoarticulares o en dactilitis o entesopatía, además se debe recomendar el uso de infiltraciones locales de glucocorticoides39-41. Aunque no es indispensable para establecer el fracaso terapéutico, en casos de monoartritis se puede considerar el tratamiento con sinoviortesis isotópica. Entre los FAME con eficacia documentada están la sulfasalazina, el metotrexato, la leflunomida o la ciclosporina A42. Las pautas recomendadas son las siguientes:
Metotrexato en escalada rápida de dosis: 7,5 mg semanales durante el primer mes. Si al mes persiste la artritis en cualquier localización, se aumentará la dosis a 15 mg semanales. Si al mes todavía persiste la artritis, se aumentará a 20 o 25 mg. Si tras 2 meses con esta dosis semanal (o en caso de intolerancia con la dosis máxima tolerada) no se ha obtenido el objetivo terapéutico, es indicación de cambio de tratamiento. En caso de ineficacia con metotrexato oral, el clínico puede considerar, por su mayor biodisponibilidad, la posibilidad de administración por vía parenteral.
Sulfla dosis de carga de 100 mg/día los primeros 3 días.
Ciclosporina A: 3-5 mg/kg/día durante al menos 3 meses o, en caso de efectos adversos, la dosis máxima tolerada.
A pesar de la escasa evidencia científica disponible con ensayos clínicos de calidad, el grupo de consenso, con base en los datos obtenidos de la práctica clínica, señala como FAME de elección el metotrexato para el tratamiento de la APs en su forma periférica. No hay datos suficientes para considerar necesaria una terapia combinada con FAME en pacientes con APs antes de pasar a un tratamiento biológico.
Antes de decidir el cambio a un tratamiento biológico, se deben seguir las mismas pautas ya comentadas en el apartado de EA. Los antagonistas del TNF* se usarán, tanto en la forma axial como periférica, en caso de que no se consiga con la terapia convencional el objetivo terapéutico predefinido. Para el tratamiento de la APs se dispone actualmente de los agentes biológicos anteriormente citados: infliximab, etanercept y adalimumab. Las dosis y vías de administración para la APs son similares a las mencionadas para la EA. En el caso del etanercept, en la APs no se ha realizado un ensayo que demuestre que 50 mg una vez a la semana tengan la misma eficacia que la dosis habitual de 25 mg 2 veces por semana, lo cual sí se ha confirmado en AR y EA. No obstante, no disponemos de datos que indiquen que en la APs no pueda usarse la dosis de 50 mg una vez por semana como alternativa a la pauta habitual. Con los 3 fármacos se puede considerar combinarlos con metotrexato, aunque no hay evidencia clara de que aumente su eficacia o disminuya su toxicidad.
Está fuera del objetivo de este documento dar recomendaciones sobre el tratamiento dermatológico de la psoriasis, pero hay que mencionar que, si bien no hay datos comparativos directos, la evidencia disponible señala que los anticuerpos monoclonales contra el TNF* tienen mayor eficacia en la afección cutánea que el receptor soluble a las dosis habitualmente recomendadas en el tratamiento de las EsP22.
Valoración de la respuesta terapéutica con los antagonistas del TNF* en la APs
Se considerará que un paciente responde a terapias biológicas si tras 3 meses de tratamiento cumple el objetivo terapéutico o sus parámetros de actividad se reducen de la siguiente forma:
En la APs con afección axial se considerarán los mismos criterios de respuesta que en la EA43.
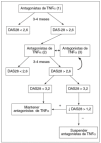
En la forma poliarticular periférica el paciente debería conseguir la remisión clínica (DAS28 < 2,6) o al menos reducir su actividad inflamatoria hasta situarla por debajo del objetivo terapéutico (DAS 28 < 3,2). En casos en los que éste no se alcance, se aceptaría como suficiente un descenso del DAS de 1,2 (desde el nivel previo), para mantener el tratamiento con el agente biológico que el clínico considere de elección, salvo que alguno de los tratamientos no biológicos previamente utilizados hubiera sido más efectivo, en cuyo caso se recomienda valorar su reinstauración (fig. 4).
Figura 4. Valoración de la respuesta al tratamiento en la artritis psoriásica poliarticular. El objetivo del tratamiento en conseguir un DAS28 < 2,6; en su defecto, DAS28 < 3,2; en último caso, un descenso de 1,2 sobre el valor previo del DAS antes de suspender el tratamiento con inhibidores del TNF*. *: reducción.
En la forma oligoarticular no existe ningún criterio válido de respuesta, y es recomendable la aproximación antes señalada.
Como ya se ha mencionado, se podría considerar fracaso del tratamiento administrado la monoartritis o la entesopatía persistentes e incapacitantes o las manifestaciones extraarticulares relevantes no controladas o recurrentes.
Evaluación y seguimiento de los pacientes en terapias biológicas
La evaluación inicial y la monitorización durante el seguimiento de los pacientes con EsP en tratamiento con antagonistas del TNF* deben realizarse, en gran parte, siguiendo las mismas pautas aconsejadas para pacientes con AR. Dadas las peculiaridades de las EsP respecto a la AR, en el anexo 1 se recogen las recomendaciones específicas para estos pacientes. El médico debe conocer con detalle la ficha técnica de los distintos productos y ajustarse a las recomendaciones establecidas.
Debe prestarse una atención especial al posible desarrollo de infecciones durante el tratamiento. A pesar de que, a diferencia de la AR, no se ha demostrado un aumento de incidencia de tuberculosis en pacientes con espondiloartritis sometidos al tratamiento convencional respecto a la población general en los primeros estudios controlados con infliximab en EA10,44, se describieron algunos casos de tuberculosis durante los primeros meses de tratamiento; por tanto, también en estos pacientes es imprescindible hacer una búsqueda de infección tuberculosa latente antes de iniciar la terapia antagonista del TNF* (anexo 1). Dichos pacientes también pueden estar expuestos a otras infecciones oportunistas, y debería considerarse especialmente la posibilidad de aparición de aspergilosis, especialmente en los pacientes con EA y afección pulmonar (fibrosis apical), ya que esta población tiene un más acentuado riesgo basal de que se desarrolle45. En fechas recientes se han comunicado diversos casos de abscesos retrofaríngeos en enfermos con EA tratados con fármacos biológicos, pero se desconoce si ésta es una circunstancia particular de este tipo de pacientes46.
Por otra parte, en los pacientes con EsP tratados con antagonistas del TNF* pueden desarrollarse fenómenos de autoinmunidad (anticuerpos antinucleares, anti-ADN, antifosfolipídicos, etc.), con una prevalencia similar a la observada en la AR y casi siempre sin repercusión clinica47.
Las singularidades en cuanto a otras posibles complicaciones de la terapia biológica (linfomas, enfermedad desmielinizante, lupus inducido) se exponen también en el anexo 1, junto con las recomendaciones y precauciones que se debe adoptar.
Conclusiones
Los agentes antagonistas del TNF* son una realidad en el tratamiento de los pacientes con EA y APs. Que otras entidades definidas dentro del grupo de las EsP puedan ser totalmente indistinguibles de la EA clásica haría válida la aplicación de dichos agentes a ellas.
En el presente consenso se han actualizado las recomendaciones de indicación y monitorización de los agentes antagonistas del TNF* en pacientes con EsP.
Es evidente que los agentes antagonistas del TNF* están cambiando de forma notable el pronóstico de las EsP. Hay datos de que estos tratamientos pueden cambiar la historia natural de estas enfermedades48. Sin embargo, los antagonistas del TNF* son fármacos de coste elevado, y aunque cada vez se dispone de más información acerca de su seguridad a largo plazo, ésta sigue siendo insuficiente. Por estos motivos, el panel considera que su aplicación deberá realizarse por profesionales médicos con experiencia en su indicación y monitorización. Estas circunstancias, junto con la probable aparición de nuevas terapias biológicas, siguen aconsejando la revisión periódica del presente consenso.