Paciente de 31 años, con historia de síndrome de superposición de lupus eritematoso sistémico y esclerosis sistémica que desarrolla un cuadro caracterizado por fiebre, pericarditis con derrame pericárdico y enfermedad pulmonar rápidamente progresiva y fatal. Se discuten aspectos diagnósticos e indicaciones terapéuticas.
A 31-year-old woman with a prior history of an overlap syndrome of systemic lupus erythematosus (SLE) and systemic sclerosis (SSc) developed fever, pericarditis with pericardial effusion and a rapidly progressive fatal interstitial lung disease. Diagnostic test and procedures, differential diagnosis and therapeutic approach are discussed.
Mujer de 31 años, sin antecedentes previos de jerarquía. Factores de riesgo: obesidad y hábito sedentario. Antecedentes patológicos: colecistectomía y oforectomía por quiste de ovario. Comenzó en el año 2003, a la edad de 25 años, con eritema malar en alas de mariposa, fotosensibilidad y fenómeno de Raynaud trifásico. Con posterioridad agregó poliatritis bilateral y simétrica (manos, pies y rodillas). En ese año fue internada por presentar anemia y derrame pericárdico. Al inicio de la enfermedad presentó laboratorio inmunológico con anticuerpo antinuclear (ANA) (+) 1/5.120, patrón nucleolar y moteado, anti-ADN doble cadena (ADNds) (−), antígenos nucleares extraíbles (−), factor reumatoideo (−) y complementos (C3 y C4) normales. Las radiografías (Rx) simples de tórax y osteoarticulares fueron normales. Un ecocardiograma bidimensional mostró derrame pericárdico moderado a severo y leve insuficiencia tricuspídea. Con diagnóstico de lupus eritematoso sistémico (LES) se medicó con prednisona (50mg/día), hidroxicloroquina (400mg/día), ranitidina (300mg/día), calcio, vitamina D e ibuprofeno (1.200mg/día), con mejoría de su cuadro clínico. Luego, la dosis de esteroides se comenzó a reducir progresivamente.
Para fines de 2003 agregó disfagia a sólidos, intermitente de localización baja y empeoró el fenómeno de Raynaud. Se agregaron bloqueantes cálcicos: nifedipina (20mg/día), con respuesta parcial. Los estudios complementarios mostraron esofagograma con hernia hiatal por deslizamiento, Rx de tórax con imágenes incipientes compatibles con intersticiopatía bibasal y una espirometría que evidenció una incapacidad ventilatoria restrictiva leve. Agregó herpes zóster intercostal izquierdo, por lo que recibió tratamiento específico local.
En enero de 2004 la paciente se hallaba asintomática con anemia leve. Continuaba con igual medicación, excepto prednisona (5mg/día). El laboratorio inmunológico reveló VDRL (+) 2 dils, fluorescent treponemal antibody absorption test (−), anticuerpos anticitoplasma de neutrófilos (−), anticardiolipinas (aCL) IgG (+) en bajo título e IgM (−) y baja actividad de anticoagulante lúpico. La paciente no presentaba historia previa de trombosis o abortos a repetición. La ecocardiografía Doppler mostró regurgitación tricuspídea, hipertensión pulmonar (HTP) y derrame pericárdico leve. Se suspendió la nifedipina y se incorporó diltiazem (120mg/día). Además, se agregó aspirina en baja dosis: 100mg/día.
En septiembre de 2004, la paciente continuó clínicamente estable. Presentó ANA (+) 1/5.120 con patrón moteado, nucleolar (Hep2), VDRL (+) 8 dils, aCL IgG (+) en alto título e IgM (+) en bajo título. El laboratorio de rutina continuó dentro de límites normales, excepto por la anemia compatible con enfermedad crónica.
En noviembre de 2004 presentó febrícula, mialgias, poliartitris bilateral y simétrica (manos, rodillas, pies) y disuria. El cultivo de orina demostró infección urinaria por Escherichia coli. Se inició tratamiento con ciprofloxacina y se aumentó la dosis de prednisona a 20mg/día, con franca mejoría y desaparición de sus mialgias y artritis.
En enero de 2005 (verano) la paciente comenzó con disnea de esfuerzo, agravó el fenómeno de Raynaud y agregó dos úlceras necróticas en el tercer dedo de la mano izquierda y en la cara posterior de la pierna izquierda con cianosis digital persistente en las manos y los pies. Se realizó tomografía computada (TC) de tórax de alta resolución que reveló compromiso alveolítico en ambas bases con fibrosis pulmonar incipiente sin otras alteraciones vasculares o mediastinales. Se comenzó tratamiento con pulso de ciclofosfamida (CF) en dosis de 1g mensual. La biopsia de la úlcera de la pierna no detectó signos de vasculitis, malignidad ni obstrucción de pequeños vasos. Las úlceras cicatrizaron paulatinamente con tratamiento local. Se disminuyó la dosis de prednisona a 10/5mg en días alternos. La paciente solo realizó el primer pulso de CF y luego abandonó el tratamiento por hallarse asintomática. En octubre de 2005 regresa a la consulta con cianosis en los dedos de las manos y los pies y acroesclerosis bilateral. El laboratorio inmunológico mostró ANA (+) 1/5.120 moteado y nucleolar, antígenos nucleares extraíbles (−), anti-DNAds (−), VDRL reactiva 1 dil, C3 nomal y C4 y CH50 levemente disminuidos. El anticoagulante lúpico fue (−), aunque no se pudo realizar aCL en dicha oportunidad. Prosiguió la medicación, con reducción de prednisona a 7,5mg/día y retomó diltiazem (120mg/día).
En abril de 2006 concurrió a la consulta por dolor, tumefacción y eritema en la cara palmar del antebrazo y la muñeca derecha. Una Rx simple demostró la presencia de calcinosis subcutánea. Además, presentaba varias lesiones en la piel de la región glútea y los miembros inferiores con aspecto de nódulos y placas infiltrativas profundas, inflamatorias y dolorosas compatibles con paniculitis lúpica, que no pudieron ser biopsiadas. Los estudios exhibieron esofagograma y espirometría sin variantes, ecocardiografía Doppler con derrame pericárdico mínimo, regurgitación tricuspídea leve y presión sistólica de la arteria pulmonar (PSAP) en 28mmHg. Las Rx de manos mostraron osteopenia difusa yuxtaarticular y groseras calcificaciones amorfas en el primer dedo de la mano derecha y una más pequeña sobre la apófisis estiloides cubital derecha. La TC de tórax de alta resolución puso en evidencia alveolitis bilateral con aumento de la fibrosis en ambas bases y extensión a vértices, mucho más avanzada en comparación con el estudio anterior. Se reiniciaron pulsos con CF pero la paciente abandonó sus consultas a reumatología del Hospital Provincial de Rosario.
En marzo de 2009, con 31 años de edad, es internada por presentar fatiga, náuseas y vómitos, mialgias generalizadas y fiebre de 39°C de 10 días de evolución. A su ingreso se hallaba medicada con prednisona (10mg/día), omeprazol (20mg/día), aspirina (100mg/día), diltiazem (60mg/día), metoprolol (5mg/día), metotrexato (15mg/semana), diclofenac y paracetamol. En el examen físico se observaron una frecuencia cardíaca de 100/min, una frecuencia respiratoria de 18/min, una presión arterial de 120/80mmHg, una temperatura de 38°C y un peso de 80kg. El examen de cabeza y cuello mostró ingurgitación yugular, sin soplos carotídeos. En el examen cardiovascular no se encontraron latidos patológicos; se encontró latido apexiano en el 5.o espacio intercostal izquierdo, sin frémitos. Los ruidos cardíacos eran normofonéticos, sin soplos ni ruidos anormales. En el examen pulmonar destacaban estertores crepitantes bibasales finos. El abdomen, sin particularidades, y la puñopercusión, negativa. En las extremidades, la paciente refería dolor muscular generalizado a la palpación. La piel mostraba livedo reticularis y varias lesiones inflamatorias nodulares y placas infiltrativas profundas compatibles con paniculitis lúpica.
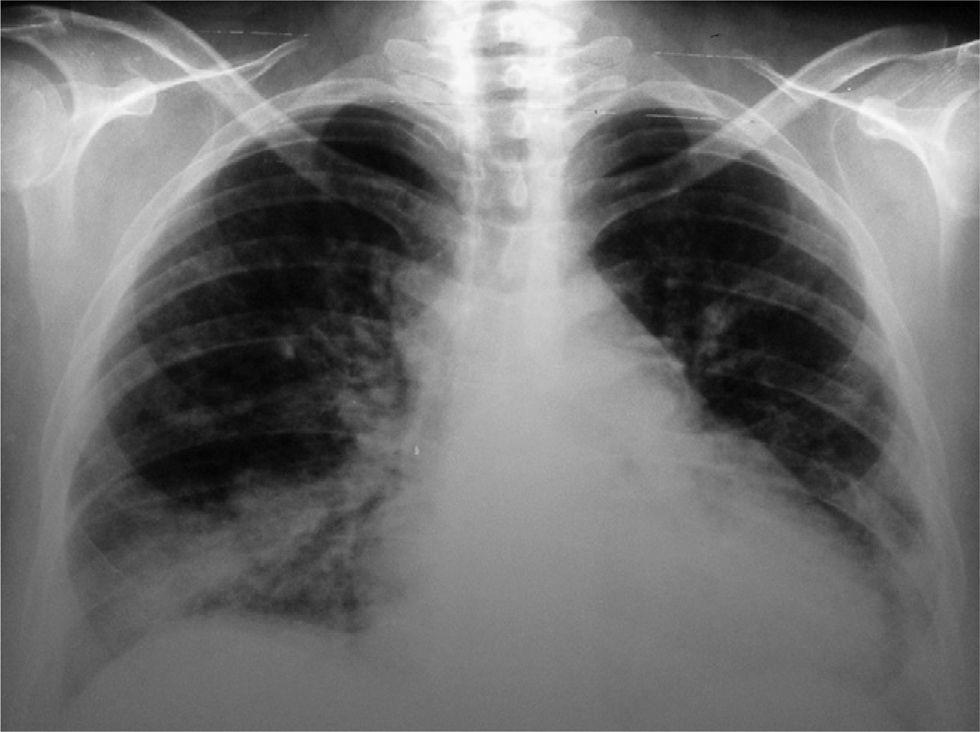
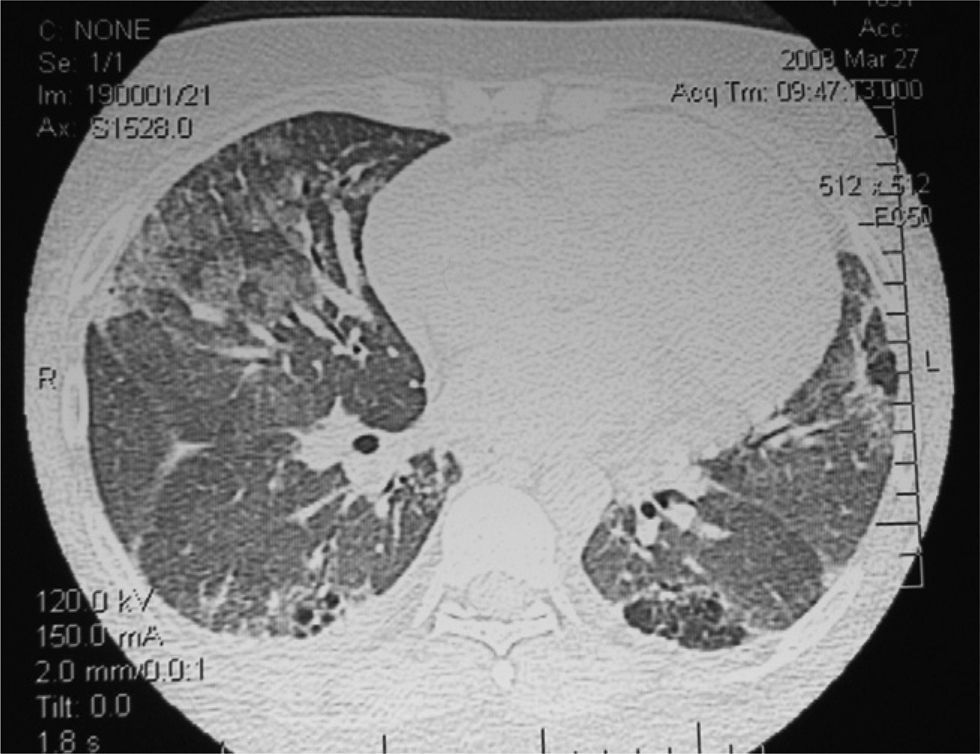
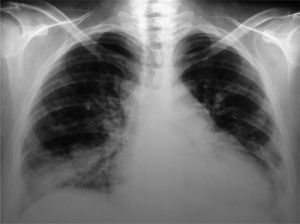
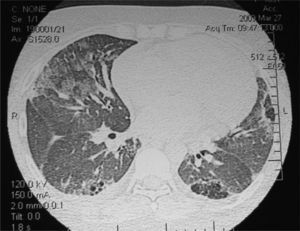
Los exámenes de laboratorio al ingreso mostraron glucosa, creatinina, ionograma y enzimas musculares dentro de límites normales. En el hemograma se evidenciaron hematocrito del 27%, hemoglobina de 7,9g/dl, recuento de glóbulos blancos de 4.600/ml, con fórmula leucocitaria y plaquetas normales. La velocidad de sedimentación globular y la proteína C reactiva fueron de 89mm/h y 6,3mg/dl, respectivamente. El sedimento de orina mostró proteínas (++) y glóbulos rojos (++). El urocultivo y el hemocultivo seriado fueron negativos. La Rx simple de tórax puso en evidencia silueta cardíaca aumentada de tamaño, compatible con derrame pericárdico, discreta procidencia del arco mediomediastinal izquierdo, refuerzo de la trama pulmonar bibasal y senos costofrénicos libres. Electrocardiograma con frecuencia cardíaca de 110/min, PR de 160ms, QRS de 80ms, aQRS de 0°, ondas T negativas en D III, V1-V2 con extrasístoles ventriculares aisladas. La ecocardiografia Doppler mostró el ventrículo izquierdo de dimensiones normales, motilidad y engrosamiento sistólico parietal, sin alteraciones segmentarias. La fracción sistólica del ventrículo izquierdo estaba conservada. La aurícula izquierda, las cavidades derechas y las válvulas aórtica, pulmonar y tricúspide fueron normales. Se observó derrame pericárdico moderado a severo con colapso parcial de la aurícula derecha sin variabilidad respiratoria del flujo transmitral mayor al 10%. La aorta mostró raíz de diámetro normal. Fue difícil estimar la PSAP. La fracción de eyección era del 66%. Durante el día 7 de la internación se repitió la ecocardiografía Doppler constatándose progresión del derrame pericárdico con PSAP de 43mm, por lo que se derivó a unidad de tratamientos intensivos. Permaneció con registros febriles diarios mayores a 38°C y estertores crepitantes pulmonares bibasales. Se repitieron hemocultivos seriados y urocultivos que resultaron negativos. En el examen analítico presentó hematocrito del 21%, hemoglobina de 6mg/dl, ferremia de 16mg/dl, recuento de glóbulos blancos de 2.800/ml con fórmula normal. Glucemia, uremia y creatininemia con valores normales. Una prueba de Coombs resultó (+). Se interpretó el cuadro actual como exacerbación de su enfermedad de base y se realizaron pulsos de betametil prednisolona de 1g/día por 3 días consecutivos. Se realizó, además, una hemotransfusión con concentrado de glóbulos rojos. En los días subsiguientes evolucionó afebril, sin signos de insuficiencia cardíaca. Se indicó hierro y leucovorina. El día 10 de internación la paciente presentó disnea de reposo. La Rx simple de tórax evidenció aumento progresivo de la silueta cardíaca, ensanchamiento mediastinal vascular, desaparición de los ángulos costofrénicos y radioopacidades reticulonodulillares perihiliares bilaterales y bibasales, con predominio derecho (fig. 1). La TC de tórax de alta resolución mostró leve cardiomegalia, derrame pericárdico, derrame pleural bilateral de leve volumen con predominio derecho; áreas de vidrio esmerilado en parches, segmentarias, bilaterales, predominando en campos pulmonares inferiores; áreas de atrapamiento aéreo, subpleurales, bilaterales con predominio de campos pulmonares superiores; opacidades reticulonodulillares bibasales, y líquido en cisura menor (fig. 2).
Tomografía computarizada de tórax de alta resolución: cardiomegalia, derrame pericárdico, derrame pleural bilateral, áreas de vidrio esmerilado en parches, segmentarias, bilaterales, predominando en campos pulmonares inferiores, áreas de atrapamiento aéreo, subpleurales, bilaterales y opacidades reticulonodulillares bibasales.
Se inició tratamiento con tazonam (4,5g/6h) y vancomicina (1g cada 12h). El día 13 de la internación aumentó su disnea de reposo que fue coincidente con Rx de tórax, que demostró progresión de los infiltrados pulmonares y signos de hipertensión venocapilar. Se indicó primero oxigenoterapia y luego ventilación asistida. Después de cinco días de plan antibiótico, evolucionó con controles febriles (37,5–38°C), por lo cual se suspendió tazonam y se inició imipenem (2g/día). Se agregó hidrocortisona (300mg/día) y anfotericina B (20mg/día). Disminuyó el ritmo de diuresis, por lo que se indicó fursemida (60mg) en infusión continua. Las muestras de urocultivo, hemocultivos seriados, líquido pericárdico (pericardiectomía) al igual que la coloracion de Ziehl-Nielsen fueron negativas. Durante el día 17 de internación, una ecocardiografía Doppler mostró fracción de eyección del 60%, derrame pericárdico moderado, colapso parcial de la aurícula derecha, flujo mitral con alteración de la relajación y leve insuficiencia mitral. La PSAP se estimó en 63mm. El día 20 de internación la paciente presentó taquipnea, con mala mecánica respiratoria y desaturación. Se conectó a asistencia mecánica respiratoria, modo controlado por volumen. Se interconsultó con neumonología y se realizó biopsia pulmonar. El día 23 de internación evolucionó a hipotensión sostenida sin respuesta a infusión de líquidos. Presentó asistolia, iniciándose maniobras de resucitación cardiopulmonar con infusión de adrenalina sin éxito, constatándose óbito el día 11 de abril de 2009.
Diagnóstico diferencial. Dr. Bernardo A. Pons-EstelSe presenta una paciente de 31 años, con diagnóstico de síndrome de superposición de LES y ES, la cual es internada por presentar un cuadro de 10 días de fiebre, pericarditis con derrame pericárdico y que evoluciona a una enfermedad pulmonar intersticial rápidamente progresiva con hipoventilación, requiriendo asistencia mecánica respiratoria y condicionando su muerte.
El LES es una enfermedad autoinmune (EAI) que puede presentarse con un espectro muy amplio de manifestaciones clínicas e inmunológicas. Puede, además, superponerse con otras EAI, en particular con la ES. Por otro lado, la ES es frecuentemente diagnosticada como lupus en sus estadios iniciales. Existen evidencias de que múltiples EAI comparten genes comunes de susceptibilidad. Tal es el caso del gen TNFSF4 (OX40L) que codifica el ligando OX40 de la molécula de coestimulación de los linfocitos T y cuyos polimorfismos de asociación han sido identificados como genes de susceptibilidad para el desarrollo tanto de LES como de ES1. Otros genes/locus comunes a varias EAI son el IRF5, el STAT4, el PTPN22 y el BANK1, los cuales demuestran el antecedente genético compartido entre estas enfermedades, en particular entre el LES y la ES2–4.
La inflamación del pericardio con o sin derrame es un hallazgo frecuente en pacientes portadores de EAI. Habitualmente, la actividad inmunológica se ve reflejada por la presencia de células LE, ANA, anti-ADNds, FR o consumo de complemento en el líquido obtenido por pericardiocentesis. La pericarditis, por lo general, se expresa como dolor retroesternal y precordial izquierdo con extensión a la espalda y al borde del trapecio. Clínicamente, hay frote pericárdico y taquicardia. Si es de instalación aguda, en corto tiempo puede provocar taponamiento cardíaco, en cuyo caso se agregan manifestaciones, como ingurgitación yugular, ruidos cardíacos hipofonéticos, hepatomegalia y pulso paradójico. El diagnóstico diferencial de cardiomegalia en una Rx simple de tórax puede ser difícil, siendo el hallazgo más frecuente el corazón «en cantimplora». El diagnóstico debe establecerse a través de un ecocardiograma bidimensional. El derrame pericárdico (habitualmente exudado) puede ser la expresión de la enfermedad subyacente; sin embargo, también puede corresponder a un proceso infeccioso con el cual se debe establecer diagnóstico diferencial. Es conocido que los pacientes con estas enfermedades tienen mayor predisposición a las infecciones debido a la disfunción del sistema inmunológico sumado a los tratamientos habituales, como esteroides e inmunosupresores. Dentro de los procesos infecciosos se deben considerar enfermedades virales, bacterianas, micobacterianas y fúngicas. Todos los estudios de cultivo fueron negativos en la paciente que estamos analizando.
El fenómeno de Raynaud es importante en la paciente que nos ocupa. Su presencia al comienzo de la enfermedad es indicador del inicio de la EAI y probablemente de su evolución al síndrome de superposición. El fenómeno de Raynaud se caracteriza por la presencia de alteración de la microcirculación con vasoespasmo paroxístico trifásico de los dígitos (fase de palidez) seguida de vasodilatación (fase cianótica) y retorno a la coloración normal o roja. El desequilibrio entre la secreción de tromboxano A2 (agente vasoconstrictor) y la de prostaciclina (agente vasodilatador potente) a partir del endotelio vascular, se halla involucrado en su patogenia. El fenómeno de Raynaud puede ser primario, en ausencia de patologías asociadas, o secundario, en cuyo caso se piensa en enfermedades colagenovasculares constituyendo un signo de valor, ya que en general es temprano y suele anteceder al desarrollo de otras manifestaciones como la esclerosis cutánea o el compromiso visceral. Su presencia es frecuente en pacientes con HTP. La videocapilaroscopia del lecho ungueal ha resultado de ayuda para distinguir entre fenómeno de Raynaud primario y secundario5. Otros métodos, como las imágenes de perfusión por láser Doppler están siendo evaluados6. En los casos asociados a ES se encuentran capilares gigantes y microhemorragias, determinándose un patrón activo cuando hay pérdida de capilares seguida de neoangiogénesis, fibrosis y «desertificación» en períodos posteriores. Este patrón difiere, además, del encontrado en otras EAI como el LES, la dermatomiositis o el síndrome antifosfolipídico5.
Uno de los desafíos más importantes para el reumatólogo es establecer el diagnóstico etiológico del compromiso pulmonar en pacientes con EAI7. Las infecciones son habituales, en general provocadas por alteraciones del sistema inmunológico, como el déficit de complemento o la alteración de la opsonización y la quimiotaxis de los neutrófilos que predispone a infecciones por Staphilococcus aureus, Streptococcus pneumoniae, E. coli o Klebsiella pneumoniae; la neutropenia origina infecciones por Serratia o Pseudomonas aeruginosa; las disfunciones de linfocitos T condicionan a infecciones bacterianas (Listeria monocytogenes, Nocardia, Salmonella), a hongos (Cryptococcus, Candida, Aspergillus, Histoplasma capsulatum) a virus (citomegalovirus, varicela, herpes) y/o a parásitos (Pneumocystis jiroveci, Toxoplasma gondii). También puede existir hipoesplenia, condicionando a infecciones por gérmenes tales como Pneumococcus, Neisseria meningitidis o Haemophilus influenzae.
El compromiso infeccioso pulmonar en estos pacientes requiere un máximo esfuerzo por identificar el/los microorganismo/s involucrado/s, ya que esto modifica el pronóstico y condiciona el tratamiento8. Es por ello que muchas veces hay que acceder a métodos invasivos de estudio para poder obtener muestras para cultivo, inmunofluorescencia o microscopia electrónica.
El médico reumatólogo debe tener presente los diagnósticos diferenciales como neumonitis, neumonía linfocítica, hemorragia pulmonar, tromboembolismo pulmonar (TEP), reacción pulmonar a drogas, infecciones, entre otros, al momento de decidir el tratamiento, ya que un cuadro de actividad de la enfermedad puede requerir inmunosupresión, lo cual en un paciente infectado puede ser mortal8. Debe recordarse que en muchas ocasiones se requiere indicar tratamiento simultáneo con antibióticos e inmunosupresores.
El cuadro clínico del compromiso pulmonar es similar en la mayoría de los casos. Puede comenzar con tos, dolor pleurítico, expectoración, disnea, hipoxemia y fiebre que oscila entre 37,5–40°C. La hemorragia pulmonar puede, además, presentar hemoptisis y caída brusca del hematocrito. El rango de progresión de los infiltrados pulmonares puede, en ocasiones, ser utilizado como guía para predecir etiología. Un proceso agudo de menos de 24h de evolución sugiere neumonía bacteriana aguda, neumonitis, hemorragia o TEP. Un proceso subagudo de varios días a una semana de evolución sugiere neumonía viral, P. jiroveci, Legionella pneumophila, micobacterias o Nocardia. El curso evolutivo de varias semanas siempre orienta a tuberculosis, infecciones fúngicas (Histoplasma o Coccidioides), neumonitis crónica o reacción pulmonar a drogas. En la neumonía linfocítica, las opacidades perihiliares en la Rx simple de tórax llevan a diagnóstico diferencial con cáncer. La presencia de condensaciones lobulares, segmentarias o en parches sugiere neumonía bacteriana, fúngica, TEP o hemorragia pulmonar, mientras que el relleno alveolar bilateral sugiere neumonitis, drogas o neumonía bacteriémica. Los infiltrados intersticiales bilaterales y difusos hablan de tuberculosis, P. jiroveci, citomegalovirus, Aspergillus, drogas o neumonitis crónica. La presencia de masas mediastinales sugiere histoplasmosis. La existencia de cardiomegalia o derrame pericárdico orienta más al compromiso autoinmune de base.
El TEP puede presentarse en pacientes con EAI9. La aparición de fenómenos trombóticos o tromboembólicos debe hacer sospechar la presencia de síndrome antifosfolipídico. Pacientes con livedo reticularis, úlceras cutáneas, alteraciones neurovasculares o cardiovasculares (especialmente en individuos jóvenes), abortos recurrentes o una prueba serológica falsa positiva para sífilis deben alertar sobre este diagnóstico; tal es la situación de la paciente que estamos considerando. En los casos de TEP, el centellograma de ventilación/perfusión es usado para establecer diagnóstico.
La HTP es una complicación frecuente de la ES y de los síndromes de superposición10. Su prevalencia es menor en pacientes con LES, por lo cual puede ser una manifestación no reconocida en esta enfermedad11. En el caso de nuestra paciente, la HTP fue otro de los hallazgos del cuadro clínico. La HTP secundaria es similar a la forma primaria pero se asocia más frecuentemente con fenómeno de Raynaud. Las manifestaciones clínicas son principalmente disnea, fatiga y disminución de la tolerancia al ejercicio. Sin embargo, muchos pacientes son asintomáticos y el diagnóstico se pone en evidencia al realizar estudios de rutina de su enfermedad de base. Desde el punto de vista fisiopatológico existe hiperreactividad vascular sumada a un estado de hipercoagulabilidad y microtromboembolismos múltiples y recurrentes que condicionan la HTP. Todo lo referido se halla fuertemente asociado a la presencia de anticuerpos antifosfolipídicos. Para su diagnóstico debe realizarse una ecocardiografía Doppler y, de ser necesario, un cateterismo cardiopulmonar.
La enfermedad intersticial pulmonar (EIP) es un grupo heterogéneo de patologías caracterizadas por inflamación y/o fibrosis del intersticio pulmonar. La nueva clasificación de las EIP introdujo el término de «enfermedad difusa del parénquima pulmonar», siendo la neumonía intersticial idiopática un subgrupo de esta enfermedad difusa12. A su vez, esta neumonía intersticial idiopática comprende varios subgrupos, dentro de los cuales está la usual interstitial pneumonia (UIP, ‘neumonía intersticial usual’). Desde el punto de vista clínico, se trata de pacientes portadores de EAI (LES, ES, dermatomiositis) que presentan tos escasamente productiva, disnea progresiva al ejercicio y estertores crepitantes bibasales. Como todos ellos son síntomas o signos tardíos de fibrosis intersticial, resulta indispensable establecer el diagnóstico en forma mucho más precoz para poder instituir una terapéutica adecuada13,14.
En pacientes con ES la EIP puede ocurrir tanto en la forma difusa como limitada de la enfermedad15. Si bien las alteraciones en una Rx simple de tórax pueden presentarse entre un 25–60% de los casos, es indispensable realizar una TC de tórax de alta resolución, ya que aumenta la posibilidad del diagnóstico16 (valor predictivo positivo: 70–100%) condicionando una menor necesidad de biopsias pulmonares.
En la UIP, la TC de tórax puede mostrar un patrón reticular predominantemente basal y periférico, generalmente «en parches», y bronquiectasias por tracción. Es común la presencia de imágenes en «panal de abeja» en estadios más avanzados. Las opacidades en «vidrio esmerilado» pueden estar presentes tanto en la EIP temprana (alveolitis temprana), como también en estadios tardíos de fibrosis17. Existe una distorsión de la arquitectura pulmonar, la cual es prominente cuando el proceso avanza hacia la fibrosis. Las pruebas de función pulmonar, como la espirometría, ponen de manifiesto un patrón tipo restrictivo con disminución de la capacidad pulmonar total y de la capacidad vital forzada. Como hay casos en los cuales los pacientes presentan normalidad de estas pruebas, el estándar de oro para evaluar la extensión del compromiso pulmonar es la capacidad de difusión de monóxido de carbono (DLCO)18. La determinación de gases en sangre demuestra hipoxemia arterial con normocapnia o hipocapnia, además de la disminución de la DLCO. Los anticuerpos antitopoisomerasa (anti-Scl70) se correlacionan mejor con el desarrollo de EIP y compromiso cutáneo difuso, mientras que los anticuerpos anticentrómero están más asociados a compromiso cutáneo limitado y enfermedad pulmonar vascular19.
En el LES, en algún momento del curso evolutivo la mayoría de los pacientes muestran signos de compromiso pulmonar, vascular, pleural o del diafragma20. El compromiso pulmonar se clasifica en secundario, cuando existen etiologías diferentes (infecciones, atipias), o bien primario, y dentro de este se incluye la EIP ya descripta, la neumonitis lúpica aguda, la hemorragia alveolar difusa, la HTP y el «síndrome de pulmones encogidos» (shinkring syndrome)21.
La neumonitis lúpica aguda es una manifestación poco frecuente en el LES (1–14%) y es resultante de la injuria a la unidad alveolopulmonar. Las manifestaciones clínicas se caracterizan por fiebre, tos (a veces con hemoptisis), dolor toráxico pleurítico, disnea, hipoxia, estertores bibasales, derrame pleural, anticuerpos anti-ADNds y sin infección aparente. La neumonitis lúpica puede evolucionar hacia una hipoxemia severa en el curso de pocas horas o días. La Rx simple de tórax muestra áreas en parches unilaterales o bilaterales de consolidación del parénquima, predominantemente en ambas bases pulmonares, asociadas o no a derrame pleural y atelectasias. La broncoscopia temprana con lavado bronquioalveolar es de ayuda en el diagnóstico, y la biopsia pulmonar es fundamental para su diagnóstico definitivo. Como el curso puede ser rápidamente evolutivo hacia la insuficiencia respiratoria, constituye una emergencia requiriendo tratamiento inmunosupresor agresivo. Debido a ello, el tratamiento es empírico, basado en la experiencia publicada y consiste en la utilización de antibióticos de amplio espectro para cubrir las probables etiologías infecciosas, el uso de terapias en pulso con altas dosis de esteroides e inmunosupresores, inmunoglobulinas endovenosas y/o plasmaféresis.
La hemorragia pulmonar aguda es una de las complicaciones más devastadoras del lupus, con una prevalencia de entre el 1–5% según las diferentes series22,23. Los síntomas, que se desarrollan en horas o días, incluyen disnea, tos, fiebre y esputo hemoptoico o hemoptisis franca. Este diagnóstico debe sospecharse frente al inicio de los síntomas mencionados acompañado de cambios radiográficos rápidamente evolutivos y caída del hematocrito. La DLCO está típicamente aumentada, en correlación con los altos niveles de hemoglobina dentro del alvéolo. Puede practicarse una broncoscopia con lavado bronquioalveolar para descartar otras causas, como infecciones, y comprobar la presencia de fluidos con alto contenido de sangre en la aspiración. Microscópicamente, pueden visualizarse glóbulos rojos y macrófagos alveolares cargados de hemosiderina en altísima proporción con evidencia, en muchos casos, de capilaritis alveolar. La mortalidad puede ser alta alcanzando a más del 50% de los pacientes. Por otro lado, se ha demostrado una alta incidencia de infecciones en pacientes lúpicos con hemorragia pulmonar, siendo los gérmenes más frecuentes Pseudomonas y Aspergillus, lo cual complica aún más el pronóstico y tratamiento24.
Diagnóstico clínico. Dr. Bernardo A. Pons-EstelSe presenta una paciente de 31 años con diagnóstico inicial de LES que evoluciona a un síndrome de superposición con ES, la cual es internada por presentar un cuadro de compromiso pulmonar rápidamente evolutivo que empeora en pocos días y que le ocasiona la muerte. De la discusión anterior debe destacarse el gran espectro de diagnósticos diferenciales que deben ser tenidos en cuenta en pacientes con EAI y compromiso pulmonar.
Se deben recordar, en primer lugar, los procesos infecciosos habituales que pueden afectar a pacientes inmunocomprometidos. Por dicho motivo, frente a la duda o a la imposibilidad de establecer un diagnóstico de certeza antes de obtener los resultados definitivos de los cultivos u otros estudios complementarios, es que debe administrarse una amplia cobertura antibiótica.
En pacientes con EAI (particularmente LES y ES) y compromiso pulmonar de rápida instalación es indispensable considerar, además de las infecciones, a aquellos cuadros de suma gravedad propios o asociados a la enfermedad de base, tales como TEP, neumonitis aguda y hemorragia pulmonar, todos los cuales son rápidamente evolutivos y de pronóstico severo. Los cuadros de pericarditis, con o sin taponamiento pericárdico deben ser tenidos en cuenta siempre en estos enfermos.
En el caso de la paciente que nos ocupa, luego de descartar patología infecciosa sobreagregada pero administrado un tratamiento apropiado antiinfeccioso, se consideró el diagnóstico de neumonitis aguda y UIP que evolucionó rápidamente a una falla orgánica que ocasionó su muerte.
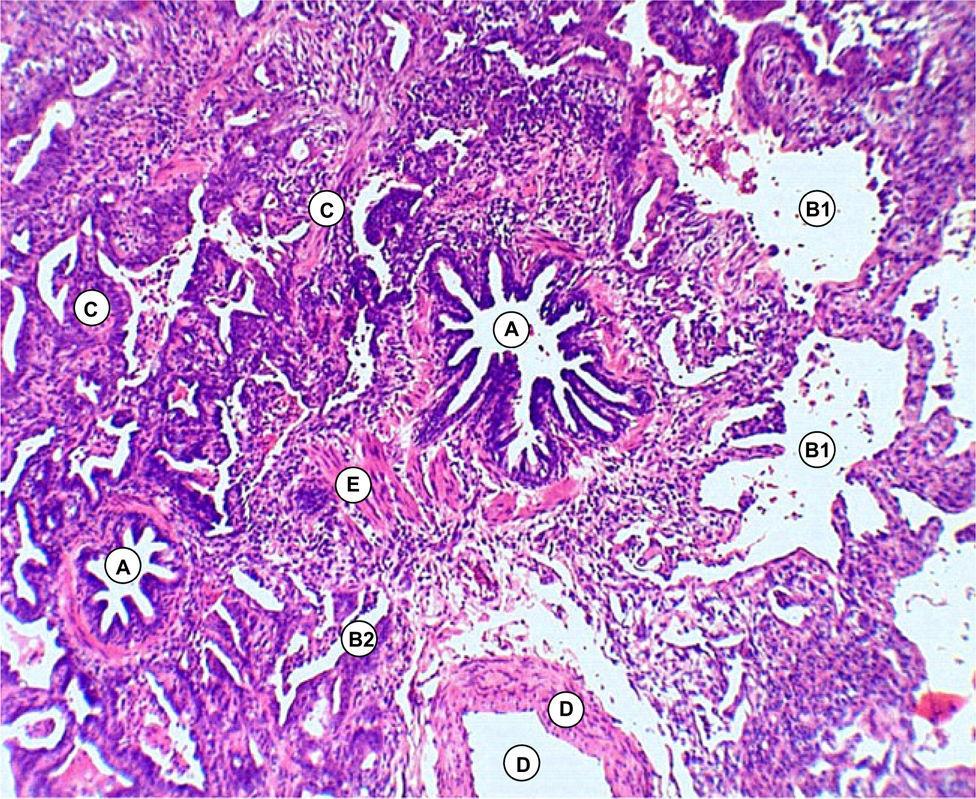
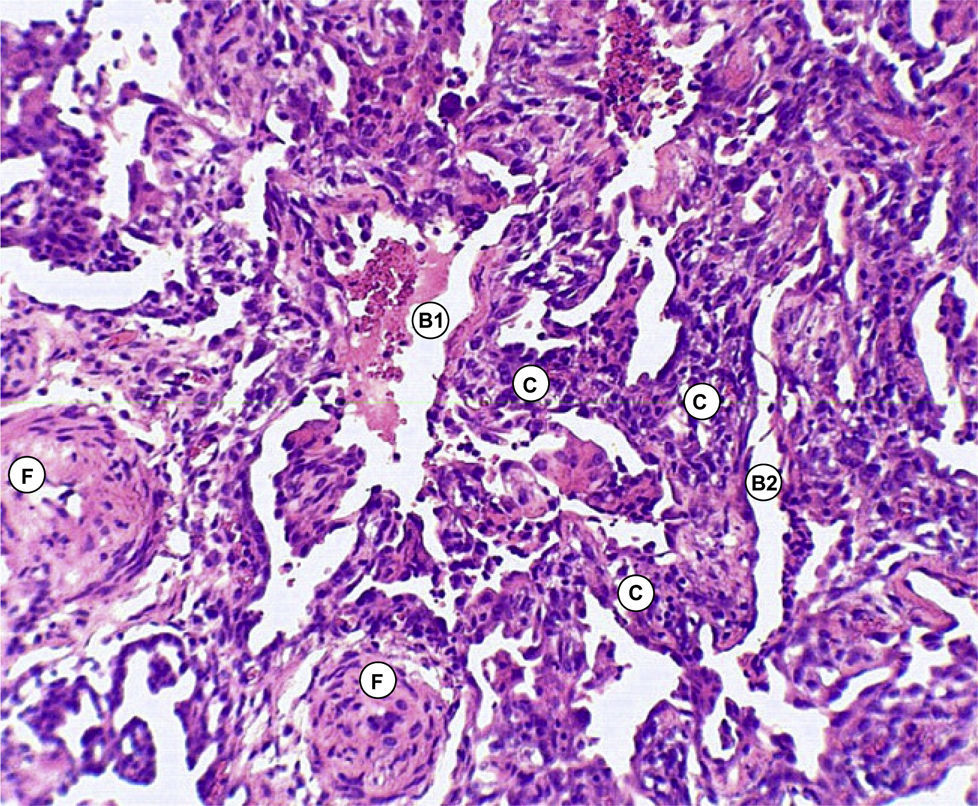
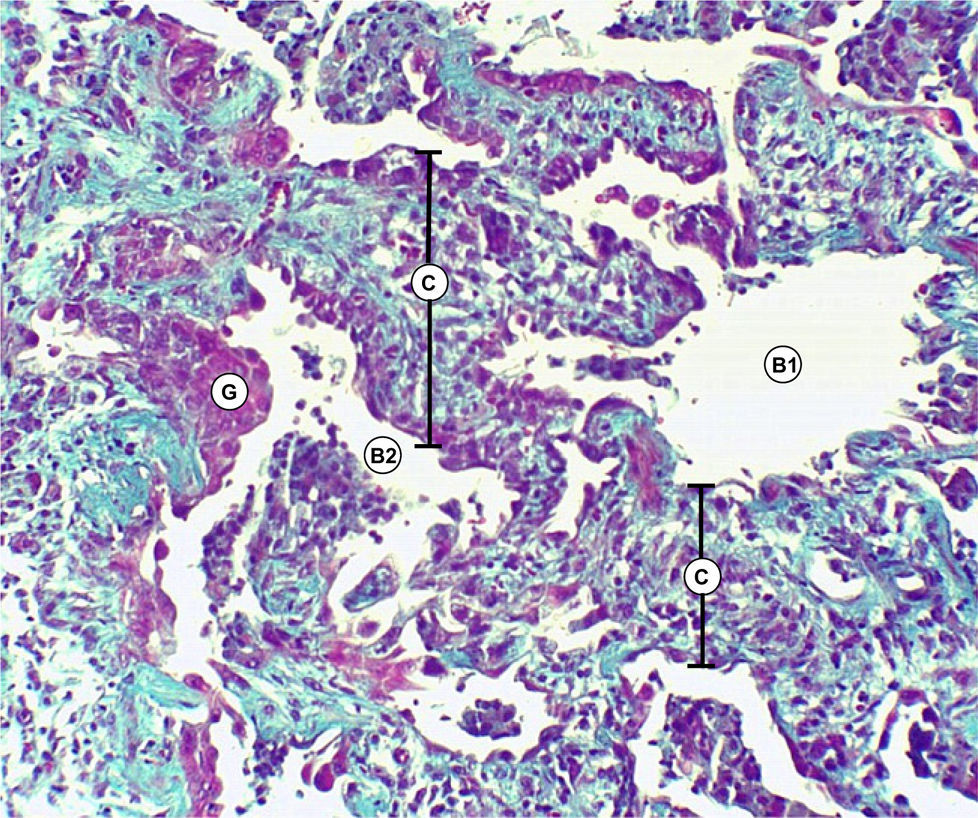
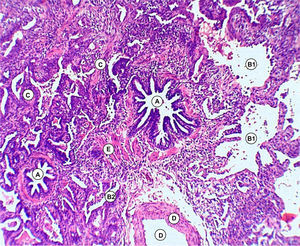
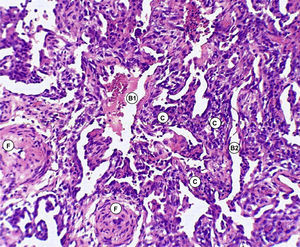
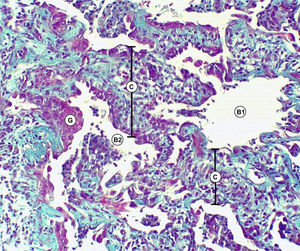
Discusión anatomopatológica. Dr. Jaime Ferrer y Marisol FerrerLa biopsia quirúrgica de pulmón, representativa de la lesión, mostró engrosamiento de los tabiques interalveolares con predominio de proliferación de fibroblastos y colágena y mínima reacción linfoplasmocitaria, alternando cavidades alveolares dilatadas y colapsadas (figs. 3–5).
No se reconocieron cambios inflamatorios granulomatosos, infiltrados específicos, signos de lesiones hemorrágicas o signos de colonización por P. jiroveci o formas fúngicas. No hay signos de lesiones neoplásicas.
En conclusión, la lesión patológica del parénquima pulmonar se corresponde con una UIP.
Comentarios y resultado definitivo. Dr. Bernardo A. Pons-EstelEntre un 15–25% de los pacientes con manifestaciones sistémicas de enfermedades reumáticas se presentan como síndrome de superposición de 2 o más entidades específicas o como enfermedades difusas e indiferenciadas del tejido conectivo25, cuya clasificación puede observarse en la tabla 1. Este grupo heterogéneo de patologías genera dificultades para establecer el diagnóstico definitivo, a la vez que provee evidencia indirecta de que procesos etiológicos y patogénicos comunes pueden ser la base de estas enfermedades.
Síndromes de superposición y enfermedades reumáticas indiferenciadas
| Enfermedad mixta del tejido conectivo |
| Lupus-esclerodermia-polimiositis-artritis reumatoidea |
| Enfermedades reumáticas sistémicas indiferenciadas |
| Síndromes de superposición |
| Artritis reumatoidea-lupus (rupus) |
| Esclerodermia-dermatomiositis/polimiositis |
| Esclerodermia-lupus |
| Esclerodermia-artritis reumatoidea |
| Superposición con polimiositis |
| Poliartritis crónica juvenil-lupus |
| Superposición con síndrome de Sjögren |
| Otras |
| Síndrome de poliartritis indiferenciadas |
| Espondiloartritis indiferenciadas |
Se presenta el caso de una paciente con diagnóstico inicial de LES que evoluciona a un síndrome de superposición con ES y años después desarrolla compromiso pulmonar rápidamente progresivo que ocasiona su muerte. A los efectos de su evolución final, resulta importante rescatar de su historia inicial la presencia de fenómeno de Raynaud, úlceras digitales, ANA (+) con patrón nucleolar y moteado, compromiso intersticial pulmonar bibasal e HTP.
Debe destacarse, como resumen de lo discutido previamente, la gran cantidad de diagnósticos diferenciales que hay que considerar cuando un paciente con diagnóstico de colagenopatía previa presenta una complicación pulmonar, debiendo tenerse en cuenta factores muy variados, tales como infección pulmonar, hemorragia pulmonar, complicaciones asociadas a compromiso vascular como TEP o HTP, hasta verdaderas neumonitis de origen inmunológico.
La amplia gama de dichos diagnósticos obliga al médico tratante a realizar todas las metodologías diagnósticas necesarias, en forma rápida, para luego establecer un tratamiento apropiado, el cual, si es instituido en forma temprana mejora la sobrevida. Sin embargo, debemos recordar que en la mayoría de los pacientes inmunocomprometidos el pronóstico puede resultar fatal, como lo indican la mayoría de las series publicadas8,13,24. En el caso que discutimos fue necesaria la realización de una biopsia pulmonar por toracotomía mínima para arribar al diagnóstico, ya que en pocos días tanto el cuadro clínico como el compromiso radiológico fueron rápidamente evolutivos. El resultado definitivo estuvo a cargo de la anatomía patológica estableciendo el diagnóstico de UIP.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Ninguno.