El lupus eritematoso sistémico es una enfermedad autoinmune sistémica que a menudo compromete la función de los órganos y reduce la supervivencia. Los avances en el diagnóstico y la terapéutica han mejorado su pronóstico a corto y medio plazo. No obstante, la mayoría de las mejoras terapéuticas proceden de avances alcanzados en otras áreas de la medicina y solo en los últimos años está cambiando esta tendencia. Lamentablemente el desarrollo de nuevos fármacos para el lupus se está enfrentando a unas dificultades especiales que han hecho que el desarrollo de rituximab en esta enfermedad haya sido detenido a pesar de los buenos resultados obtenidos en los estudios observacionales. La presente revisión analiza algunos de los aspectos que influyen en estas dificultades desde la perspectiva de LESIMAB una base de datos del grupo de trabajo EASSER.
Systemic lupus erythematosus is an autoimmune disease that may involve the function of organs and reduce the survival of patients. Advances in the diagnosis and treatment have improved the short-term prognosis.However, most therapeutic improvements come from progress in other areas of medicine and only in recent years is this trend changing. Unfortunately, the development of new drugs for lupus is facing specific difficulties and the development of rituximab in lupus has been stopped despite good results in the observational studies. This review examines some of the aspects that influence these difficulties from the perspective of the LESIMAB database.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune no órgano-específica relativamente poco frecuente que en no pocas ocasiones provoca graves complicaciones que comprometen la función de algunos órganos importantes y reducen la supervivencia de los pacientes1.
La prevalencia del LES muestra una tendencia ascendente en las últimas décadas, según ha mejorado la capacidad diagnostica. En general se acepta entre 40 y 150 casos por 100.000 habitantes, con notables diferencias raciales. El estudio EPISER obtuvo una frecuencia de 91 pacientes/100.000 habitantes (IC 95%: 30–390)2. Aunque puede afectar a todos los grupos poblacionales, esta enfermedad afecta típicamente a mujeres (la proporción mujeres: hombres es 9–10:1) en edad fértil (el 75% tiene entre 16 y 55 años).
En el LES es característica la aparición de autoanticuerpos, entre los que destacan los antinucleares (ANA) y anti-DNA. Los primeros son esenciales para el diagnóstico, al estar presentes en prácticamente todos los pacientes y en general permanecen positivos a lo largo de toda la evolución. Los anti-DNA se asocian al grado de actividad inflamatoria de la enfermedad y determinadas complicaciones viscerales, especialmente nefritis y su disminución es una variable subrogada de la eficacia de un tratamiento.
La enfermedad resulta muy heterogénea en función de la frecuencia e intensidad de los brotes inflamatorios, así como por los órganos afectados. El pronóstico depende fundamentalmente del compromiso visceral, con las peores expectativas en la afectación renal y sistema nervioso central. La supervivencia de los pacientes con LES, tanto en adultos como en niños, ha mejorado drásticamente en las últimas décadas. En los años sesenta la supervivencia a los 5 años era del 50%, en los noventa del 80% y en los últimos años la supervivencia a los 10 años es superior al 90%1. A pesar de esta importante mejora a corto plazo, el pronóstico de la enfermedad a largo plazo esencialmente no ha cambiado demasiado, salvo por la mejora pronóstica relativa que ha supuesto la detección de casos benignos.
Manejo terapéutico del lupusNo existe un tratamiento definitivo para el LES y la respuesta es tan variable como las manifestaciones de la enfermedad. Los glucocorticoides son fármacos esenciales en el control de las manifestaciones clínicas, con los inconvenientes conocidos asociados a su uso prolongado.
De forma similar a la artritis reumatoide, utilizamos fármacos modificadores de la enfermedad (FARME). La hidroxicloroquina parece eficaz para reducir el número de brotes y para el tratamiento de las manifestaciones dérmicas y se recomienda su uso en la mayoría de pacientes con LES3. El metotrexato es útil en el control de las manifestaciones articulares y pacientes sin compromiso visceral. La leflunomida también ha sido utilizada de forma ocasional.
Los inmunosupresores se utilizan como ahorradores de glucocorticoides y en pacientes con compromiso visceral. Los más usados en LES son la azatioprina y el micofenolato mofetil, así como su metabolito activo, el ácido micofenólico.
La ciclosporina y el tacrolimus actúan inhibiendo la función de células T, ambos fármacos tienen una nefrotoxicidad notable, que limita su uso en LES.
La ciclofosfamida es muy eficaz en la inducción de remisión de manifestaciones severas, nefritis, neurolupus o anemia hemolítica. La pauta original NIH tiene un gran número de eventos adversos a corto y medio plazo, lo que ha motivado pautas (eurolupus) con reducción de dosis4. En todo caso existe una clara tendencia a limitar el uso de ciclofosfamida. En general se acepta que las complicaciones graves deben ser tratadas con una terapia de inducción enérgica, seguida de un tratamiento de mantenimiento con fármacos menos tóxicos, como azatioprina o micofenolato mofetil5. Dada la toxicidad de la ciclofosfamida en cuanto a esterilidad, infecciones o carcinogénesis, también se ha utilizado micofenolato para la fase de inducción6, con resultados similares en eficacia a los obtenidos con ciclofosfamida, al menos en determinados pacientes7.
Todo este arsenal terapéutico, unido a un diagnóstico más precoz y un mejor conocimiento de la enfermedad, ha permitido una mejoría notable en la calidad y esperanza de vida de los pacientes con LES. Determinados pacientes son refractarios a las medidas convencionales, sobre todo aquellos con compromiso renal o sistema nervioso central.
Tratamientos biológicos en LESLa experiencia favorable en AR con anti-TNF motivó su uso en LES, pero su capacidad de inducir autoinmunidad, ha limitado su empleo a casos concretos de LES, con predominio articular8,9.
La inmunidad celular está alterada en el LES, existe un fallo en el reconocimiento de antígenos propios y un exceso en la producción de anticuerpos, por lo que resulta razonable utilizar ambas células T y B, como dianas terapéuticas10.
Los tratamientos con anticuerpos dirigidos a células T parecen descartados por efectos adversos, y la interacción T-B está siendo explorada con estudios clínicos controlados con CTLA4 Ig (abatacept). Los anticuerpos anti-CD154 se han asociado a un exceso de trombosis, por lo que ha sido descartada.
La célula B parece una diana apropiada en una enfermedad mediada por anticuerpos. Existen varios abordajes sobre las células B:
- •
Anticuerpos dirigidos a receptores específicos de células B. Disponemos de Ac contra dos receptores CD20 (rituximab, ofatumumab) y CD22 (epratuzumab).
- •
Limitar la activación BAFF/APRIL. Bien mediante anticuerpos contra BAFF (belimumab) o mediante el receptor (atacicept).
El receptor CD20 no se internaliza ni se desprende de la superficie celular y está presente casi exclusivamente en las células B salvo las subpoblaciones más inmaduras y células plasmáticas maduras. Rituximab actúa sobre el receptor CD20 e induce una depleción por apoptosis mediada por complemento11. Entre los mecanismos de acción no solo debemos considerar la disminución de formación de anticuerpos, ya que las células plasmáticas maduras de vida larga, no poseen CD20 ni son sensibles a los inmunosupresores. Rituximab induce depleción B, aumento de la actividad T reguladora y disminuye la activación de células T.
El grado y duración de la depleción es variable, no solo en función de la dosis, como se demuestra en el estudio de escalada de dosis12, en el que se produce depleción en la dosis menor (100mg). Los autores encuentran relación de la no depleción con el fenotipo del receptor FcγIIIa13 del que depende la capacidad de apoptosis mediada por complemento. No obstante, la depleción también está mediada por citotoxicidad dependiente de anticuerpos y por apoptosis directamente inducida por la unión de rituximab al CD20.
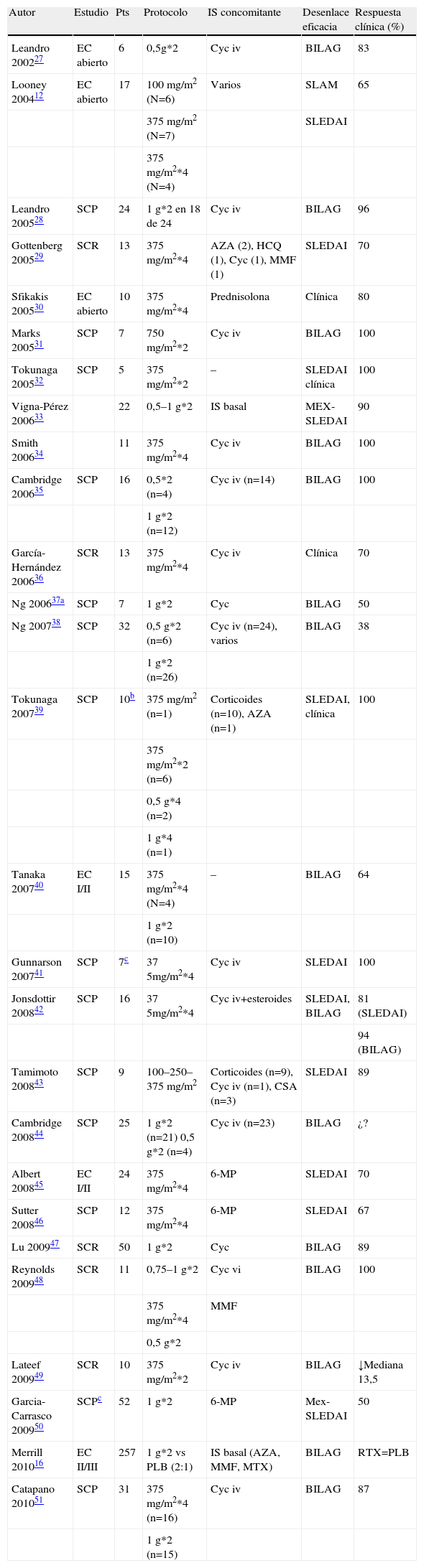
La experiencia con rituximab en lupus ha sido dominada por estudios abiertos y series casos prospectivos que reflejan en gran medida la práctica clínica actual, la cual se circunscribe actualmente al tratamiento de pacientes con enfermedad refractaria. Hasta ahora se han publicado más de 700 pacientes con este tratamiento con una tasa de remisiones que varía entre el 50 y el 100% de los casos (tabla 1). Existe una gran variación entre las dosis utilizadas en los diferentes estudios; la pauta utilizada en linfoma, 4 dosis semanales de 375mg/m2, ha sido algo más común que la dosis autorizada para AR, dos dosis de 1g separadas 15 días, pero no hay elementos que permitan diferenciar cuál es la más útil (tabla 1).
Tabla de evidencia sobre el uso de rituximab en el lupus eritematoso sistémico
| Autor | Estudio | Pts | Protocolo | IS concomitante | Desenlace eficacia | Respuesta clínica (%) |
| Leandro 200227 | EC abierto | 6 | 0,5g*2 | Cyc iv | BILAG | 83 |
| Looney 200412 | EC abierto | 17 | 100mg/m2 (N=6) | Varios | SLAM | 65 |
| 375mg/m2 (N=7) | SLEDAI | |||||
| 375mg/m2*4 (N=4) | ||||||
| Leandro 200528 | SCP | 24 | 1g*2 en 18 de 24 | Cyc iv | BILAG | 96 |
| Gottenberg 200529 | SCR | 13 | 375mg/m2*4 | AZA (2), HCQ (1), Cyc (1), MMF (1) | SLEDAI | 70 |
| Sfikakis 200530 | EC abierto | 10 | 375mg/m2*4 | Prednisolona | Clínica | 80 |
| Marks 200531 | SCP | 7 | 750mg/m2*2 | Cyc iv | BILAG | 100 |
| Tokunaga 200532 | SCP | 5 | 375mg/m2*2 | – | SLEDAI clínica | 100 |
| Vigna-Pérez 200633 | 22 | 0,5–1g*2 | IS basal | MEX-SLEDAI | 90 | |
| Smith 200634 | 11 | 375mg/m2*4 | Cyc iv | BILAG | 100 | |
| Cambridge 200635 | SCP | 16 | 0,5*2 (n=4) | Cyc iv (n=14) | BILAG | 100 |
| 1g*2 (n=12) | ||||||
| García-Hernández 200636 | SCR | 13 | 375mg/m2*4 | Cyc iv | Clínica | 70 |
| Ng 200637a | SCP | 7 | 1g*2 | Cyc | BILAG | 50 |
| Ng 200738 | SCP | 32 | 0,5g*2 (n=6) | Cyc iv (n=24), varios | BILAG | 38 |
| 1g*2 (n=26) | ||||||
| Tokunaga 200739 | SCP | 10b | 375mg/m2 (n=1) | Corticoides (n=10), AZA (n=1) | SLEDAI, clínica | 100 |
| 375mg/m2*2 (n=6) | ||||||
| 0,5g*4 (n=2) | ||||||
| 1g*4 (n=1) | ||||||
| Tanaka 200740 | EC I/II | 15 | 375mg/m2*4 (N=4) | – | BILAG | 64 |
| 1g*2 (n=10) | ||||||
| Gunnarson 200741 | SCP | 7c | 375mg/m2*4 | Cyc iv | SLEDAI | 100 |
| Jonsdottir 200842 | SCP | 16 | 375mg/m2*4 | Cyc iv+esteroides | SLEDAI, BILAG | 81 (SLEDAI) |
| 94 (BILAG) | ||||||
| Tamimoto 200843 | SCP | 9 | 100–250–375mg/m2 | Corticoides (n=9), Cyc iv (n=1), CSA (n=3) | SLEDAI | 89 |
| Cambridge 200844 | SCP | 25 | 1g*2 (n=21) 0,5g*2 (n=4) | Cyc iv (n=23) | BILAG | ¿? |
| Albert 200845 | EC I/II | 24 | 375mg/m2*4 | 6-MP | SLEDAI | 70 |
| Sutter 200846 | SCP | 12 | 375mg/m2*4 | 6-MP | SLEDAI | 67 |
| Lu 200947 | SCR | 50 | 1g*2 | Cyc | BILAG | 89 |
| Reynolds 200948 | SCR | 11 | 0,75–1g*2 | Cyc vi | BILAG | 100 |
| 375mg/m2*4 | MMF | |||||
| 0,5g*2 | ||||||
| Lateef 200949 | SCR | 10 | 375mg/m2*2 | Cyc iv | BILAG | ↓Mediana 13,5 |
| Garcia-Carrasco 200950 | SCPc | 52 | 1g*2 | 6-MP | Mex-SLEDAI | 50 |
| Merrill 201016 | EC II/III | 257 | 1g*2 vs PLB (2:1) | IS basal (AZA, MMF, MTX) | BILAG | RTX=PLB |
| Catapano 201051 | SCP | 31 | 375mg/m2*4 (n=16) | Cyc iv | BILAG | 87 |
| 1g*2 (n=15) |
AZA: azatioprina; Cyc iv: cicloosfamida intravenosa; EC: ensayo clínico; IS: inmunosupresión; MMF: micofenolato; 6-MP: 6 metil-prednisolona; MTX: metotrexato; Pts: pacientes; RTX: rituximab; SCP: serie de casos prospectiva; SCR: serie de casos retrospectiva.
La vida media de rituximab es de 21 días y aunque se produce una rápida depleción de linfocitos circulantes, la depleción máxima puede ocurrir a los 3 meses. Las subpoblaciones B en pacientes con lupus muestran un reparto diferente a la población normal. En general la repoblación ocurre a partir de los 6 meses, con grandes diferencias entre pacientes. También existen diferencias en la reconstitución inmune. En aquellos que presentan un predominio de células B naive y un retraso en la recuperación células de memoria (CD27+) se observan remisiones clínicas prolongadas14.
La reducción en la formación de anticuerpos es variable, los anti-DNA no se modificaron en el estudio de Looney, en tanto que otros autores reflejan una disminución. No obstante, también se observa disminución de anti-DNA tras el tratamiento con glucocorticoides en brotes.
En una reciente revisión sistemática de la bibliografía15, los autores seleccionan 27 estudios no controlados, con un total de 456 pacientes. Encuentran eficacia en la reducción de contajes SLEDAI y BILAG. El SLEDAI medio inicial de 8,8 se redujo un 58% y el BILAG inicial 14,7 se redujo un 61%, con niveles de significación p<0,001 en ambos. En general los estudios prospectivos en condiciones de práctica clínica con rituximab demuestran que en los pacientes con lupus que consiguen una buena depleción de células B alcanzan reducciones de la actividad en torno al 80% con respuestas favorables también en pacientes graves y refractarios a tratamiento estándar11.
Solo hay dos ensayos controlados, EXPLORER16 con 257 pacientes de lupus excluidos los que tenían nefritis y LUNAR17 en nefritis con 144; en total 401 pacientes. Los resultados del EXPLORER no muestran mayor eficacia con el comparador en el objetivo BILAG. El LUNAR comparó la respuesta en pacientes de nefritis lúpica tratados con glucocorticoides y micofenolato aleatorizados a placebo o rituximab y no demostró una mayor repuesta completa, pero sí mejor respuesta parcial, considerada como 1) normalizacion de Cr sérica o aumento inferior al 15%; 2) sedimento urinario inactivo, y 3) cociente en orina de proteína/creatinina <0,5.
En ambos estudios se comparó rituximab o placebo en pacientes en tratamiento con inmunosupresores y corticoides, que podrían minimizar las diferencias. En la experiencia del Hospital de Valme (Sevilla) se trató solo los pacientes no respondedores a los inmunsupresores habituales, lo que obviaría este inconveniente. Esta experiencia consistió en 17 pacientes de lupus resistente azatioprina, ciclofosfamida o micofenolato. Los primeros pacientes fueros tratados en 2004, disponiéndose por tanto de un seguimiento de hasta 5 años en algunos pacientes, con varios ciclos de tratamiento. La nefritis refractaria fue la causa de tratamiento en 7 pacientes, con un seguimiento medio de 12 meses, que recibieron una media de 2,4 ciclos de tratamiento. Se objetivó una reducción del SLEDAI previo 22,7±3,1 y posterior 1,3±2,2. La proteinuria media al inicio 3,26g/d se redujo a 0,7g/d. Se observó remisión completa en 5 pacientes (71%) y parcial en 2 casos (29%). La tolerancia fue excelente. En la actualidad utilizamos rituximab de forma habitual en los pacientes con LES refractarios a los tratamientos inmunosupresores habituales.
Basándonos en esta experiencia y en los casos publicados en la literatura propusimos, coincidiendo con la creación del grupo de trabajo de enfermedades autoinmunes de la Sociedad Española de Reumatología (EASSER), aunar la experiencia de otros centros españoles en una base de datos se denominó LESIMAB. Esto además permitiría al nuevo grupo obtener una mayor visibilidad en poco tiempo.
La base de datos LESIMABEl objetivo general del proyecto LESIMAB fue conocer la efectividad, la seguridad y los factores involucrados en la respuesta a rituximab de los pacientes con LES en condiciones de práctica clínica.
Se partió lógicamente desde la hipótesis de que rituximab sería efectivo para tratar la actividad de la enfermedad cuando otros fármacos inmunomoduladores hubieran fracasado. Esta hipótesis no solo se basó en nuestra propia experiencia sino también en los resultados publicados en otras series de casos (tabla 1).
Se incluyeron retrospectivamente solo pacientes clasificados como LES según los criterios de la ACR 199718 que hubieran recibido por lo menos una infusión de rituximab, lo que nos permitiría conocer la experiencia completa de todos los centros participantes con este biológico a la vez que hacer un análisis por intención de tratar. Gracias a esta colaboración, se adhirieron al proyecto 19 centros con un total de 131 pacientes. Teniendo en cuenta el total de pacientes que estos centros tienen en seguimiento, la tasa media de uso de rituximab fue del 0,8%. Esta baja cifra de uso de rituximab podría sugerir que el porcentaje de pacientes con lupus que tiene esta complejidad es afortunadamente mínimo pero también que este fármaco reserva actualmente a situaciones extremas.
Dado que uno de los motivos de que los ensayos clínicos no hayan encontrado diferencias entre rituximab y placebo ha sido la elección de los desenlaces de eficacia y el diseño de los estudios. Esto se debe a que los desenlaces actuales están basados en estudios observacionales más que experimentales, a la heterogeneidad de las manifestaciones clínicas de lupus y su curso evolutivo cambiante; los fármacos inmunomoduladores utilizados son diversos y que a diferencia de lo que sucede con la artritis reumatoide, la definición de la respuesta en el lupus no está estandarizada.
Según el American College of Rheumatology (ACR), the Food and Drug Administration (FDA), the Outcome Measures in Rheumatology Clinical Trials (OMERACT), the European League Against Rheumatism (EULAR), deben incluirse una evaluación de daño acumulado y un índice de actividad de la enfermedad19,20. Los índices de actividad más empleados en los ensayos clínicos son SELENA-SLEDAI y BILAG, los cuales son instrumentos de medida de la actividad que se correlacionan fuertemente21,22 y que han demostrado ser efectivos y fiables en estudios observacionales pero no en ensayos clínicos, aunque sus valores basales no siempre predicen el desarrollo de daño y otros desenlaces importantes de la enfermedad. Uno de los problemas que tienen ambos índices de actividad del lupus es que no se ha establecido cuál es el umbral de cambio con significado clínico, mientras que en el caso de SLEDAI no se captan muchas de las manifestaciones clínicas usuales en los pacientes con manifestaciones graves de la enfermedad. Cuando elegimos los desenlaces de LESIMAB pensamos en un índice que se hiciera corrientemente en la práctica clínica por su sencillez y que tuviera alguna fiabilidad en caso de que hubiera que realizarse retrospectivamente en algún caso23,24, lo cual eliminaba del panorama a BILAG, pero apuntaba a SLEDAI como el más oportuno. Parte de la falta de sensibilidad al cambio de SLEDAI ha sido corregida en la versión desarrollada por Safety of Estrogens in Lupus Erythematosus: National Assessment trial (SELENA–SLEDAI)25, eficaz para la definición de brote pero no así para la de respuesta, que sigue dependiendo de los cambios de puntuación observados en la versión clásica. Por este motivo, decidimos hacer una definición clínica adicional de mejoría para aquellas manifestaciones que no eran captadas por la versión clásica de SLEDAI, con lo cual quedó del siguiente modo:
- •
Respuesta completa: obtención de un SLEDAI=0 tras el inicio del tratamiento. Si el paciente tenía alguna manifestación clínica no captada, además debía obtenerse: 1) mejoría ≥80% en LES neurológico; 2) ≥80% en neutropenia autoinmune (cifras de neutrófilos mayores de 1.500); 3) normalización de las cifras de hemoglobina sin necesidad de trasfusiones ni signos clínico-analíticos de hemólisis (si tenía otras causas de anemia ajenas al LES, no se exigió la normalización completa de la hemoglobina); 4) desaparición de los síntomas respiratorios de LES pulmonar junto con la mejoría de las pruebas de imagen, de alguna de las pruebas de función respiratoria [incremento de TLC ≥25% o de la FVC ≥25% o DLCO/VA (KCO)≥40%] y la normalización de la saturación de oxígeno en el test de la marcha, y 5) mejoría del 50% en la proteinuria basal (con una reducción absoluta >0,5g/d) sin empeoramiento de la función renal (dentro del 10%).
- •
Respuesta parcial: reducción de SLEDAI >3 sin empeoramiento ni nueva aparición en ninguno de sus ítems26. Si el paciente tenía alguna manifestación clínica no captada, además debía obtenerse: 1) mejoría ≥20% en LES neurológico; 2) ≥20% en neutropenia/trombopenia autoinmune; 3) incremento de las cifras de hemoglobina ≥2 g/dl sin necesidad de trasfusiones o escasa necesidad de trasfusiones y mejoría de los signos clínico-analíticos de hemólisis; 4) mejoría de los síntomas respiratorios de LES pulmonar junto con la mejoría de las pruebas de imagen, de alguna de las pruebas de función respiratoria [incremento de TLC ≥15% o de la FVC ≥15% o DLCO/VA (KCO) ≥30%] y la normalización de la saturación de oxígeno en el test de la marcha, y 5) mejoría del 50% en la proteinuria basal (con una reducción absoluta >0,5g/d) sin empeoramiento de la función renal (dentro del 10%).
Las variaciones en el SLEDAI de 1–3 se consideraron fallos de tratamiento pero no nuevo brote. Sin embargo, si un paciente no alcanzó la remisión parcial de la actividad de la enfermedad después del inicio de rituximab debido a que los ítems renales de SLEDAI (sedimento, piuria, proteinuria) no fueron alcanzados, todavía pudo ser considerados en remisión parcial si obtuvo una mejoría del 50% en la proteinuria que tenía antes del tratamiento, pero sin que empeoren (dentro del 10%) las medidas que al principio eran normales. Si la indicación del tratamiento fue trombopenia y la mejoría de SLEDAI se mantuvo entre 1 y 3, todavía pudo ser considerado como una respuesta parcial si hubo una mejoría de las plaquetas y superó las 100.000plaquetas/mm3.
En cuanto a la definición de brote leve o moderado se siguió exactamente las definiciones de SELENA-SLEDAI. Para evaluar el nivel de daño se usó el SLICC/ACR DI.
En cuanto a las variables de desenlace, se eligieron dos basadas en análisis de supervivencia: 1) tiempo hasta la mejoría completa o parcial, y 2) tiempo hasta el brote leve/moderado o grave tras una mejoría inicial. Elegimos estos desenlaces porque nos permitirían analizar el conjunto de los casos como una cohorte dinámica y conocer cuánto tiempo se mantiene la mejoría clínica asociada con rituximab. Como también estuvo entre nuestros planes un análisis de la efectividad del primer ciclo, se eligieron otras medidas de desenlace secundarias evaluadas a las semanas 12.a y 16.a, como la proporción de respuestas completas o parciales y brotes.
El análisis de seguridad se hizo mediante la recogida de acontecimientos adversos relevantes según terminología MedDRA. Se calcularon las tasas de los mismos, se graduaron por gravedad, su relación causal con rituximab y su desenlace final. Asimismo, se recogió la tasa mortalidad y sus causas en todo el conjunto de casos.
La base de datos se estructuró en 5 bloques en los cuales se recogieron variables clínicas, analíticas y epidemiológicas basales del lupus y su evolución tras el primero y los sucesivos ciclos de rituximab.
En los próximos meses, LESIMAB espera continuar su difusión científica mejorando la visibilidad de EASSER y contribuyendo a mostrar el interés presente en la Sociedad Española de Reumatología por las enfermedades autoinmunes sistémicas.
Conflicto de interesesLos autores han participado como ponentes en conferencias para Roche, Abbott, Schering-Plough (actualmente MSD), Wyeth (actualmente Pfizer) y Bristol-Meier-Squibb. Ambos también han participado eventualmente como asesores científicos en estas mismas compañías.
Debemos agradecer la participación de los centros que han enviado los casos a LESIMAB y al grupo de trabajo de la Sociedad Española de Reumatología EASSER. Los coinvestigadores participantes en LESIMAB por orden alfabético son:
José Luis Andreu, Hospital Puerta de Hierro, Madrid
Jaime Calvo Alén, Hospital Sierrallana (Torrelavega), Santander
Patricia Carreira, Hospital Universitario Doce de Octubre, Madrid
Luis Carreño, Hospital Gregorio Marañón, Madrid
Mónica Fernández Castro, Hospital Puerta de Hierro, Madrid
María Galindo, Hospital Universitario Doce de Octubre, Madrid
Antonio Fernández-Nebro, HRU Carlos Haya, Málaga
Mercedes Freire González, Complejo Hospitalario Juan Canalejo, A Coruña
Txaro García de Vicuña, Hospital de la Princesa, Madrid
Blanca E. Hernández, Hospital CU Virgen Macarena, Sevilla
María López Lasanta, HRU Carlos Haya, Málaga
Francisco Javier López Longo, Hospital Gregorio Marañón, Madrid
José Luis Marenco de la Fuente, Hospital de Valme, Sevilla
Víctor Martínez Taboada, Hospital Marqués de Valdecilla, Santander
Javier Narváez, Hospital de Bellvitge, Barcelona
Alejandro Olivé Marqués, Hospital Germans Trias i Pujol, Badalona (Barcelona)
José María Pego Reigosa, Hospital do Meixoeiro (CHU de Vigo)
José J Pérez Venegas, Hospital de Jerez de la Frontera, Cádiz
Enrique Raya Álvarez, Hospital CU San Cecilio, Granada
Iñigo J Rúa-Figueroa, Hospital Dr. Negrín, Las palmas de Gran Canaria
Ana I Sánchez Atrio, Hospital Universitario Príncipe de Asturias, Alcalá de Henares
Eva Tomero, Hospital de la Princesa, Madrid
Eduardo Úcar Angulo, Hospital de Basurto, Bilbao
Paloma Vela Casasempere, Hospital General de Alicante, Alicante
Antonio Zea, Hospital Ramón y Cajal, Madrid