En el síndrome de Sjögren primario (SSP) no se ha descrito hasta el momento una terapia eficaz para las manifestaciones glandulares a pesar del desarrollo de múltiples agentes orales y biológicos en los últimos años. Varios fármacos empleados como tratamiento de fondo en otras enfermedades se han probado empíricamente y, reconocida la hiperactividad de la célula B en el SSP, también los moduladores de estas se han ensayado en esta enfermedad. En este artículo se revisan los datos existentes sobre el uso de tratamientos modificadores de la enfermedad exclusivamente en el síndrome seco, encontrando que los ensayos publicados con fármacos antirreumáticos orales han mostrado resultados contradictorios y desalentadores, mientras que algunos tratamientos biológicos han resultado esperanzadores. Los problemas encontrados se centran sobre todo en la falta de una correcta y homogénea metodología en los diseños de los ensayos.
No effective treatment has been documented for the glandular primary Sjögren syndrome (PSS) despite the development of oral and biologic agents that have significant activity against other autoimmune disorders. Some disease-modifying agents have been empirically evaluated for the treatment of PSS. Targeting B cells also seems very promising in SSP because of the B-cell hyperactivity recognized in this desease. This article reviews existing data on the use of disease-modifying therapy for glandular of SSP. To date, published studies and trials of oral DMARDs for the treatment of SSP have shown disappointing results. B-cell modulation is clearly a promising therapy for PSS. Many challenges in trial design and execution are evident from the studies reviewed.
El síndrome de Sjögren primario (SSP) afecta típicamente a las glándulas exocrinas. Los criterios de clasificación más recientes, los del consenso Europeo-Americano (E-A) del 20021, incluyen criterios subjetivos y objetivos del síndrome seco a nivel de la boca y de los ojos. Cuando se plantea un tratamiento de fondo en una enfermedad autoinmune y crónica como el SSP, se busca una terapia que modifique positivamente el curso de la misma, controle la actividad inflamatoria, frene la progresión y evite las secuelas. Para ello es necesario conocer la etiopatogenia de la misma y definir los parámetros clínicos y biológicos que queremos modificar. Como en la mayoría de las enfermedades autoinmunes, la etiología del SSP es desconocida. A pesar del desarrollo de agentes orales y biológicos, hasta el momento, no se ha descrito una terapia eficaz para las manifestaciones glandulares del SSP. En este artículo se revisan los datos existentes sobre el uso de tratamientos modificadores de la enfermedad exclusivamente para las manifestaciones del síndrome seco en el SSP. No se comentarán los trabajos centrados en el desarrollo de agonistas colinérgicos muscarínicos orales sistémicos ya que no existe ninguna evidencia que sugiera que la terapia secretagoga afecte al proceso inflamatorio autoinmune en el SSP.
Corticoides (GC)Existe una escasa evidencia que apoye el uso de GC para el tratamiento de la disfunción glandular en el SSP a pesar de su amplia utilización en enfermedades autoinmunes. Miyawaki et al2, realizaron un estudio piloto prospectivo abierto incluyendo 20 enfermos con SSP de acuerdo a los criterios japoneses 19863. Los pacientes recibieron tratamiento inicial con prednisolona diaria a 15mg para luego disminuirla hasta una dosis de mantenimiento entre 7,5 y 5mg. Se evaluaron el test de Saxon y síntomas subjetivos de sequedad oral. En el seguimiento a 6 meses, el flujo salival aumentó significativamente desde el primer mes, permaneciendo en todo momento en valores significativamente superiores al basal. Todas las preguntas del cuestionario de sequedad oral también mejoraron de forma significativa.
Hidroxicloroquina (HCQ)Los múltiples mecanismos de acción inmunológica descritos en los antipalúdicos sitúan a estos fármacos como una de las armas terapéuticas mas empleadas en las enfermedades autoinmunes. Kruize et al en 19934, publicaron un ensayo doble ciego cruzado, incluyendo 19 pacientes con SSP según criterios de Daniels y Talal de 19875. Se establecieron 2 grupos al azar para recibir HCQ durante un año seguido de placebo el 2.o año, o bien placebo durante el 1.er año seguido de HCQ el 2.o año. Tras 2 años, no se encontraron diferencias significativas entre grupos en los síntomas de sequedad, ni en la gammagrafía con tecnecio y galio, ni en las pruebas objetivas de la función de la lágrima. Recientemente, Rihl et al6, presentaron un estudio retrospectivo con 14 pacientes con SSP según criterios E-A1. Todos los enfermos eran ANA positivo y 8 pacientes además presentaban α-fodrina+ (IgG o A). Como grupo control eligieron a 21 individuos con síndrome seco, antiRo y antiLa negativos, con anticuerpos α-fodrina +. Se investigó el comportamiento del anticuerpo α-fodrina, que se ha postulado recientemente como posible marcador de actividad glandular. Tras 4,9 meses de tratamiento, la producción de saliva mejoró significativamente en los pacientes con SSP respecto a sus valores basales; además, la mayoría de los respondedores fueron aquellos con una reserva glandular basal >1g/2min y, curiosamente, la mayoría de estos fueron α-fodrina positivos. Al contrario, en el grupo control, fue el test de Schirmer el que alcanzó una mejoría significativa respecto a sus valores basales y, llamativamente, también en este caso encontraron una correlación positiva entre los respondedores y la presencia de α-fodrina.
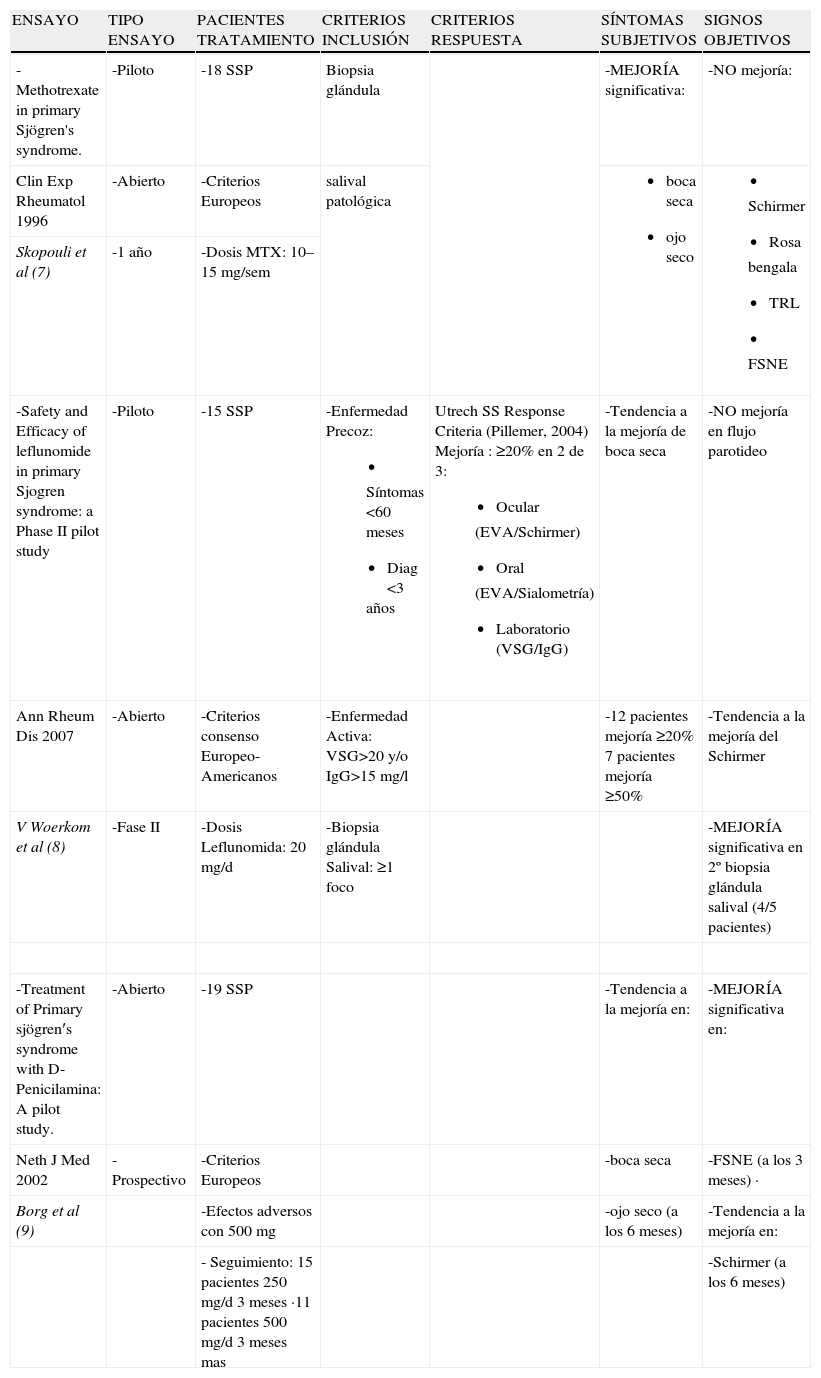
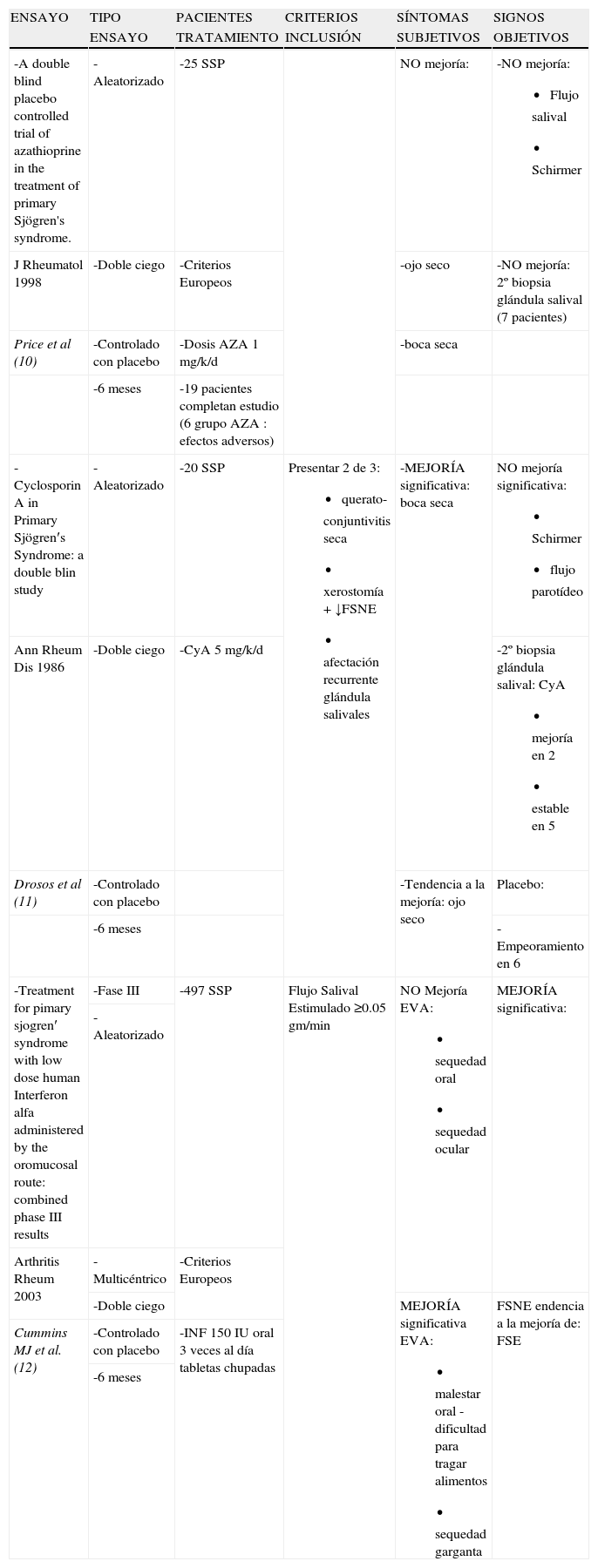
Fármacos modificadores de la enfermedad (FAME)Varios fármacos empleados como tratamiento de fondo en otras enfermedades se han probado empíricamente en el síndrome seco. En la tabla 17–9 se detallan 3 estudios abiertos en los cuales se analizó la eficacia de metotrexato (MTX), leflunomida (LF) y d-penicilamina (DP). En los 3 ensayos se incluyó un número de pacientes por debajo de 20. Únicamente LF se administró en pacientes que cumplían los criterios consenso E-A (1), pacientes con enfermedad precoz, definida como aquella de menos de 3 años de evolución, y pacientes con enfermedad activa, evaluada en función de los valores de la VSG y la IgG. En los resultados destacar: la mejoría significativa de los síntomas subjetivos de sequedad con el MTX, la mejoría del grado histológico en la 2.a biopsia de glándula salival postratamiento en el grupo con LF, y el aumento significativo del flujo salival no estimulado (FSNE) con DP. Con una metodología mas adecuada, en la tabla 210–12 se muestran los ensayos publicados de azatioprina (AZA), ciclosporin A (CyA) e interferón alfa (IFNα) en el síndrome seco del SSP. Los 3 son estudios aleatorizados doble ciego y controlados con placebo durante 6 meses. AZA y CyA se emplearon en un grupo de pacientes pequeño, 25 y 20 respectivamente y, únicamente con CyA se alcanzó una mejoría significativa en la sequedad subjetiva de la boca. AZA tampoco consiguió modificar la segunda biopsia de glándula salival tras el tratamiento, mientras que con CyA 2 pacientes mejoraron el grado histológico, 5 permanecieron estables y uno empeoró, en comparación con el grupo placebo donde la histología empeoró en 6 pacientes y en 2 permaneció estable. En el seguimiento a un año de la cohorte con CyA13, los resultados fueron similares a los encontrados en el 1.er trabajo, excepto que la histología en el grupo tratado empeoró a los 12 meses. Con IFN el tamaño muestral es claramente superior al resto de ensayos: 497 pacientes con SSP según criterios europeos14. Sus autores emplearon como criterio de inclusión: flujo salival estimulado (FSE) ≥0,05gm/min, sin embargo, la mejoría significativa solo se alcanzó en el FSNE. Algunas de las preguntas del cuestionario de sequedad oral mejoraron significativamente: malestar oral, dificultad para tragar alimentos, sequedad de garganta.
FAME 1
| ENSAYO | TIPO ENSAYO | PACIENTES TRATAMIENTO | CRITERIOS INCLUSIÓN | CRITERIOS RESPUESTA | SÍNTOMAS SUBJETIVOS | SIGNOS OBJETIVOS |
| -Methotrexate in primary Sjögren's syndrome. | -Piloto | -18 SSP | Biopsia glándula | -MEJORÍA significativa: | -NO mejoría: | |
| Clin Exp Rheumatol 1996 | -Abierto | -Criterios Europeos | salival patológica |
|
| |
| Skopouli et al (7) | -1 año | -Dosis MTX: 10–15mg/sem | ||||
| -Safety and Efficacy of leflunomide in primary Sjogren syndrome: a Phase II pilot study | -Piloto | -15 SSP | -Enfermedad Precoz:
| Utrech SS Response Criteria (Pillemer, 2004) Mejoría : ≥20% en 2 de 3:
| -Tendencia a la mejoría de boca seca | -NO mejoría en flujo parotideo |
| Ann Rheum Dis 2007 | -Abierto | -Criterios consenso Europeo-Americanos | -Enfermedad Activa: VSG>20 y/o IgG>15mg/l | -12 pacientes mejoría ≥20% 7 pacientes mejoría ≥50% | -Tendencia a la mejoría del Schirmer | |
| V Woerkom et al (8) | -Fase II | -Dosis Leflunomida: 20mg/d | -Biopsia glándula Salival: ≥1 foco | -MEJORÍA significativa en 2º biopsia glándula salival (4/5 pacientes) | ||
| -Treatment of Primary sjögren′s syndrome with D-Penicilamina: A pilot study. | -Abierto | -19 SSP | -Tendencia a la mejoría en: | -MEJORÍA significativa en: | ||
| Neth J Med 2002 | -Prospectivo | -Criterios Europeos | -boca seca | -FSNE (a los 3 meses) · | ||
| Borg et al (9) | -Efectos adversos con 500mg | -ojo seco (a los 6 meses) | -Tendencia a la mejoría en: | |||
| - Seguimiento: 15 pacientes 250mg/d 3 meses ·11 pacientes 500mg/d 3 meses mas | -Schirmer (a los 6 meses) |
EVA: Escala Analógica Visual; FSE: Flujo Salival estimulado; FSNE: Flujo Salival no Estimulado; Ig G: Inmunoglobulina G; SSP: Síndrome de Sjögren Primario; TRL: Tiempo de Ruptura de Lágrima; VSG: Velocidad de Sedimentación Globular.
FAME 2
| ENSAYO | TIPO | PACIENTES | CRITERIOS | SÍNTOMAS | SIGNOS |
| ENSAYO | TRATAMIENTO | INCLUSIÓN | SUBJETIVOS | OBJETIVOS | |
| -A double blind placebo controlled trial of azathioprine in the treatment of primary Sjögren's syndrome. | -Aleatorizado | -25 SSP | NO mejoría: | -NO mejoría:
| |
| J Rheumatol 1998 | -Doble ciego | -Criterios Europeos | -ojo seco | -NO mejoría: 2º biopsia glándula salival (7 pacientes) | |
| Price et al (10) | -Controlado con placebo | -Dosis AZA 1mg/k/d | -boca seca | ||
| -6 meses | -19 pacientes completan estudio (6 grupo AZA : efectos adversos) | ||||
| -Cyclosporin A in Primary Sjögren′s Syndrome: a double blin study | -Aleatorizado | -20 SSP | Presentar 2 de 3:
| -MEJORÍA significativa: boca seca | NO mejoría significativa:
|
| Ann Rheum Dis 1986 | -Doble ciego | -CyA 5mg/k/d | -2º biopsia glándula salival: CyA
| ||
| Drosos et al (11) | -Controlado con placebo | -Tendencia a la mejoría: ojo seco | Placebo: | ||
| -6 meses | -Empeoramiento en 6 | ||||
| -Treatment for pimary sjogren′ syndrome with low dose human Interferon alfa administered by the oromucosal route: combined phase III results | -Fase III | -497 SSP | Flujo Salival Estimulado ≥0.05 gm/min | NO Mejoría EVA:
| MEJORÍA significativa: |
| -Aleatorizado | |||||
| Arthritis Rheum 2003 | -Multicéntrico | -Criterios Europeos | |||
| -Doble ciego | MEJORÍA significativa EVA:
| FSNE endencia a la mejoría de: FSE | |||
| Cummins MJ et al. (12) | -Controlado con placebo | -INF 150 IU oral 3 veces al día tabletas chupadas | |||
| -6 meses |
AZA: Azatioprina; CyA: Ciclosporina; EVA: Escala Analógica Visual; FSE: Flujo Salival Estimulado; FSNE: Flujo Salival No Estimulado; INF: Interferon; SSP: Síndrome de Sjögren Primario.
El SSP afecta sobre todo a mujeres por lo que se ha buscado el papel terapéutico de las hormonas sexuales. Drosos et al en 198815 estudiaron el papel de la nandrolona (100mg/im/2semanas) en 20 mujeres con SSP en un ensayo doble ciego controlado con placebo, durante 6 meses, sin encontrar diferencias significativas entre los grupos en los síntomas subjetivos y signos objetivos de sequedad. En un estudio mas reciente, Pillemer et al16 administraron dehidroepiandrosterona oral (DHEA) en un ensayo aleatorizado doble ciego y controlado con placebo, a 28 mujeres con SSP que cumplían los criterios E-A1. A las 24 semanas, excepto en la sequedad subjetiva de la boca, no se consiguió mejorar significativamente los síntomas de ojo seco, ni modificar las pruebas objetivas de sequedad (test de Schirmer, de Van Bijsterveld y flujo salival).
Agentes biológicosLos avances en el conocimiento de la etiopatogenia del SSP nos han permitido explorar nuevas estrategias terapéuticas. Vamos a revisar que fármacos biológicos se han empleado hasta ahora y cuales son sus resultados en el tratamiento de la función glandular en el SSP.
Inhibidores del factor de necrosis tumoral (anti-TNFα)En el 2004 Sankar et al17 realizaron un estudio piloto con etanercept (25mg/subcut/2 veces a la semana), de distribución aleatoria doble ciego y controlado con placebo, durante 12 semanas, en el que incluyeron 28 pacientes que cumplían los criterios de San Diego de 198618 y/o los de consenso E-A1. Como criterios de respuesta definieron la mejoría ≥20% respecto al basal en 2 de estos 3 parámetros: sequedad oral, sequedad ocular y parámetros de laboratorio (VSG, IgG). El tratamiento con etanercept no produjo mejoría significativa en los síntomas subjetivos o signos objetivos de sequedad. Mariette et al19 desarrollaron un ensayo multicéntrico, de distribución aleatoria doble ciego y controlado con placebo, incluyendo 103 pacientes con SSP que cumplían los criterios E-A1. Como criterios de inclusión establecieron: pacientes con enfermedad activa, definida por una puntuacion >50mm en 2 de 3 parámetros (dolor articular, fatiga y sequedad). Como criterios de respuesta definieron la mejoría ≥30% respecto al basal en al menos 2 de los 3 parámetros descritos. A las 22 semanas el tratamiento con infliximab no demostró diferencias significativas entre grupos en la función glandular.
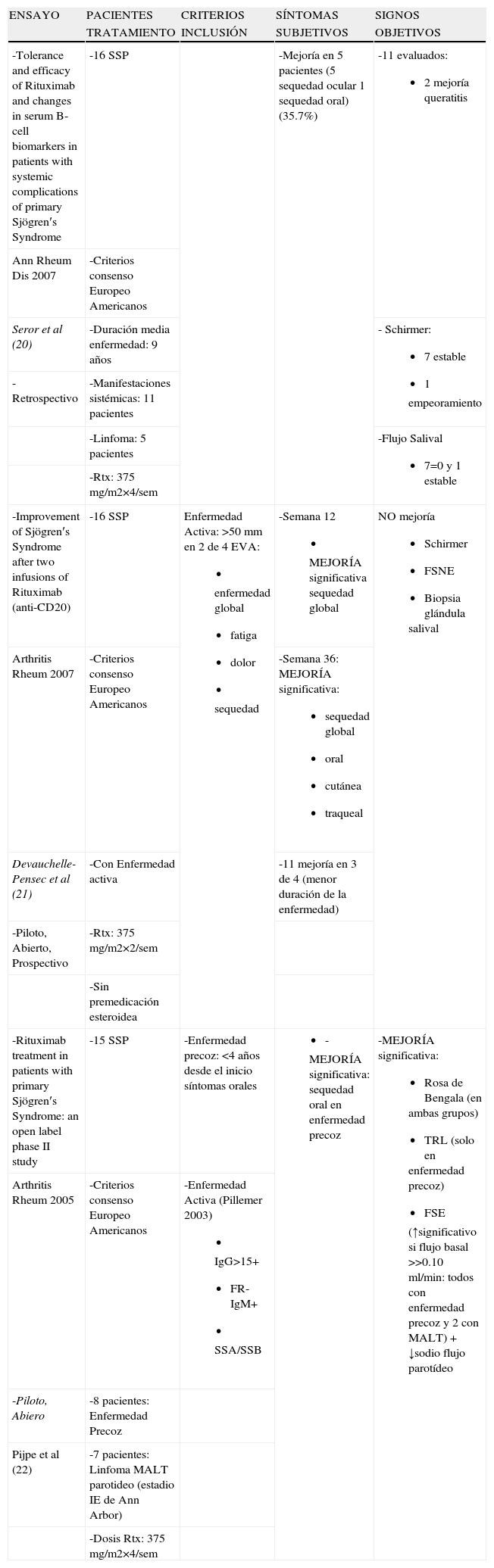
Agentes que disminuyen las células BDesde hace tiempo se ha reconocido la hiperactividad de la célula B en el SSP, por lo tanto el rituximab (anti-CD20) podría ser una alternativa en el tratamiento de fondo de esta enfermedad. En la tabla 3 repasamos 3 estudios de rituximab en SSP20–22. El número de pacientes incluidos no fue mayor de 16. Todos los enfermos cumplían los criterios E-A1. Seror et al diseñaron un ensayo retrospectivo20 para ver la eficacia de rituximab en las manifestaciones sistémicas del SSP. Devauchelle-Pensec et al21 evaluaron rituximab a dosis bajas: 2 infusiones de 375mg/m2, en vez de 4, sin premedicación con esteroides, en pacientes con enfermedad activa, definida como aquella con una puntuación >50mm en 2 de 4 parámetros (enfermedad global, fatiga, dolor y sequedad). Pijpe et al22 estudiaron 2 grupos de pacientes: el primero con enfermedad precoz, definida como aquella con un tiempo de evolución de los síntomas orales menor de 4 años, y el segundo grupo: pacientes con linfoma MALT de parótida asociado. El primer ensayo20 consiguió únicamente mejorar la sequedad ocular en 5 pacientes. El segundo trabajo21 alcanzó una mejoría significativa de los síntomas subjetivos de sequedad en la semana 12 y 36, comprobándose además que la eficacia quedaba restringida a los pacientes con enfermedad precoz. Lo mismo encontraron los autores del tercer estudio22, aquellos pacientes con menor duración de la enfermedad alcanzaron un mejoría significativa en la sequedad oral, en las pruebas objetivas de función de la lágrima y en el flujo salival estimulado; el aumento de flujo se correlacionó además con un flujo basal por encima de 0,10ml/min y una disminución del sodio parotídeo.
Rituximab
| ENSAYO | PACIENTES | CRITERIOS | SÍNTOMAS | SIGNOS |
| TRATAMIENTO | INCLUSIÓN | SUBJETIVOS | OBJETIVOS | |
| -Tolerance and efficacy of Rituximab and changes in serum B-cell biomarkers in patients with systemic complications of primary Sjögren′s Syndrome | -16 SSP | -Mejoría en 5 pacientes (5 sequedad ocular 1 sequedad oral) (35.7%) | -11 evaluados:
| |
| Ann Rheum Dis 2007 | -Criterios consenso Europeo Americanos | |||
| Seror et al (20) | -Duración media enfermedad: 9 años | - Schirmer:
| ||
| -Retrospectivo | -Manifestaciones sistémicas: 11 pacientes | |||
| -Linfoma: 5 pacientes | -Flujo Salival
| |||
| -Rtx: 375mg/m2×4/sem | ||||
| -Improvement of Sjögren′s Syndrome after two infusions of Rituximab (anti-CD20) | -16 SSP | Enfermedad Activa: >50mm en 2 de 4 EVA:
| -Semana 12
| NO mejoría
|
| Arthritis Rheum 2007 | -Criterios consenso Europeo Americanos | -Semana 36: MEJORÍA significativa:
| ||
| Devauchelle-Pensec et al (21) | -Con Enfermedad activa | -11 mejoría en 3 de 4 (menor duración de la enfermedad) | ||
| -Piloto, Abierto, Prospectivo | -Rtx: 375mg/m2×2/sem | |||
| -Sin premedicación esteroidea | ||||
| -Rituximab treatment in patients with primary Sjögren′s Syndrome: an open label phase II study | -15 SSP | -Enfermedad precoz: <4 años desde el inicio síntomas orales |
| -MEJORÍA significativa:
|
| Arthritis Rheum 2005 | -Criterios consenso Europeo Americanos | -Enfermedad Activa (Pillemer 2003)
| ||
| -Piloto, Abiero | -8 pacientes: Enfermedad Precoz | |||
| Pijpe et al (22) | -7 pacientes: Linfoma MALT parotideo (estadio IE de Ann Arbor) | |||
| -Dosis Rtx: 375mg/m2×4/sem |
EVA: Escala Analógica Visual; FSE: Flujo Salival Estimulado; FSNE: Flujo Salival No Estimulado; Rtx: Rituximab; SSP: Síndrome de Sjögren Primario; TRL: Tiempo de Ruptura de Lágrima.
La característica histológica de las glándulas salivales en el SSP es la presencia de sialadenitis linfocítica focal. De la cohorte de pacientes de Pijpe22, en un estudio posterior23, se analizaron 5 pacientes del grupo con enfermedad precoz en los que se realizó una 2.a biopsia de glándula parótida durante 12 semanas de tratamiento con rituximab. Los resultados fueron: disminución del infiltrado, del número de centros germinales (ausentes completamente en 4 pacientes), de la cantidad y extensión de las lesiones linfoepiteliales, de la proliferación acinar del parénquima en todos los pacientes y de la ratio célula B:T. La hipótesis de una posible reversibilidad de las alteraciones glandulares tras el tratamiento con rituximab, es un objetivo deseable que se debería plantear ante cualquier fármaco candidato a ser un modificador de la enfermedad. Publicado en este año por Meijer et al, encontramos en la literatura médica un ensayo clínico de mejor calidad metodológica24: es un aleatorizado doble ciego controlado con placebo, donde se incluyeron 30 pacientes con SSP según criterios E-A1. Como criterios de inclusión exigían un FSE basal ≥0,15ml/min entre otros. A diferencia de los ensayos previos, se empleó la dosis de 1g de rituximab en los días 0 y 15. El objetivo principal fue modificar el FSE. En la semana 5 y 12 el FSE mejoró respecto a sus cifras basales en el grupo rituximab, y únicamente en la semana 12, esta fue significativamente superior al grupo placebo. Desde la semana 5, también el grupo rituximab mejoró de forma significativa su Escala Analógica Visual (EVA) de sequedad ocular respecto a sus valores basales y, en la semana 36, esta fue significativamente superior al grupo placebo. Otros parámetros como el FSNE y la EVA de sequedad oral también se modificaron positiva y significativamente respecto a sus cifras basales en el grupo con rituximab. Steinfeld et al en el 2006 evaluaron la seguridad y la eficacia epratuzumab, un anti CD22 monoclonal25. Es un trabajo abierto con 16 pacientes con SSP según criterios E-A1, con enfermedad activa definida por parámetros que representan la hiperactividad de la célula B (IgG>1,4g/l o VSG>25mm/h y autoanticuerpos positivos). Como criterio de respuesta establecieron la mejoría ≥20% respecto al basal en 2 de 5 parámetros: test de Schirmer, FSNE, fatiga, VSG e IgG. A los 6 meses de seguimiento, el 67% de los pacientes alcanzaron una mejoría del 20% en la semana 32, el 50% una respuesta del 30% y el 45% una respuesta del 50%. En el test de Schirmer y el FSNS: casi la mitad de los pacientes alcanzan una mejoría de al menos el 20% en la semana 32. Comprobaron que este anticuerpo produce una depleción parcial de la célula B, del 50%, en sangre periférica.
¿Qué puede aportar el reumatólogo?Comparado con otras enfermedades, como la artritis reumatoide, en la que se ha recorrido un largo camino que ha conducido hasta un tratamiento de fondo muy satisfactorio, en el SSP queda mucho trabajo por hacer. Es necesario establecer una agenda de trabajo realista, rigurosa y factible que conduzca al desarrollo de una terapia de fondo eficaz en el SSP. El primer paso es evaluar las dificultades para interpretar los resultados de los ensayos que hemos revisado: 1) el número de pacientes incluido en la mayoría de los estudios es pequeño; 2) los criterios de clasificación utilizados son variados por lo que las cohortes no son homogéneas y no se pueden comparar; 3) no existen unos criterios unificados y estandarizados para definir enfermedad precoz, criterios de actividad y criterios de respuesta; 4) es crítico establecer y estandarizar los parámetros que detectan la mejoría en la disfunción glandular, las manifestaciones extraglandulares y la actividad de los biomarcadores; tampoco el grupo OMERACT ha planteado por el momento una metodología estandarizada, y 5) es de gran interés realizar siempre una metodología correcta en los ensayos clínicos. Conocidas estas, el próximo paso es intentar solucionarlas.
ConclusionesLos ensayos publicados con fármacos antirreumáticos orales modificadores de la enfermedad han mostrado resultados contradictorios y desalentadores, aunque algunos no se han comprobado en trabajos con una metodología científica correcta. Algunos tratamientos biológicos muestran resultados esperanzadores, como la modulación de las células B, terapia prometedora que en los próximos años tendrá que demostrar con certeza su utilidad. Los retos venideros son pues, la mejora en los diseños de los ensayos, el empleo de una clasificación uniforme y medición de resultados validada, junto con el surgimiento de nuevos agentes moleculares, biológicos e inmunomoduladores, que conduzcan a la adición de los tratamientos de fondo al arsenal terapéutico del SSP.