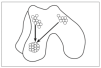
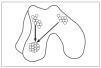
En la morfogénesis del esqueleto los procesos de la formación de articulaciones y la diferenciación de cartílago están estrechamente relacionados. Además, la regulación de la diferenciación del los condrocitos y la homeostasis de la matriz extracelular (MEC) son fundamentales para la función adecuada de la articulación. Cada elemento esquelético se forma a partir de la agregación de células mesenquimales y forman las condensaciones precartilaginosas; entonces ocurre la proliferación y la diferenciación de los condrocitos1 y el reemplazo de cartílago por hueso mediante la osificación endocondral (fig. 1A), lo cual le da rigidez al esqueleto. Sin embargo, para que éste tenga movilidad, es fundamental la formación de las articulaciones.
Figura 1. Condrogénesis y formación de articulaciones. A: el esqueleto de cartílago se forma a partir de la condensación de células mesenquimales y después, los moldes cartilaginosos. B: los moldes de cartílago se segmentan y forman las articulaciones sinoviales. Los condrocitos del centro de la agregación detienen su maduración en la interzona y se forman tres capas celulares. Las células de la capa media mueren por apoptosis y las capas adyacentes forman los cartílagos articulares.
Antes de que se inicie la hipertrofia de los elementos esqueléticos, en una región específica de la condensación precartilaginosa (fig. 1A), algunas células conforman la presunta región de la articulación llamada interzona2,3 (fig. 1B), que se caracteriza por ser una región de células altamente condensadas y aplanadas, agrupadas en tres capas4; estas células pierden su fenotipo diferenciado y producen una MEC rica en colágeno tipos I y III5, a diferencia de la MEC del cartílago, rica en colágeno tipo II y agrecano. El gen Wnt9a es la primera molécula que se expresa en la interzona3,6 e inhibe la expresión de Sox9, el marcador del linaje condrogénico, dando como consecuencia la disminución de la expresión de colágeno tipo II; además se activa la expresión de algunas pcoteínas morfogénicas de hueso (BMP) como factor de crecimiento y diferenciación 5 (GDF5)7 y algunos de sus antagonistas como nogina8 y cordina, que regulan el desarrollo de la articulación. Moléculas de adhesión celular como la integrina a5b1 podrían regular la formación de las articulaciones al mantener el estado diferenciado de los condrocitos9; así, para que se forme la interzona es necesaria la desaparición de las integrinas a5b1.
La cavidad articular se forma al desaparecer la capa central de la interzona mediante el proceso conocido como cavitación, mientras que las dos áreas de alta densidad podrían responder al GDF5 y diferenciarse para formar el cartílago articular que recubre las superficies articulares de los huesos adyacentes. Al inicio de la cavitación se incrementan el hialuronato y su receptor CD44; la adhesión celular disminuye, y posiblemente esto active la apoptosis que facilita la separación completa de los elementos esqueléticos adyacentes. Posiblemente, los diversos tipos celulares presentes en una articulación sinovial madura, como las células sinoviales, los condrocitos articulares permanentes y las células de la cápsula articular, tengan su origen en la interzona.
Los condrocitos del cartílago articular permanente que se originan de la interzona son muy parecidos a los condrocitos de la placa de crecimiento. En ambos tejidos observamos las distintas etapas de diferenciación del cartílago, como los condrocitos de reserva, en proliferación, prehipertróficos e hipertróficos. Sin embargo, ambos cartílagos tienen importantes diferencias; la más evidente es que los condrocitos articulares disminuyen considerablemente su maduración hacia la hipertrofia, sintetizan una MEC abundante en colágeno II y proteoglucanos y sólo presentan una reducida zona de cartílago hipertrófico en una región conocida como "marca de agua" o tide mark (fig. 2B), mientras que en la placa de crecimiento se observa una amplia región de condrocitos hipertróficos (fig. 2A) que finalmente serán reemplazados por osteocitos durante la osificación endocondral. Los condrocitos hipertróficos tienen un mayor volumen celular y producen una MEC muy específica, rica en colágeno tipo X10. La hipertrofia de los condrocitos se sigue de apoptosis, invasión de vasos sanguíneos, osteoclastos y otras células mesenquimales provenientes del pericondrio y la producción de la matriz de hueso. Por ello, el tamaño y la forma de los huesos largos y las articulaciones dependen de la regulación coordinada de la proliferación, la maduración y la hipertrofia de los condrocitos, que se regulan por múltiples señales; una de ellas es Indian Hedgehog (Ihh), que coordina la proliferación y la diferenciación de los condrocitos.
Figura 2. Mecanismos de la diferenciación de los condrocitos en un hueso en desarrollo y maduro. A: la señalización de las diferentes moléculas que regulan la diferenciación de los condrocitos, desde su etapa en reposo, proliferación, prehipertrófico e hipertrófico. En azul se muestran las moléculas que activan la diferenciación y en rojo las que la inhiben. B: la diferencia más notable entre el cartílago articular y la placa de crecimiento reside en la tasa de maduración de los condrocitos hacia la hipertrofia.
Ihh es producida por los condrocitos prehipertróficos e induce la expresión de PTHrP en el pericondrio, que regula la tasa a la que los condrocitos salen del ciclo celular y siguen a la hipertrofia11,12. Cuando los condrocitos prehipertróficos dejan de expresar Ihh continúan su maduración hacia la hipertrofia y se activa la expresión de Runx2 y Runx313 en el pericondrio, que inducen su diferenciación a osteoblastos. Por el contrario, el FGF18 a través de su receptor FGFR3 regula negativamente la proliferación celular y promueve la hipertrofia de los condrocitos; además, la activación constitutiva de FGFR3 inhibe la formación de articulaciones14.
El balance de estas señales puede determinar que los condrocitos en proliferación del molde cartilaginoso puedan convertirse en condrocitos prearticulares o en condrocitos prehipertróficos. No sólo en las etapas embrionarias el desequilibrio de las señales proliferativas y de hipertrofia tiene importantes consecuencias en el cartílago articular; la osteoartritis es un notable ejemplo de ese desequilibrio de señales. Es bien conocido que las lesiones del cartílago articular pueden resultar en osteoartritis, donde ocurre la degeneración de las articulaciones, evidenciada por la degradación del cartílago articular, la formación de tejido fibroso y el crecimiento de osteofitos. La formación de tejido fibroso es una respuesta de cicatrización inmediata a un daño traumático. Esta cicatrización en muchas ocasiones es promovida por el factor de crecimiento tumoral beta (TGFb), que a su vez podría inducir la formación de osteofitos que recapitulan la condrogénesis y la osificación endocondral en el cartílago articular adulto. Existen modelos animales que recapitulan esta enfermedad degenerativa de las articulaciones como los ratones mutantes de Smad315, una molécula que transduce la señal de TGFb; el análisis de estos ratones muestra el incremento de la hipertrofia de los condrocitos en el cartílago articular evidenciado por la expresión ectópica de colágeno tipo X. Por otro lado, también se ha relacionado la osteoartritis con el aumento de la expresión de Runx2. Otras vías de señalización que regulan la hipertrofia del cartílago y la osteoartritis son las BMP y Wnt. Cuando se inactiva el receptor BmprIa del ratón, se generan fenotipos similares a los de la osteoartritis humana16, y cuando se activa la vía de Wnt al bloquear a su antagonista Dkk, se revierten los procesos de destrucción del cartílago articular y la osificación endocondral17, lo que indica que estas vías permiten el mantenimiento del cartílago articular adulto.
La variación genética de las moléculas de las vías relacionadas con la proliferación y la diferenciación del condrocito como las que hemos mencionado podrían ser un importante factor de riesgo de osteoartritis en humanos. El estudio detallado de estos mecanismos tendría que evaluarse como una posible estrategia terapéutica para el mantenimiento del cartílago articular o para el diseño de estructuras biocompatibles con células que no pierdan su fenotipo diferenciado y sirvan como implantes en tejidos con daño articular.
Agradecimientos
Proyecto financiado por CONACYT Salud-2003-C01-98.