Evaluar la supervivencia del tratamiento con etanercept (ETN) y las causas de discontinuación en una cohorte local de pacientes en tratamiento biológico (TB). Comparar con la supervivencia general del resto de TB.
Pacientes y métodosEstudio observacional prospectivo de cohortes. Se han analizado los datos de diagnóstico, fecha de inicio y fin de tratamiento, así como la causa de interrupción de nuestro registro de TB. Mediante el método de Kaplan-Meier se ha estimado la supervivencia de ETN al año, a los 2 años y a los 5 años.
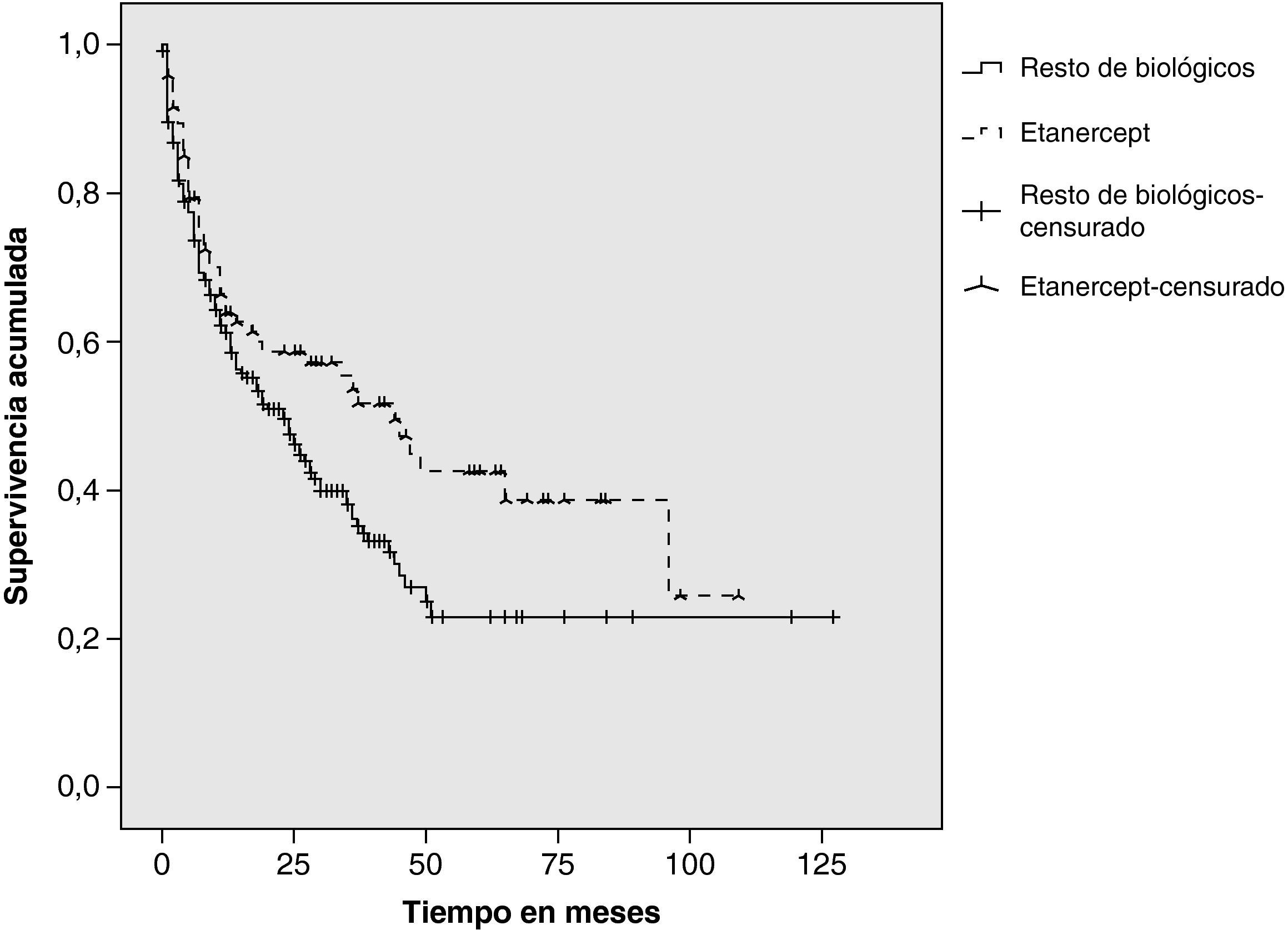
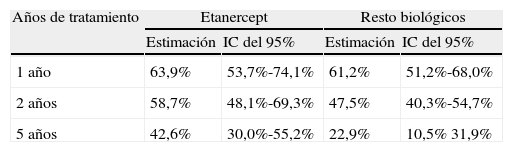
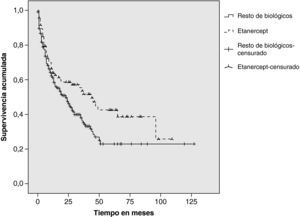
ResultadosDe un total de 205 pacientes que recibieron TB, 92 (45%) iniciaron tratamiento con ETN. En el 48% el diagnóstico fue artritis reumatoide, 33% espondilitis anquilosante, 11% artritis psoriásica y 8% otros diagnósticos (artritis idiopática juvenil, espondiloartritis asociada a enfermedad inflamatoria intestinal y síndrome SAPHO). Continúan con ETN 48 pacientes (52%). Las causas de discontinuación fueron: ineficacia (65%), acontecimiento adverso (33%), pérdida de seguimiento (2%). En 2 pacientes el tratamiento se retiró por remisión clínica. Los acontecimientos adversos fueron: infección (4 pacientes), reacción cutánea post-inyección (3), uveítis (3), neoplasia (2) y otros (3). La supervivencia estimada de ETN al año de tratamiento fue del 64% (IC del 95%, 54-74), a los dos años del 59% (48-69) y a los 5 años del 43% (30-52), y la del resto de TB fue del 61% (51-68), el 47,5% (40-55) y el 23% (10,5-32), respectivamente. Los tests estadísticos revelaron diferencias significativas (log-rank: p=0,024; Breslow: p=0,068; Tarone-Ware: p=0,040).
ConclusionesEn nuestra cohorte de pacientes la supervivencia estimada de ETN en el primero, segundo y quinto de año de tratamiento es superior a la obtenida con el resto de TB, siendo la diferencia significativa a los 5 años.
To evaluate the duration of etanercept (ETN) treatment and motives for discontinuation in our local cohort of patients with rheumatic pathology and compare them to the group with other biological treatments.
Patients and methodsProspective observational cohort study. Disease diagnosis, start and end date and motive for discontinuation were recorded. Survival estimation was explored using Kaplan-Meier analysis with remaining patients censored at 1-year, 2-years and 5-years follow-up.
ResultsNinety-two (45%) out of 205 patients started ETN treatment. Disease diagnoses recorded were: 48% rheumatoid arthritis, 33% ankylosing spondylitis, 11% psoriatic arthritis, 8% others (juvenile idiopathic arthritis, inflammatory bowel disease related spondylitis, SAPHO syndrome). 52% of patients are still on the drug. The motives for discontinuation were: inefficacy (65%), adverse events (33%) and lack of compliance (2%). Two patients discontinued ETN due to prolonged disease control. Adverse events were: infection (4 patients), post-injection skin reaction (3), uveitis (3), neoplasia (2) and others (3). Using a Kaplan–Meier analysis, at 1-year 64% (CI95% 54-74) of patients with ETN treatment had not experienced treatment failure, at 2-years, 59% (48-69) and at 5-years, 43% (30-52). With the rest of biologicals estimated survival was 61% (51-68), 47,5% (40-55) and 23% (10,5-32) respectively. Statistical analysis revealed significant differences (log-rank: P=.024; Breslow: P=.068; Tarone-Ware: P=.040).
ConclusionsIn our cohort of patients treated with ETN the estimated survival was better than patients treated with other biological drugs at 1-year, 2-years and 5-years.
La terapia biológica (TB), iniciada con los inhibidores del factor de necrosis tumoral alfa (TNF-α) infliximab (INF), adalimumab (ADA) y etanercept (ETN), ha cambiado radicalmente el tratamiento de ciertas enfermedades reumáticas como la artritis reumatoide (AR), la espondilitis anquilosante (EA) o la artritis psoriásica (APs). La eficacia de estos fármacos anti-TNF ha sido demostrada en numerosos ensayos clínicos; sin embargo, no existen ensayos clínicos comparativos y los estudios de metaanálisis no demuestran superioridad entre ellos1,2.
Estudios recientes basados en los registros nacionales de pacientes con AR y EA en terapia biológica han comunicado menores tasas de discontinuación con ETN que con ADA e INF3–6. En pacientes con APs se han descrito tasas de supervivencia superiores para ETN y ADA que con INF7, un dato que no se ha confirmado en otro estudio posterior8.
El objetivo de nuestro estudio es evaluar la supervivencia del tratamiento con etanercept (ETN) y las causas de su discontinuación en una cohorte local de pacientes en tratamiento biológico, en situación de práctica clínica real y compararla con la supervivencia general del resto de terapia biológica.
MétodosSe realizó un estudio observacional prospectivo de cohortes utilizando los datos del registro de pacientes con terapia biológica de la sección de reumatología del Hospital Marina Baixa. Este registro se inició en el año 2001, con el fin de valorar la seguridad y el manejo a largo plazo de estos fármacos en la práctica clínica real y compararlo con registros de otras poblaciones. Incluye, previa obtención del consentimiento informado para acceder a su historia clínica, a cualquier paciente que haya recibido al menos una dosis de alguno de los fármacos biológicos por parte de la sección de reumatología. Se trata de un estudio observacional en práctica clínica real, sin intervención en la elección, inicio o discontinuación del tratamiento biológico.
Los datos de los pacientes se recogieron por los propios reumatólogos de la unidad en una hoja de cálculo informática (Excel 2003® Microsoft TM), cuyo acceso está restringido para cumplir con la Ley de protección de datos vigente en la actualidad.
El protocolo de estudio fue aprobado por los comités éticos locales correspondientes siguiendo las directrices de la declaración de Helsinki.
Variables del estudioSe incluyeron: características epidemiológicas (edad, sexo), diagnóstico principal, año de diagnóstico y el resultado de la prueba de Mantoux y booster. Se determinaron en los pacientes con AR, AIJ o APs, el factor reumatoide (FR) en U/ml y los anticuerpos antipéptidos citrulinados (anti-PCC) mediante técnica de ELISA de segunda generación. En pacientes con espondiloartropatía se analizó la presencia del antígeno de histocompatibilidad HLA-B27.
Para cada fármaco biológico recibido de forma correlativa, se recogieron el tipo de fármaco y la fecha de inicio y de fin (y, por tanto, el tiempo de tratamiento recibido). Las causas de discontinuación se clasificaron en: ineficacia, complicación, remisión clínica y pérdida de seguimiento.
Los diferentes tratamientos se introdujeron de forma prospectiva para cada paciente, desde el inicio de la terapia. En aquellos pacientes que habían iniciado previamente el tratamiento, por ejemplo en otro centro, se incluyeron los datos de forma retrospectiva.
Análisis estadísticoMediante el método de Kaplan-Meier se ha estimado la función de supervivencia y se han trazado las curvas para los tratamientos con ETN y para el resto de biológicos en conjunto. Para comprobar si existen diferencias entre ambos grupos se han utilizado diferentes test (log-rank, Breslow, Tarone-Ware) mediante el paquete estadístico PASW Statistics 18®.
ResultadosDesde el año 2001, de un total de 205 pacientes que iniciaron TB, 92 (45%) pacientes recibieron ETN (51% como primer fármaco biológico, 42% como segundo fármaco, 7% como tercer fármaco y 2% como cuarto fármaco).
Los diagnósticos de los pacientes que recibieron ETN fueron los siguientes: AR 48%, EA 33%, APs 11%, otros 8% (AIJ, espondiloartritis asociada a enfermedad inflamatoria intestinal y síndrome SAPHO). En la actualidad 48 pacientes continúan tratamiento con ETN (52%).
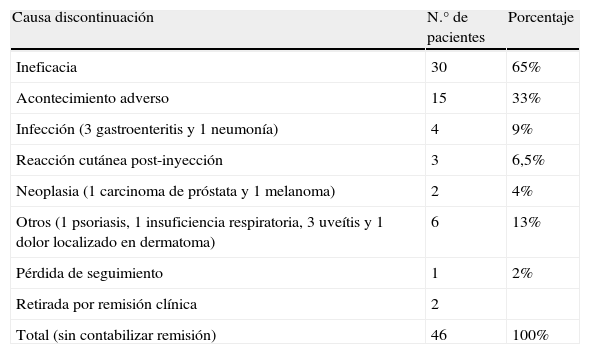
Causas de discontinuaciónLas causas de discontinuación de ETN fueron las siguientes (tabla 1): ineficacia en 30 pacientes (65%), acontecimiento adverso en 15 pacientes (33%) y pérdida de seguimiento en 1 paciente (2%). En 2 pacientes el tratamiento se retiró por remisión clínica prolongada.
Causas de discontinuación de ETN
| Causa discontinuación | N.° de pacientes | Porcentaje |
| Ineficacia | 30 | 65% |
| Acontecimiento adverso | 15 | 33% |
| Infección (3 gastroenteritis y 1 neumonía) | 4 | 9% |
| Reacción cutánea post-inyección | 3 | 6,5% |
| Neoplasia (1 carcinoma de próstata y 1 melanoma) | 2 | 4% |
| Otros (1 psoriasis, 1 insuficiencia respiratoria, 3 uveítis y 1 dolor localizado en dermatoma) | 6 | 13% |
| Pérdida de seguimiento | 1 | 2% |
| Retirada por remisión clínica | 2 | |
| Total (sin contabilizar remisión) | 46 | 100% |
Los acontecimientos adversos registrados fueron: infección en 4 pacientes, reacción cutánea post-inyección en 3 pacientes, neoplasia en 2 pacientes y otras causas en 6 pacientes.
Del grupo total de pacientes en TB, en 7 (3%) de ellos el reumatólogo responsable lo interrumpió por remisión clínica prolongada. De ellos, 4 pacientes reiniciaron el mismo tratamiento por empeoramiento y se contabilizaron como «continuación» para el cálculo de la supervivencia.
En otros 6 pacientes el tratamiento se interrumpió de forma preventiva (gestación, cefalea con parestesias, granulomatosis nasofaríngea en estudio, infarto agudo de miocardio, angor inestable y otro motivo no conocido) y se reinició posteriormente. Estos casos también se contabilizaron como «continuación» del tratamiento. Las retiradas por infección se contabilizaron como «discontinuación», aunque el tratamiento se reiniciara a los pocos meses.
Dos pacientes que abandonaron por motivos personales la TB y, posteriormente, reiniciaron el mismo fármaco se contabilizaron como «discontinuación» y tratamiento nuevo.
Duración del tratamiento y supervivencia estimadaLa duración media del tratamiento con ETN fue de 53 meses (mediana 44 meses) y la del resto de biológicos fue de 43 meses (mediana 23 meses). Se estimó la supervivencia a 1, 2 y 5 años (tabla 2). Las funciones de Kaplan-Meier mostraron mayor supervivencia para ETN que para el resto de tratamientos biológicos en conjunto (fig. 1). Los tests estadísticos de comparación entre ambos grupos revelaron diferencias significativas (log-rank: p=0,024; Breslow: p=0,068; Tarone-Ware: p=0,040).
Al comparar la supervivencia de ETN entre ambos sexos no se encontraron diferencias significativas. Tampoco se encontraron diferencias al comparar entre los diagnósticos de AR y EA (resultados no incluidos).
DiscusiónLos ensayos clínicos son el patrón de oro de la evidencia clínica, pero tienen ciertas limitaciones. Suelen incluir a un número limitado de pacientes, con rigurosos criterios de selección, como la exclusión de enfermedades concomitantes, y su periodo de seguimiento es corto9. Sin embargo, los registros observacionales ofrecen una valoración continua y real de los fármacos estudiados y permiten obtener un conocimiento mayor sobre la eficacia y seguridad a largo plazo. Los registros locales de fármacos ofrecen una visión cercana y real de lo que ocurre en el seguimiento cotidiano. En la práctica clínica los acontecimientos adversos, la falta de respuesta primaria y la ineficacia secundaria son problemas habituales. Incluso con los nuevos TB no se alcanza una respuesta satisfactoria en un 40-50% de los pacientes con AR y es frecuente que dejen de ser eficaces con el tiempo10.
ETN es un receptor soluble del TNF completamente humano, mientras que INF y ADA son anticuerpos monoclonales frente al TNF (INF es quimérico y ADA es completamente humano). Su farmacocinética es diferente en algunos aspectos. En concreto, la semivida de eliminación de ETN es menor y la formación de anticuerpos neutralizantes es poco frecuente11. Por otra parte, ETN no ha demostrado eficacia en el tratamiento de la enfermedad inflamatoria intestinal donde los anticuerpos monoclonales anti-TNF sí lo han hecho12,13. Además, parece que existe menor incidencia de tuberculosis con ETN respecto a INF y ADA14-17. Todo ello hace probable que los datos de eficacia y seguridad no sean idénticos en los tres anti-TNF.
En nuestro grupo de pacientes, el tratamiento con ETN mostró mayor supervivencia que el resto de terapia biológica considerada en conjunto. Esta diferencia fue relevante a partir del segundo año de tratamiento, alcanzando la significancia estadística en el quinto año. Estos datos son comparables con los comunicados por los registros nacionales de AR de Alemania5 (70% de supervivencia el primer año), Dinamarca3 (56% el segundo año), Italia-Lombardía18 (62,5% a los 3 años) y difieren del registro sueco4 (70% el quinto año).
Nuestro estudio no encuentra diferencias de supervivencia de tratamiento en el grupo ETN ni en el resto de TB al comparar los pacientes con diagnóstico de AR y EA. Esto difiere de lo reportado por el registro checo y por BIOBADASER, que describen mayor supervivencia de los anti-TNF en los pacientes con EA en comparación con AR, aunque el registro checo solo incluye a los pacientes que recibieron TB por primera vez19,20.
No obstante, nuestro estudio presenta limitaciones. La principal es el número restringido de pacientes que puede condicionar la potencia estadística. Para no disminuir más el número, se han incluido los tratamientos sin tener en cuenta los biológicos utilizados previamente, y se sabe que esto condiciona la eficacia21. Por otra parte, al utilizar datos de un registro previo no se han podido incluir variables de actividad clínica, duración de la enfermedad o fármacos anteriores, que hubieran sido deseables para mostrar una tabla comparativa entre los diferentes fármacos y descartar sesgos de selección. Además nuestros datos pertenecen a pacientes con diversos diagnósticos y la eficacia de la TB puede ser diferente para cada patología22.
Nuestro estudio, en concordancia con el resto de registros, muestra una menor tasa de discontinuación de ETN que el resto de TB. Esto podría deberse a una menor frecuencia de acontecimientos adversos y/o a una mayor eficacia clínica. Sin embargo, el diseño del estudio no es el adecuado para realizar comparaciones directas, sólo permite el planteamiento de hipótesis que deben ser comprobadas con ensayos clínicos aleatorizados.
Finalmente, en nuestro caso este tipo de registro local ha sido útil para intentar homogeneizar el manejo de los pacientes en TB y mantener la alerta sobre la aparición de efectos adversos.
En resumen, los datos extraídos de nuestro registro local muestran una mayor supervivencia de ETN al compararlo con el resto de TB, de forma similar a otros registros nacionales.
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.
Gracias a la Dra. Loreto Carmona por su colaboración para la redacción del artículo; sin su entusiasmo no haríamos públicos los resultados de nuestras modestas investigaciones.