El abatacept (ABA) es una proteína de fusión recombinante humana que permite el bloqueo de la señal co-estimuladora del linfocito T, evitando su activación. Se han realizado estudios aleatorizados y controlados de eficacia y seguridad del ABA combinado con metotrexato (MTX), frente a MTX en monoterapia y frente a infliximab (IFB) combinado con MTX en pacientes con artritis reumatoide naive a terapia biológica. ABA ha demostrado ser más eficaz que el MTX y al menos igual que IFB+MTX, en términos de actividad y remisión clínica, funcionalidad física y disminución de la progresión radiológica. Los datos de seguridad a 7 años han demostrado que el fármaco es equiparable al MTX en monoterapia y más seguro que la combinación IFB+MTX, aunque las infecciones continúan siendo el principal riesgo del uso de ABA. En esta revisión se resumen los datos de seguridad y eficacia de los estudios AIM, ATTEST, fase IIb IM101-100 y AGREE.
Abatacept (ABA) is a recombinant human fusion protein that blocks co-stimulation signals on T lymphocytes, impeding their activation. Randomized and controlled trials examining efficacy and safety have been performed with ABA combined with methotrexate (MTX), vs MTX monotherapy and vs infliximab (IFB) combined with MTX in patients with Rheumatoid Arthritis and who are naïve to biologic therapy. ABA has shown to be more effective than MTX and at least as effective as IFB+MTX, in terms of activity and clinical remission, physical function and reduction in radiological progression. Safety data at 7 years have shown that the drug is comparable to MTX in monotherapy and safer than the IFB+MTX combination, although infections still constitute the main risk when using ABA. This review summarizes the safety and efficacy data of the AIM, ATTEST, Phase IIb IM101-100 and AGREE trials.
Los datos epidemiológicos disponibles en la Sociedad Española de Reumatología cifran la prevalencia de la artritis reumatoide (AR) en la población española en el 0,5%1, lo que significa que al menos 200.000 personas sufren esta enfermedad en nuestro país. La incidencia anual de AR en España es de 8,3 casos/100.000 habitantes, similar a los países de nuestro entorno2. La enfermedad afecta preferentemente a la mujer (3:1, relación mujer/hombre) con cierta predilección por la 4.a y 5.a década de la vida, lo que condiciona un largo tiempo de afectación articular y un importante incremento de la morbi-mortalidad, que está globalmente aumentada respecto a la población general.
En las últimas décadas se ha sugerido que la AR se está presentando con un curso evolutivo más benigno. Sin embargo, esta apreciación probablemente se deba a que los recientes avances en el conocimiento de la historia natural y de la patogenia de la AR han permitido tanto un diagnóstico más temprano como un tratamiento más agresivo y no a cambios reales en la agresividad intrínseca de la enfermedad. Respecto a la terapia, durante la última década el arsenal terapéutico de la AR se ha visto intensamente reforzado por nuevos fármacos de naturaleza biológica. Entre ellos se encuentra el abatacept (ABA) una proteína de fusión recombinante humana formada por la fracción extracelular del receptor CTLA-4 y un dominio Fc de IgG1 humana. Esta molécula permite in vivo el bloqueo de la señal de co-estimulación del LT evitando su activación. La eficacia y seguridad del ABA en pacientes con AR ha sido avalada por los resultados de ensayos clínicos controlados y aleatorizados en pacientes con AR y por los datos de seguimiento a largo plazo de los mismos. Esta revisión se centrará en los datos de eficacia y seguridad obtenidos de los ensayos clínicos AGREE, AIM, ATTEST, y Estudio fase IIb IM 101-100, en los que se estudió el ABA en pacientes con AR naive a metotrexato o con respuesta inadecuada a metotrexato (MTX) que no habían sido tratados con fármacos anti-factor de necrosis tumoral (TNF)-α.
Resultados de eficacia clínicaEstudio AIM (abatacept en respuesta inadecuada a metotrexato)Estudio doble ciego, aleatorizado, controlado con placebo, multicéntrico, en fase III de un año de duración en dosis paralelas que incluyó a pacientes con AR activa (N=656) y con una respuesta inadecuada a fármacos antirreumáticos modificadores de enfermedad (FAME) incluido metotrexato (MTX) y que nunca habían sido tratados con anti-TNF. Los objetivos primarios se evaluaron a los 6 meses y posteriormente los pacientes pasaron a una fase de extensión abierta con seguimiento a los 2 y 5 años
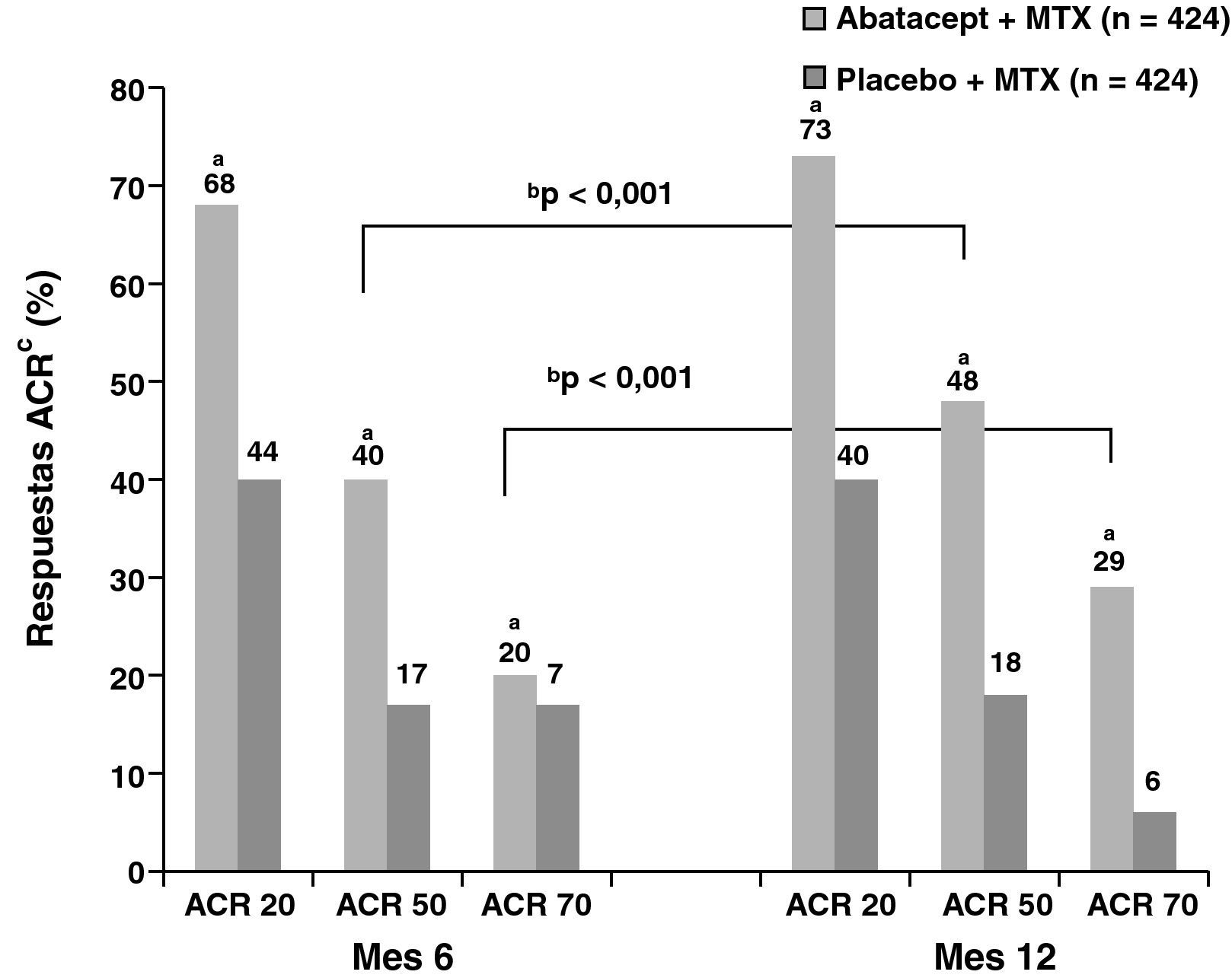
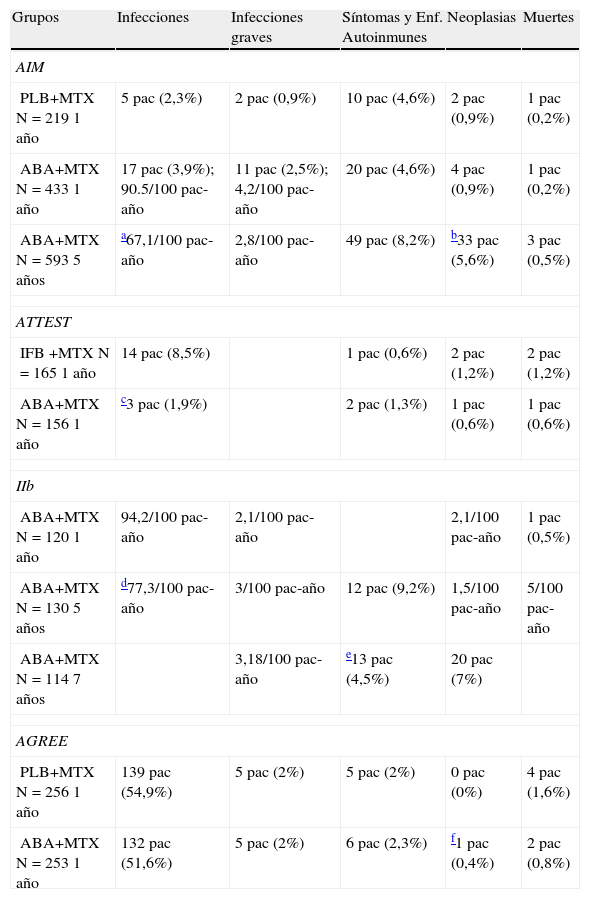
Las tasas de respuesta obtenidas mediante índices compuestos ACR y DAS28 en el grupo ABA+MTX (N=433) fueron altas incluso desde el sexto mes frente al grupo de MTX+placebo (PLB) (N=219) (ACR50 39,9 vs. 16,8%; ACR70 19,8 vs. 6,5%; p<0,001) y se incrementaron de forma progresiva al año y con diferencias respecto al control (ACR50 48,3 vs. 18,2% y ACR70 28,8 vs. 6,1%, p<0,001) (fig. 1)3. Respecto a los datos obtenidos en la valoración mediante DAS28, al inicio ambos grupos de tratamiento presentaban actividad clínica elevada (media de DAS28=6,4). A los 6 meses estas cifras se redujeron en el grupo de ABA+MTX respecto al control tanto al analizar por baja actividad (DAS28≤3,2; 30,1 vs. 10,0%; p<0,001) como por remisión (DAS28≤2,6; 14,8 vs. 2,8%; p<0,001). Al completar el año del estudio, un 44,1% se encontraban en baja actividad y más de una cuarta parte de pacientes (25,4%) del brazo de tratamiento estaban en remisión frente a tan solo 1,9% en el grupo de PLB+MTX.
Respuestas de ACR a los 6 y 12 meses en el grupo de abatacept en comparación con placebo.
ap<0,001 para abatacept frente a placebo; bp<0,001 para abatacept solo, 12 frente a 6 meses; cpoblación ITT, en la que todos los abandonos se consideraron como no respondedores en cuanto a ACR después de su abandono. Abreviaturas: ACR: criterio de respuesta American College of Rheumatology; ITT: intención de tratar; MTX: metrotexato.
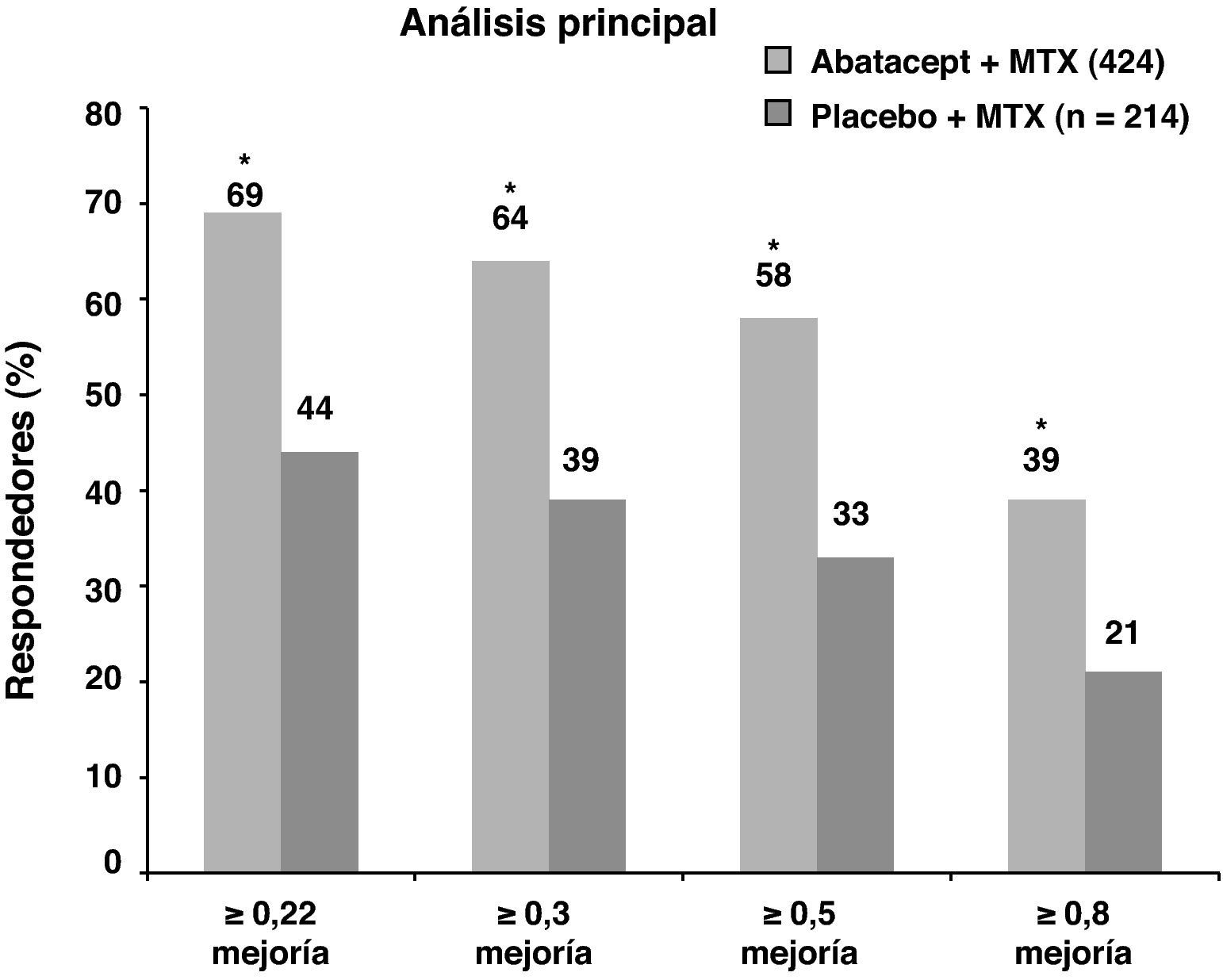
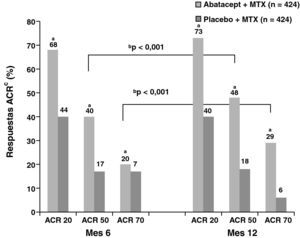
En relación a la función física ambos grupos de tratamiento presentaban cifras elevadas de HAQ-DI (1,7) al inicio. Al año se consideraron respondedores a aquellos pacientes que conseguían al menos una diferencia en el HAQ-DI≥0,3 unidades respecto de la basal. Siguiendo este criterio, el grupo de ABA+MTX presentó mejorías estadísticamente significativas frente al grupo placebo (63,7 vs. 39,3%; p<0,001) (fig. 2). Además, se observó mejoría en el componente físico y mental en los test de calidad de vida, en los test de calidad de sueño medida por sleep problem index (SPI) y en la fatiga determinada por escala visual analógica (EVA) durante el primer año de seguimiento en los pacientes del grupo ABA + MTX respecto del grupo control3.
Porcentaje de pacientes tratados con abatacept que alcanzaron respuesta HAQ-DI a los 12 meses.
*p<0,001 para abatacept frente a placebo; basado en la población ITT, con pacientes retirados considerados como no respondedores; los respondedores según HAQ alcanzaron una reducción media desde el basal de 0,3 unidades. Abreviaturas: HAQ: cuestionario de valoración de salud; ITT: intención de tratar: MTX: metrotexato.
La importancia de este ensayo clínico radica no solo en los buenos resultados obtenidos en tasas de respuestas, sino, y sobre todo, por los datos de progresión del daño radiográfico. Se evaluó el cambio respecto del valor inicial del daño estructural articular tanto en la puntuación total de Sharp (TSS) modificado por Genant como en sus dos componentes, la erosión y el pinzamiento. Al año, el grupo de ABA+MTX demostró un retardo en la progresión radiológica de aproximadamente la mitad en la puntuación total en comparación con PLB+MTX (0,25 vs. 0,53, p<0,029)3.
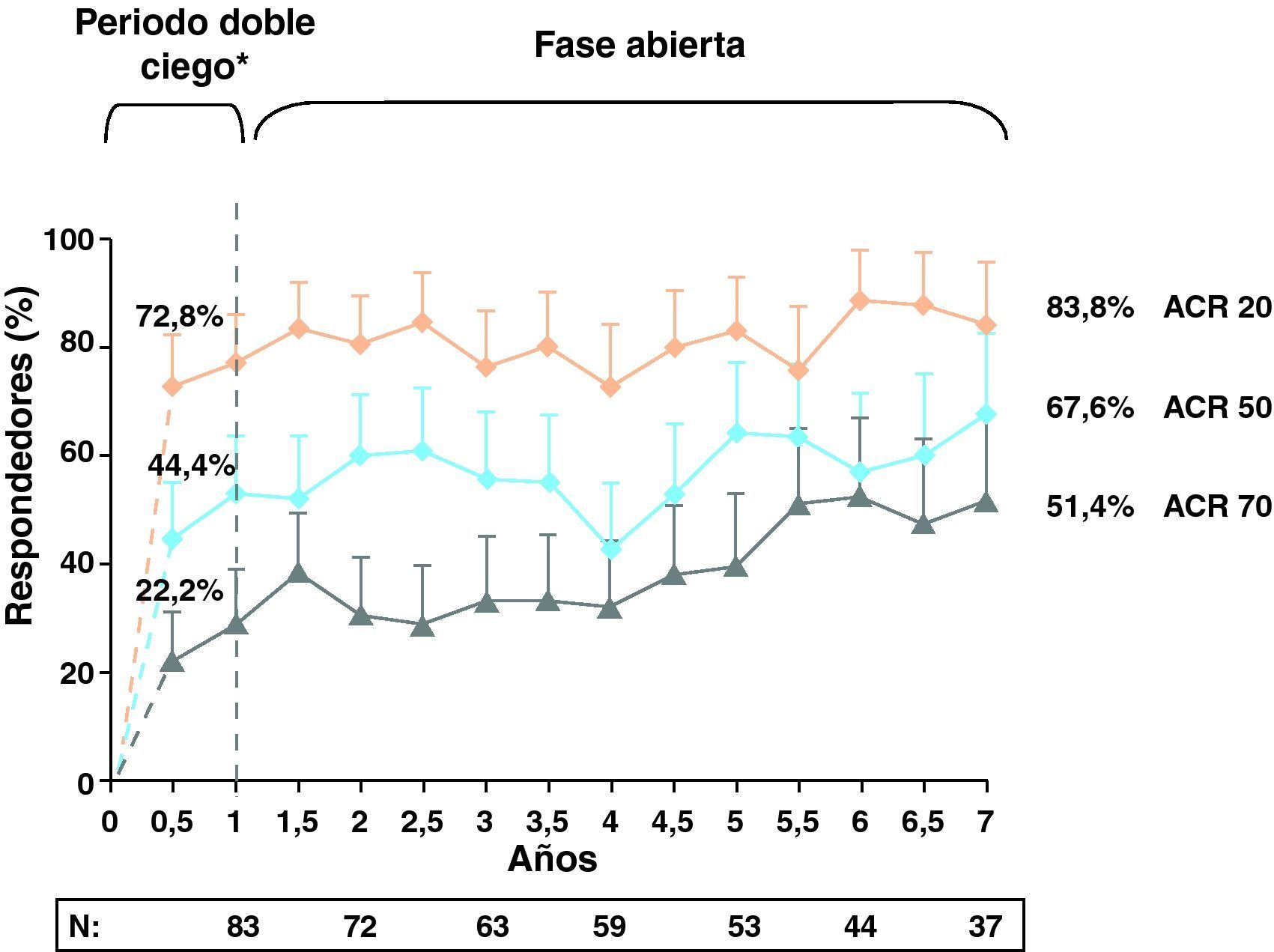
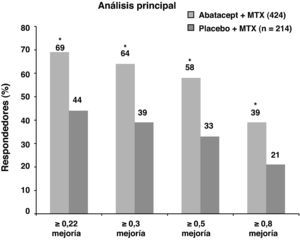
Tras el primer año, el ensayo continuó en su fase de extensión abierta a 2 y 5 años. A los 5 años hasta el 70,4% de los pacientes del grupo de ABA+MTX permanecían en el estudio. En este periodo de extensión las cifras de respuesta ACR, lejos de disminuir o estabilizarse, se incrementaron de manera progresiva, presentando cifras elevadas de respuesta ACR50: 61,7 y 61,1% y ACR70 38 y 39,6% a 2 y 5 años, respectivamente. Estos porcentajes se mantuvieron estables hasta los 7 años de seguimiento (fig. 3). Al igual ocurrió con los resultados de respuestas DAS28 durante este periodo de seguimiento: DAS28≤3,2: 56,1 y 54,7% y DAS28 ≤2,6: 30,9 y 33,7% también a los 2 y 5 años, respectivamente4.
Porcentaje de respuestas ACR a los 7 años.
Se muestran las tasas de respuesta de los 0–6 meses; población ITT: análisis de casos observados basado en todos los pacientes aleatorizados a abatacept que entraron en la ELP y de los que se disponía de datos en la visita de interés. Abreviaturas: ITT: intención de tratar; DC: doble ciego; ELP: extensión a largo plazo.
De forma paralela a la respuestas clínicas, se observó una importante mejoría en el HAQ-DI y SF-36 que seguía manteniéndose a los 2 y a los 5 años5,6.
Respecto al daño estructural, al 2.° año existió una reducción del 57% del daño articular (reducción en erosión 66% y en pinzamiento 47%). En los años siguientes se mantuvo el enlentecimiento del daño estructural total (0,37, 0,34 y 0,26), de las erosiones (0,23, 0,23 y 0,11) y del pinzamiento (0,14, 0,11 y 0,14). A los 5 años, un 45,1% de los pacientes continuaban sin progresión del daño estructural7.
Todos estos datos confirman la eficacia clínica de abatacept asociado a FAME incluido MTX y naïve a terapia anti-TNF.
El estudio ATTEST (AbaTacept o infliximab frente a placebo, ensayo de tolerancia, eficacia y seguridad en el tratamiento de la AR)Único ensayo clínico aleatorizado, doble ciego, multicéntrico en fase III que comparó directamente la eficacia de dos terapias biológicas en un mismo estudio, ABA (10mg/kg/4sem; N=156) e infliximab (IFB) (3mg/kg/8sem; N=165) frente a PLB (N=110) en combinación con MTX en pacientes con AR con respuesta inadecuada a MTX solo. El objetivo primario fue la tasa de respuesta DAS28 y ACR20 a los 6 meses.
A los 6 meses, en ambos brazos de tratamiento (ABA e IFB) cerca del doble de los pacientes alcanzaban un DAS28≤3,2 (ABA 20,7 vs. IFB 25,6%) respecto a MTX+PLB (10,8%) y más del triple alcanzaban una remisión (DAS28≤2,6) (ABA 11,3 vs. IFB 12,8%) respecto a MTX (2,9%). Curiosamente, al año los datos del grupo de ABA tendían a aumentar (baja actividad 35,3% y remisión 18,7%) frente al estancamiento de los resultados obtenidos con IFB (22,4 y 12,2%, respectivamente) con una reducción media en los valores de DAS28 a los 6 y 12 meses en −2,55 y −2,88 unidades en el grupo ABA frente a −2,25 y −2,25 unidades en el grupo de IFB (vs. −1,48 en el grupo placebo, p<0,001). Los datos de respuestas ACR en todos los tiempos eran similares en ambos grupos de tratamiento y superiores a MTX, incluso desde el 6.° mes (ACR50 y 70: ABA: 40,4 y 20,5%; IFB: 37 y 24,2%; MTX: 20 y 9,1%; p<0,05), pero se veían incrementadas al año de manera significativa en el grupo tratado con ABA (ABA: 45,5 y 26,3%) mientras que se estancaban los datos de IFB (36,4 y 20,6%)8.
A pesar de las limitaciones existentes en este estudio relativas a la utilización sistemática de IFB solo a 3mg/kg, la eficacia de ABA quedó clara, comportándose de manera similar al IFB en los primeros meses, con una tendencia a superarlo en eficacia a lo largo del tiempo de seguimiento.
Los datos a 2 años de seguimiento presentados en el EULAR 2009 en Copenhague, que incluyeron a más del 90% de los pacientes inicialmente tratados, pusieron de manifiesto el incremento de los datos de baja actividad (42% en el 2.° año respecto del 35,3% en el primero) y de remisión (26 vs. 18,7%) en el grupo ABA+MTX. Estos resultados fueron similares en el grupo tratado con IFB+MTX que tras completar el año cambiaron a ABA+MTX, incrementándose la tasa de los respondedores tanto en baja actividad (45 vs. 22,4%) como en remisión (29 vs. 12,2%), al igual que en las respuestas ACR del 2.° respecto del 1.er año (ACR50 71 vs. 36,4%; ACR70 45 vs. 20,6%,)9,10
Ensayo fase IIbEstudio multicéntrico, aleatorizado y controlado con placebo para evaluar la seguridad y eficacia clínica a 12 meses de dos dosis diferentes de ABA: 2mg/kg (N=105) y 10mg/kg (N=115) o placebo (N=119), en combinación a MTX y administradas por vía intravenosa en pacientes con AR activa con respuesta insuficiente a MTX11. Al año de seguimiento, los pacientes fueron cambiados a una dosis fija de 10mg/kg/4sem, dado que la dosis de 2mg/kg/4sem no presentaba diferencias significativas respecto a PLB realizándose un seguimiento en fase de extensión abierta a 5 años12 y 7 años 13.
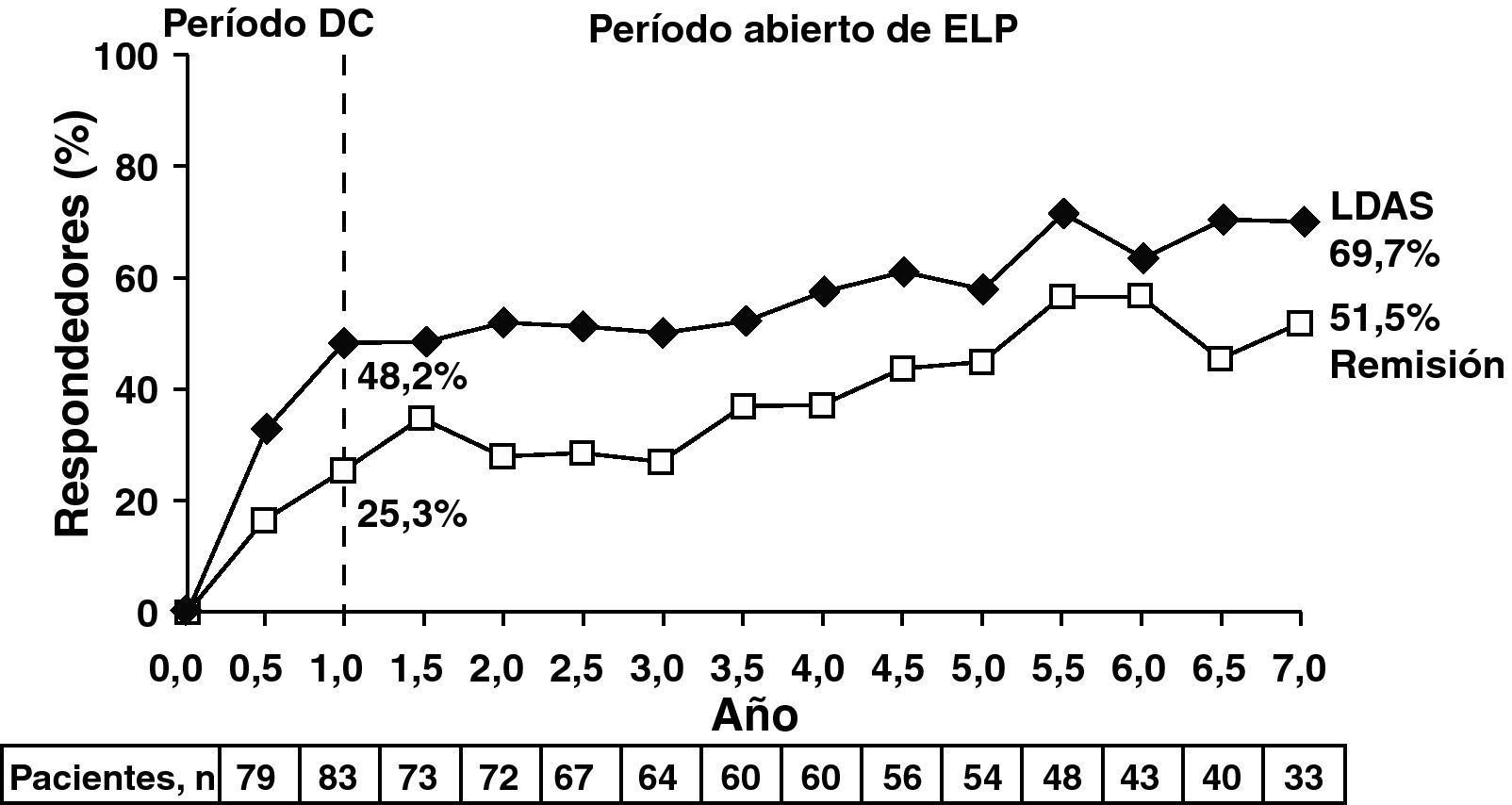
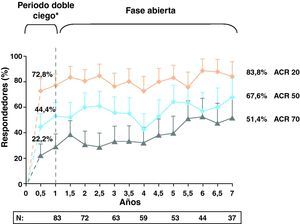
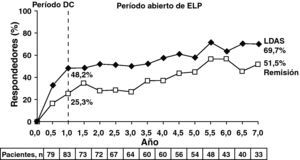
Los datos de respuesta clínica fueron incrementándose progresivamente a lo largo del tiempo de seguimiento (DAS28≤3,2: 48,2, 58,5 y 69,7% y DAS28≤2,6: 25,3, 45,3 y 51,5% para 1, 5 y 7 años, respectivamente). Igualmente ocurrió con las tasas de respuestas ACR70 que fueron significativas desde el 1.er al 7.° año (28,9 vs. 51,4%).
Cabe destacar la elevada tasas de remisión (DAS28≤2,6) y de respuestas ACR70 alcanzadas a los siete años que llegó a darse en más de la mitad de los pacientes tratados (51,5 y 51,4%) (fig. 4)13.
LDAS y remisión DAS28 a los 7 años en pacientes tratados con abatacept.
Los datos están basados en todos los pacientes originalmente aleatorizados a abatacept 10mg/kg que entraron en la ELP, con datos disponibles en la visita de interés (análisis «casos observados»); remisión definida según DAS28 (PCR)=DAS28 <2,6; LDAS=DAS28 (PCR) ≤3,2. Abreviaturas: DAS28: escala de actividad de la enfermedad; DC: doble ciego; ELP: extensión a largo plazo; IC: intervalo de confianza; LDAS: estado de la actividad de la enfermedad bajo.
Estudio realizado en pacientes con AR, naïve a MTX, con <2 años de evolución y con factores de mal pronóstico (≥12 articulaciones dolorosas, ≥10 articulaciones inflamadas, proteína C reactiva ≥ 0,45mg/dl, factor reumatoide y/o anti-CCP positivo y evidencia de erosión radiográfica en manos, muñecas o pies). En este estudio, los pacientes fueron aleatorizados 1:1 a recibir 10mg/kg/4sem de ABA+MTX o PLB+MTX.
Al año, el grupo de tratamiento (ABA+MTX) alcanzó un ACR50 57,4 vs. 42,3% en el grupo MTX+PLB; y un porcentaje de remisión DAS28≤2,6 de 41,4 vs. 23,3%, consiguiendo reducciones globales en el DAS28 de −3,22 (vs. −2,49) (p<0,001)14.
En este estudio se obtuvieron datos de progresión del daño estructural mediante seguimiento radiográfico. Los datos fueron similares a los obtenidos en el estudio AIM, así, al año, el grupo de ABA+MTX presentaba un cambio medio de la puntuación total de 0,63 vs. 1,06 en el grupo MTX+PLB mediante el TSS modificado por Genant. Además, se observó que los pacientes en el grupo ABA+MTX presentaban un cambio igual o superior a 0,3 unidades respecto a los datos basales en el HAQ-DI y una mejoría significativa en los componentes físico y mental del SF-3615.
Resultados de seguridad clínicaLos estudios de seguridad han ocupado siempre un papel muy importante en el desarrollo de los fármacos biológicos en reumatología. En los estudios AIM, ATTEST, AGREE y fase IIb, los datos de seguridad del ABA fueron también extensamente reportados. En la tabla 1 se resumen los datos sobre infecciones, síntomas y enfermedades autoinmunes, neoplasias y muertes observadas en estos estudios y en los periodos de extensión.
ABA: abatacept; IFB: infliximab; MTX: metotrexato; Pac: pacientes; PLB: placebo.
| Grupos | Infecciones | Infecciones graves | Síntomas y Enf. Autoinmunes | Neoplasias | Muertes |
| AIM | |||||
| PLB+MTXN=2191 año | 5 pac (2,3%) | 2 pac (0,9%) | 10 pac (4,6%) | 2 pac (0,9%) | 1 pac (0,2%) |
| ABA+MTXN=4331 año | 17 pac (3,9%); 90.5/100 pac-año | 11 pac (2,5%); 4,2/100 pac-año | 20 pac (4,6%) | 4 pac (0,9%) | 1 pac (0,2%) |
| ABA+MTXN=5935 años | a67,1/100 pac-año | 2,8/100 pac-año | 49 pac (8,2%) | b33 pac (5,6%) | 3 pac (0,5%) |
| ATTEST | |||||
| IFB +MTXN=1651 año | 14 pac (8,5%) | 1 pac (0,6%) | 2 pac (1,2%) | 2 pac (1,2%) | |
| ABA+MTXN=1561 año | c3 pac (1,9%) | 2 pac (1,3%) | 1 pac (0,6%) | 1 pac (0,6%) | |
| IIb | |||||
| ABA+MTXN= 1201 año | 94,2/100 pac-año | 2,1/100 pac-año | 2,1/100 pac-año | 1 pac (0,5%) | |
| ABA+MTXN=1305 años | d77,3/100 pac-año | 3/100 pac-año | 12 pac (9,2%) | 1,5/100 pac-año | 5/100 pac-año |
| ABA+MTXN=1147 años | 3,18/100 pac-año | e13 pac (4,5%) | 20 pac (7%) | ||
| AGREE | |||||
| PLB+MTXN=2561 año | 139 pac (54,9%) | 5 pac (2%) | 5 pac (2%) | 0 pac (0%) | 4 pac (1,6%) |
| ABA+MTXN=2531 año | 132 pac (51,6%) | 5 pac (2%) | 6 pac (2,3%) | f1 pac (0,4%) | 2 pac (0,8%) |
Las infecciones graves más habituales registradas durante los 2 primeros años del periodo de extensión fueron neumonía, bronquitis aguda, celulitis e infección del tracto urinario4.
Dentro de los diagnósticos de tumores reportados durante los 5 años del periodo de extensión se encuentran tumores cutáneos no melanocíticos, tumores de órganos sólidos y neoplasias hematológicas4.
La infección grave más frecuente fue la neumonía (ABA 1,3 vs. IFB 1,8%), además se informó de 5 casos de infección oportunista grave (incluidos 2 casos de tuberculosis) en el brazo de IFB, mientras que en el de ABA no se registró ninguna16.
Las infecciones más frecuentes fueron la neumonía (1%) y la diverticulitis (1%). No se encontraron infecciones por gérmenes oportunistas ni casos de tuberculosis12.
El periodo acumulativo de 7 años, un total de 13 pacientes experimentaron un síntoma autoinmune o desarrollaron una enfermedad autoinmune. La más frecuente fue la psoriasis, pero también se presentaron la vasculitis cutánea, vasculitis reumatoidea, eritema nodoso, síndrome seco y esclerosis múltiple12.
En este estudio el ABA fue bien tolerado, siendo los efectos adversos (EA) más frecuentes los de intensidad leve (cefalea, nasofaringitis y náuseas)10. La incidencia global de EA se mantuvo estable a los 5 años (tasa de incidencia acumulada de 300,2 y 242,3 por 100 pacientes-año)4.
Los efectos adversos severos (EAS) (17,7/100 pacientes año a los 12 meses y 13,9/100 pacientes año a los 5 años) fueron más frecuentes en el grupo de ABA+MTX (15%) que en el de PLB+MTX (11,9%). Los más comunes, excluyendo los brotes de artritis, fueron neumonía, carcinoma basocelular y dolor torácico que ocurrieron en más del 0,5% de los pacientes durante los 5 años del periodo de extensión.
Estudio ATTESTComo ya hemos comentado, el estudio ATTEST es interesante porque evalúa los perfiles de seguridad de 2 agentes biológicos con mecanismos de acción diferentes (ABA e IFB), bajo las mismas condiciones de estudio. Durante los 12 meses del periodo doble-ciego, los EA relacionados con la administración del tratamiento (la infusiones) y las interrupciones del tratamiento debidas a EA fueron menores en el grupo tratado con ABA que en el tratado con IFB (EA totales 89,1 vs. 93,3%; EA relacionados con el tratamiento 46,2 vs. 58,2% e interrupciones debidas a EA 3,2 vs. 7,3%). Lo mismo ocurre con los EAS, que fueron hasta 2 veces más frecuentes en el grupo de IFB (EAS totales: 9,6 vs. 18,2%; EAS relacionados con el tratamiento 3,2 vs. 8,5%; interrupciones del tratamiento por EAS 2,6 vs. 3,6%)8. Esta frecuencia se mantuvo durante el segundo año de seguimiento de estos pacientes, ya en el periodo de extensión (EA: 15,76 en periodo doble ciergo vs. 9,96/100 pacientes año en el periodo de extensión)9. Además, se presentaron 3 veces menos reacciones infusionales agudas en el grupo de ABA que en el de IFB (7,1 vs. 24,8%). Los tipos más frecuentes de reacciones infusionales fueron la hipotensión y la urticaria que se presentaron solo en el grupo tratado con IFB (0 vs. 4,8%), seguidos de la cefalea y las náuseas (1,3 vs. 4,2% y 1,9 vs. 4,2%, respectivamente)8.
Ensayo fase IIbSegún los datos de este estudio, el ABA fue bien tolerado y los perfiles de seguridad de ambas dosis utilizadas (2mg/kg y 10mg/kg) fueron similares a los del grupo placebo.
La tasa de incidencia de EA y EAS permaneció durante los 7 años de seguimiento de manera similar que en el periodo doble ciego (EA 366,1 y EAS 17,4/100 pacientes año vs. EA 489,7 y EAS 20/100 pacientes año)13. Los tipos de incidencias más frecuentes fueron: nasofaringitis (30,3%), infecciones respiratorias (23%), tos (22,3%), cefalea (23,7%), náusea (15,3%) y diarrea (19,9%)12.
Estudio AGREEDurante el año de seguimiento la frecuencia de EA, EAS y abandonos del tratamiento por EAS fue similar en ambos grupos (EA: 84,8 vs. 83,4%; EAS: 7,8 vs. 7,9%; interrupciones del tratamiento por EAS: 1,2 vs. 1,2%). Los EA más frecuentes fueron los leves: náuseas, infección del tracto respiratorio superior y cefalea. Hasta 16 pacientes (6,3%) experimentaron una reacción infusional aguda en el grupo de tratamiento, mientras que en el grupo de MTX fueron 5 pacientes (2%), todas de intensidad leve o moderada, exceptuando un caso de urticaria severa que se presentó en el grupo tratado con ABA.
Dos pacientes del grupo tratado con ABA quedaron embarazadas durante el estudio. Una de las pacientes que había recibido una dosis de ABA presentó un test de embarazo en orina positivo en el día 1 y sufrió un aborto espontáneo entre los días 1 y 30. La otra paciente había recibido 9 infusiones del fármaco cuando presentó el test de embarazo en orina positivo (día 253), confirmándose por ecografía, se procedió a inducir el aborto en el día 281. Ambas pacientes fueron retiradas del estudio14.
ConclusionesDe los datos de eficacia y seguridad de los estudios analizados se concluye que el ABA asociado a metotrexato representa una opción de tratamiento efectiva con un buen perfil de seguridad para los pacientes con artritis reumatoide, incluyendo a los de inicio agresivo, que no han sido previamente tratados con otras terapias biológicas.
Conflicto de interesesEl Dr. A.E.C. ha participado como asesor de BMS en foros nacionales impartiendo conferencias sobre eficacia y seguridad de abatacept. El Dr. F.D.G. ha participado como asesor de BMS en foros nacionales e internacionales y ha impartido conferencias sobre eficacia y seguridad de Abatacept; ha recibido fondos para investigación clínica y básica de: MSD, Pfizer, Roche y UCB. El resto de autores declaran no tener conflicto de intereses.