La artritis reumatoide (AR) es una de las causas más frecuentes de amiloidosis tipo AA. En la mayoría de los pacientes es asintomática y sólo cuando existen grandes depósitos en determinados órganos ocasiona problemas funcionales. Presentamos 2 pacientes con amiloidosis secundaria a AR, con afectación renal e intestinal, que respondieron al tratamiento con etanercept.
Rheumatoid arthritis (RA) is one of the most common causes of AA amyloidosis. Most patients are asymptomatic and only when there are large deposits in certain organs, functional problems arise. We report two patients with amyloidosis secondary to RA, with renal and intestinal involvement, who responded to treatment with etanercept.
La amiloidosis se caracteriza por el depósito de una sustancia amorfa (amiloide) en los espacios extracelulares de diversos órganos y tejidos condicionando alteraciones funcionales y estructurales. En la práctica clínica la forma más frecuente es la secundaria, cuyos depósitos contienen la proteína AA, que se relaciona con procesos infecciosos e inflamatorios crónicos, como la artritis reumatoide (AR). A continuación presentamos 2 pacientes con AR establecida, de larga evolución, con respuesta inadecuada a varios tratamientos inmunomoduladores y con persistencia de actividad inflamatoria, además de presentar amiloidosis secundaria, que fueron tratados de forma satisfactoria con etanercept. La terapia antiTNFα ha sido utilizada en pacientes con artritis inflamatoria y amiloidosis secundaria.
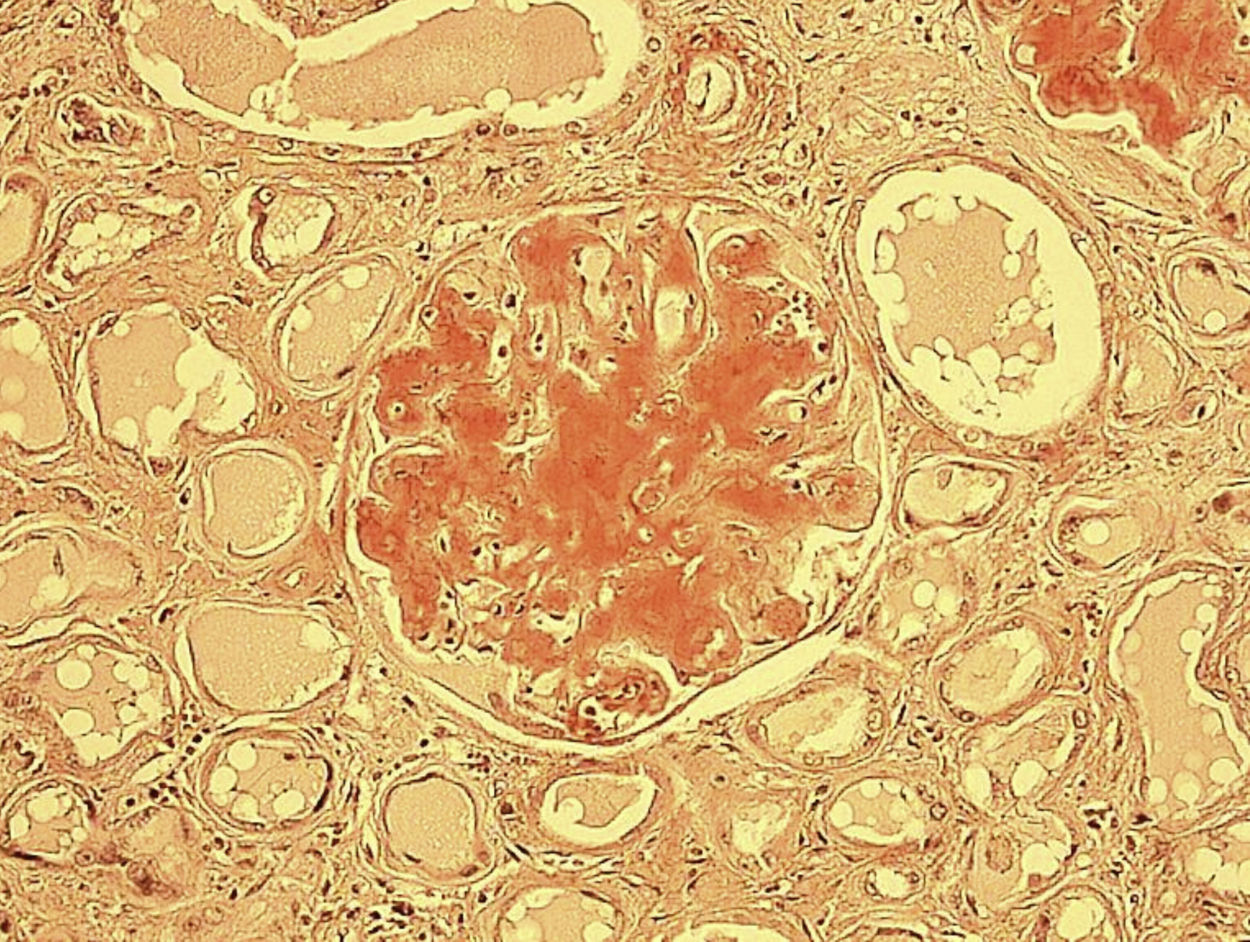
Caso clínico 1Se trata de un varón de 63 años con antecedentes de AR de más de 15 años de evolución tratada con antiinflamatorios no esteroideos (AINE), glucocorticoides, metotrexato, ciclosporina, salazopirina, sales de oro, antipalúdicos de síntesis y desde hacía 3 años, con leflunomida, con actividad clínica leve-moderada. Entre otros antecedentes padece hipertensión arterial y dislipidemia; síndrome de apnea obstructiva del sueño; cardiopatía isquémica; neumopatía intersticial multifactorial conocida desde hacía 5 años y controlada mediante pruebas de función respiratoria y radiológicas periódicas y tratada con broncodilatadores, y por último, antecedentes de infección pasada por Pneumocistis jiroveci en tratamiento profiláctico con trimetropim-sulfametoxazol. A finales del año 2008 ingresa por síndrome nefrótico observándose a la exploración física: 100,7 kg de peso, regular estado general, eupneico en reposo, saturación del 96%; hábito cushingoide; tensión arterial de 130/70mmHg y temperatura de 37°C; auscultación cardiopulmonar normal; abdomen globuloso, blando y depresible; edemas con fóvea hasta la raíz de los muslos, abdomen y manos; artritis bilateral de las articulaciones metacarpofalángicas y limitación a la flexo-extensión en ambos carpos; deformidad de ambos tobillos y pies, más el derecho. Entre las exploraciones complementarias destaca anemia normocítica normocrómica; velocidad de sedimentación globular (VSG) de 130 mm/1.ª hora; hiperfibrinogenemia reactiva; urea de 112 mg/dl; creatinina de 3,8 mg/dl; aclaramiento de creatinina de 45,4 ml/min; ácido úrico de 8,2 mg/dl, proteínas totales de 4,5 g/dl; proteína C reactiva de 10,9 mg/dl; proteinograma con aumento de fracciones alfa 1, alfa 2 y betaglobulinas y disminución de las gammaglobulinas; albúmina de 1,5 g/dl y en el sistemático de orina se detecta proteinuria, microhematuria y abundantes cilindros granulosos-hialinos y más de 11 g de proteínas en orina de 24 h. La serología de los virus de hepatitis B y C y HIV y el Mantoux fueron negativos. La ecocardiografía fue normal y en la radiología de tórax se observaron signos de hiperinsuflación con imágenes de fibrosis de predominio periférico cortical y basal y afectación erosiva evolucionada en la radiografía de manos y pies. Se le realizó biopsia renal con hallazgos compatibles con amiloidosis tipo AA (fig. 1). Entre las posibilidades terapéuticas, se barajó el inicio de glucocorticoides a altas dosis y ciclofosfamida, pero dadas las condiciones clínicas del paciente y sus antecedentes personales, se decidió el inicio de tratamiento deplectivo y albúmina intravenosa, asociado a terapia biológica (etanercept 50 mg semanales) y dosis bajas de glucocorticoides. Dado que el paciente era dislipidémico e hipertenso, continuó su tratamiento con estatinas, sustituyendo los antagonistas del calcio por antagonistas de receptores de angiotensina II. A las 4 semanas del inicio del etanercept la proteinuria disminuyó en más de un 50% (5 g en 24 h) y actualmente, tras más de un año de tratamiento, el paciente se encuentra en remisión clínica desde el punto de vista articular y mantiene una función renal normal con creatinina de 1,5 mg/dl y proteinuria residual de menos de 1 g en 24 h.
Biopsia renal: se observa depósito extracelular de un material filamentoso homogéneo acelular PAS +, rojo Congo +, de aspecto histológico glaseado y eosinófilo, denominado «amiloide». La preparación es de un corte renal teñido con rojo Congo, en el que apreciamos el amiloide como una sustancia homogénea teñida de un color rojizo-anaranjado que aparece engrosando el intersticio renal y obliterando las luces capilares glomerulares, llegando incluso a reemplazar al glomérulo (200x).
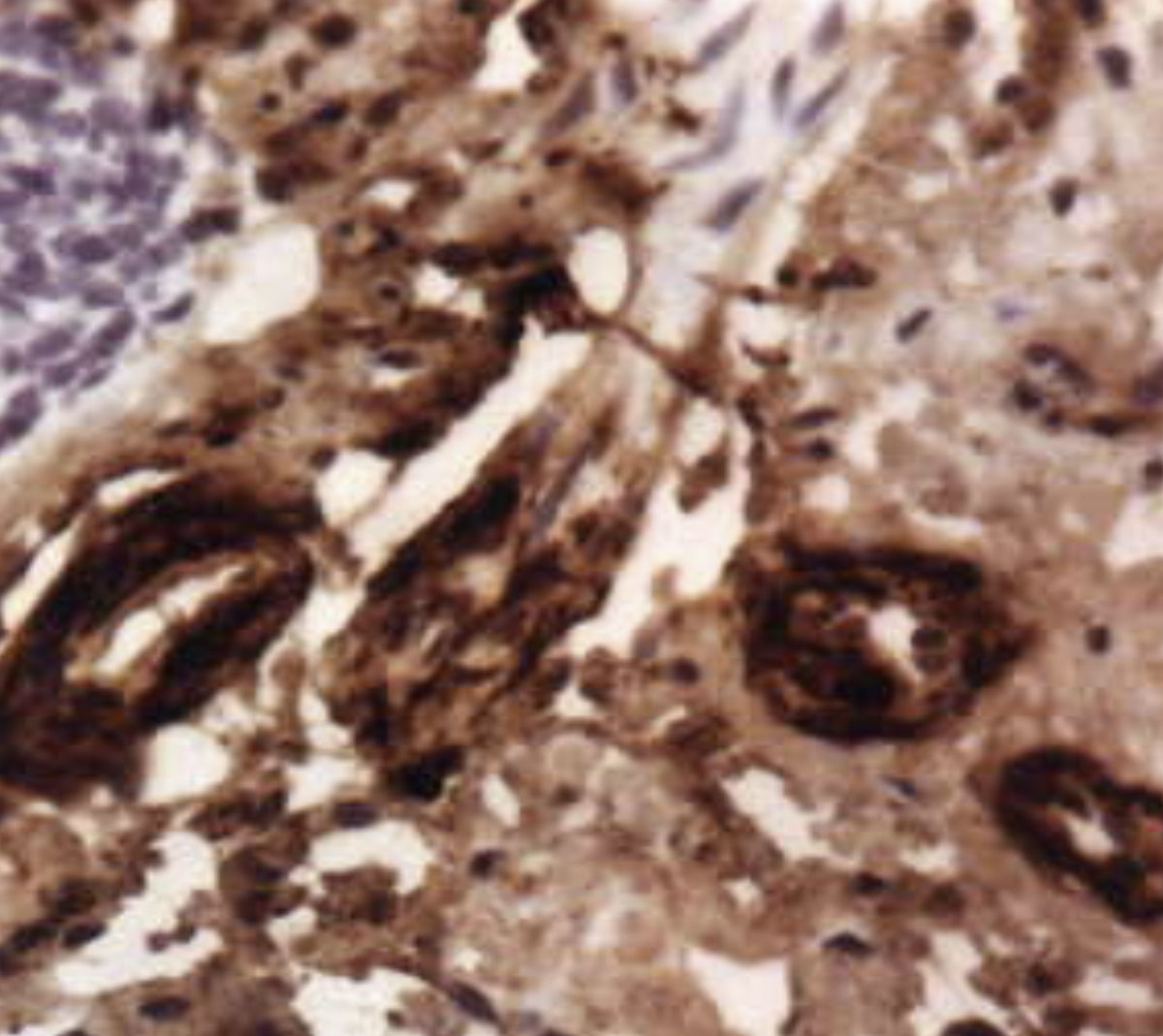
Presentamos el caso de una mujer de 68 años de edad con antecedentes de AR de 20 años de evolución, en tratamiento con AINE, glucocorticoides a dosis bajas (5 mg al día de prednisona), metotrexate y leflunomida; prótesis bilateral de caderas y rodilla derecha; hipertensión arterial, síndrome mielodisplásico en tratamiento con eritropoyetina e insuficiencia renal crónica leve. Ingresa por cuadro de diarreas de 8 semanas de evolución, pérdida de peso de 20 kg y edema en los miembros inferiores. En la exploración física se aprecia: 45 kg de peso, regular estado general, tensión arterial de 110/60 mmHg y una temperatura de 36°C; auscultación cardiopulmonar normal; abdomen blando y depresible; edemas con fóvea hasta raíz de muslos y en manos. Aparato locomotor: artritis de metacarpofalángicas bilaterales y limitación a la flexo-extensión en ambos carpos. En la analítica destaca anemia normocítica normocrómica, VSG de 110 mm/1.ª h, urea de 46 mg/dl, creatinina de 1,3 mg/dl, sistemático de orina normal, con proteínas en orina de 24 h negativa, proteinograma con aumento de fracciones alfa 1, alfa 2, beta y gammaglobulinas y albúmina disminuida. La serología de virus de hepatitis B y C, el Mantoux y el Booster fueron negativos. Se le realizó estudio digestivo completo (ecografía, endoscopia oral, estudio baritado y cultivos de heces), cuyos resultados fueron normales, y se realizó colonoscopia con toma de biopsia de colon, cuyos hallazgos fueron compatibles con depósito de amiloide AA (fig. 2). Se inicia tratamiento sintomático con diuréticos y albúmina intravenosa. Dado el antecedente de síndrome mielodisplásico se descarta la terapia con ciclofosfamida para no añadir toxicidad medular y, ante la existencia de actividad articular activa, se decide iniciar terapia biológica con etanercept (50 mg semanales) asociado a dosis bajas de glucocorticoides orales. Actualmente, tras 6 meses de tratamiento, la paciente se encuentra prácticamente asintomática desde el punto de vista articular y digestivo, habiendo desaparecido el síndrome diarreico y presentando controles analíticos correctos.
DiscusiónLa AR es una de las causas más frecuentes de amiloidosis tipo AA. En un estudio realizado en 121 pacientes con AR a los que se le realizó aspirado de grasa abdominal, se demostró una prevalencia de depósitos de amiloide hasta en un 29%, existiendo relación con la mayor duración de la enfermedad y la instauración de tratamiento con inmunomoduladores1. En la mayoría de los pacientes la amiloidosis es asintomática y sólo cuando existen grandes depósitos en determinados órganos ocasiona problemas funcionales específicos: así, en la afectación renal se detectará proteinuria progresiva, microhematuria o disminución severa de la función renal; los depósitos gastrointestinales ocasionarán sangrado o cuadros malabsortivos; la localización en los vasos pequeños puede causar neuropatía o eventos isquémicos y una disfunción restrictiva cardiaca o alteraciones de la conducción, pueden ser resultado de depósitos de amiloide en el miocardio o el pericardio. La forma más sencilla de confirmar el diagnóstico es a través de biopsia de grasa subcutánea abdominal, gingival o rectal, objetivando en la histopatología la tinción de rojo Congo y la típica birrefringencia amarilla y verde bajo la luz de microscopía polarizada. La amiloidosis AA es una enfermedad con elevada morbimortalidad, debido a la enfermedad renal terminal, los procesos infecciosos, el fallo cardiaco, la perforación intestinal o la hemorragia digestiva2. Los factores que ensombrecen el pronóstico son el descenso de la albúmina y la creatinina séricas y la proteinuria elevada en orina de 24 h3. Puede conducir a insuficiencia renal terminal, sobre todo en pacientes con niveles de amiloide sérico A persistentemente superiores a 10 mg/l4. Es por ello que la principal arma terapéutica en esta entidad consiste en el correcto tratamiento del proceso inflamatorio subyacente (ya sea con agentes citostáticos en la AR o con antibióticos en las infecciones crónicas), lo que puede resultar en la estabilización y la mejora de la función renal, en la reducción de la excreción urinaria de proteínas y en la parcial resolución de los depósitos de amiloide. No existe un tratamiento específico que disuelva los depósitos de amiloide y evite que se acumulen en los tejidos, pero se estima que además del tratamiento sintomático, es necesario el control estricto de la actividad del proceso inflamatorio reumático, con la consecuente menor formación de proteínas de fase aguda y la reducción de los depósitos de amiloide. Se han mostrado eficaces la azatioprina, el metotrexato, la ciclofosfamida, el clorambucilo y la colchicina (sobre todo en el tratamiento de la fiebre mediterránea familiar y en la prevención del desarrollo de amiloidosis en esta entidad)5. En los dos casos presentados, no se decidió iniciar ciclofosfamida, por la posible toxicidad del fármaco, en cuanto a mielosupresión e infecciones; además, la respuesta clínica, tanto articular como en el órgano diana afectado en cada caso, quizás hubiese sido más lenta y menor que con otras alternativas terapéuticas más recientemente ensayadas. Así, en los últimos años se ha propuesto que el bloqueo del TNF podría reducir la proteinuria y mejorar la función renal en la amiloidosis renal secundaria a AR6. Se han utilizado los 3 antiTNF actualmente disponibles, tanto en monoterapia como en combinación con metotrexato7, demostrándose en biopsias repetidas de mucosa gastroduodenal una disminución significativa de los depósitos de amiloide tras el inicio del tratamiento biológico8. En diversos estudios en los que se inició tratamiento con etanercept, se objetivó disminución de la proteinuria, mantenimiento e incluso mejoría de la función renal y desaparición del cuadro malabsortivo por disminución de los depósitos de amiloide9,10. En otros trabajos se ha constatado que, tanto la duración de la amiloidosis como el nivel de proteinuria fueron factores independientes predictores de fallo al tratamiento con antiTNF y que, sin embargo, la proteinuria era determinante como predictor de mortalidad y las infecciones fueron más frecuentes en estos pacientes tratados con terapia biológica11. No debemos olvidar que, aunque esta nueva terapia dirigida contra el TNF ha abierto nuevas expectativas terapéuticas en estos pacientes, puede tener efectos secundarios importantes (infecciones, mielotoxicidad) y que, dado que las evidencias clínicas son aún escasas, debemos ser cautos al decidir el inicio de estos tratamientos, valorando los beneficios/riesgos de forma individualizada en cada paciente. En conclusión, la experiencia acumulada en los últimos años con el uso de los tratamientos antiTNF en las distintas enfermedades reumáticas inflamatorias nos hace valorar esta terapia como una opción razonable en la amiloidosis secundaria, aunque hacen falta más estudios de seguimiento a largo plazo.