La enfermedad pulmonar intersticial (EPI) es una complicación común de la esclerosis sistémica (ES). El empleo de la tomografía computarizada de alta resolución (TACAR) se ve muy limitado, y el ultrasonido pulmonar (USP) puede ser un instrumento alternativo para la evaluación de la EPI.
ObjetivoDeterminar la validez del USP en la detección temprana de la EPI en pacientes con ES.
MétodosSe incluyeron 68 pacientes con ES≥18 años sin síntomas respiratorios. Un reumatólogo valoró el estado respiratorio subclínico, otro reumatólogo, cegado a la evaluación clínica realizó el USP. Para determinar la validez concurrente se realizó una TACAR.
ResultadosUn 41,2% de pacientes mostró EPI por USP, a diferencia de los controles sanos (4,8%) (p=0,0001). Las variables asociadas con los hallazgos de EPI al USP fueron anticuerpos anti-centrómero (p=0,005) y la puntuación de piel RSS (p=0,004). Se encontró una correlación positiva entre los hallazgos de EPI por USP y TACAR (p=0,001). La sensibilidad fue del 91,2% y la especificidad de 88,6%. Una buena confiabilidad entre observadores de los hallazgos por USP fue observada (k=0,72).
ConclusionesAl ser una herramienta alternativa válida, confiable y factible, consideramos que el USP puede ser implementado para la detección temprana de EPI en ES.
Interstitial lung disease (ILD) is a common comorbidity present in patients with systemic sclerosis (SSc). Employment of high-resolution computed tomography (HRCT) is very limited and lung ultrasound (LUS) can be an alternative tool for the early evaluation of ILD.
ObjectiveTo determine the validity of LUS in the early detection of ILD in patients with SSc.
MethodsSixty-eight patients with SSc ≥18 years without respiratory symptoms were included. A rheumatologist rated the subclinical respiratory condition, another rheumatologist blinded to the clinical assessment performed the LUS. To determine validity HRCT was performed as well.
ResultsPrevalence of ILD in SSc patients was 41.2% in contrast to the 4.8% healthy controls (P=.0001). Variables associated with LUS and HRCT findings were anti-centromere antibodies (P=.005) and the Rodnan skin score (P=.004). A positive correlation was present between the findings of HRCT and LUS (P=.001). Sensitivity and specificity were 91.2% and 88.6% respectively. Good reliability in the LUS findings was found between observers (k=.72).
ConclusionsBy proving to be a valid, trustworthy and feasible alternative tool, we consider that LUS can be implemented for the early detection of ILD in SSc.
La enfermedad pulmonar intersticial (EPI) es una entidad clínica que afecta a más de la mitad de los pacientes con esclerosis sistémica (ES)1,2. Por lo general se presenta antes del cuarto año de la ES y frecuentemente es subclínica o asintomática3,4. Si bien la gravedad de la EPI varía considerablemente, esta llega a representar una de las principales causas de muerte en los pacientes con ES5,6. Por ello, es importante crear conciencia de esta potencial complicación debido a que impacta considerablemente en el pronóstico, la calidad de vida y la respuesta al tratamiento del paciente con ES.
En la actualidad se cuenta con diferentes herramientas para detectar la EPI en pacientes con ES; además de la evaluación clínica, existen pruebas que evalúan la función respiratoria (PFR) y métodos de imagen. A pesar de que estos son los métodos más utilizados para la detección de EPI, recientemente se demostró que en etapas iniciales de la enfermedad los síntomas respiratorios pueden estar ausentes, mientras que el desarrollo de la EPI ya se ha iniciado. Aunado a ello, las pruebas complementarias, como las PFR, también presentan una baja sensibilidad para la detección de EPI en etapas iniciales, debido a que frecuentemente los pacientes no presentan alteraciones o apenas muestran algunos cambios restrictivos u obstructivos inespecíficos que no dan cuenta de la magnitud de la enfermedad7. En este contexto es donde los métodos de imagen pueden tener un papel clave en la detección de la EPI.
La radiografía de tórax es empleada ampliamente como primer método de imagen para la evaluación de la EPI. No obstante, posee una muy baja sensibilidad en las primeras etapas de la misma, lo que limita ampliamente su uso, especialmente para evaluar los cambios tempranos de la EPI.
La tomografía computarizada de alta resolución (TACAR) es una técnica de imagen muy sensible debido a que ha demostrado ser de utilidad en el diagnóstico y pronóstico de la EPI8,9; tiene el potencial de detectar cambios pulmonares muy tempranos8. A pesar de esto, su uso de rutina se ve ampliamente limitado por sus elevados costos, por la poca disponibilidad en centros de salud y por la considerable radiación que emana en cada examen.
Recientemente se ha propuesto que el ultrasonido (US) de pulmón puede tener un papel importante en la evaluación de la EPI en pacientes con ES10–14. La totalidad de estos trabajos fueron realizados en pacientes con ES que ya tenían una EPI establecida, logrando demostrar resultados muy interesantes, por ejemplo, una adecuada correlación entre sus hallazgos y los de la TACAR, buena reproducibilidad entre operadores y sobre todo óptima factibilidad10–14.
A pesar de la creciente evidencia respecto al uso del US pulmonar en EPI de pacientes con ES, en la actualidad no existen datos certeros acerca de su papel en la detección de EPI en etapas tempranas (incluidas fases asintomáticas o preclínicas), y sobre todo si dicho instrumento posee un papel predictivo en la evolución de la EPI. Haciendo énfasis en esta incertidumbre, nuestro equipo de investigadores decidió plantearse el objetivo de investigar la validez del US pulmonar en la detección temprana de la EPI.
Material y métodosPacientesSe incluyeron en el estudio pacientes consecutivos que acudieron al Instituto Nacional de Rehabilitación referidos por reumatólogos internos y externos con diagnóstico de ES en función de los criterios internacionales15. Los criterios de inclusión fueron: edad>18 años, no fumadores y con diagnóstico de ES sin síntomas respiratorios (disnea y tos). Para evitar cualquier superposición de los hallazgos pulmonares los pacientes fueron excluidos si tenían un diagnóstico previo de EPI, antecedentes de enfermedades pulmonares distintas de EPI —como enfermedad pulmonar obstructiva crónica y edema pulmonar debido a insuficiencia cardíaca o signos mínimos de hipertensión pulmonar— y si alguna vez se habían sometido a cirugía pulmonar. La exclusión por otras causas de EPI se realizó principalmente sobre la base de manifestaciones clínicas. En aquellos pacientes con sospecha mínima de insuficiencia cardíaca o hipertensión pulmonar se realizó una ecocardiografía para excluir la afectación cardíaca y determinar la presión arterial pulmonar.
Diseño del estudioEn el siguiente ensayo clínico controlado todos los pacientes y controles sanos fueron sometidos a evaluación clínica completa por parte de un reumatólogo experto para confirmar la ausencia de síntomas respiratorios. Se prestó especial atención a la detección de finas crepitaciones o «sonido de velcro» en las bases pulmonares durante la auscultación. Adicionalmente, se realizó la escala de disnea de Borg. La puntuación de piel Rodnan skin score, radiografía de tórax y PFR se realizaron únicamente en los pacientes con ES el mismo día, al igual que el US pulmonar, que fue realizado por un reumatólogo experto en la técnica, quien estaba ciego en relación con la evaluación clínica y los resultados de laboratorio.
Para determinar la validez concurrente se realizó la TACAR en los pacientes con ES dentro de los 7 días posteriores al US pulmonar. El operador en este caso también estaba cegado en relación con los hallazgos clínicos, de laboratorio y de US. Finalmente, se obtuvieron pruebas serológicas de todos los pacientes para determinar anticuerpos anti-centrómero y anti-Scl70. Para determinar la reproducibilidad interobservador, 2 reumatólogos con diferente experiencia en US y ciegos a los análisis clínicos evaluaron la mitad de los pacientes (un experto con más de 12 años de experiencia en US y un operador con un año de experiencia en US, quien además recibió previamente un un mes de capacitación en US pulmonar). Se incluyó un grupo control con sujetos sanos pareados por edad y género, que fueron reclutados entre el personal de salud de la institución y familiares de pacientes que acudían al área de US.
El presente estudio se realizó en acuerdo con la Declaración de Helsinki y las reglamentaciones locales. El Comité de Ética local aprobó el estudio INR/CI/42/15 y se obtuvo el consentimiento informado de todos los pacientes.
Evaluación del ultrasonido pulmonarEl examen de US pulmonar se realizó en el área de US de la división de enfermedades musculoesqueléticas y reumáticas (INR-LGII) con un equipo MyLab Seven (ESAOTE SpA) provisto de un transductor multifrecuencia lineal de 5-13MHz, con pacientes en posición supina o casi supina (con los brazos elevados y las manos detrás del cuello) para la parte anterior y exploración lateral, y en posición sentada (con los brazos a lo largo del tronco) para exploración posterior. Los parámetros para el US de pulmón fueron los siguientes: frecuencia=10-13MHz; frecuencia de repetición de pulsos (PFR)=1 y filtro de pared=4. El protocolo de exploración se basó en el publicado anteriormente14.
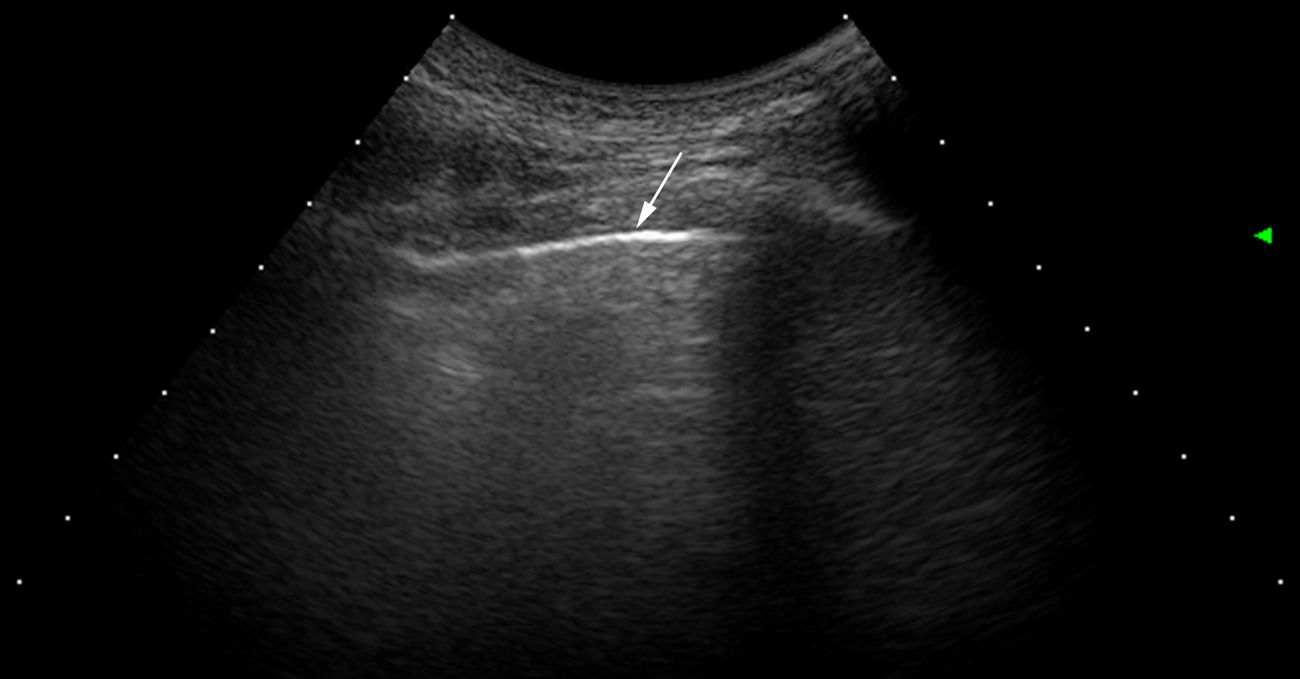
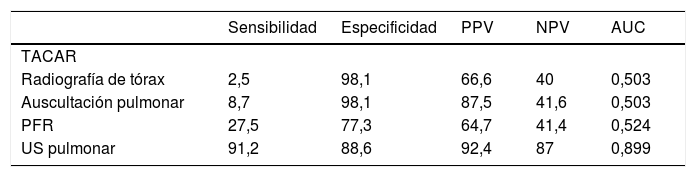
Interpretación del ultrasonidoEl hallazgo elemental a evaluar por US es la línea B, que se define como un artefacto de reverberación de base estrecha hiperecoica, que se extiende como un rayo láser hasta el borde de la pantalla. Estas líneas B por lo general no están presentes en pulmones de sujetos sanos16,17 (fig. 1). En cada espacio intercostal (EI) se registró el número de líneas B, posteriormente se registró y clasificó la suma total de todas las líneas B encontradas por el US pulmonar con base en la escala semicuantitativa propuesta anteriormente (0=normal, ≤5 líneas B; 1=leve, ≥6 y ≤15 líneas B; 2=moderada, ≤16 y ≥30 líneas B; 3=grave, ≥30 líneas B). Lo anterior con el objetivo de correlacionarse con los hallazgos de la TACAR.
Evaluación de tomografía axial computarizada de alta resoluciónEl examen de TACAR se realizó mediante protocolo estándar utilizando un escáner de potencia CT Light E Light Speed ??CT con un tubo de rotación con un tiempo de exploración de 0,65segundos. Los escaneos se obtuvieron con aspiración completa desde el vértice hasta la base del pulmón con los pacientes en posición supina, a 120kV y 300mA, con un espesor de corte de 1,25mm y un espaciado de 7mm. En los casos que mostraban un aumento de opacidad en los segmentos posterobasales también se adquirió un número limitado de secciones a través de las zonas inferiores del pulmón, con el paciente en decúbito prono, para asegurar que la opacidad no se debiera a la perfusión dependiente de la gravedad. La evaluación de TACAR no incluyó el uso de agentes de medios de contraste.
La afectación pulmonar se evaluó mediante segmentos pulmonares de acuerdo con la puntuación de Warrick18. Para correlacionar con precisión los hallazgos de US con la HRCT se expresó en la siguiente puntuación semicuantitativa: (0=normal [0 puntos]; 1=leve [<8puntos]; 2=moderado [de 8 a 15 puntos] y 3=marcado [>15 puntos]).
Análisis estadísticoEl análisis estadístico se realizó con el paquete estadístico Stata v13.0 (StataCorp., TX, EE. UU.). Los resultados descriptivos se expresaron como media y DE y mediana. Los datos categóricos se expresaron como proporciones. En análisis multivariado (para determinar las asociaciones entre las variables y los hallazgos de US) se realizó un modelo de regresión logística múltiple no condicional para la obtención de las razones de momios. El coeficiente de Spearman se usó para la correlación entre el US y la TACAR. La precisión (incluida sensibilidad y especificidad) se midió por el área bajo la curva ROC. La fiabilidad interobservador se calculó mediante una estadística kappa ponderada19. Un valor de p<0,05 se consideró estadísticamente significativo.
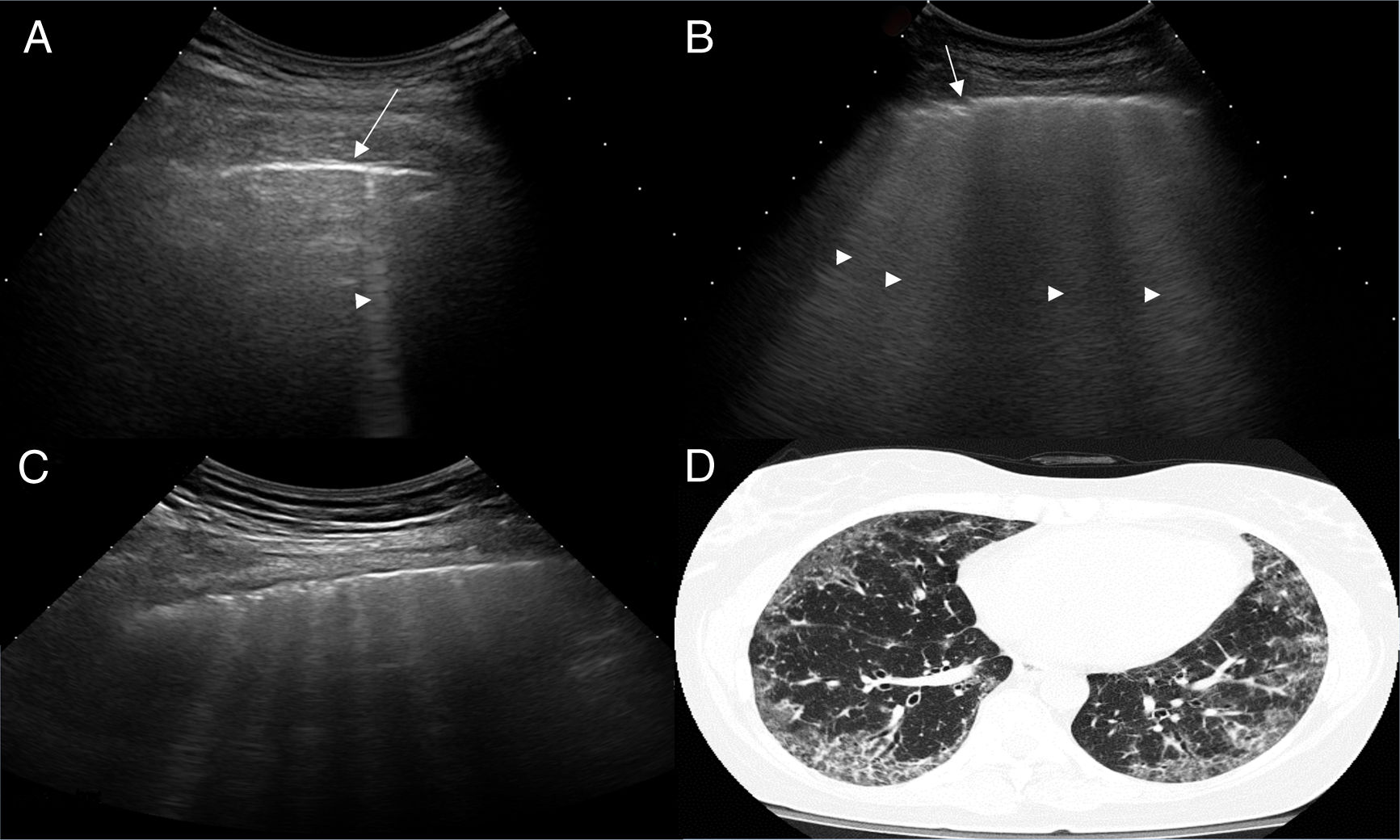
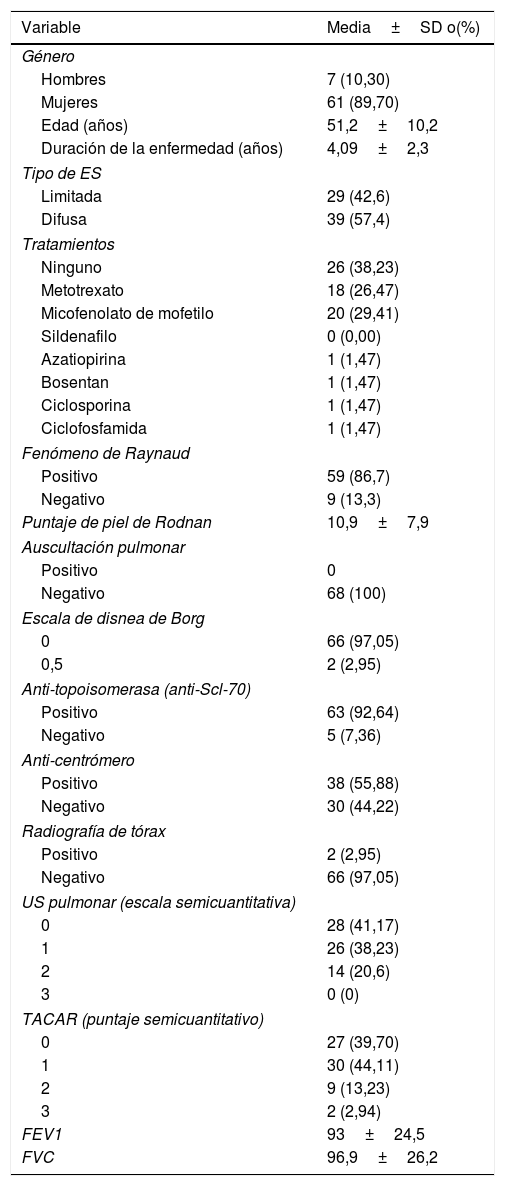
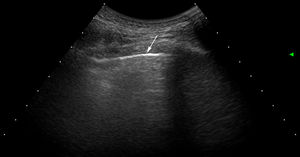
ResultadosUn total de 77 pacientes con diagnóstico de ES fueron remitidos para ser incluidos en el estudio. Ningún paciente presentó, en la fase de reclutamiento, sospecha alguna de hipertensión pulmonar. Nueve pacientes fueron excluidos, ya que presentaron al menos un criterio de exclusión. El estudio finalmente se realizó en 68 pacientes con ES y 68 controles sanos. Un total de 952 EI en 68 pacientes con ES fueron examinados por US pulmonar. Las características demográficas y clínicas de la población de estudio se ilustran en la tabla 1. Veintiocho de los 68 pacientes (41,2%) mostraron signos de EPI por US en contraste con los controles sanos (4,8%) (p=0,0001). La figura 2 muestra diferentes cuadros de EPI detectados por US, incluyendo un cuadro de comparación entre US y TACAR.
Datos demográficos de la población estudiada
| Variable | Media±SD o(%) |
|---|---|
| Género | |
| Hombres | 7 (10,30) |
| Mujeres | 61 (89,70) |
| Edad (años) | 51,2±10,2 |
| Duración de la enfermedad (años) | 4,09±2,3 |
| Tipo de ES | |
| Limitada | 29 (42,6) |
| Difusa | 39 (57,4) |
| Tratamientos | |
| Ninguno | 26 (38,23) |
| Metotrexato | 18 (26,47) |
| Micofenolato de mofetilo | 20 (29,41) |
| Sildenafilo | 0 (0,00) |
| Azatiopirina | 1 (1,47) |
| Bosentan | 1 (1,47) |
| Ciclosporina | 1 (1,47) |
| Ciclofosfamida | 1 (1,47) |
| Fenómeno de Raynaud | |
| Positivo | 59 (86,7) |
| Negativo | 9 (13,3) |
| Puntaje de piel de Rodnan | 10,9±7,9 |
| Auscultación pulmonar | |
| Positivo | 0 |
| Negativo | 68 (100) |
| Escala de disnea de Borg | |
| 0 | 66 (97,05) |
| 0,5 | 2 (2,95) |
| Anti-topoisomerasa (anti-Scl-70) | |
| Positivo | 63 (92,64) |
| Negativo | 5 (7,36) |
| Anti-centrómero | |
| Positivo | 38 (55,88) |
| Negativo | 30 (44,22) |
| Radiografía de tórax | |
| Positivo | 2 (2,95) |
| Negativo | 66 (97,05) |
| US pulmonar (escala semicuantitativa) | |
| 0 | 28 (41,17) |
| 1 | 26 (38,23) |
| 2 | 14 (20,6) |
| 3 | 0 (0) |
| TACAR (puntaje semicuantitativo) | |
| 0 | 27 (39,70) |
| 1 | 30 (44,11) |
| 2 | 9 (13,23) |
| 3 | 2 (2,94) |
| FEV1 | 93±24,5 |
| FVC | 96,9±26,2 |
TACAR: tomografía axial computarizada de alta resolución; VEF: volumen espiratorio forzado; VEF 1: volumen espiratorio forzado en 1 segundo.
Exámenes de US que muestran diferentes cuadros de EPI basados en el número de lineas B.
A. Solo hay una línea B (punta de flecha). B. Se distinguen 4 líneas B (puntas de flecha). Ambos casos presentan irregularidad pleural (flechas). C. Examen de US mostrando un espacio intercostal con 6 líneas B y neta irregularidad de la pleura en comparación con el cuadro TACAR de EPI (D).
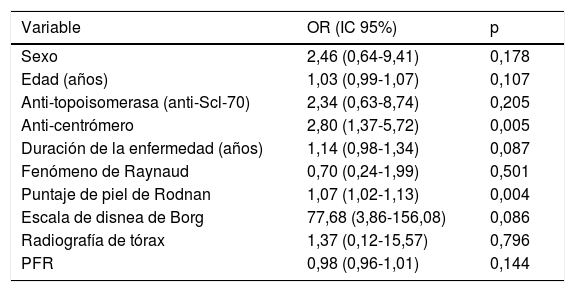
La puntuación de piel Rodnan skin score y los anticuerpos anticentrómero (p=0,004 y p=0,005 respectivamente) fueron las variables clínicas y de laboratorio que mostraron asociación con EPI detectada por US. No se encontró asociación con sexo, edad, duración de la enfermedad, radiografía de tórax ni las PFR (tabla 2).
Asociación entre signos del US-EPI y variables
| Variable | OR (IC 95%) | p |
|---|---|---|
| Sexo | 2,46 (0,64-9,41) | 0,178 |
| Edad (años) | 1,03 (0,99-1,07) | 0,107 |
| Anti-topoisomerasa (anti-Scl-70) | 2,34 (0,63-8,74) | 0,205 |
| Anti-centrómero | 2,80 (1,37-5,72) | 0,005 |
| Duración de la enfermedad (años) | 1,14 (0,98-1,34) | 0,087 |
| Fenómeno de Raynaud | 0,70 (0,24-1,99) | 0,501 |
| Puntaje de piel de Rodnan | 1,07 (1,02-1,13) | 0,004 |
| Escala de disnea de Borg | 77,68 (3,86-156,08) | 0,086 |
| Radiografía de tórax | 1,37 (0,12-15,57) | 0,796 |
| PFR | 0,98 (0,96-1,01) | 0,144 |
OR: razón de momios; IC: intervalo de confianza, PFR: pruebas de funcionamiento respiratorio.
Se encontró una correlación positiva entre la evaluación de las líneas B del US y la evaluación de la TACAR con la puntuación Warrick (coeficiente de correlación de Spearman rho=0,8022; p=0,0001).
La sensibilidad y especificidad de US en la detección de EPI calculada con respecto a la TACAR fueron 91,2% y 88,6% respectivamente, mientras que fueron 2,5% y 98,1%, 8,7% y 98,3%, 27,5% y 77,3% para la radiografía de tórax, PFR y auscultación pulmonar respectivamente. La tabla 3 muestra más detalles sobre la sensibilidad, la especificidad, el valor predictivo y el área bajo la curva ROC.
Sensibilidad, especificidad, valores predictivos y área bajo la curva ROC
| Sensibilidad | Especificidad | PPV | NPV | AUC | |
|---|---|---|---|---|---|
| TACAR | |||||
| Radiografía de tórax | 2,5 | 98,1 | 66,6 | 40 | 0,503 |
| Auscultación pulmonar | 8,7 | 98,1 | 87,5 | 41,6 | 0,503 |
| PFR | 27,5 | 77,3 | 64,7 | 41,4 | 0,524 |
| US pulmonar | 91,2 | 88,6 | 92,4 | 87 | 0,899 |
AUC: área bajo la curva ROC; NPV: valor predictivo negativo; PFR: pruebas de función respiratoria; PPV: valor predictivo positivo.
Los valores globales de kappa para la confiabilidad entre observadores de la puntuación semicuantitativa de US mostraron un buen acuerdo entre los 2 investigadores (k=0,72). El tiempo medio empleado para realizar la evaluación por US pulmonar fue de 8,6minutos (±SD 1,4; rango de 6 a 12minutos).
DiscusiónLa detección temprana de la EPI representa uno de los principales retos para mejorar la calidad de vida de los pacientes con ES20–22. Actualmente la TACAR es el método de imagen de referencia para la evaluación de la EPI, que incluye el diagnóstico y pronóstico, con ella es posible detectar cambios pulmonares tempranos y afectación pulmonar subclínica20–22. En los últimos años ha surgido evidencia interesante acerca del potencial que posee el US pulmonar para evaluar la EPI en pacientes con ES. Diversas investigaciones proporcionaron importante información acerca de la correlación que existe entre los hallazgos de US y la TACAR en pacientes que padecen ES con EPI establecida14,23–25. Aunado a esto se han publicado datos alentadores sobre el excelente desempeño del US pulmonar en términos de viabilidad y fiabilidad para evaluar la EPI13,25–28. Lo anterior ha permitido que se abra una interesante ventana de investigación, centrada en la propuesta de las líneas B como novedosos biomarcadores de los cambios de la EPI en pacientes con ES.
A pesar de la literatura emergente, hasta la fecha, no hay estudios enfocados en evaluar el valor del US pulmonar en el diagnóstico temprano de la EPI, y hasta nuestro conocimiento, este es el primer estudio enfocado en lo expuesto anteriormente.
Nuestros resultados muestran, mediante US pulmonar, una alta prevalencia de EPI subclínica (41,2%) en pacientes con ES. Estos datos son de gran interés debido a que los pacientes evaluados se encontraban asintomáticos desde el punto de vista respiratorio. Adicional a esto, la escala de disnea de Borg y las PFR en los pacientes no mostraron anomalías respiratorias restrictivas y/o obstructivas al inicio (tabla 1). Esto puede sustentar la hipótesis de que la EPI puede permanecer en silencio durante varios años, antes de que aparezcan los síntomas respiratorios, como se demostró previamente en algunos estudios de TACAR20,22. Estos datos inducen a reflexionar acerca de la utilidad de dichas herramientas, que son empleadas ampliamente para el cribado de la EPI en ES, en etapas muy tempranas.
Además, la sensibilidad y la especificidad del US pulmonar para evaluar la EPI fueron similares a la TACAR, mientras que la radiografía de tórax, la auscultación pulmonar y las PFR mostraron una sensibilidad y especificidad deficientes. Como se esperaba, se demostró una correlación positiva entre la evaluación de líneas B del US pulmonar y la evaluación de la puntuación de Warrick. Los resultados de la confiabilidad interobservador también fueron altamente significativos, así como la factibilidad, ya que el examen pulmonar completo (US pulmonar) se realizó en una media de 8,6±SD 1,4minutos, lo cual es relevante para integrar el examen de US pulmonar durante la consulta rutinaria diaria.
A partir de un análisis más detallado de nuestros resultados se pueden hacer algunas consideraciones adicionales: en primer lugar, la radiografía de tórax se confirma como una herramienta de imagen de nula sensibilidad para la evaluación de la EPI, especialmente en etapas tempranas. En segundo lugar, la auscultación clínica y las PFR pueden omitir una EPI en fases tempranas. En tercer lugar, el US pulmonar ofrece muchas ventajas para la evaluación pulmonar; es un procedimiento de cabecera ampliamente disponible, de bajo costo y fácilmente aceptado por el paciente. En cuarto lugar, las máquinas portátiles, incluso sin Doppler de potencia, pueden ser suficientes para una evaluación pulmonar completa y detallada, como se demostró anteriormente28.
Estamos conscientes de que nuestro estudio presenta algunas limitaciones. Primero, el bajo número de pacientes inscritos, que no permite una evaluación precisa en términos de sensibilidad y especificidad que podría respaldar de una manera más firme los datos presentados. En segundo lugar, no se realizaron otras pruebas funcionales como la prueba de caminata de 6minutos o capacidad de difusión pulmonar. En tercer lugar, otra limitación fue el hecho de que no se realizó un análisis intraobservador, esto debido principalmente a factores de tiempo y logísticos. En cuarto lugar no se realizaron exámenes como TACAR, PFR o radiografía de tórax en la población sana, lo que hubiera permitido medir con mayor precisión la sensibilidad y especificidad del US pulmonar. Por otro lado, otra limitación fue la ausencia de un análisis que determinara si existían diferencias entre los pacientes con y sin tratamiento. Por último, solo las líneas B se consideraron como una lesión elemental de EPI en US pulmonar. Recientemente se ha propuesto la irregularidad pleural como una nueva lesión en la EPI que puede ser medida con US pulmonar. Sin embargo, su implicación clínica aún no está consolidada.
ConclusionesEl US pulmonar demostró ser una herramienta válida, confiable y factible para detectar la EPI temprana en la ES, incluso en fases preclínicas. A pesar de que queda mucho trabajo por hacer, los resultados preliminares expuestos en el presente estudio pueden representar un hito hacia una posible implementación, en un futuro cercano, del US pulmonar como una herramienta de cribado inocuo para un diagnóstico muy temprano de la EPI en ES.
FinanciaciónEste trabajo recibió un apoyo por parte del la Unidad de Investigación del Colegio Mexicano de Reumatología (CMR 06/18).
Conflicto de interesesNinguno.