Los medicamentos siguen un camino que está estrictamente regulado e intervenido hasta que llegan a los pacientes. Una vez en el mercado, los mecanismos que rigen su uso son muy complejos debido a la gran cantidad de actores que interactúan. Para tomar decisiones es necesario que se extienda una cultura evaluativa entre todos los que intervienen y que el análisis económico forme parte estructurada de las actuaciones de médicos y gestores. Dado que el médico ocupa un lugar central en este mercado del medicamento, es necesario que asuma esta responsabilidad participando activamente de esta evaluación.
Medicines are strictly regulated and controlled until they reach the patients. Once in the market, the mechanisms governing their use are very complex due to the large number of actors playing different roles. It is necessary to extend an evaluation culture among all involved and to make economic analysis a structured part of decisions made by physicians and health managers. Since physicians occupy a central place in this market of medicines, it is necessary that they assume their responsibility by actively participating in this evaluation.
Para que un determinado medicamento llegue a un paciente tiene que haber superado una serie de etapas que son poco conocidas para el público en general pero también, lo que resulta más sorprendente, para los médicos. La inclusión de un medicamento en los protocolos asistenciales y las guías de prescripción farmacoterapéuticas por parte de los pagadores, personificados en el título de este artículo en la figura del gerente, constituye una de las etapas finales que algunos médicos viven como una barrera a la prescripción. Este artículo analiza cuáles son estas etapas que atraviesa un medicamento hasta llegar a la prescripción, acercándose al punto de vista del gestor y analizando someramente algunas herramientas de análisis económico que es necesario conocer para entablar un diálogo fructífero con nuestros gestores.
¿Por qué regulan los medicamentos?El medicamento es un bien de consumo que está estrictamente regulado. La propia sociedad ha ido requiriendo del legislador la adopción de medidas que aseguren que cuando un medicamento está en el mercado, lo está con todas las garantías. Aunque no siempre ha estado claro quién tenía que prestar aval a dichas garantías y las sociedades médicas, la propia industria farmacéutica y la administración se han disputado este derecho1. En este sentido, la legislación ha ido avanzando a golpe de incidentes. Desde los primeros esfuerzos reguladores de finales del siglo xix en manos de comités de médicos notables que pretendían asegurar una correcta información sobre la venta de supuestos medicamentos en carromatos hasta incidentes como el del elixir de sulfanilamida, que ocasionó 107 muertos, la mayor parte de ellos niños, en 19372, o el de la talidomida entre 1956 y 1962, que ocasionó miles de malformaciones, fundamentalmente en el centro de Europa3.
Ha sido sin duda este último desastre de la talidomida el que ha marcado un hito definitivo en la regulación de los medicamentos. Las legislaciones se completaron a partir de entonces estableciendo los requisitos que rigen actualmente y que son, en esencia, la exigencia a la industria farmacéutica de pruebas previas a la introducción de cualquier medicamento en el mercado demostrando la calidad, la seguridad clínica y preclínica, la eficacia y —consecuentemente— la correcta información sobre este. Los responsables de prestar estas garantías a la sociedad son las denominadas agencias reguladoras; en España, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Presentar pruebas previas a la comercialización exige la realización de estudios preclínicos y clínicos (también sujetos a una estricta regulación) que suponen una fuerte inversión por parte de la industria farmacéutica. Las agencias de medicamentos evalúan los estudios realizados por las compañías y otorgan o no la autorización de comercialización, estableciendo en caso positivo también cuáles son las condiciones de utilización del medicamento que terminan plasmándose en la ficha técnica y el prospecto del producto. Las agencias también evalúan cualquier cambio en las condiciones del medicamento una vez autorizado y autorizan nuevas indicaciones, cambios en las condiciones de seguridad, nuevos fabricantes, etcétera. De este modo, un medicamento comercializado es un producto sometido a una evaluación continua de su relación beneficio/riesgo por parte de las agencias de medicamentos.
El desarrollo de un medicamento hasta la autorización es, por tanto, un proceso complejo y costoso. En general, acelerar la autorización de los medicamentos exigiendo menos pruebas previas pondría los nuevos medicamentos en disposición de ser utilizados antes pero incrementando la incertidumbre sobre su uso. En el extremo contrario, reducir completamente la incertidumbre relacionada con un medicamento antes de su puesta en el mercado haría prácticamente imposible su comercialización. Encontrar el punto justo entre estos dos extremos es uno de los retos que afrontan las agencias reguladoras.
El complejo «mercado» del medicamentoPara muchos otros bienes de consumo, la mera puesta en el mercado abre la posibilidad de que dichos productos sean utilizados directamente por los consumidores. Las leyes que rigen este mercado hacen que el mercado se regule a sí mismo: alguien produce un bien de consumo que supone un beneficio, en este caso en términos de salud, para alguien que lo compra, obteniendo el productor un retorno económico. Si las expectativas sobre el producto no se ven satisfechas por precio o por resultado, el consumidor deja de comprarlo. En un mercado perfectamente competitivo (un productor, un consumidor), la eficiencia está garantizada, de modo que solo permanecen en el mercado los productos eficientes.
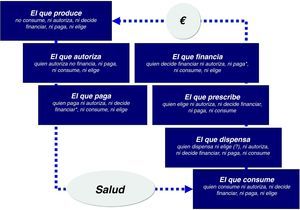
Sin embargo, en el mundo del medicamento este escenario se ve alterado como mínimo por dos actores más que se interponen en la relación entre el productor y el consumidor (fig. 1). Uno de ellos ya ha sido comentado y es la autoridad reguladora de las agencias de medicamentos, sin cuya autorización nada de lo demás ocurre. El segundo es el médico que prescribe y que se interpone entre la industria que produce el medicamento y el sujeto que lo recibe (excluidos los medicamentos sin prescripción médica).
En los países con sistemas nacionales de salud públicos, este esquema se completa con la interposición de un actor más entre la autoridad reguladora y el médico, que son las autoridades sanitarias que deciden si los sistemas públicos de salud financian o no el medicamento y a qué precio. En todos los países de nuestro entorno las autoridades que deciden sobre la autorización de un medicamento y las que toman la decisión de financiación y precio son distintas. En España, la transferencia de las competencias sanitarias hace que quienes finalmente terminan pagando la factura de los medicamentos utilizados en el sistema nacional de salud sean las comunidades autónomas, ante las que rinden sus cuentas los gerentes de los centros de atención primaria y especializada.
De modo que por parte de las autoridades sanitarias se producen dos intervenciones —la autorización de comercialización y la decisión de financiación y precio— que se producen de manera secuencial, que están relacionadas de algún modo, pero que son independientes entre sí. De hecho, mientras los criterios de autorización son comunes en toda la Unión Europea y muy parecidos en el contexto de los países que participan en la International Conference of Harmonization4, las decisiones de precio y financiación son más difíciles de armonizar aun entre países próximos. Mientras que en Estados Unidos para que un medicamento esté en el mercado basta con demostrar calidad, seguridad y eficacia en comparación con placebo, la incorporación efectiva del medicamento a la prestación farmacéutica en los países con sistemas públicos de salud requiere, con diferencias en el desarrollo de este, que haya una demostración también en términos de coste-efectividad. Este requerimiento adicional, que dependiendo del lado desde el que se mire se llama «cuarta garantía» o «cuarta barrera», exige colocar el medicamento en el contexto de otras intervenciones dirigidas al mismo problema de salud (basadas en medicamentos o no) y en condiciones de práctica habitual o cercanas a ella.
En realidad, igual que ocurre con la evaluación continua de la relación beneficio/riesgo de un medicamento, debe existir una evaluación continua del coste/efectividad. La eficiencia en el sector del medicamento —y en el sector salud en general— no está garantizada por un mercado perfecto y, si no hacemos algo, no se produce por sí sola. Es por tanto necesario superar viejos paradigmas en los que la separación entre «reguladores» y «pagadores» era absoluta y abordar un nuevo modelo de relación en el que la cultura evaluativa es el centro, avanza como en una carrera de relevos con diferentes herramientas en diferentes momentos de la vida de un medicamento y, sobre todo, sirve para la toma de decisiones relevantes por parte de aquellos que las deben tomar.
La visión del gestorEn medio de este «mercado» imperfecto, la posición del gerente es la de quien ni produce, ni autoriza, ni decide la financiación (en parte), ni prescribe (aunque quien prescribe «depende»’ de ellos) ni consume (aunque es responsable de la prestación sanitaria a la población). Y sin embargo, la factura sale de su presupuesto, es decir, es el que paga. Y la factura en medicamentos crece y crece cada año. Aproximadamente entre un 4 y un 11% anual hasta 2010 en que, por primera vez en muchos años, se produce un descenso no motivado por medidas de uso racional sino fundamentalmente por las medidas extraordinarias para la reducción del déficit público. El gerente, igual que ocurre con las economías domésticas, tiene un presupuesto y la necesidad de decidir en qué se gasta ese presupuesto. Y como se ha repetido en innumerables ocasiones, un euro gastado en un determinado concepto evita gastarlo en otro concepto (es el llamado coste de la oportunidad).
Hay una parte del crecimiento en el gasto de medicamentos que se debe al propio incremento de la actividad sanitaria ya que, por regla general, más actividad significa más gasto. Y mayor precisión diagnóstica significa tratar lesiones o condiciones que antes no se trataban y, por tanto, más gasto. Tener nuevas técnicas diagnósticas significa nuevas enfermedades o nuevas clasificaciones de estas, y detrás de ello nuevos tratamientos. En ocasiones, son nuevos usos de medicamentos ya existentes y, a veces, estos nuevos usos se acompañan de un incremento significativo de su coste. Otras son nuevos medicamentos, todos ellos significativamente más caros, no todos ellos con igual grado de innovación desde el punto de vista de los resultados finales. Los gestores deben entender, por un lado, que más gasto no quiere decir necesariamente más gasto ineficiente, pero los médicos deben entender, por otro, que cualquier nueva técnica diagnóstica o innovación no debe ser incorporada sin más.
La evaluación de la innovación¿Cómo juzgar entonces la bondad de los nuevos tratamientos o intervenciones a la hora de justificar su uso y, sobre todo, su financiación dentro de un sistema público obligado a gestionar adecuadamente los recursos de todos? La utilización de diferentes herramientas de evaluación forma ya parte de la adopción y difusión de las innovaciones sanitarias por parte de las administraciones públicas5. Hacer una revisión exhaustiva de estos instrumentos no es objeto de este artículo, pero sí hacer alguna reflexión general en torno a ellos.
En primer lugar, ¿es posible evaluar la innovación terapéutica sin contar con los médicos prescriptores? Es posible evaluarla, pero tremendamente difícil desarrollar estrategias a largo plazo si ellos no participan. ¿Es posible la participación de los médicos prescriptores sin que abracen de alguna manera los principios de esta cultura evaluativa? No, es absolutamente imposible desarrollar algún tipo de estrategia si no se entienden los principios y necesidades que la mueven. De hecho, lo que es necesario es que el médico prescriptor entienda su papel central como diana del complejo mercado del medicamento y asuma su responsabilidad como «usuario», expulsando del mercado las opciones menos eficientes. Empeñarse en impulsar estrategias que no cuenten con el médico prescriptor está condenado al fracaso. Empeñarse en que estas estrategias no son necesarias es estar sencillamente fuera de la realidad. ¿Qué deberían aportar los profesionales? Sencillamente, una posición equilibrada.
Por ejemplo, para delimitar lo que realmente es innovación. Esta es una de esas palabras «paraguas» debajo de la cual cabe tanto una pequeña ventaja de fabricación que permite reducir los costes de producción, como una pequeña y subjetiva ventaja de comodidad, como una revolucionaria nueva acción terapéutica capaz de evitar mortalidad en una determinada patología. Como se ha comentado, un mercado perfecto, eficiente a la hora de poner cada cosa en su sitio, terminaría separando claramente lo que es una innovación verdadera de lo que es un pequeño cambio o un simple maquillaje. Pero no ocurre siempre igual en el imperfecto mercado del medicamento fundamentalmente por esa disociación entre el que paga, el que elige o prescribe, y el que finalmente utiliza. En la mayor parte de los casos no es el paciente el que termina estableciendo si algo es una innovación o no que merezca la pena, sino el profesional que prescribe. Esto hace que recaiga sobre él una responsabilidad que necesariamente tiene que ir ligada a un coste que no siempre percibe ni tiene en cuenta. Nada es útil o no en sí mismo, sino en un contexto en el que el coste es un elemento decisivo. Que esta «conciencia» sobre el verdadero valor de los medicamentos esté alejada o simplemente no esté alineada con el prescriptor final (por la interposición de elementos correctores) es algo que ha fracasado repetidamente. A cambio, el profesional debe implicarse en dar una visión no sesgada de la innovación. El mercado termina inclinado a satisfacer las necesidades de los usuarios. Si las necesidades se colman con pequeñas innovaciones, la puerta que estamos enseñando es esa y no la del desarrollo de verdaderas innovaciones. Llamar gran innovación a la gran innovación y pequeño cambio al pequeño cambio es beneficioso para todos, incluida la propia industria, que algunas veces también ve cómo quedan sepultados algunos avances significativos tras una maraña de dudosas innovaciones.
Un instrumento que estaba llamado a ayudar en esta reflexión sobre lo verdaderamente útil y lo fútil era la llamada medicina basada en la evidencia (MBE)6. Sin embargo, años después, la MBE se ha terminado convirtiendo en algunos casos en una especie de trampa. Y esto es así, al menos en parte, porque la mayor parte de la investigación clínica que se realiza se hace a iniciativa de la industria farmacéutica. Y no es que sólo se investigue aquello que la industria farmacéutica quiere, sino que, además, los nuevos instrumentos de evaluación, las nuevas técnicas diagnósticas o los nuevos paradigmas de tratamiento se aplican solo a aquellos tratamientos que son más nuevos. El resultado aparente es que solo aquello más nuevo está soportado por la evidencia. De este modo, la base de evidencia que se hace disponible a los médicos para ayudar en sus elecciones terapéuticas está guiada por estudios financiados por la industria, que comparan sus productos con placebo y miden su utilidad en términos de variables subrogadas. Aunque entre un 20 y un 25% de los ensayos clínicos que se realizan en España lo son por iniciativa de grupos independientes académicos u hospitalarios, lo cual se debe a las convocatorias públicas que han puesto una significativa cantidad de dinero para este propósito, sigue prevaleciendo la iniciativa de la industria que, lógicamente, hace la investigación que necesita para sus productos y no otra. ¿Qué se les puede pedir a los profesionales a este respecto? Una visión neutra y equilibrada que huya del fanatismo basado en la evidencia y ayude de nuevo a separar aquellos planteamientos que suponen un avance significativo de los que no.
De modo que lo que percibe un gestor es que le esperan medicamentos más sofisticados y más caros, la individualización de las terapias medicamentosas, una población más envejecida, unos ciudadanos cada vez más informados y demandantes, unos beneficios inciertos y un escaso apoyo a la hora de decidir. Y para decidir necesita elementos que guíen su decisión. En correspondencia con nuestro esquema, el profesional en cada centro y las sociedades científicas a nivel global ocupan un lugar fundamental en este complejo entramado. De modo que esta posición central entre quien vende (la industria farmacéutica), quien paga (personificado en nuestro gerente) y quien consume (el paciente que de alguna manera subroga algunas de sus decisiones en el médico) es realmente estratégica.
La justificación ante el gestor: el coste-beneficio del tratamiento de la osteoporosisA la hora de afrontar la justificación ante el gestor de la introducción de cualquier medicamento o intervención sanitaria es necesario entender su punto de vista. Este no suele ser el del ahorro de recursos, sino el de aplicación de la evaluación económica como instrumento para establecer prioridades y gastar un presupuesto para conseguir el máximo beneficio. ¿Cuál es, por tanto, el beneficio esperado? Es necesario entender que los estudios farmacoeconómicos se basan con frecuencia en asunciones que los acercan más a la imperfecta capacidad predictiva de la economía como ciencia que a la tozuda reproducibilidad del método experimental y que, junto al juicio científico sobre lo que es útil y lo que no, están los valores sociales que desempeñan un aspecto determinante en la toma de decisiones. El impacto sociosanitario y económico de la osteoporosis reside en su consecuencia, la fractura osteoporótica y el impacto que esta tiene sobre la calidad de vida y, eventualmente, la mortalidad del paciente7,8. Sin embargo, esta relación no está tan clara para la fractura vertebral como para la fractura de cadera y, en todo caso, no parece que pueda significar lo mismo dependiendo de otros factores, como edad, comorbilidad, etcétera9. Es necesario contemplar este análisis de los subgrupos de pacientes que más pueden beneficiarse de un determinado tratamiento y aplicarles eventualmente escenarios de tratamiento distintos cuando proceda. ¿Y cómo compara este beneficio esperado con otros potenciales beneficios en otras enfermedades o en la misma enfermedad pero derivados de otras intervenciones? La evaluación económica considera como beneficio la ganancia en salud que está relacionada con las preferencias y los valores de la población y que marca, en definitiva, a qué quiere la sociedad dedicar sus recursos. Para evaluar el beneficio es necesario medir la efectividad de todas las intervenciones, considerando también aquellas no relacionadas con el uso de medicamentos. Así como es imposible considerar la eficacia de un medicamento fuera del contexto de sus competidores (utilidad terapéutica), es imposible hacer lo mismo sin compararlo con otras alternativas no basadas en medicamentos, ni con otras enfermedades o situaciones clínicas.
La medida de la efectividad en osteoporosis será lógicamente la disminución de la tasa de fractura o de aquellos tipos de fractura que es más significativo evitar, o de la propia mortalidad. Si tenemos los costes asociados a una intervención y la efectividad, podemos calcular el cociente coste-efectividad. Ahora bien, los estudios que avalan la efectividad deben ser lo suficientemente consistentes como para que su calidad y relevancia se trasladen a sus conclusiones10. Mientras que el ensayo clínico aleatorizado y controlado es el estándar en términos de eficacia, no siempre sus resultados son relevantes en términos de práctica clínica diaria. Para tomar decisiones y asignar recursos es necesario, sin embargo, tener una estimación del beneficio en condiciones reales y esta información procede, en muchas ocasiones, de estudios observacionales, especialmente de aquellos que analizan resultados relevantes en los términos en los que el traslado a la realidad es más directa. Los pacientes con osteoporosis no quieren tener una mayor densidad ósea, sino prevenir las fracturas y sus consecuencias. Y es seguro que ello a cambio de un determinado nivel de riesgo, y no otro, y a un determinado coste, y no otro.
En el caso de la osteoporosis, no es solo la hipotética mortalidad consecuencia de la fractura la variable que se debe analizar como beneficio, sino también la calidad de vida en sus múltiples dimensiones. El problema es que para obtener una cuantificación de la calidad de vida relacionada con la salud es necesario recurrir a instrumentos que, aun validados, carecen de la consistencia de otras variables más duras. Es por ello que, en general, han tenido más éxito entre las preferencias de la sociedad en general, y de los gestores en particular, aquellas enfermedades o condiciones con un impacto directo sobre la mortalidad y no sobre otros resultados intermedios. Aun en este caso, uso de variables intermedias, hay que ser muy cuidadoso a la hora de establecer su relación con variables más duras o finales (p. ej., entre masa ósea y riesgo de fractura).
Sin embargo, teniendo una medida del coste y la efectividad de un tratamiento (cantidad y calidad de vida o años de vida ajustados por calidad de vida), es necesario tener en cuenta determinados factores que reflejan la forma que tiene la sociedad de valorar los beneficios sanitarios. Por ejemplo, hay que ajustar por el momento del tiempo en que se producen los costes y los beneficios. En general, es mejor aplazar los costes y obtener los beneficios cuanto antes, por lo que el análisis económico introduce un parámetro denominado tasa de descuento. La brecha de tiempo entre los costes incurridos y los potenciales beneficios a futuro, junto a que estos beneficios se produzcan o no en el presupuesto de nuestro hipotético gerente, son elementos que se deben tener en cuenta, como también hay que tener en cuenta la incertidumbre con la que se producen tanto los costes como los beneficios, es decir, incorporar la influencia de la incertidumbre mediante la fórmula del valor esperado (o utilidad). Por ejemplo, los tratamientos se valoran en razón a una probabilidad de producir los efectos esperados, lo cual nunca es una eficacia del 100% en la totalidad de la población diana. Por eso no siempre es fácil trasladar la evidencia procedente de los estudios de la bibliografía a las circunstancias particulares del ámbito para el que quiere calcularse la efectividad, lo cual suele acompañarse de un cierto debate11.
Ser crítico en el análisis de los resultados es fundamental para que el médico prescriptor pueda trasladar una visión real a quienes tienen que asumir la toma de decisiones. Es deseable que el médico mantenga una posición no siempre fácil de salvaguardar entre el paciente y sus necesidades, el gestor del dinero público y la propia industria farmacéutica. ¿Cómo valorar, por ejemplo, una ventaja de comodidad en la que el que paga por ella no es el que la disfruta? La industria farmacéutica desempeña legítimamente su papel, pero el médico no debería asumir ese papel como propio sino erigirse en protagonista y asumir que la elección de la opción más coste-efectiva forma parte de su práctica diaria dentro de un sistema público de salud como el nuestro. Ello ayudaría a una toma de decisiones más racional, a que el profesional se sienta más valorado, a que la industria desarrolle un criterio claro sobre lo que realmente supone una innovación o no y a disminuir el riesgo de desarrollos costosos que luego no consigan un retorno de la inversión.
ConclusiónLa incorporación de nuevos tratamientos y tecnologías requiere tener en cuenta sus costes y posibles beneficios. Para muchas tecnologías, este camino empieza una vez en el mercado. Sin embargo, el medicamento es una tecnología que nace evaluada por las agencias reguladoras, lo que debería tenerse en cuenta para no repetir evaluaciones innecesariamente. Una vez en el mercado, el conocimiento sobre el uso del medicamento en condiciones reales se incrementa exponencialmente. El papel del médico prescriptor como diana del mercado y auténtico «consumidor» del medicamento debe mantenerse cercano al núcleo de tomas de decisiones. Incorporar el término eficiencia al vocabulario sanitario es un paso fundamental para tomar conciencia de la importancia del gasto sanitario y para seguir avanzando. Solo así pacientes, sistema sanitario, industria y la sociedad en su conjunto obtendrán el mayor beneficio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.