La artritis psoriásica (APs) es una enfermedad inflamatoria sistémica crónica que afecta a la piel, las estructuras musculoesqueléticas y otros órganos y sistemas, comprometiendo la funcionalidad, la calidad de vida y reduciendo la expectativa de vida de los pacientes. Es una enfermedad compleja que requiere atención y manejo especializado y oportuno. Las alternativas para el tratamiento de las manifestaciones de la APs se han incrementado y, adicionalmente, el efecto de los distintos agentes sobre manifestaciones específicas ha sido aclarado en estudios recientes, por lo tanto, es conveniente incorporar la evidencia disponible para construir una estrategia en el tratamiento de estos pacientes. El Colegio Mexicano de Reumatología seleccionó una comisión para evaluar estas distintas alternativas y generar recomendaciones.
MétodosEl grupo de estudio incluyó a 16 reumatólogos y tres dermatólogos certificados, que fueron seleccionados de diferentes instituciones de salud y regiones del país. Se conformó un comité ejecutivo que coordinó las reuniones y un comité de expertos que seleccionó los criterios de búsqueda en la literatura, elaboró las preguntas de investigación, calificó la calidad de la evidencia y generó las recomendaciones en los distintos dominios de la enfermedad con base en la metodología GRADE.
ResultadosSe generaron 24 recomendaciones actualizadas para el tratamiento de pacientes con APs. Las recomendaciones establecen el papel de los medicamentos disponibles actualmente en nuestro país. Se enfatiza la importancia del control adecuado de la enfermedad, individualizando el perfil de involucramiento de cada paciente en cada uno de los seis dominios potencialmente afectados por la enfermedad. Además, se establece la secuencia en la elección de los tratamientos disponibles para cada dominio, basada en su eficacia, perfil de seguridad y accesibilidad.
ConclusionesCon este documento de consenso se podrá mejorar la atención de los pacientes con APs. Las recomendaciones se generaron de acuerdo con la mejor información disponible y en consideración del sistema de salud de México.
Psoriatic arthritis is a chronic systemic inflammatory disease that affects the skin, musculoskeletal structures and other organs and systems compromising functionality, quality of life and reducing the life expectancy of patients. It is a complex disease that requires specialist and timely care and management. The alternatives for treating the manifestations of psoriatic arthritis have increased and the effect of the different agents on specific manifestations has been clarified in recent studies. Therefore, we should incorporate the available evidence to build a strategy for the treatment of these patients. The Mexican College of Rheumatology selected a committee to evaluate these different alternatives and make recommendations.
MethodsThe study group included 16 rheumatologists and 3 certified dermatologists, selected from different health institutions and regions of the country. An executive committee was formed to coordinate the meetings and a committee of experts selected the literature search criteria, prepared the research questions, rated the quality of the evidence, and produced the recommendations in the different disease domains based on the GRADE methodology.
Results24 updated recommendations were generated for the treatment of patients with psoriatic arthritis. The recommendations establish the role of the drugs currently available in our country. The importance of adequate disease control is emphasized, individualizing the level of involvement of each patient in each of the six domains potentially affected by the disease. In addition, the sequence in the choice of treatments available for each domain is established, based on their efficacy, safety profile and accessibility.
ConclusionsWith this consensus document, it will be possible to improve the care of patients with psoriatic arthritis. The recommendations were generated based on the best available information and in consideration of the Mexican health system.
La artritis psoriásica (APs) es una enfermedad reumática, sistémica, heterogénea y grave, que se caracteriza por inflamación de las articulaciones, de las estructuras periarticulares y la piel y sus anexos, manifestada como psoriasis. La afección musculoesquelética puede involucrar a diferentes dominios incluyendo: artritis periférica, afección axial, entesitis y dactilitis1. La afección dermatológica incluye a la piel y las uñas.
La heterogeneidad de la APs obliga a personalizar el tratamiento considerando el involucro que cada paciente tiene en cada dominio: artritis periférica, afección axial, entesitis, dactilitis, piel y uñas. Esta individualización es ahora más importante debido a que la eficacia de los distintos tratamientos es heterogénea entre los dominios, por lo tanto, el tratamiento puede ser subóptimo si no considera el perfil de afección del paciente.
Además de las esferas cutánea y articular, la APs afecta otros sistemas. La enfermedad, en especial en las etapas activas induce un estado de desequilibrio sistémico, caracterizado por síndrome metabólico y un incremento significativo de la morbilidad cardiovascular. Por lo anterior, el tratamiento adecuado del proceso inflamatorio se convierte en una estrategia para minimizar el impacto de la enfermedad.
El tratamiento de la APs suele iniciar con con los antiinflamatorios no esteroideos (AINE) e incluye además los fármacos modificadores de la enfermedad sintéticos convencionales (FARMEsc), los fármacos modificadores de la enfermedad con diana específica (FARMEe) que abarcan a los inhibidores de la cinasa de Janus (tofacitinib) y de la fosfodiesterasa-4 (apremilast), así como, los fármacos modificadores de la enfermedad biológicos (FARMEb), entre los que están los agentes antagonistas del factor de necrosis tumoral (I-TNF), el antagonista de las interleucinas (IL) 12/23 (ustekinumab), los de la IL-17 (secukinumab e ixekizumab), y el de la IL-23 (guselkumab), y el abatacept (proteína de fusión con CTLA-4) que es un inhibidor de la coestimulación de linfocitos T.
Esta expansión de opciones terapéuticas ofrece a los pacientes nuevas posibilidades en el control de su enfermedad, pero a la vez nos obliga a replantear las estrategias en la selección de los distintos tratamientos, valorando la eficacia de cada uno de los agentes para manifestaciones específicas de la APs, y en lo posible, establecer un orden en su prescripción. Estas recomendaciones pretenden optimizar el tratamiento de los pacientes con APs con base en la evidencia científica disponible y utilizando el criterio de expertos en el manejo de estos pacientes.
Las recomendaciones consideran los dominios de afección de APs propuestos por el grupo de GRAPPA2 como punto de partida para definir la utilidad de los distintos agentes terapéuticos. Estas recomendaciones están avaladas por el Colegio Mexicano de Reumatología.
MétodosComité ejecutivo: Se integró un comité ejecutivo (CE) constituido por los investigadores principales, una coordinadora del proyecto y dos vocales.
Las funciones del CE incluyeron la planeación y ejecución del proyecto, la selección de los integrantes del grupo de expertos, la calendarización y logística de las reuniones y la selección del personal encargado de la revisión bibliográfica, así como su metodología.
Grupo de expertos. Se conformó un grupo de 16 reumatólogos y tres dermatólogos con conocimientos y experiencia en el tratamiento de pacientes con APs y con experiencia en recomendaciones y guías terapéuticas. Las funciones del grupo de expertos fueron: la selección de temas y subtemas con relación a la definición y clasificación de la APs, la elaboración de las preguntas de investigación empleadas en la revisión sistemática de la literatura (RSL) teniendo en consideración los seis dominios de afección de la APs, la elección de las medidas de desenlace primarias y secundarias, la elaboración de las agendas de trabajo y, finalmente, la redacción de las recomendaciones.
Revisión sistemática de la literatura. Como requisito previo a la sesión del consenso se llevó a cabo una RSL sobre tratamientos para APs, la revisión fue llevada a cabo por dos investigadores independientes. En el Anexo 1 se presenta la descripción metodológica completa de la RSL.
La RSL incluyó preguntas de investigación desglosadas por dominios: artritis periférica, enfermedad axial, dactilitis, entesitis, psoriasis en piel y psoriasis (Ps) ungueal. Para cada dominio se cuestionó: actividad inflamatoria, deterioro estructural, mejoría, remisión parcial, enfermedad inactiva, actividad moderada, actividad alta, actividad muy alta, mejoría clínica importante, mejoría clínica muy importante, calidad de vida y estado de salud. Además, se complementó con la seguridad y eficacia de tratamientos farmacológicos, no farmacológicos y quirúrgicos considerados en la RSL. La RSL incluyó artículos publicados en lengua inglesa y castellana.
Para establecer los criterios de búsqueda se empleó la pregunta Patient or problem, Intervention, Comparison, Outcomes (PICO) contemplando los siguientes criterios:
Pacientes. Pacientes con diagnóstico de APs con inicio de la enfermedad ≥ 18 años.
Intervención. Terapia farmacológica (FARMEb, FARMEsc, AINE, glucocorticoides, otros), terapia no farmacológica (ejercicio y programas de información) e intervención quirúrgica.
Comparación. Las diferentes intervenciones ya mencionadas fueron evaluadas en diversos regímenes o dosis, en comparación con el uso de otra intervención, placebo o ninguna.
Desenlaces. Se utilizaron las medidas de desenlace más utilizadas en cada uno de los dominios analizados.
En artritis periférica los índices del American College of Rheumatology improvement response criteria (ACR) para 20, 50 y 70% de mejoría (ACR20, ACR50, ACR70) y el Disease Activity Score for 28 Joints (DAS-28). En enfermedad axial se analizaron los índices de actividad Ankylosing Spondylitis Disease Activity Score (ASDAS) y Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) y de funcionalidad Bath Ankylosing Spondylitis Functional Index (BASFI), los criterios de mejoría ASAS 20, ASAS 40, ASAS 5/6, ASAS partial remission (ASAS-PR), dolor, Proteína C reactiva (PCR), así como los índices radiográficos Bath Ankylosing Spondylitis Radiology Index (BASRI), modified Stoke Ankylosing Spondylitis Spine Score (mSASS) y Radiographic AS Spinal Score (RASSS) e índices a partir de la resonancia magnética (Leeds, Berlin, Spondyloarthritis Research Consortium of Canada [SPARCC Scoring system]).
En entesitis, las medidas de desenlace consideradas fueron el cambio del valor inicial en la puntuación de entesitis, el Maastricht Ankylosing Spondylitis Enthesitis Score (MASSES), el Leeds Enthesitis Index (LEI), el Spondyloarthritis Research Consortium of Canada Enthesitis Index (SPARCC) y el porcentaje de resolución de casos de entesitis.
En dactilitis se consideraron el Leeds Dactylitis Index-Basic (LDI-B), el porcentaje de resolución de casos de dactilitis, y el cambio del valor inicial de puntuación del Dactylitis Severity Score (DSS).
En psoriasis en la piel se consideraron como medidas de desenlace los índices Psoriasis Area Severity Index (PASI) con mejoría de 50, 75, 90 y 100% (PASI50/75/90/100), Body Surface Area (BSA) y el indicador de respuesta Physician's Global Assessment (PGA).
En la Ps ungueal se analizaron estudios que reportaron el Nail Psoriasis Severity Index (NAPSI) y el modifiedNail Psoriasis Severity Index (mNAPSI).
Para evaluar la seguridad de los tratamientos se evaluó la frecuencia de eventos adversos graves, infección, infección grave, malignidad y descontinuación del tratamiento por evento adverso (Anexo 1).
La RSL abarcó el periodo de enero de 2016 a junio de 2020, además, se revisaron los estudios pivotales de los fármacos que tuvieran la indicación en APs si hubiesen sido publicados en forma previa. Los estudios elegibles fueron: metaanálisis, revisiones sistemáticas, ensayos clínicos aleatorizados controlados, ensayos clínicos controlados y ensayos clínicos de extensión. Las estrategias de búsqueda se replicaron en las bases de datos PubMed, EMBASE, ScienceDirect y CINAHL, considerando las características y limitaciones de cada sistema de información.
El grado de evidencia de los artículos fue calificada con la escala GRADE, de acuerdo con el riesgo de sesgo, consistencia, resultados directos, heterogeneidad, precisión y sesgo de publicación.
Reuniones de trabajoLa primera sesión de trabajo se planeó para que los expertos presentaran al pleno del comité las características y definiciones principales en el manejo de la APs y se discutieran las características del sistema de salud y las opciones terapéuticas disponibles en México. Esta discusión orientó la búsqueda de información para la RSL y se consideraron preguntas de investigación específicas para cada dominio de la enfermedad.
Las recomendaciones se adaptaron al contexto del sistema de salud nacional y se enriquecieron con la evidencia obtenida en la RSL y con la experiencia clínica de los expertos.
Reunión preliminarDurante el proceso de elaboración de este consenso se discutieron algunos factores que limitan potencialmente el acceso de los pacientes a su atención integral. Además, se seleccionó el listado de temas que se incluyeron en cada una de las búsquedas en la literatura médica.
Reunión de consensoEn la segunda reunión se presentaron los documentos analizados en la RSL, haciendo énfasis en los resultados de eficacia y seguridad de cada estudio. Adicionalmente, se revisaron a detalle las recomendaciones y guías para el tratamiento de APs (GRAPPA, EULAR y de la SER) para lograr una visión generalizada de los conceptos terapéuticos contemporáneos.
Se analizó en forma estructurada la evidencia proveniente de la RSL y, el coordinador del consenso presentó al comité los temas y subtemas asociados, con base en una discusión interna se generaron las propuestas de cada recomendación tomando como estructura en esta discusión abordar cada uno de los dominios de la enfermedad. Ante cada propuesta de recomendación, los expertos señalaron su opinión, en casos de desacuerdo, se revisó a mayor detalle aspectos específicos de la RSL.
Prevalencia de la APsSe desconoce la prevalencia de APs o de Ps en la población mexicana. La prevalencia de la psoriasis varía en las distintas etnias y zonas geográficas. Se ha reportado una prevalencia de 2,8% en Islas Faroe, de 1,4% en Suecia y en los Estados Unidos fue de 1,3% en población afroamericana y de 3,15% en población general3. La prevalencia de la APs varía en el rango de un caso (en Japón) a 420 casos (en Italia) por cada 100 mil habitantes (con valor medio de 180 casos por 100.000 habitantes) y se estima que alrededor de 30% de los pacientes con psoriasis desarrolla algún tipo de artritis4.
En un estudio realizado en Argentina, se examinaron expedientes de 138.288 clientes de seguros médicos privados en el periodo de 2000 a 2006, se estimó una prevalencia de 74 casos en cada 100.000 habitantes (IC 95%, 57-94)5.
El análisis desglosado por área geográfica en pacientes con psoriasis indica que la prevalencia de APs en europeos fue de 22,7% (IC 95%, 20,6-25,0%), en sudamericanos 21,5% (IC 95%, 15,4-28,2%), en norteamericanos 19,5% (IC 95%, 17,1-22,1%), en africanos 15,5% (IC 95%, 0,009-51,5%) y en asiáticos 14,0% (IC 95%, 11,7-16,3%)6. Lo anterior resalta la importancia de la realización de estudios epidemiológicos en la población de nuestro país para definir con mayor precisión el impacto real de la enfermedad.
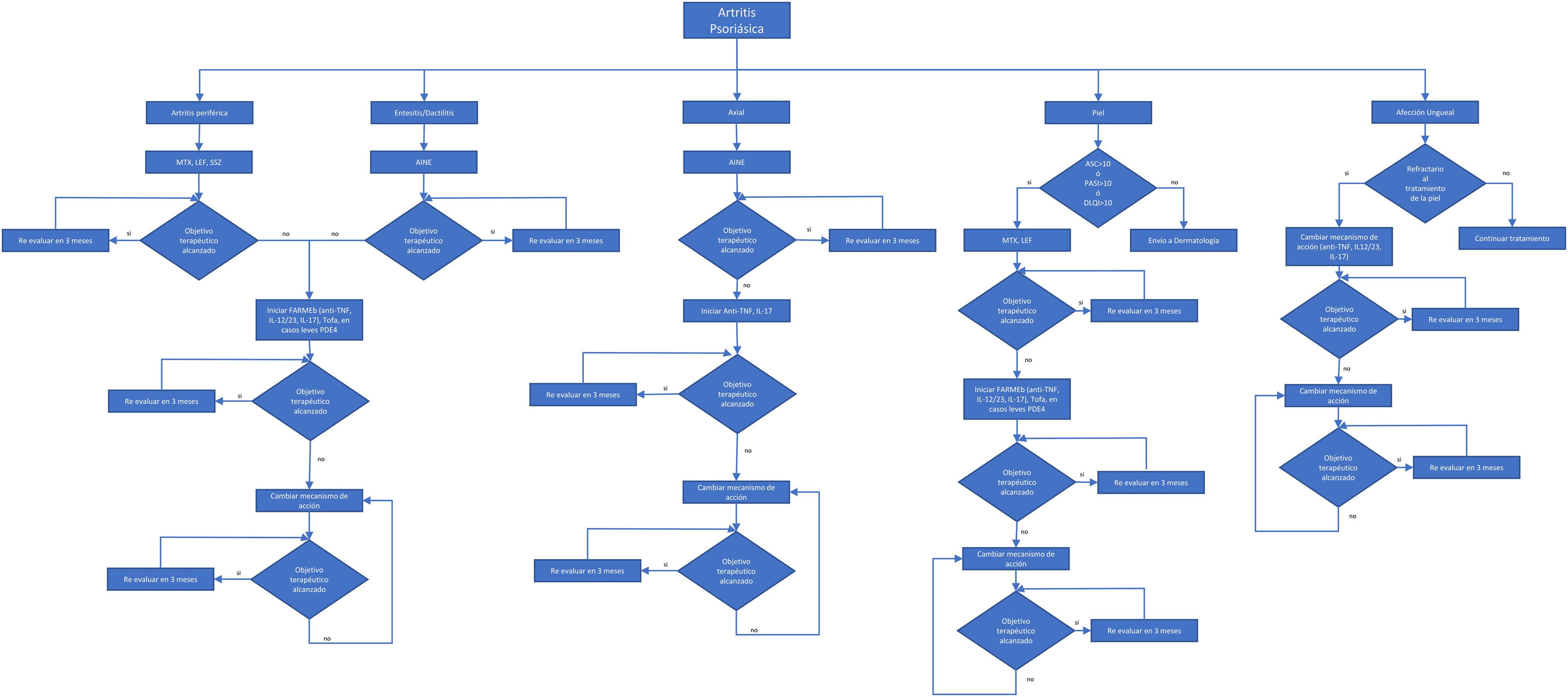
Aspectos terapéuticos y recomendacionesLos algoritmos para el tratamiento de las manifestaciones musculoesqueléticas de la APs recomiendan iniciar el tratamiento con antiinflamatorios no esteroideos (AINE)7. De no haber respuesta o presentarse toxicidad, se recomienda cambiar a metotrexato (MTX), leflunomida (LEF) o sulfasalazine (SSZ) (FARMEsc), aunque la eficacia es variable y hay pobre respuesta en pacientes con enfermedad axial. El algoritmo de tratamiento propuesto en este consenso se muestra en la figura 1.
Algoritmo de tratamiento para Artritis psoriásica.
AINE: antiinflamatorio no esteroideo; MTX: metotrexato; LEF: leflunomida; FARMEb: fármacos modificadores de la enfermedad biológicos; Tofa: tofacitinib; Anti-TNF; IL-12/23, IL-17: inhibidores del factor de necrosis tumoral; interleucinas 12,23, o 17; PDE4: apremilast.
En el diseño de la estrategia terapéutica es necesario considerar el patrón de afección de cada paciente en cada dominio.
En los casos resistentes de APs se requiere el uso de FARMEb8–10. Las guías de GRAPPA no indican de manera clara una preferencia de uso de FARMEb en primera línea de tratamiento, mientras que las guías EULAR sí consideran los I-TNF como línea inicial de tratamiento en pacientes con falla a FARMEsc y con enfermedad predominantemente periférica o en etapas tempranas de enfermedad predominantemente axial8,9,11. No todos los tratamientos con FARMEb son exitosos, algunos pacientes no logran alcanzar o mantener estados satisfactorios por diversas razones. En adelante se analizarán los distintos tratamientos disponibles en APs.
FARMEscMetotrexatoEl uso de MTX es una de las primeras opciones para los pacientes que no han tenido respuesta al tratamiento con AINE, hay evidencia de baja calidad que indica que con dosis de ≤ 15 mg semanales es superior a placebo y su uso se indica para la piel y la artritis periférica. Adicionalmente, no se ha definido el efecto del MTX sobre la progresión radiográfica, el compromiso axial, entesitis, dactilitis, uñas, la fatiga o la calidad de vida12.
LeflunomidaSe administra en dosis de 20 mg al día. Los estudios de eficacia de LEF en APs no son de buena calidad, ya sea por aplicarse en una población pequeña13 o porque son observacionales14,15 aunque los resultados obtenidos son semejantes a los obtenidos con MTX. Desde el punto de vista articular se reporta una tasa de ACR70 discretamente mayor con LEF pero con menor eficacia en el control de la psoriasis14, el perfil de seguridad es similar al del MTX y no hay estudios que evalúen la combinación de ambos. No se ha demostrado una utilidad de LEF en el resto de los dominios.
SulfasalazinaSe emplea en dosis de hasta 2 a 3 g al día. Su uso es limitado debido a que el efecto es sólo sobre la artritis periférica sin mejorar la afección cutánea, no se ha demostrado su utilidad en el componente axial, o el resto de los dominios. Al igual que MTX y LEF, la evidencia de eficacia de SSZ en el tratamiento de APs es de baja calidad y se le considera inferior a MTX16–21.
TacrolimusEs un fármaco inmunosupresor de la familia de los inhibidores de la calcineurina, que ha sido utilizado en el tratamiento de las recaídas o las resistencias en diversas afectaciones reumáticas. La evidencia disponible es de baja calidad, por lo que no se puede hacer una recomendación con base en sus resultados de eficacia. Puede ser empleado después de falla a FARMEb22.
Fármacos modificadores de la enfermedad biológicosFARMEbLa terapia biológica en APs se ha incrementado en forma reciente con una variedad de dianas terapéuticas y también el número de nuevos agentes dirigidos a estas dianas, esto ha diversificado las posibilidades de tratamiento, enriqueciendo la perspectiva para los pacientes con enfermedad refractaria.
El primer grupo de FARMEb utilizado en APs incluye a los antagonistas del factor de necrosis tumoral (I-TNF), a este se suman: el antagonista de IL-12/23 (ustekinumab)23–25, de la IL-17 (secukinumab e ixekizumab)26,27, de la IL-23 (guselkumab)28,29 y abatacept, el cual bloquea la coestimulación de linfocitos T.
I-TNFEl grupo de los I-TNF incluye a cinco medicamentos: etanercept, infliximab, adalimumab, certolizumab pegol y golimumab. Todos han recibido la indicación para el tratamiento de APs en México. Existe evidencia de su eficacia en el tratamiento de la Ps y de la APs, esta evidencia se origina de varios ensayos clínicos controlados.
Etanercept mostró que 59% de los pacientes con APs, alcanzaban a las 12 semanas una respuesta ACR20 y 47% un PASI50 a la semana 2430. Infliximab en el estudio IMPACT demostró a las 16 semanas alcanzar un ACR20 en 65% de los pacientes y a la semana 50 un PASI50 en 80%31. Adalimumab en su estudio ADEPT logró un ACR20 en 58% de los pacientes en la semana 20 y un PASI75 en 59% a la semana 2432. Certolizumab en el RAPID-PsA obtuvo un puntaje ACR20 en 58% de los pacientes a la semana 12 y un PASI75 en 62,2% a la semana 2433. Finalmente, golimumab, en su estudio GO-REVEAL, obtuvo un ACR20 en 51% de los pacientes en la semana 14 y un PASI75 en 58% a las 52 semanas34.
La eficacia de los I-TNF ha quedado demostrada para cada uno de los dominios señalados por GRAPPA (artritis periférica, afección axial, piel, uñas, dactilitis y entesitis). De igual manera, se ha demostrado reducción en la progresión radiográfica en las articulaciones periféricas, medida con el índice de Sharp modificado, su rol en la prevención de las alteraciones estructurales a nivel axial no se ha definido. La comparación entre los diferentes I-TNF ha demostrado perfiles de eficacia y de seguridad muy similares, de hecho, se ha demostrado que, en caso de falla a alguno de ellos, la sustitución por otro agente del mismo grupo puede beneficiar al paciente, aunque la tendencia ante la pérdida de la eficacia es cambiar de mecanismo de acción.
Inhibidores de la IL-12 y la IL-23Ustekinumab inhibe el receptor p40 el cual es compartido por la IL-12 y de la IL-23 y por lo tanto antagoniza a ambas. Ha sido ampliamente utilizado en pacientes con APs, se ha demostrado su utilidad en la piel y en uñas, además es también eficaz en la artritis periférica, entesitis y dactilitis, su eficacia en el componente axial es cuestionable por no demostrar un efecto suficiente en pacientes con espondiloartritis axial. Los estudios PSUMMIT 1 y 2 demostraron que ustekinumab a dosis de 45 mg y 90 mg a 24 y 52 semanas es eficaz en el tratamiento de APs en pacientes con falla a FARME e I-TNF23–25.En el estudio PSUMMIT1, en pacientes con falla a FARMEsc y AINE, ustekinumab demostró una respuesta ACR20 a la semana 24 en 42,4% (45 mg) y 49,5% (90 mg) de los pacientes vs. 22,8% de los pacientes con placebo (p<0,0001), respuesta ACR50 en 24,9% (45 mg) y 27,9% (90 mg) vs. 8,7% con placebo y respuesta ACR70 en 12,2% (45 mg) y 14,2% (90 mg) vs. 2,4% con placebo (p<0,0001). Con relación a los objetivos secundarios, hubo mejoría en la dactilitis (p = 0,0003) y la entesitis (45 mg y 90 mg) p = 0019 y p<0,0001, respectivamente, vs. placebo. Un total de 69,1% alcanzaron un PASI75 a las 52 semanas con ambas dosis23.
De manera más reciente, se han desarrollado fármacos antagonistas especíicos para la IL-23. Hay estudios publicados de guselkumab, risankizumab y tildrakizumab. De los tres, solo guselkumab tiene la indicación para Ps y APs en México. En el estudio Discover-1, se utilizaron dos esquemas de dosificación de guselkumab, 100 mg cada cuatro semanas o 100 mg cada ocho semanas, después de dos dosis iniciales de carga (semanas 0 y 4), el grupo de cada cuatro semanas obtuvo un ACR 20 a la semana 24 en 59% y el de cada ocho semanas en 52 vs. 22% en el grupo placebo. El ACR 50 se obtuvo en 36% (cada cuatro semanas) y en 30% (cada ocho semanas) vs. 9% en el grupo placebo, y el ACR70 en 20% (cada cuatro semanas), en 12% (cada ocho semanas) y en 6% del grupo placebo. La respuesta PASI100 se obtuvo en 45% (cada cuatro semanas), en 26% (cada ocho semanas) vs. 6% en el grupo placebo. Guselkumab tuvo un efecto favorable en la entesitis alcanzando significancia estadística en la dosis de cada cuatro semanas y aunque la resolución de la dactilitis fue superior a placebo en ambos grupos de guselkumab, la diferencia no alcanzó significancia estadística. Si bien la información disponible de guselkumab muestra resultados prometedores, dada su muy reciente inclusión en nuestro país, ninguno de los miembros de este panel tiene experiencia con el y en este punto no consideramos adecuado incluirlo como opción en esta versión de nuestras recomendaciones.
Inhibidores de IL-17En la actualidad existen dos integrantes en esta clase terapéutica disponibles en México, secukinumab e ixekizumab.
Secukinumab demostró un efecto superior a placebo a las 24 semanas, alcanzó un ACR20 en 54% de los pacientes a dosis de 300 mg SC y en 51% de los pacientes con 150 mg SC vs. 15% del grupo que recibió placebo. En relación con la piel, la respuesta PASI75 fue de 63 y 48%, respectivamente, vs. 16% del grupo placebo. Las dosis iniciales fueron semanales por las primeras cuatro aplicaciones y mensual de la quinta en adelante. La resolución de la dactilitis fue de 47 vs. 15% del grupo placebo y de la entesitis de 40 vs. 22% del grupo tratado con placebo26. En el seguimiento a dos años, los pacientes tratados con secukinumab registraron actividad mínima de la enfermedad, definida con PASDAS, en 36,1 y 35,1%, con las dosis de 300 mg y 150 mg, respectivamente35.
Por otra parte, ixekizumab (IXE) a dosis de 80 mg cada dos semanas o cada cuatro semanas, en pacientes con APs vírgenes a FARMEb (SPIRIT-P1), demostró superioridad a placebo en respuesta con ACR20 (62,1% IXE quincenal, 57,9% de IXE mensual y 30,2% en el grupo placebo [p ≤ 0,001], y un PASI75 en 79,7% con IXE quincenal, en 71,2% con IXE cada cuatro semanas y en 10,4% del grupo placebo) (p ≤ 0,001) a las 24 semanas36, esta mejoría se mantuvo hasta la semana 5237. Se identificó también mejoría significativa en los síntomas cutáneos, calidad de vida relacionada a la salud y productividad laboral38. En el estudio SPIRIT-P2, en pacientes con APs resistente a I-TNF, se obtuvo una diferencia en ACR20 (48% IXE quincenal, 53% IXE cada cuatro semanas, comparados con 20% del grupo placebo) (p<0,0001) a la semana 2439, además de una respuesta significativamente más alta que placebo en minimal disease activity (MDA), Disease Activity Index for PsA (DAPSA) y DAS28-PCR en los pacientes tratados con IXE40. Al integrar los datos de los estudios SPIRIT-P1 y P2, el tratamiento con IXE resultó en una mejoría significativa en pacientes con entesitis y dactilitis preexistente41,42.
AbataceptAbatacept ha demostrado su utilidad en el control de la artritis periférica. Su utilidad en manifestaciones cutáneas, ungueales o bien en los componentes axiales, de dactilitis o de entesitis es inferior a las otras alternativas de FARMEb, por lo cual se recomienda básicamente para pacientes cuya manifestación musculoesquelética predominante sea artritis periférica y en quienes la Ps se encuentre bajo control43,44.
Fármacos modificadores de la enfermedad sintéticos dirigidos a un blanco específicoTofacitinibAdemás de la terapia biológica, la inhibición de las cinasas de Janus por agentes como tofacitinib (i-Jak) ha demostrado también su eficacia en varios dominios de la enfermedad. En la actualidad, tofacitinib tiene la indicación para el tratamiento de la APs y ha demostrado efectividad en las alteraciones cutáneas y en las musculoesqueléticas, en el estudio OPAL45, tofacitinib obtuvo un ACR20 en 68% y un PASI75 en 56% a 12 meses. En este mismo estudio se demostró mejoría en la dactilitis y en la entesitis además de otros dominios como fatiga y función física. La dosis de 10 mg dos veces al día fue superior a la de 5 mg dos veces al día. Tofacitinib es también de utilidad en pacientes con APs en quienes ha fallado el tratamiento con I-TNF, la dosis aprobada es de 5 mg cada 12 horas46.
Actualmente están en activo ensayos cínicos con otros inhibidores de cinasas de Janus (upadacitinib y filgotinib) sin embargo estos medicamentos aún no se encuentran disponibles en nuestro país.
ApremilastApremilast es un FARMEe, inhibidor de la fosfodiesterasa-4, se utiliza en dosis de hasta 60 mg al día. Tiene un perfil de seguridad aceptable, por ello es utilizada en los pacientes de APs con varias comorbilidades. Los resultados de la terapia con apremilast pueden ser observados después de cuatro meses. No se recomienda combinarlo con medicamentos biológicos47–49. Los estudios PALACE constan de tres fases, con reportes a la semana 16, 28, 52 y con una fase de extensión por cuatro años (fase abierta), en una serie de tres publicaciones reportaron los resultados de los estudios con un mismo diseño: ensayos clínicos, aleatorizados, controlados con placebo para demostrar la eficacia de apremilast a dosis de 20 y 30 mg por vía oral dos veces al día, en 1.493 pacientes con APs activa y con antecedente de falla a FARME.
En la semana 260, 67,2% de los pacientes alcanzaron respuesta ACR 20, 44,4 y 27,4% respuesta ACR 50 y ACR 70, respectivamente. Con relación a la entesitis y la dactilitis, 62,4% tuvieron un índice de MASES de 0 y un 80,9% presentaron un conteo de dactilitis de 0. Le respuesta en la piel en pacientes de más de 3% de superficie corporal afectada registraron una respuesta PASI75 en 43,6% de los casos.
Restricciones en el uso de FARMEb y de i-JakEl inicio de terapia biológica o de i-Jak tiene como prerrequisito un proceso de escrutinio. En este proceso se incluye la búsqueda de tuberculosis activa o latente, mediante la realización de Quantiferón o de derivado proteico purificado (PPD), cualquiera de las dos pruebas debe ser complementada por una telerradiografía de tórax. El escrutinio también incluye la realización de biometría hemática completa, pruebas de funcionamiento hepático, serología de hepatitis y detección del virus de inmunodeficiencia humana (VIH).
Como regla general, el inicio de terapia biológica o de i-Jak está contraindicado en pacientes con infecciones activas, con cirugías electivas en un plazo muy breve o con enfermedades sistémicas serias que se encuentren descontroladas (metabólicas, cáncer, infecciones crónicas). Estos fármacos tienen contraindicación relativa en pacientes con aumento en factores de riesgo para infecciones (edad avanzada, citopenias, historia de infecciones recurrentes) y dependiendo de su mecanismo de acción, tienen contraindicaciones específicas.
Los I-TNF deben ser utilizados con cautela en pacientes con factores de riesgo para desarrollar tuberculosis y su uso en pacientes con tuberculosis latente requiere de un periodo de tratamiento profiláctico. Su uso está restringido también en pacientes con insuficiencia cardiaca congestiva o con enfermedades desmielinizantes. Ha resultado de interés la relación de los I-TNF con cáncer cutáneo, ya que su uso se contraindica en pacientes con psoriasis sometidos a tratamiento con luz ultravioleta.
El uso de agentes I-IL-17 tiene como contraindicación relativa la historia de enfermedad inflamatoria intestinal o de uveítis recurrente. Los i-Jak tienen como contraindicación que el paciente tenga historia de herpes zóster diseminado o multidermatoma, además de pacientes con riesgo incrementado de trombosis50,51. Ustekinumab y abatacept no tienen contraindicaciones específicas.
Resultados de la revisión sistemática de la literaturaLa RSL nos permitió localizar la información sobre APs publicada en el periodo de enero de 2016 a junio de 2020. Se clasificó su grado de evidencia y de este análisis, se dio respuesta a las preguntas planteadas y se generaron las recomendaciones.
RecomendacionesAspectos generales del tratamiento:
En opinión del grupo de expertos se definieron como principios generales del tratamiento del paciente con APs:
- 1.
El tratamiento debe ser definido por común acuerdo entre el médico y el paciente, después de brindar al paciente la información necesaria para que norme su criterio.
- 2.
El tratamiento debe iniciar desde las etapas más tempranas de la enfermedad.
- 3.
El tratamiento debe ser proporcionado por el médico especializado, el reumatólogo para las manifestaciones musculoesqueléticas y es deseable la participación del dermatólogo en el control de las alteraciones de la piel, en casos severos desde el diagnóstico inicial o en aquellos refractarios al tratamiento en cualquier etapa.
- 4.
El tratamiento está dirigido a reducir los síntomas de la enfermedad en los dominios que se encuentren afectados, mejorar la funcionalidad del paciente, prevenir el daño estructural, así como la pérdida de la función. El objetivo debe ser la remisión clínica o si no es posible, lograr un bajo grado de actividad clínica. Para cada dominio existen diferentes instrumentos validados, sin embargo, el concepto de objetivo terapéutico alcanzado no logra un consenso unísono. Preferentemente la definición de mejoría en cada dominio debe basarse en el uso de instrumentos validados.
- 5.
El tratamiento debe ser personalizado, es necesario identificar los dominios que la enfermedad afecta en cada paciente, seleccionar el que más impacta el bienestar del paciente y con base en este seleccionar medicamentos que logren su control.
- 6.
El paciente debe ser reevaluado en forma periódica para lograr un control más cercano de la actividad de la enfermedad.
- 7.
El tratamiento incluye la detección y el adecuado control de las comorbilidades.
Recomendación 1. Los AINE están recomendados para mejorar los síntomas de la artritis periférica, utilizando dosis plenas, sin combinación, de manera intermitente y con las debidas precauciones por los posibles eventos adversos.
Calidad de la evidencia: Baja. Fuerza de la Recomendación: Débil.
Recomendación 2. En los pacientes sin consumo previo de FARMEsc, es altamente recomendado iniciar tratamiento con fármacos de este grupo, como MTX12, LEF14 o SSZ16–21. No hay evidencia de eficacia que sustente el uso de ciclosporina (CyA) para el tratamiento de APs y se recomienda cautela por su perfil de toxicidad.
Calidad de la evidencia: Alta. Fuerza de la Recomendación: Fuerte.
Recomendación 3. Ante el fallo de FARMEsc, se debe considerar el uso de FARMEb. Durante el periodo de revisión se identificaron estudios que refuerzan esta recomendación para los I-TNF33,52–57, IL-12/2323–25, I-IL-1726,27. Si no hay una respuesta adecuada a los fármacos de este primer grupo, se recomienda iniciar tratamiento con tofacitinib46 o abatacept58 y en casos leves con apremilast.
Calidad de la evidencia: Alta. Fuerza de la Recomendación: Fuerte.
Recomendación 4. En el caso de que un FARMEb falle por ineficacia o debido a eventos adversos, se puede intercambiar por otro FARMEb o i-jak preferentemente con un mecanismo de acción diferente.
Calidad de la evidencia: Alta. Fuerza de la Recomendación: Fuerte.
Recomendación 5. Los glucocorticoides de vida intermedia (prednisona o deflazacort) por vía oral se recomiendan en periodos de reactivación de la APs, en dosis inferiores o menores a 7,5 mg/día de prednisona o su equivalente en el caso de la vía oral, por periodos cortos de tiempo, con el fin de evitar eventos adversos, que incluyen la exacerbación de la psoriasis tras la interrupción del tratamiento. No se recomienda el uso sistémico de glucocorticoides fluorados para el tratamiento de manifestaciones musculoesqueléticas. La aplicación intraarticular de glucocorticoides puede ser considerada en casos refractarios en presentaciones mono u oligoarticulares.
Calidad de la evidencia: Baja: Fuerza de la recomendación: Débil.
Enfermedad axialRecomendación 6. El tratamiento de primera línea para los síntomas de la enfermedad axial en APs son los AINE, se recomienda únicamente la utilización de dosis terapéuticas sin combinarlos con otro AINE, tomando las debidas precauciones por los posibles eventos adversos. (Acuerdo: 100%).
Calidad de evidencia: Baja, Fuerza de la recomendación: débil.
Recomendación 7. Ante el fallo de AINE se recomienda el uso de I-TNF59–63 en primera línea y en casos refractarios o con contraindicación para I-TNF, se recomienda el uso de I-IL-1726,27. El uso de I-IL-17 debe ser considerado en pacientes con psoriasis extensa o muy activa, el uso de I-IL-17 debe evitarse en pacientes con enfermedad inflamatoria intestinal. El uso de I-TNF (excepto etanercept) debe ser preferido en pacientes con historia de uveítis.
Calidad de la evidencia: Alta. Fuerza de la Recomendación: Fuerte.
Recomendación 8 Ante respuesta inadecuada a un FARMEb, se recomienda el cambio a un FARMEb con otro mecanismo de acción restringiéndose este cambio sólo a los dos mecanismos de acción previamente señalados (I-TNF, I-IL-17). No hay evidencia suficiente de efectividad con ustekinumab, apremilast, abatacept o tofacitinib por lo que no están recomendados para enfermedad axial.
Calidad de la evidencia: Alta. Fuerza de la Recomendación: Fuerte.
Recomendación 9. La fisioterapia y la rehabilitación física están recomendadas como complemento al tratamiento farmacológico64.
Calidad de la evidencia: Moderada. Fuerza de la recomendación: Débil.
Recomendación 10. En este dominio de la enfermedad no hay evidencia de efectividad de los FARME, incluyendo SSZ, por lo que no se recomienda su uso.
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
EntesitisLa entesitis es una manifestación frecuente de la APs, su presencia impacta empeora varias medidas de actividad de la enfermedad, empobrece el pronóstico y deteriora la calidad de vida. En la mayor parte de los casos la entesitis acompaña a la artritis periférica o bien a la afección axial. Se ha descrito un subgrupo de entesitis aislada en APs pero este es menor a 5% del total de pacientes65. Por lo tanto, el tratamiento de la entesitis en general no determina el tratamiento global, para los casos en los cuales se logre el control de las otras manifestaciones y la entesitis sea resistente a esas medidas terapéuticas se consideran las siguientes opciones.
Recomendación 11. En opinión de los expertos, la primera línea de tratamiento en entesitis incluye los AINE, aunque la evidencia no deriva de ensayos específicos.
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
Recomendación 12. No hay estudios que sustenten la eficacia de los FARMEc en el tratamiento de la entesitis, no obstante, en opinión de los expertos, el único FARMEc con efecto en entesitis es la SSZ, se recomienda utilizarla sólo en pacientes refractarios, con alguna contraindicación o en aquellos que por limitaciones presupuestales de las instituciones de salud no pueden recibir terapia biológica o FARMEsbe.
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
Recomendación 13. En la entesitis resistente a AINE y FARMEc se recomienda el uso de Anti-TNF33,52–57, ustekinumab66, I-IL-1767,68. Si hay contraindicación para terapia biológica considere tofacitinib o si el cuadro es muy leve, apremilast.36,39,43,46,69
Calidad de la evidencia: Alta. Fuerza de la recomendación: Fuerte.
Recomendación 14. No se recomienda la aplicación local de glucocorticoides en sitios de entesitis.
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
Recomendación 15. A pesar de no haber estudios para evaluar la eficacia de la fisioterapia en entesitis, es un tratamiento complementario que se prescribe con frecuencia a estos pacientes.
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
DactilitisLa dactilitis es una manifestación clínica que impacta en forma desfavorable a los pacientes con APs, sin embargo, no suele presentarse en ausencia de la artritis o de la entesitis, por lo tanto, en la mayor parte de los casos la presencia de dactilitis no es determinante en la elección del tratamiento, para aquellos casos en los que sí lo sea se establecen las siguientes recomendaciones.
Recomendación 16. El tratamiento de primera línea en dactilitis es con AINE, se recomienda únicamente la utilización de dosis terapéuticas sin combinar más de un AINE y vigilancia por posibles eventos adversos.
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
Recomendación 17. En dactilitis resistente a AINE y FARMEc se recomienda el uso de Anti-TNF33,52–57, ustekinumab66, IL-1767,68. Si hay contraindicación para terapia biológica considere tofacitinib o si el cuadro es muy leve, apremilast.36,39,43,46,69
Calidad de la evidencia: Alta. Fuerza de la Recomendación: Fuerte.
Recomendación 18. Para los expertos mexicanos no se considera recomendable la práctica de la infiltración con glucocorticoides, no obstante, en casos resistentes, y sólo cuando sea estrictamente necesario, se pueden utilizar glucocorticoides sistémicos, siempre que se utilice una dosis que no sobrepase los 7,5 mg/día de prednisona o equivalente, por periodos cortos de tiempo, con el fin de evitar eventos adversos, que incluyen la exacerbación de la psoriasis tras la interrupción del tratamiento.
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
Recomendación 19. En la segunda línea de tratamiento se debe utilizar FARMEsc, la experiencia se limita a SSZ.
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
Psoriasis cutáneaEn la mayoría de los pacientes, el tratamiento de psoriasis representa por sí mismo un reto, por ello, ante casos resistentes, moderados o graves en los que los indicadores de área de superficie corporal (BSA), el PASI o el Dermatology Life Quality Index (DLQI) son mayores a 10, se recomienda referir al paciente a dermatología o tratarlo en conjunto con un dermatólogo. En tanto el paciente no haya sido evaluado por el dermatólogo, se puede iniciar tratamiento para aliviar los síntomas con antihistamínicos y mantener la función de barrera con la aplicación dos o tres veces al día de agentes tópicos, como emolientes (por ejemplo, aceite de almendras dulces) o lubricantes (minerales como petrolato o vegetales).
Recomendación 20. En los casos leves (ASC ≤10 o PASI ≤10 o DLQI ≤10), la primera línea de tratamiento incluye los agentes tópicos, seguidos de FARMEsc y fototerapia. En los casos leves con el DLQI >10, se deberá considerar el tratamiento con FARMEsc o FARMEb específicos de dermatología. (Acuerdo: 100%).
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
Recomendación 21. En los casos moderados o graves (ASC > 10 o PASI > 10 o DLQI > 10), el tratamiento deberá ser determinado por un dermatólogo. Puede ser iniciado con agentes tópicos combinados con FARMEsc (específicos de dermatología) o fototerapia. Es importante señalar que se puede considerar un caso leve como moderado o grave, si la calidad de vida está muy afectada. (Acuerdo: 100%).
Calidad de la evidencia: Baja. Fuerza de la recomendación: Débil.
Recomendación 22. Los pacientes con enfermedad moderada o grave con falla a FARMEsc pueden ser tratados con I-TNF36,45,70,71, ustekinumab58,72, I-IL-1736,58,69,72, y mientras que tofacitinib aún no está aprobado para psoriasis en placas, en pacientes con psoriasis leve o factores de riesgo para desarrollar infecciones puede utilizarse apremilast. Ciertos pacientes sin tratamiento previo con FARMEsc, también pueden ser medicados con FARMEb. Está recomendado intercambiar entre fármacos FARMEsc, de FARMEsc a FARMEb o entre FARMEb de distinto mecanismo de acción.
Calidad de la evidencia: Alta. Fuerza de la Recomendación: Fuerte.
Psoriasis unguealEn la mayoría de los casos, la Ps ungueal integra el perfil del paciente con Ps, por lo tanto, la elección del tratamiento de la Ps en su componente cutáneo suele dar respuesta a la afección ungueal en la mayor parte de los pacientes. Para aquellos pacientes en los cuales la Ps ungueal persista como una alteración significativa a pesar de una buena respuesta en otros dominios, establecemos las siguientes recomendaciones:
Recomendación 23. Se han realizado pocos estudios de Ps ungueal en pacientes con PsA, por ello, el tratamiento está basado principalmente en datos de estudios de psoriasis en piel o de Ps ungueal con subgrupos de pacientes con APs. Se ha demostrado la eficacia de los I-TNF36,73, I-IL-1736,39, ustekinumab74 y tofacitinib75 sobre las alteraciones ungueales y se recomienda su uso.
Calidad de la evidencia: Alta. Fuerza de la Recomendación: Fuerte.
Recomendación 24. No se recomienda la aplicación local de glucocorticoides en la matriz ungueal.
Calidad de la evidencia: Baja. Fuerza de la Recomendación: Débil.
DiscusiónEl Colegio Mexicano de Reumatología ha generado estas recomendaciones mediante el esfuerzo consensado de un grupo de expertos en aspectos clínicos, evaluación y tratamiento de la APs.
Además de reumatólogos, el grupo incluyó dermatólogos para refinar las recomendaciones de tratamiento en la Ps y la afección ungueal y definir en forma conjunta el tratamiento para las distintas manifestaciones, así como abordar aspectos generales en la atención y compartir perspectivas en el retraso en el diagnóstico y las barreras de acceso a los distintos aspectos de su atención médica.
Donde ha sido posible, las recomendaciones se han generado con base en evidencia resultante de una RSL actualizada al 30 de junio de 2020, aunque también se ha considerado la experiencia clínica de los expertos y las características del sistema de salud mexicano. La evidencia fue calificada utilizando el sistema GRADE. En varias recomendaciones la evidencia es sólida y las recomendaciones tienen un buen sustento, esto es aún más claro en el empleo de las nuevas terapias, las cuales pasaron por rigurosos ensayos en su proceso de aprobación, estos ensayos definen con claridad el ámbito de utilidad de cada uno de los tratamientos.
Se consideraron los seis dominios principales de la APs y se buscó evidencia para actualizar las recomendaciones. Sin embargo, y en contexto con recomendaciones más recientes, consideramos que la entesitis, la dactilitis y la afección ungueal difícilmente guían la elección del tratamiento en las etapas más tempranas y su importancia se resalta en casos en los cuales estas manifestaciones son refractarias, para considerar un ajuste secundario.
Se han incluido en estas recomendaciones a los AINE como punto de partida en los cuatro dominios musculoesqueléticos. En el caso de la artritis periférica y de la entesitis, el uso de FARMEc y en el caso de resistencia, el inicio de FARMEb o FARMEe. El uso de estos dos últimos grupos de tratamiento requiere de especial consideración pues su acceso está restringido por su cobertura médica para una proporción significativa de nuestra población. Lo anterior exige optimizar las estrategias previas al inicio de la terapia biológica. Afortunadamente la artritis periférica es la presentación más frecuente observada en México y esto permite el uso de varios FARMEc como tratamientos iniciales.
El compromiso axial en casos resistentes a AINE limita el tratamiento con FARMEb solo a dos citocinas, los I-TNF y a los I-IL-17. Aun cuando hay evidencia de un efecto favorable de tofacitinib y filgotinib en espondiloartritis axial, la información disponible al momento no permite recomendarlas. Ustekinumab no se considera como tratamiento eficaz en la afección axial por no demostrar efecto en ensayos de espondiloartritis axial más que en pacientes con APs y afección axial. Recientemente, sin embargo, se han establecido diferencias entre la afección axial de la espondiloartritis axial y la de la APs76, por lo cual sería deseable la evaluación más detallada del efecto sobre la afección axial en pacientes con APs en los que sean tratados primariamente por afección periférica, existe la posibilidad de que un medicamento que no demuestre utilidad en espondiloartritis axial no asociada a psoriasis sí tenga utilidad en la afección axial de la APs.
En contraparte con la afección axial, el resto de los dominios en la APs ha visto aparecer nuevas opciones para su tratamiento. Se han autorizado nuevos FARMEb y se cuenta con evidencia que sustenta alta eficacia de ustekinumab, I-IL-17, I-IL-23, FARMEe en artritis periférica, entesitis y dactilitis, así como en manifestaciones en piel y afección ungueal. La experiencia de los reumatólogos mexicanos con el uso de glucorticoides locales en infiltración de las entesis, en dactilitis o lechos ungueales es pobre y no se recomiendan en nuestra población.
Un elemento para considerar en nuestra población es que el acceso al sistema de salud mexicano es heterogéneo. Hay una diversidad de coberturas y éstas restringen el acceso de algunos medicamentos para ciertas poblaciones, varios sistemas de salud pública dan acceso a algunos del FARMEb y FARMEe pero en esquemas diferenciados que no necesariamente incluyen a todos los fármacos de cada grupo. Por otra parte, y en congruencia, todos los medicamentos señalados en estas recomendaciones cuentan con la indicación para APs por nuestra agencia regulatoria (COFEPRIS) y están disponibles para atención privada. La ausencia de algunos de los fármacos aquí mencionados en un cuadro básico específico requerirá que los médicos tratantes seleccionen alternativas viables para dar respuesta a las necesidades de los pacientes en su entorno específico. Para este fin es afortunada la relativa redundancia en el efecto de varios grupos de medicamentos pues abre una diversidad de estrategias para el tratamiento inicial y para el manejo de casos refractarios.
FinanciaciónNovartis de México asumió los costos de las reuniones, sin intervenir en las discusiones o los planteamientos realizados por los médicos participantes.
Conflicto de interesesJ. Casasola-Vargas: Abbvie, Janssen, UCB, Novartis; D. Flores-Alvarado: Janssen, UCB, Novartis, Abbvie, Roche; Luis H. Silveira, Jannsen; G. Reyes-Cordero: Novartis, Eli-Lilly, Abbvie, Pfizer, UCB, Gilead; G. Villanueva Quintero, Mario Amaya Guerra: Abbvie, Celgene, Janssen, Isdin, Leo, Lilly, Novartis. Pfizer, Sanofi; B.E. Zazueta Montiel: Novartis, Eli Lilly, Roche, Amgen, UCB; A. Mendoza-Fuentes: Novartis, Abbvie; A. López Rodriguez: Novartis, Janssen, Eli Lilly; R. Burgos-Vargas: Novartis, UCB, Abbvie; C. Pacheco-Tena: Pfizer, Abbvie, R-Pharm, Astra-Zeneca, UCB, Janssen, Merck-Serono, Sanofi, Eli-Lilly, Novartis, Gilead.
El Comité para el desarrollo de las recomendaciones para el manejo de la APs agradece el apoyo del Colegio Mexicano de Reumatología y a la compañía Novartis por el apoyo irrestricto a las actividades de nuestro comité.