Elaborar unas recomendaciones multidisciplinares para mejorar el manejo de la enfermedad pulmonar intersticial difusa asociada a la artritis reumatoide (EPID-AR).
MétodosUn panel de reumatólogos y neumólogos expertos identificó preguntas clínicas de investigación relevantes para el objetivo del documento. Se realizaron revisiones sistemáticas de la evidencia, que se graduó de acuerdo con los criterios del SIGN. Tras ello, se formularon las recomendaciones.
ResultadosSe seleccionaron seis preguntas PICO, tres de las cuales específicamente evaluaron la seguridad y la eficacia de los glucocorticoides, fármacos de acción lenta moduladores de la enfermedad (FAME) sintéticos clásicos e inmunosupresores, FAME biológicos, FAME sintéticos dirigidos y antifibróticos en el tratamiento de los pacientes con EPID-AR. Se formularon un total de 12 recomendaciones específicas sobre este tema con base en la evidencia encontrada y/o consenso de expertos.
ConclusionesSe presenta el primer documento oficial SER-SEPAR de recomendaciones específicas para el abordaje terapéutico de la EPID-AR con el fin de ayudar en la toma de decisiones a los clínicos directamente implicados en su manejo.
To develop multidisciplinary recommendations to improve the management of rheumatoid arthritis-related interstitial lung disease (RA-ILD).
MethodsClinical research questions relevant to the objective of the document were identified by a panel of rheumatologists and pneumologists selected based on their experience in the field. Systematic reviews of the available evidence were conducted, and evidence was graded according to the Scottish Intercollegiate Guidelines Network (SIGN) criteria. Specific recommendations were made.
ResultsSix PICO questions were selected, three of which analysed the safety and effectiveness of glucocorticoids, classical synthetic disease-modifying anti-rheumatic drugs (DMARDs) and other immunosuppressants, biological agents, targeted synthetic DMARDs, and antifibrotic therapies in the treatment of this complication. A total specific of 12 recommendations on this topic were formulated based on the evidence found and/or expert consensus.
ConclusionsWe present the first official SER-SEPAR document with specific recommendations for RA-ILD management developed to resolve some common clinical questions, reduce clinical healthcare variability, and facilitate decision-making for patients.
La enfermedad pulmonar intersticial difusa (EPID) es una de las manifestaciones extraarticulares más frecuente y grave de la artritis reumatoide (AR), siendo en la actualidad la segunda causa de muerte prematura por esta enfermedad1-5.
El tratamiento de los pacientes con EPID-AR es un escenario clínico particularmente difícil y complejo. Estos enfermos son habitualmente excluidos en los ensayos clínicos aleatorizados (ECA), y no se han realizado estudios controlados que hayan evaluado específicamente la eficacia de fármacos para el tratamiento de esta complicación. La evidencia publicada sobre el tema es escasa, en su gran mayoría de baja calidad metodológica, y en algunos aspectos muestra resultados contradictorios. Tampoco existen hasta la fecha recomendaciones consensuadas por sociedades científicas.
Además, existe un cuerpo creciente de literatura que sugiere que algunos de los medicamentos que habitualmente empleamos en el manejo de la AR podrían desencadenar una EPID o empeorar una EPID preexistente.
Con base en lo anteriormente expuesto, y con el fin de dar respuesta a esta necesidad asistencial, se presenta el primer documento oficial elaborado por las sociedades españolas de Reumatología (SER) y de Neumología y Cirugía Torácica (SEPAR) con recomendaciones específicas sobre el abordaje terapéutico de la EPID-AR, resolviendo algunos interrogantes clínicos habituales y facilitando la toma de decisiones.
MétodosEn el desarrollo de estas recomendaciones se ha utilizado una síntesis cualitativa de la evidencia científica y técnicas de consenso, que recogen el acuerdo de expertos en función de la evidencia disponible y de su experiencia clínica6.
El proceso para el desarrollo del proyecto ha sido el siguiente:
- 1.
Creación del grupo de trabajo. Se constituyó un grupo de trabajo interdisciplinar formado por 5 reumatólogos miembros de la SER (JN, GB, IC, NMV y AMO) y 5 neumólogos de la SEPAR (MA, ECJ, MAN, CV y JARP). Los participantes fueron avalados por su sociedad para la participación en este documento. La coordinación de los aspectos clínicos y metodológicos se realizó, respectivamente, por uno de los reumatólogos (JN) y un neumólogo (JARP), como investigadores principales (IP), y dos especialistas en metodología de la Unidad de Investigación de la SER.
- 2.
Identificación de las áreas claves. Se definieron los contenidos y aspectos clave del documento, planteándose las preguntas clínicas de investigación con más impacto en la práctica clínica. Las preguntas se reformularon en formato paciente, intervención, comparación, outcome o desenlace (PICO).
- 3.
Búsqueda bibliográfica. Se realizó una búsqueda de la evidencia científica publicada que fue ampliándose sucesivamente hasta octubre 2020. Para ello, se utilizaron las bases de datos PubMed (MEDLINE), EMBASE y Cochrane Library (Wiley Online). El proceso se completó con una búsqueda manual en las referencias de los estudios identificados, así como de pósteres y resúmenes de congresos que los revisores y expertos consideraron de interés.
- 4.
Análisis y síntesis de la evidencia científica. Reumatólogos expertos en revisión de la evidencia de la SER llevaron a cabo las revisiones sistemáticas (RS) y la síntesis de la evidencia científica. Se evaluó el nivel de la evidencia científica, utilizando los criterios del Scottish Intercollegiate Guidelines Network (SIGN)7 (Anexo).
- 5.
Formulación de recomendaciones. Finalizada la lectura crítica, los IP, junto con los componentes del grupo de expertos encargados de revisar la evidencia de cada una de las preguntas PICO, formularon las recomendaciones, basándose en la evaluación formal o «juicio razonado» de la evidencia, para cada una de las preguntas. Se tuvo en cuenta la calidad, la cantidad y la consistencia de la evidencia científica, la generalizabilidad de los resultados, su aplicabilidad y su impacto clínico. La graduación de la fuerza de las recomendaciones se realizó también con el sistema del SIGN7. Para aquellas cuestiones en las que la evidencia no era suficiente, se formularon recomendaciones basadas en el consenso del grupo de expertos.
Las recomendaciones se han dividido en cinco áreas principales: incidencia y prevalencia de la EPID en la AR, factores de riesgo para la aparición de EPID en esta enfermedad, factores pronósticos de mortalidad y de progresión pulmonar, seguridad del tratamiento farmacológico en los pacientes con EPID-AR, y su eficacia en el manejo esta complicación.
- 6.
Revisión externa. El borrador del documento se sometió a revisión externa, para asegurar la validez y la exactitud de las recomendaciones, y, posteriormente, a exposición pública, con el propósito de que otros socios de la SER y de la SEPAR, así como distintos grupos y entidades potencialmente interesadas, pudieran evaluar el documento y formular las apelaciones o sugerencias.
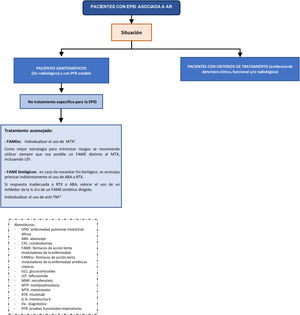
Se han formulado un total de 18 recomendaciones, 12 de las cuales se refieren al tratamiento de los pacientes con EPID-AR (tabla 1).
Recomendaciones SER-SEPAR para el tratamiento de la enfermedad pulmonar intersticial difusa asociada a la artritis reumatoide
| Recomendaciones | Grado de la recomendación |
|---|---|
| Para el tratamiento de los pacientes con enfermedad pulmonar intersticial difusa asociada a artritis reumatoide se recomienda un manejo terapéutico multidisciplinar | √ |
| Si la enfermedad intersticial difusa está presente en el debut de la artritis reumatoide, se recomienda una valoración individualizada para el uso de metotrexato, dado que existe un riesgo de neumonitis aguda inducida por el fármaco, aunque sea bajo | A |
| En estos casos, el grupo elaborador considera que la mejor estrategia para minimizar riesgos es utilizar siempre que sea posible otro FAME sintético clásico | √ |
| En pacientes con artritis reumatoide, cuando la enfermedad intersticial difusa se diagnostica o empeora durante el primer año del tratamiento con metotrexato, este se deberá suspender temporalmente hasta aclarar si existe o no una relación de causalidad | √ |
| En pacientes con artritis reumatoide en tratamiento con metotrexato durante más de un año, a los que se les diagnostica una enfermedad pulmonar intersticial difusa, puede mantenerse el fármaco, ya que no existe evidencia que justifique su retirada | D |
| En pacientes con artritis reumatoide y enfermedad pulmonar intersticial difusa que no tengan ascendencia asiática, leflunomida puede considerarse un medicamento seguro | √ |
| En los pacientes con artritis reumatoide y enfermedad pulmonar intersticial difusa que precisen tratamiento biológico se recomienda usar indistintamente abatacept o rituximab como opciones más seguras | D |
| En los pacientes con artritis reumatoide y enfermedad pulmonar intersticial difusa, en caso de contraindicación o respuesta inadecuada a abatacept y rituximab, se puede valorar el uso de un inhibidor de la IL-6 o de un FAME sintético dirigido | D |
| En los pacientes con artritis reumatoide en tratamiento con anti-TNF y enfermedad pulmonar intersticial difusa estable, no hay evidencia concluyente para recomendar su retirada si el medicamento ha conseguido un buen control de la clínica articular | √ |
| En los pacientes con enfermedad pulmonar intersticial difusa asociada a artritis reumatoide con un patrón radiológico inflamatorio (NINE, NO, NIL, etc.) en los que se considere necesario el tratamiento con glucocorticoides, se recomienda su uso siempre a la menor dosis y durante el menor tiempo posible | √ |
| El grupo elaborador considera que la evidencia disponible es insuficiente para emitir una recomendación concluyente sobre el uso de inmunosupresores en el tratamiento de la enfermedad pulmonar intersticial difusa asociada a artritis reumatoide | D |
| En el caso de decidir su uso, el grupo elaborador sugiere el empleo de micofenolato por su mejor perfil de seguridad | √ |
| Aunque la evidencia de eficacia de los FAME biológicos en el tratamiento de la enfermedad pulmonar intersticial difusa asociada a artritis reumatoide es escasa, los datos de vida real sugieren que tanto abatacept como rituximab podrían ser útiles para estabilizar o mejorar la función pulmonar, particularmente en aquellos pacientes con un patrón radiológico no fibrótico | D |
| En el subgrupo de pacientes con enfermedad pulmonar intersticial difusa asociada a artritis reumatoide con un fenotipo fibrosante progresivo, se recomienda el uso de nintedanib manteniendo el tratamiento de fondo de la artritis reumatoide | B |
FAME: fármacos de acción lenta moduladores de la enfermedad; IL: interleucina; NIL: neumonía intersticial linfocíticas; NINE: neumonía intersticial no específica; NO: neumonía organizativa.
Si se desea información adicional sobre cualquiera de los apartados que se resumen en este artículo, se puede acceder al contenido completo del documento en la web de la SER (www.ser.es).
Abordaje multidisciplinar en el diagnóstico y tratamiento de la EPID-AR- •
Recomendación. Para el tratamiento de los pacientes con EPID-AR se recomienda un manejo terapéutico multidisciplinar (recomendación de grado √).
El abordaje multidisciplinar aporta múltiples ventajas en las diferentes etapas de la atención a estos enfermos: reduce el tiempo para la identificación precisa de la EPID, garantiza una adecuada estadificación de la gravedad tanto de la EPID como de las manifestaciones extrapulmonares, disminuye el tiempo entre el diagnóstico y el inicio del tratamiento, mejora la elección de los tratamientos farmacológicos, asegura una pro-actividad en el manejo de la neumopatía con una visión holística, reduce el tiempo para la toma de decisiones en los casos que precisan una intensificación o un cambio en la estrategia terapéutica, y garantiza un seguimiento protocolizado reduciendo la variabilidad8. Además, se optimizan recursos diagnósticos y terapéuticos, disminuyendo los costes8.
La aproximación terapéutica de los pacientes con EPID-AR debe ser individualizada e integral con el objetivo de controlar la actividad de la enfermedad de base e impedir, en aquellos casos que los que sea necesario, la progresión de los cambios fibróticos pulmonares. De ahí la importancia de que las decisiones terapéuticas sean consensuadas entre reumatólogos y neumólogos.
Seguridad de los fármacos de acción lenta moduladores de la enfermedad (FAME) sintéticos clásicos (FAMEsc), FAME biológicos y FAME sintéticos dirigidos (FAMEsd) en los pacientes con EPID-AR—En pacientes con EPID-AR, ¿es seguro el tratamiento con metotrexato (MTX) o con leflunomida (LEF)?
- •
Recomendación. Si la EPID está presente en el debut de la AR, se recomienda una valoración individualizada para el uso de MTX, dado que existe un riesgo de neumonitis aguda inducida por el fármaco, aunque sea bajo (recomendación de grado A). En estos casos, el grupo elaborador considera que la mejor estrategia para minimizar riesgos es utilizar siempre que sea posible otro FAME sintético clásico (recomendación de grado √).
- •
Recomendación. En pacientes con AR, cuando la EPID se diagnostica o empeora durante el primer año del tratamiento con MTX, este se deberá suspender temporalmente hasta aclarar si existe o no una relación de causalidad (recomendación de grado √).
- •
Recomendación. En pacientes con AR en tratamiento con MTX durante más de un año, a los que se les diagnostica una EPID, puede mantenerse el fármaco ya que no existe evidencia que justifique su retirada (recomendación de grado D).
- •
Recomendación. En pacientes con EPID-AR que no tengan ascendencia asiática, LEF puede considerarse un medicamento seguro (recomendación de grado √).
La seguridad pulmonar de los dos FAMEsc más utilizados en el tratamiento de la AR9 se ha puesto en duda por estudios de cohortes, un estudio de casos y controles, series de casos y una revisión sistemática de la literatura (RSL) que sugieren su posible implicación como desencadenantes de una EPID, o como causantes de un empeoramiento en pacientes con EPID previa10-16.
Respecto a la pregunta sobre si existe o no un riesgo de EPID inducida o exacerbada en pacientes con AR en tratamiento con MTX, según las conclusiones de un metaanálisis de ensayos controlados (22 estudios con 8.584 pacientes; I2: 3%), el uso de MTX se asocia a un aumento del riesgo de complicaciones respiratorias (riesgo relativo [RR]:1,10; intervalo de confianza [IC] del 95%:1,02-1,19), fundamentalmente por un incremento del riesgo de infecciones (RR: 1,11; IC95%: 1,02-1,21) y de neumonitis aguda (RR: 7,81; IC95%: 1,76-34,72)17. En este metaanálisis no se demostró que el tratamiento con MTX aumente el riesgo de muerte por enfermedad pulmonar (RR: 1,53; IC95%: 0,46-5,01) (nivel de evidencia 1+).
La neumonitis aguda por MTX suele presentarse durante el primer año de tratamiento (mediana de 36 semanas)10,18 y se produce por un mecanismo de hipersensibilidad al fármaco, no dependiendo de la dosis total acumulada10-14,17,18. Presenta algunas características que permiten diferenciarla de la EPID-AR (tabla 2). Para su diagnóstico se han propuesto unos criterios que obligan a la exclusión sistemática de otras causas, especialmente las infecciones (tabla 3)19. Como factores de riesgo para su aparición se han señalado la edad avanzada (>60años), el uso previo de otros FAMEsc, la presencia de diabetes mellitus (DM) insulino-dependiente y el antecedente de EPID previa secundaria a AR (odds ratio [OR]: 7,1)12,18. Este último dato es el principal argumento para evitar su uso en los pacientes con EPID-AR.
Principales características de la neumonitis por metotrexato y de la enfermedad pulmonar intersticial difusa asociada a artritis reumatoide
| Neumonitis por MTX | EPID asociada a AR | |
|---|---|---|
| Frecuencia | 0,3% | EPID sintomática: 10-29% |
| Curso clínico | Inicio agudo o subagudo durante el primer año de tratamiento | Generalmente en los primeros 5 a 10 años de evolución de la enfermedadAfectación que con frecuencia se identifica tardíamente (muchas veces la EPID se mantiene asintomática o paucisintomática hasta estadios avanzados) |
| Síntomas clínicos | Febrícula o fiebre, tos no productiva y disnea que suele evolucionar a la insuficiencia respiratoriaEosinofilia en sangre periférica (50%) | Tos seca repetitiva y disnea de esfuerzo, que puede progresar de forma más o menos rápida hasta la insuficiencia respiratoria |
| Hallazgos en la TC de alta resolución torácica | NINE o daño alveolar agudo (NIA) | NIU > NINEMenos frecuentes: NO, BR-EPID, CPFE, NIDRaramente: NIL, NOFA |
| Lavado broncoalveolar | Predominio de linfocitos CD4 con incremento del índice CD4/CD8, siendo rara la presencia de eosinofilia | Habitualmente predominio neutrofílico |
BR-EPID: bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial; CPFE: patrón combinado fibrosis pulmonar + enfisema; NIA: neumonía intersticial aguda; NID: neumonía intersticial descamativa; NINE: neumonía intersticial no específica; NIL: neumonía intersticial linfoide; NIU: neumonía intersticial usual; NO: neumonía organizativa; NOFA: neumonía organizada fibrinoide aguda; TC: tomografía computarizada.
Criterios propuestos para el diagnóstico de la neumonitis por metotrexato19
| Criterios mayores | Criterios menores |
|---|---|
| 1. Histopatológico: neumonitis por hipersensibilidad | Disnea <8 semanas de evolución |
| 2. Radiológico: patrón intersticial difuso y/o infiltrados alveolares nodulares o parcheados | Tos no productivaSaturación de O2 <90% |
| 3. Microbiológico: hemocultivos, cultivos de esputo, lavado broncoalveolar (LBA) y serologías negativas | DLCO <70%Leucocitos <15.000 |
Definida: 1 mayor o mayores 2 y 3 + 3 de los cinco criterios menores.
Probable: mayores 2 y 3 + 2 de los cinco criterios menores.
Aunque la neumonitis aguda por MTX es una realidad clínica, la RSL demuestra que está claramente sobrediagnosticada. Así, en un metaanálisis en el que se analizó la misma cuestión en otras enfermedades tratadas con MTX, pero que no cursan con manifestaciones pulmonares (7 estudios con 1.630 pacientes afectos de psoriasis, artropatía psoriásica o enfermedad inflamatoria intestinal; I2: 0%), no se observó ningún aumento del riesgo de complicaciones respiratorias (RR: 1,03; IC95%: 0,90-1,17), ni infecciosas (RR: 1,02; IC95%: 0,88-1,19) ni no infecciosas (RR: 1,07; IC95%: 0,58-1,96)20.
En esta misma línea, los resultados de un estudio multicéntrico internacional de casos y controles publicado recientemente (410 pacientes con EPID-AR y 673 controles con AR) no demuestran que el tratamiento con MTX sea un factor de riesgo para el desarrollo de esta complicación (OR: 0,43; IC95%: 0,26-0,69; p=0,0006)21 (nivel de evidencia 2++). Tampoco se ha observado que el MTX aumente el riesgo de EPID en pacientes con AR en dos estudios de cohortes: ni en un estudio poblacional danés con datos de 30.512 enfermos a los 5años tras el inicio del MTX (cociente de riesgo o Hazard ratio [HR]: 1,0; IC95%: 0,78-1,27)22 (nivel de evidencia 3), ni en un estudio multicéntrico realizado en el Reino Unido en 2.692 pacientes con AR de reciente comienzo (1.578 expuestos a MTX y 1.114 no expuestos: OR: 0,85; IC95%: 0,49-1,49; p=0,578)23 (nivel de evidencia 2+).
Finalmente, los datos del Cardiovascular Inflammation Reduction Trial (CIRT), ECA que evaluó la posible eficacia del tratamiento con MTX (≤20mg/semana por vía oral) para prevenir el desarrollo de eventos cardiovasculares en pacientes con cardiopatía isquémica previa, DM o síndrome metabólico, confirman que la neumonitis aguda es un efecto adverso potencial del MTX, pero se demuestra que su prevalencia real en pacientes sin AR es muy baja, situándose en el 0,3%24-26.
No solo no se ha confirmado que el MTX aumente el riesgo de desarrollar una EPID en pacientes con AR, sino que incluso parece retrasar su aparición y mejorar su pronóstico21,23,27-31 (nivel de evidencia 2++, 2+, 2−, 3). Hoy en día se sabe que la actividad moderada o alta mantenida de la AR de acuerdo con las puntuaciones del DAS28 es uno de los factores de riesgo para el desarrollo de EPID (nivel de evidencia: 2++) y uno de los factores pronósticos asociados a mayor mortalidad de la EPID-AR (NE: 2+). Por lo tanto, mantener controlada la actividad de la AR (remisión o baja actividad) previene la aparición de EPID y mejora su pronóstico32,33.
La posible implicación de la LEF tanto en el desarrollo de EPID como con el empeoramiento de una EPID preexistente en pacientes con AR se sustenta fundamentalmente en dos estudios de farmacovigilancia postmarketing realizados en Japón34 y en Corea35, y en una revisión de casos publicados en la literatura15. La prevalencia de EPID inducida o exacerbada atribuida a LEF en estos estudios fue del 1%-1,2%. En la mayoría de las veces la clínica se presentó en las primeras 20 semanas de tratamiento, y la mortalidad osciló entre el 18% y el 41%. Como principales factores de riesgo para su desarrollo se identificaron la administración de la dosis de carga de LEF (100mg/día durante 3días), el tabaquismo, el bajo peso y el antecedente de EPID previa15,34,35.
En un estudio canadiense de casos y controles anidado a una cohorte extensa de AR que evaluó el riesgo de EPID con LEF en comparación MTX y agentes biológicos, únicamente se objetivó un aumento del riesgo de esta complicación en el grupo de enfermos con EPID previa o que habían recibido MTX (RR: 2,6; IC95%: 1,2-5,6)36. Finalmente, en un metaanálisis posterior que analizó esta cuestión (8 estudios, incluyendo 4 ECA, con un total de 4.579 pacientes; I2: 0%), no se observó ningún aumento del riesgo de complicaciones respiratorias (RR: 0,99; IC95%: 0,56-1,78), ni infecciosas (RR: 1,02; IC95%: 0,58-1,82) ni no infecciosas (RR: 0,64; IC95%: 0,41-0,97)37 (nivel de evidencia 1+). Siete de los ocho estudios incluidos se hicieron en población no asiática.
El análisis global de estos cinco estudios obliga a ser cautelosos con el uso de LEF en pacientes de ascendencia asiática, pues no es descartable que haya un riesgo aún no bien definido. Por el contrario, en población caucásica este riesgo no se ha demostrado. En una RSL, la frecuencia de esta complicación en países occidentales fue inferior al 0,1%16. Esta disparidad podría deberse a diferencias farmacogenéticas entre distintos grupos raciales, como las que se han descrito en las vías de metabolización del MTX. La seguridad de LEF en combinación con abatacept (ABA), rituximab (RTX) o tocilizumab (TCZ) se ha confirmado en varios estudios abiertos realizados en pacientes con EPID-AR progresiva en práctica clínica real38-44. Todos estos estudios se han realizado en países europeos (cuatro de ellos en España)38-41.
—En pacientes con EPID-AR, ¿cuál es el FAME biológico o FAMEsd más seguro?
- •
Recomendación. En los pacientes con EPID-AR que precisen tratamiento biológico se recomienda usar indistintamente ABA o RTX como opciones más seguras (recomendación de grado D).
- •
Recomendación. En los pacientes con EPID-AR, en caso de contraindicación o respuesta inadecuada a ABA y RTX, se puede valorar el uso de un inhibidor de la IL-6 o de un FAMEsd (recomendación de grado D).
- •
Recomendación. En los pacientes con AR en tratamiento con un fármaco antagonista del factor de necrosis tumoral (TNF) alfa y EPID estable, no hay evidencia concluyente para recomendar su retirada si el medicamento ha conseguido un buen control de la clínica articular (recomendación de grado √).
Los antagonistas del TNF alfa (anti-TNF), y en menor medida el TCZ, se han visto implicados tanto en el desarrollo de una EPID como en el empeoramiento de una EPID preexistente en pacientes con AR.
La posible implicación de los anti-TNF se sustenta principalmente en revisiones sistemáticas de series de casos y de casos clínicos16,45-47, un estudio retrospectivo de casos y controles (con elevado riesgo de sesgo por su diseño, tamaño de muestra pequeño y corto espacio de seguimiento)48, y en algunos estudios observacionales49,50. De acuerdo con estos trabajos, la prevalencia de EPID inducida o exacerbada atribuida al tratamiento con anti-TNF oscila entre el 0,5% y el 3%. Esta complicación se ha descrito con todos los anti-TNF. Se presenta en los primeros 6meses tras el inicio del biológico (en la mayoría de los casos durante las primeras 20 a 26semanas) y suele ser grave y con mala evolución (mortalidad del 29 al 35%). Además de los patrones clásicos de neumopatía intersticial, también se han descrito lesiones de tipo sarcoideo, con el desarrollo de granulomas pulmonares no caseificantes, sobre todo en pacientes tratados con etanercept (ETC)51,52.
Los principales factores de riesgo implicados en la aparición de esta complicación son la edad avanzada, la existencia de EPID previa y el tratamiento concomitante con MTX o LEF16,45-47, lo que hace realmente difícil esclarecer si hay o no una relación causal. Esta posible relación de causalidad se ve aún más cuestionada por la reciente publicación de dos estudios observacionales retrospectivos (ambos realizados a partir de datos de asegurados en mutuas médicas norteamericanas) que no encuentran diferencias estadísticamente significativas en la frecuencia de EPID, ni al comparar pacientes tratados con anti-TNF con pacientes tratados con FAME sintéticos (HR ajustada anti-TNF versus FAME: 1,03; IC95%: 0,51-2,07)53, ni al comparar los diferentes anti-TNF con otros biológicos (RTX, ABA o TCZ)28. En este último estudio tampoco se encontraron diferencias significativas en el riesgo de hospitalización por EPID entre las distintas terapias biológicas analizadas.
Estos resultados son coincidentes con otro estudio previo realizado a partir de una base de datos de 17.598 pacientes con AR, en los que tampoco se encontró relación de causalidad aparente entre el desarrollo de EPID y diferentes tratamientos, entre los que se incluyeron ETC e infliximab (IFX)54.
En este escenario, ni siquiera los registros nacionales de terapias biológicas ofrecen resultados concordantes. Así, según los datos del registro británico de terapias biológicas (BSRBR), los pacientes tratados con anti-TNF tienen una prevalencia aumentada de EPID (anti-TNF: 2,9% versus FAME sintéticos: 1,8%; p=0,02) y una mortalidad atribuida a esta complicación numéricamente más alta (anti-TNF: 21% versus FAME: 7%; p=NS)49. Además, en este registro la mortalidad a los 5años en los pacientes con EPID-AR que recibieron un anti-TNF en primera línea también fue superior a la de los que recibieron RTX: la tasa de mortalidad para todas las causas fue de 94,8 (IC95%: 74,4-118,7) con anti-TNF y 53 (IC95%: 22,9-104,6) con RTX por 1.000 pacientes/año. El riesgo de mortalidad ajustado se redujo a la mitad en la cohorte tratada con RTX en primera línea, si bien la diferencia no fue estadísticamente significativa (HR: 0,53; IC95%: 0,26-1,10)55. Por el contrario, en un estudio realizado a partir del registro español de terapias biológicas (BIOBADASER), ni la incidencia de EPID, ni la mortalidad por esta complicación, fueron superiores en los pacientes tratados con anti-TNF en comparación con otra cohorte de pacientes con AR sin tratamiento biológico (EMECAR)56.
La experiencia publicada con inhibidores de la interleucina (IL) 6 en pacientes con EPID-AR se limita a TCZ y muestra también resultados contradictorios28,42,47,57-62. Por un lado, el tratamiento con TCZ se ha relacionado tanto con el desarrollo de EPID como con el empeoramiento de una EPID preexistente en pacientes con AR. Una RSL realizada en el año 2010 que analizó esta cuestión incluyó datos de 3 ensayos ECA con un total de 589 pacientes47 (nivel de evidencia 2++). De ellos, 6 (1%) desarrollaron eventos adversos pulmonares no infecciosos, incluyendo 3 exacerbaciones de EPID previa (con un fallecimiento) y 2 casos de EPID de inicio. Además, su posible implicación se sustenta en algunos casos clínicos57,58 (nivel de evidencia 3), y en un estudio de vigilancia postmarketing que analizó datos de seguridad acumulados de 7.901 pacientes japoneses59. En este estudio, la incidencia de EPID fue de 10 casos/1.000 pacientes-año, siendo claramente superior a la estimada en la enfermedad (entre 1,05 y 4,1 casos/1.000 pacientes-año) (nivel de evidencia 2+). Por eso, en la ficha técnica del fármaco se incluye una advertencia específica sobre este riesgo dentro de las precauciones especiales de empleo.
Sin embargo, y como ya hemos comentado anteriormente, en un estudio observacional retrospectivo publicado recientemente no se encontraron diferencias estadísticamente significativas en la frecuencia de EPID ni en el riesgo de hospitalización por EPID al comparar los diferentes agentes biológicos entre sí28 (nivel de evidencia 2−). En otro estudio reciente de casos y controles se revisaron retrospectivamente 395 enfermos con AR tratados con TCZ, dividiéndose la muestra en dos grupos: pacientes con y sin EPID60.Ninguno de los pacientes sin EPID al inicio del tratamiento desarrolló esta complicación de novo. En el subgrupo de enfermos con EPID previa, solo el 8% empeoraron. El único factor de riesgo asociado con el empeoramiento fue el mal control de la actividad inflamatoria (índice clínico de actividad de la enfermedad [CDAI] >10 a las 24 semanas) (nivel de evidencia 2−). En base a estos resultados, los autores sugieren que la progresión de la EPID en estos pacientes parece estar más en relación con la actividad de la AR que con una toxicidad pulmonar del fármaco. En la misma línea, y cuestionando esta relación de causalidad, se han publicado un número creciente de casos clínicos61,62 y un estudio de cohortes retrospectivo42 (nivel de evidencia 3), que demuestran una mejoría o una estabilización de la función pulmonar en la mayoría de los pacientes con EPID-AR tratados con TCZ, aunque no todos los casos presentaban una neumopatía progresiva.
Tanto la nueva edición de la guía de práctica clínica para el manejo de pacientes con artritis reumatoide de la SER (GUIPCAR)63, como la guía de la Sociedad Británica de Reumatología64, coinciden en señalar en sus revisiones sistemáticas que ABA y RTX son los agentes biológicos más seguros en los pacientes con EPID-AR. Con ABA solo se han publicado hasta la fecha dos casos de EPID inducida o exacerbada aparentemente relacionadas con el fármaco65,66. Además, en un estudio de vigilancia postmarketing que recogió datos de seguridad integrados de 3.173 pacientes incluidos en sus estudios pivotales y seguidos hasta 8años, la incidencia de EPID en el grupo tratado con ABA fue de 1,1/1.000 pacientes-año (IC95%: 0,06-0,20), cifra similar a la estimada en la AR (nivel de evidencia 2+)67. Con respecto a RTX, en una RSL realizada hasta junio del 2010 solo se identificaron 3 casos de EPID aparentemente relacionados con el fármaco en pacientes con AR47 (nivel de evidencia 2++). De estos 3 enfermos, uno tenía también un linfoma y otro una enfermedad de Castleman concomitante, por lo que en ambos casos RTX se combinó con otros fármacos, incluyendo quimioterápicos. Dos de los pacientes habían recibido también tratamiento con MTX (nivel de evidencia 3). Con posterioridad y hasta la fecha, no se ha publicado ningún otro caso adicional. Además, existe un número creciente de estudios abiertos (nivel de evidencia 2− o 3) que confirman su seguridad en este escenario38-41,43,44,68-72. En la práctica clínica asistencial es bien conocido que el uso prolongado de RTX en pacientes con EPID-AR se asocia con un pequeño aumento del riesgo de infecciones respiratorias o urinarias, en su mayoría no graves y relacionadas con el desarrollo de hipogammaglobulinemia como efecto adverso del fármaco73.
La seguridad de los FAMEsd a nivel pulmonar no ha sido evaluada en ningún ECA y la información disponible también es escasa. En los ensayos clínicos de desarrollo de tofacitinib (TOFA) y en la fase posterior a la comercialización se han notificado casos de EPID (algunos de ellos mortales), sobre todo en pacientes asiáticos. Por ello, en la ficha técnica del fármaco se incluye una mención específica sobre este riesgo dentro del apartado de advertencias y precauciones especiales de empleo. No obstante, recientemente se ha publicado un análisis post hoc que investigó específicamente esta cuestión en 7.061 pacientes con AR incluidos en 21 ECA de TOFA, estimando una incidencia de EPID de 1,8 casos/1.000 pacientes-año74 (nivel de evidencia 2+). Esta incidencia es similar a la estimada en la AR y se mantuvo estable a lo largo del tiempo. Los datos de este estudio son coincidentes con los de un metaanálisis anterior que analizó la seguridad pulmonar de los FAMEsd75 (nivel de evidencia 1+). Según este trabajo, que incluyó 47 ECA, 25 estudios observacionales y 7 estudios de vigilancia postcomercialización (con un total de 159.652 pacientes), el tratamiento con los inhibidores de la JAK aumenta el riesgo de diferentes tipos de infección respiratoria, pero no de complicaciones pulmonares no infecciosas, incluyendo la EPID. También se han publicado algunos casos clínicos de EPID-AR tratados con TOFA sin evidencia de empeoramiento pulmonar76. Con baricitinib no hay alertas hasta el momento sobre su posible implicación en el desarrollo de EPID o en el empeoramiento de una EPID preexistente, tras el análisis y seguimiento a largo plazo de los pacientes incluidos en sus ECA77.
En conclusión, tanto ABA como RTX son fármacos seguros en los pacientes con EPID-AR, por lo que el grupo elaborador recomienda priorizar indistintamente su uso como agentes biológicos de primera elección. Con la evidencia disponible, los inhibidores de la IL-6 o los FAMEsd tampoco estarían formalmente contraindicados, aunque su uso debe individualizarse.
La evidencia de causalidad que sustenta la posible implicación de los anti-TNF es, en su mayoría, de baja calidad y de difícil interpretación por sesgos de confusión. Además varios estudios de la misma calidad metodológica han obtenido resultados completamente opuestos, por lo que el grupo elaborador considera que no es posible realizar una recomendación concluyente en uno u otro sentido. Sin embargo, el hecho de que esta complicación se haya descrito en pacientes tratados en monoterapia con un anti-TNF, o que se hayan descrito casos de EPID en pacientes tratados por colitis ulcerosa o por espondiloartritis47, nos obliga a ser cautelosos, pues no es descartable que haya un riesgo aún no bien definido y probablemente sobreestimado. Por eso se aconseja una estrategia de minimización de riesgos, evitando su uso en aquellos pacientes con EPID-AR en los que se vaya a iniciar un tratamiento biológico. En los pacientes en tratamiento con un anti-TNF a los que se diagnostica una EPID, no hay evidencia concluyente para recomendar su retirada si el medicamento ha conseguido un buen control de la clínica articular, siempre y cuando se verifique que la EPID se mantiene estable.
Eficacia de los glucocorticoides (GLC), FAMEsc y otros inmunosupresores, FAME biológicos, FAMEsd y agentes antifibróticos en el tratamiento de la EPID asociada a la AR- •
Recomendación. En los pacientes con EPID-AR con un patrón radiológico inflamatorio en los que se considere necesario el tratamiento con GLC, se recomienda su uso siempre a la menor dosis y durante el menor tiempo posible (recomendación de grado √).
- •
Recomendación. El grupo elaborador considera que la evidencia disponible es insuficiente para emitir una recomendación concluyente sobre el uso de inmunosupresores en el tratamiento de la EPID-AR (recomendación de grado D). En el caso de decidir su uso, el grupo elaborador sugiere el empleo de micofenolato por su mejor perfil de seguridad (recomendación de grado √).
- •
Recomendación. Aunque la evidencia de eficacia de los FAME biológicos en el tratamiento de la EPID-AR es escasa, los datos de vida real sugieren que tanto ABA como RTX podrían ser útiles para estabilizar o mejorar la función pulmonar, particularmente en aquellos pacientes con un patrón radiológico no fibrótico (recomendación de grado D).
- •
Recomendación. En el subgrupo de pacientes con EPID-AR con un fenotipo fibrosante progresivo se recomienda el uso de nintedanib, manteniendo el tratamiento de fondo de la AR (recomendación de grado B).
En la práctica clínica se suelen emplear los GLC para el tratamiento de la EPID-AR, asociados o no a un FAMEsc o a un inmunosupresor. No existen ECA que hayan evaluado la eficacia de los GLC en esta complicación, por lo que la evidencia que sustenta su uso se basa fundamentalmente en la experiencia clínica y en los datos de vida real. El grupo elaborador avala su empleo en los patrones de EPID con un componente inflamatorio relevante: neumonía intersticial no específica (NINE), neumonía organizativa, neumonía intersticial linfoide, así como en la bronquiolitis respiratoria asociada a EPID, y en la neumonía intersticial descamativa en caso de ausencia de mejoría tras abandono del tabaco o cuando se presenta en pacientes no fumadores. Su uso en los patrones fibróticos (neumonía intersticial usual [NIU] y NINE fibrosante) es cuestionable, excepto en las exacerbaciones agudas.
Por su perfil de efectos adversos, el grupo elaborador recomienda el uso de GLC siempre a la menor dosis y durante el menor tiempo posible. El tratamiento prolongado con dosis de prednisona (PDN) >7,5mg/día aumenta el riesgo de infecciones graves y empeora el riesgo cardiovascular y la mortalidad en los pacientes con AR78-82.
Una estrategia para disminuir la iatrogenia sería aplicar en la práctica clínica diaria los nuevos conocimientos sobre los mecanismos de acción de los GLC. En la actualidad se sabe que ejercen su acción antiinflamatoria por dos vías: una genómica, clásica, y otra no genómica83,84. La vía genómica tiene un inicio de acción lento, un efecto persistente (siendo responsable de los efectos adversos de los GLC), y se activa al 100% con dosis de PDN de 30mg/día. Por lo tanto, si damos dosis mayores de 30mg/día (la pauta clásica de 1mg/kg/día) solo conseguimos incrementar la toxicidad sin que su efecto antiinflamatorio aumente de forma sustancial. Por el contrario, la vía no genómica ejerce una acción antiinflamatoria mucho más intensa y rápida. Esta vía comienza a activarse de forma apreciable a partir de 100mg/día de metilprednisolona, con un efecto máximo por encima de los 250mg/día. La terapia en pulsos endovenosos por encima de 100-250mg/día durante 3días tiene mayor eficacia y menor toxicidad que el tratamiento prolongado con dosis altas de PDN.
En base a estos conocimientos, hoy en día se aconseja no superar los 30mg/día de PDN, con independencia del cuadro clínico del paciente. En caso de ser necesario por gravedad inicial o exacerbación aguda, se valorará la administración de pulsos de metilprednisolona (125mg o 250mg al día durante 3días, o 500mg/día en los casos más graves), con lo que se consigue una eficacia superior y más rápida (generalmente en menos de 24horas) que el tratamiento prolongado con dosis de 1mg/kg/día.
También se han utilizado la ciclofosfamida (CF), la azatioprina (AZA), el micofenolato (MMF) y la ciclosporinaA (CsA) en el tratamiento de la EPID-AR. Los estudios que han evaluado la eficacia de estos inmunosupresores son de muy baja calidad metodológica (casos clínicos, series de casos y algunos estudios observacionales) (nivel de evidencia3)85-97, por lo que la evidencia disponible es insuficiente para emitir una recomendación concluyente sobre su uso en uno u otro sentido. En el caso de decidir su empleo, el inmunosupresor que parece tener un mejor perfil de seguridad es el MMF. En un trabajo multicéntrico que analizó la mortalidad a lo largo de los últimos 25años en una cohorte de 290 pacientes con EPID-AR, comparándola con 290 controles con AR sin esta complicación de la misma edad y sexo, la mortalidad, tanto general como por causa respiratoria, fue mayor en los pacientes tratados con CF o AZA que en los tratados con MMF98.
Tampoco se han realizado hasta la fecha ECA que evalúen la eficacia y la seguridad de los FAME biológicos o de los FAMEsd en el tratamiento de la EPID-AR. La experiencia publicada con FAME biológicos se limita principalmente a estudios observacionales realizados con RTX39,40,44,70-72 o ABA38,43,68,69,99,100 (nivel de evidencia 2− o 3). Además de la ausencia de un grupo control, entre las limitaciones de estos estudios destaca el hecho de que no todos los pacientes incluidos tenían una EPID activa, como lo demuestra la falta de una valoración protocolizada con PFR en parte de los casos. A pesar de estas limitaciones, los estudios observacionales de vida real son consistentes y sugieren que tanto ABA como RTX, además de ser seguros, parecen ser también potencialmente útiles en el tratamiento de la EPID-AR, consiguiendo estabilizar, e incluso mejorar, los parámetros de función respiratoria y los hallazgos en la TCAR como mínimo en las dos terceras partes de los pacientes, incluyendo casos en los que la EPID había empeorado a pesar del tratamiento previo con GLC y FAMEsc o inmunosupresores y pacientes con EPID fibrosante crónica con un fenotipo progresivo39.
Con TCZ se han publicado casos clínicos61,62 y un estudio observacional retrospectivo42. En este estudio, que incluyó 28 pacientes tratados con TCZ (23 en monoterapia), se observó una mejoría o estabilización en las PFR en el 76% de los casos (mejoría 20%) y en los cambios radiológicos en la TCAR en el 92,8% al final de un período de seguimiento (mediana) de 30meses (nivel de evidencia3).
Apoyando de forma indirecta el posible efecto beneficioso de los agentes biológicos no anti-TNF (RTX, ABA y TCZ) en el tratamiento de la EPID-AR, otro estudio realizado en España demuestra que la progresión pulmonar con estos fármacos es inferior a la que se observa con los anti-TNF41.
La experiencia publicada con FAMEsd se limita a algunos casos clínicos de EPID-AR tratados con TOFA sin evidencia de empeoramiento pulmonar76.
De los dos fármacos antifibróticos comercializados para el tratamiento de la fibrosis pulmonar idiopática (FPI) (nintedanib y pirfenidona), de momento únicamente nintedanib ha sido aprobado por la Agencia Española de Medicamentos (AEMPS) para el tratamiento de la EPID-AR con un fenotipo fibrosante progresivo101. Los criterios que definen este fenotipo se muestran en la tabla 4. La aprobación con esta indicación se sustenta en los datos del ECA faseIII INBUILD102, que evaluó la eficacia del fármaco en diferentes tipos de EPID fibrosante progresiva diferente a la FPI, incluyendo un grupo de pacientes con EPID-EAS mayoritariamente con AR o esclerodermia (nivel de evidencia 1++). El 69,5% de los pacientes recibieron GLC a dosis <20mg/día y el 78%, tratamiento concomitante con FAMEsc (MTX, LEF o antipalúdicos) y/o FAME biológicos (ABA, TCZ, ETC, IFX o adalimumab). Además, a los 6meses del ensayo se permitió el tratamiento de rescate con AZA, MMF, ciclosporinaA, tacrolimus, RTX, CF o PDN >20mg/día en caso de empeoramiento pulmonar o de la enfermedad de base102-104. Al final de las 52 semanas de tratamiento, nintedanib consiguió frenar el deterioro de la capacidad vital forzada (CVF) en este grupo de pacientes en un 58% en comparación con placebo, aunque no se objetivaron diferencias significativas entre grupos en la calidad de vida medida mediante el cuestionario King's Brief Interstitial Disease (K-BILD), ni tampoco en la frecuencia de la primera exacerbación aguda o en la mortalidad102. El perfil de seguridad del fármaco fue similar al ya conocido, y no surgieron nuevas alertas de seguridad cuando se administró en combinación con GLC, FAMEsc, inmunosupresores y/o FAME biológicos.
Definición de EPID fibrosante progresiva según el ensayo controlado aleatorizado INBUILD102
| Cambios fibróticos afectando a más del 10% del parénquima pulmonar en la tomografía computarizada de alta resolución (TCAR) de tórax y cualquiera de los siguientes:• Una disminución en la FVC >10% en los 24 meses previos a pesar del tratamiento• Una disminución de la FVC entre el 5-10% con evidencia de progresión de los cambios fibróticos en la TCAR en los 24 meses previos a pesar del tratamiento• Una disminución de la FVC entre el 5-10% con empeoramiento de los síntomas respiratorios (disnea y tos seca) en los 24 meses previos a pesar del tratamiento• Un empeoramiento de la disnea con progresión fibrosante en la TCAR en los 24 meses previos a pesar del tratamiento |
CVF: capacidad vital forzada; DLCO: capacidad de difusión pulmonar de monóxido de carbono.
Algunos expertos también incluyen como definición de progresión una disminución de la FVC entre el 5-10% con un empeoramiento de la DLCO mayor del 15% en los 24 meses previos a pesar del tratamiento (George PM, el al. Lancet Respir Med 2020;8:925-34).
Se presenta el primer documento oficial elaborado por la SER y la SEPAR de recomendaciones específicas para el abordaje terapéutico de la EPID-AR, con el fin de ayudar en la toma de decisiones a los clínicos directamente implicados en su manejo.
El documento clarifica la seguridad de MTX y LEF, de los FAME biológicos y de los FAMEsd. Una de las conclusiones más importantes es que se confirma que el riesgo real de neumonitis aguda inducida por el MTX es bajo (0,3%)24-26, no habiéndose demostrado que el fármaco aumente de forma relevante el riesgo de desarrollar EPID en los pacientes con AR21,23,27-33. Clásicamente, la neumonitis por MTX ha sido erróneamente sobrediagnosticada, condenando el uso de un fármaco que no solo ha demostrado gran eficacia en el control de la clínica articular, sino que también parece mejorar el pronóstico de la neumopatía. Destacar también que en los pacientes con EPID-AR que no tengan ascendencia asiática, LEF puede considerarse un medicamento seguro16,36,37, y que tanto ABA como RTX se confirman como los fármacos biológicos de primera elección en estos enfermos por su seguridad38-41,43,44,47,63-72.
Además, existe un número creciente de estudios abiertos que demuestran que ABA y RTX parecen ser también útiles en el tratamiento de esta complicación, consiguiendo estabilizar, e incluso mejorar, los parámetros de función respiratoria y los hallazgos en la TCAR en las dos terceras partes de los pacientes, particularmente en aquellos con un patrón radiológico no fibrótico38-40,43,44,69-72,99,100.
Por último, subrayar la incorporación del nintedanib en el arsenal terapéutico para el tratamiento de las formas fibrosantes de EPID-AR (NIU y NINE fibrótica), preferentemente en combinación con el tratamiento de fondo de la enfermedad. De acuerdo con la indicación aprobada por la AEMPS, solo se puede emplear en los casos con EPID-AR con un fenotipo fibrosante progresivo a pesar del tratamiento; por lo tanto, como terapia de segunda o tercera línea101.
Finalmente, en algunos estudios se ha demostrado que el patrón NIU responde menos al tratamiento y tiene un pronóstico peor en comparación con los patrones no NIU39,43,44. Pero aunque respondan menos, hay evidencia suficiente que confirma la eficacia de los tratamientos inmunosupresores/biológicos en los pacientes con NIU, tanto en datos de vida real38-40,43,44,69-72,99,100, como en los ECA realizados en esclerodermia105,106. Esta evidencia justifica su empleo en los pacientes con EPID-AR con este patrón, con independencia de que se asocie o no un tratamiento antifibrótico.
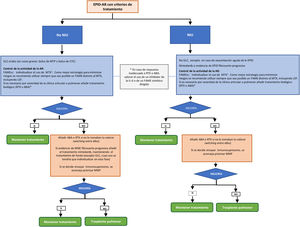
Es evidente la necesidad de más investigación clínica que ayude a clarificar la seguridad y la eficacia de los diferentes fármacos en el manejo de los pacientes con esta complicación. En espera de nuevos estudios, en la figura 1 se propone un algoritmo de tratamiento de los pacientes con EPID-AR y patrón NIU o no NIU. En ningún caso, ni el algoritmo ni las recomendaciones, deben ser considerados como normas restrictivas de uso sino como una ayuda a la toma de decisiones. Reconocemos que las directrices están destinadas a dar una orientación solamente y que muchas de las recomendaciones del documento derivan de la opinión consensuada del panel de expertos y de estudios con un bajo nivel de evidencia.
Algoritmo de tratamiento de la enfermedad pulmonar intersticial asociada a artritis reumatoide (patrón NIU o no NIU).1 En pacientes con AR en tto con MTX durante más de 1 año, a los que se les diagnostica una EPID puede mantenerse el fármaco ya que no existe evidencia que justifique su retirada.
2 En los pacientes en tratamiento con anti-TNF y EPID estable, no hay evidencia concluyente para recomendar su retirada si el medicamento ha conseguido un buen control de la clínica articular.
Protección de personas y animales. los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste proyecto ha sido financiado por la Sociedad Española de Reumatología (SER) y la Sociedad Española de Neumología y Cirugía Torácica (SEPAR).
AutoríaTodos los autores han hecho contribuciones sustanciales en: a)la concepción y el diseño del estudio y el análisis de los datos; b)el borrador del artículo o la revisión crítica del contenido intelectual, y c)la aprobación definitiva de la versión que se presenta.
Conflicto de interesesJavier Narváez ha recibido financiación de Bristol, Kern, Lilly, Pfizer, Roche y Sanofi para la asistencia a cursos/congresos; honorarios de Abbvie, Bristol, Boehringer, Gebro Pharma, GSK, Kern, Lilly, Pfizer, Sanofi y Sobi en concepto de ponencias y de consultorías para compañías farmacéuticas u otras tecnologías, y ha participado en ensayos clínicos financiados de Boehringer, GSK, Janssen, Roche y Vorso.
Petra Díaz del Campo Fontecha ha declarado ausencia de intereses.
Noé Brito García ha declarado ausencia de intereses.
Gema Bonilla ha recibido financiación de Abbvie y Janssen para la asistencia a cursos/congresos y honorarios de Abbvie, BMS, Boehringer, Novartis, Roche y UCB en concepto de ponencias.
Myriam Aburto ha recibido financiación de Boehringer y Roche para la asistencia a cursos/congresos; honorarios de BMS, Boehringer y Roche en concepto de ponencias, y ayuda económica de Boehringer en concepto de consultoría para compañías farmacéuticas u otras tecnologías. También ha participado en un ensayo clínico de Boehringer.
Iván Castellví ha recibido financiación de Actelion, BMS, Boehringer, Kern, Lilly, Novartis, Pfizer y Sanofi para la asistencia a cursos/congresos; honorarios de Actelion, BMS Boehringer, Nordic, Pfizer y Roche en concepto de ponencias; financiación de Actelion para programas educativos o cursos, y ha recibido ayuda económica de Actelion, Boehringer, Gebro y Kern, en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
Esteban Alberto Cano Jiménez ha recibido financiación de Boehringer y Roche para la asistencia a cursos/congresos; honorarios de Boehringer, Chiesi, Roche y Rovi en concepto de ponencias, y ha recibido ayuda económica de Galápagos, en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
Natalia Mena Vázquez ha recibido financiación de Abbvie, Novartis, Pfizer y Roche para la asistencia a cursos/congresos; honorarios de Abbvie, MSD, Pfizer y Roche en concepto de ponencias, y ha recibido financiación de Abbvie y MSD para programas educativos o cursos.
María Asunción Nieto ha recibido financiación de Boehringer, MSD, Roche y TEVA para la asistencia a cursos/congresos; honorarios de Boehringer, BMS y Roche en concepto de ponencias y para programas educativos o cursos; financiación de Boehringer y Roche por participar en una investigación y ha recibido ayuda económica de Roche, Boehringer y Astra en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
Ana María Ortiz ha recibido financiación de Lilly, Novartis, Pfizer, Roche, Sandoz, Sanofi y UCB para la asistencia a cursos/congresos; honorarios de Abbvie, Lilly, MSD y Roche en concepto de ponencias; financiación de Bristol, Gilead, MSD y Roche, por participar en una investigación y ha recibido ayuda económica de Abbvie, Gilead, Janssen, Lilly y Pfizer, en concepto de consultoría para compañías farmacéuticas u otras tecnologías. También ha participado en ensayos clínicos de MSD/Amgen y Bristol.
Claudia Valenzuela ha recibido financiación de Boehringer y Roche para la asistencia a cursos/congresos; honorarios de Roche en concepto de ponencias, y ha recibido ayuda económica de Boehringer, Galápagos y Roche en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
Miguel Ángel Abad Hernández ha declarado ausencia de intereses.
Isabel Castrejón ha declarado ausencia de intereses.
María Correyero Plaza ha declarado ausencia de intereses.
Félix Manuel Francisco Hernández ha declarado ausencia de intereses.
María Vanesa Hernández Hernández ha declarado ausencia de intereses.
José Antonio Rodríguez Portal ha recibido financiación de Roche y Sanofi para la asistencia a cursos/congresos; honorarios de Roche, Boehringer y Janssen en concepto de ponencias; ayuda económica de Bristol, Janssen, Roche y Boehringer en concepto de consultoría para compañías farmacéuticas u otras tecnologías, y ha participado en ensayos clínicos financiados por Gilead, Roche y Boehringer.
El grupo de expertos del presente trabajo quiere manifestar su agradecimiento a Mercedes Guerra Rodríguez, documentalista de la SER, por su colaboración en las estrategias de búsqueda de la evidencia.
Además, agradecen expresamente a los doctores Raimon Sanmartí Sala y Gustavo Enrique Zabert, como expertos revisores del documento, por su revisión crítica y aportaciones al mismo.
También quieren agradecer al Dr. Federico Díaz González, director de la Unidad de Investigación de la SER, por su participación en la revisión del manuscrito final y por contribuir a preservar la independencia de este documento.