La artritis psoriásica (APs) es una enfermedad inflamatoria crónica mediada por el sistema inmune que afecta al sistema musculoesquelético y la piel, y se manifiesta de forma heterogénea y con un curso variable. En la práctica clínica habitual se ha observado variabilidad y limitaciones en su seguimiento. El objetivo del proyecto CREA fue consensuar estrategias de mejora para la valoración inicial y el seguimiento de los pacientes con APs en España.
Materiales y métodosSe realizó una encuesta a una muestra representativa de reumatólogos expertos del territorio español, que contenía 33 preguntas sobre la práctica clínica habitual, los recursos disponibles y las limitaciones actuales en el seguimiento de los pacientes con APs. Se discutieron los resultados en reuniones regionales y se propusieron 105 estrategias que, finalmente, fueron valoradas por 85 expertos en un consenso Delphi.
ResultadosLas limitaciones destacadas en el seguimiento de la APs fueron la falta de tiempo en consulta, de personal de enfermería, y el retraso en la realización de pruebas de imagen. Se propusieron 108 estrategias relacionadas con la evaluación de los índices de calidad de vida e impacto de la enfermedad; las comorbilidades y las manifestaciones extraarticulares; las pruebas de laboratorio; las pruebas de imagen; la exploración física y metrología y los índices de actividad y función. Entre todas, 53 se consideraron altamente aconsejables, sin diferencias regionales en los valores de consenso.
Discusión y conclusionesLas propuestas ofrecidas en el estudio actual son aplicables a todo el territorio nacional, responden a las necesidades no cubiertas detectadas en la encuesta inicial, conforman un cuadro de actuación mínimo y aseguran un seguimiento óptimo de los pacientes con APs.
Psoriatic arthritis (PsA) is a chronic immune-mediated inflammatory disease that affects the musculoskeletal system and skin, and manifests heterogeneously, with a variable course. In current clinical practice, variability and limitations in its follow-up have been observed. The aim of the CREA project was to agree on strategies to improve the initial assessment and follow-up of patients with PsA in Spain.
Materials and methodsA survey was conducted among a representative sample of expert rheumatologists in Spain, containing 33 questions on current clinical practice, available resources, and current limitations in the follow-up of patients with PsA. The results were discussed in regional meetings and 105 strategies were proposed and finally evaluated by 85 experts in a Delphi consensus.
ResultsThe most important limitations in the follow-up of PsA were lack of consultation time, lack of nursing staff, and delays in performing imaging tests. A total of 108 strategies were proposed related to the assessment of quality of life and disease-impact indices; comorbidities and extra-articular manifestations; laboratory tests; imaging tests; physical examination and metrology; and activity and function indices. Of the total, 53 were considered highly advisable, with no regional differences in consensus values.
Discussion and conclusionsThe proposals offered in the current study are applicable to the entire country, respond to the unmet needs detected in the initial survey, form a minimum action framework, and ensure optimal follow-up of patients with PsA.
La artritis psoriásica (APs) es una enfermedad inflamatoria crónica mediada por el sistema inmune que produce destrucción articular y discapacidad, y que se manifiesta de forma heterogénea y con un curso de la enfermedad variable1,2. Su prevalencia en España se sitúa alrededor del 0,6% de la población3.
La APs puede afectar de diversas formas a nivel musculoesquelético (artritis, espondilitis, entesitis o dactilitis) y extraarticular (afectación de piel y uñas, uveítis o enfermedad intestinal inflamatoria)4. Se ha descrito que el 25-70% de los pacientes con APs pueden presentar afectación axial y que puede ser exclusiva en un 5% de ellos5. Dado que algunos dermatólogos o médicos de atención primaria pueden no estar familiarizados con las manifestaciones axiales, es necesario incidir en su detección mediante la sintomatología, la exploración física y las pruebas de imagen6.
La APs se asocia a una alta prevalencia de ciertas comorbilidades: hipertensión arterial y diabetes mellitus entre otras7. Tanto las diversas manifestaciones de la APs8 como las comorbilidades asociadas9 ejercen un gran impacto sobre la calidad de vida (CdV) de los pacientes y requieren de un manejo multidisciplinar10,11.
Los desafíos que emergen en el manejo de la APs han sido abordados por un panel de expertos a nivel europeo, y se han formulado recomendaciones para incrementar el conocimiento de la patología entre los especialistas involucrados, mejorar el diagnóstico temprano y favorecer la atención multidisciplinar12. En España se han publicado estándares de calidad para promover la atención multidisciplinar integrada y mejorar la calidad de los cuidados ofrecidos a los pacientes con APs11,13, pero su implementación ha resultado ser variable y, probablemente, insuficiente14,15. Además, se ha desarrollado un cuadro de actuación para facilitar la evaluación de los pacientes con APs16, y se han consensuado qué variables deben evaluarse en aquellos pacientes que reciben terapia biológica17.
En este marco, el proyecto CREA se llevó a cabo con 2 objetivos: a) conocer la práctica clínica habitual, los recursos disponibles y las limitaciones actuales en el seguimiento de los pacientes con APs y b) elaborar y consensuar estrategias para optimizar el diagnóstico y el seguimiento de los pacientes con APs en España.
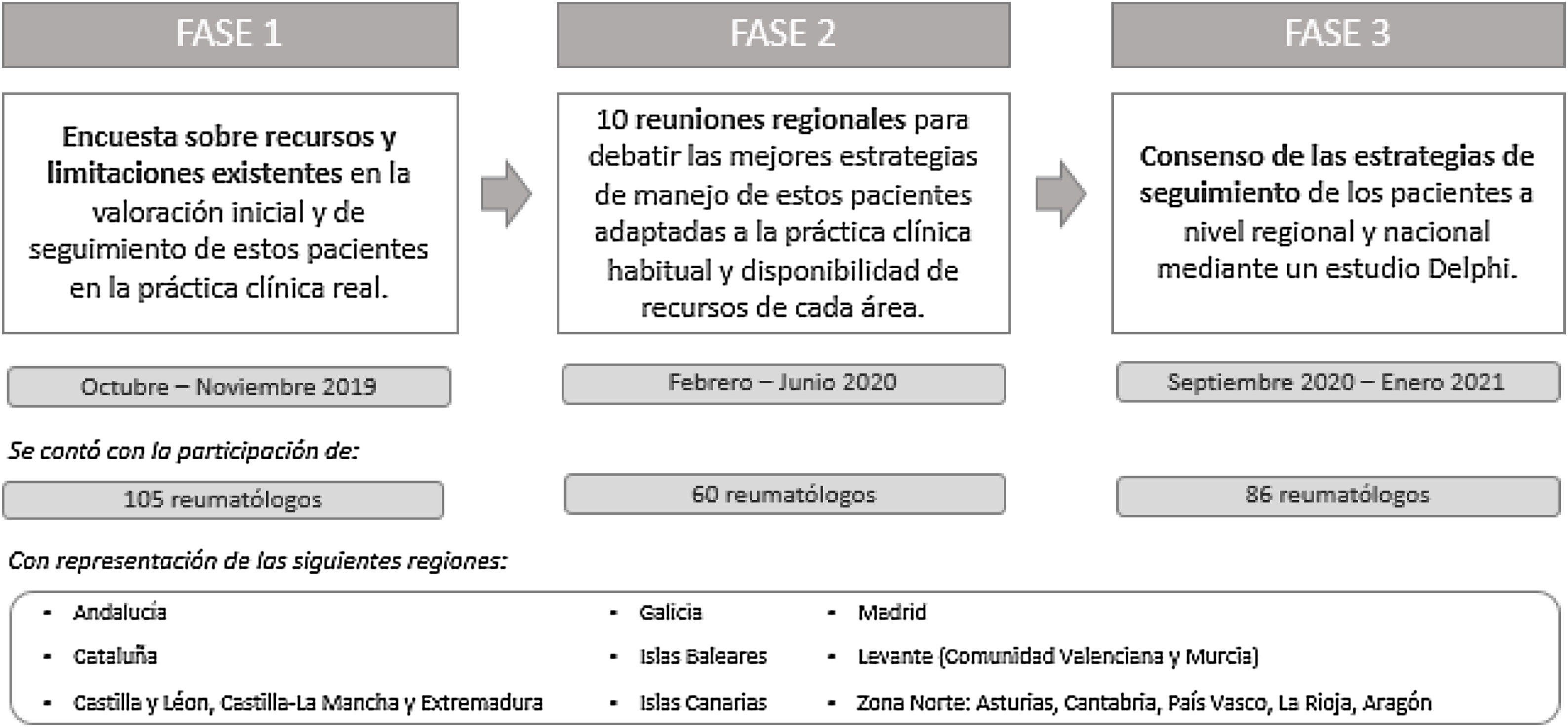
MétodosEl proyecto CREA se desarrolló en 3 fases diferenciadas: una encuesta a nivel nacional; una serie de reuniones para debatir los resultados de la encuesta a nivel regional y proponer estrategias adaptadas a cada territorio; y un consenso Delphi para validar las estrategias propuestas (fig. 1).
Encuesta de recursos y limitacionesUn comité científico compuesto por 10 expertos diseñó una encuesta sobre la atención especializada de los pacientes con APs, con la finalidad de conocer los recursos y las limitaciones existentes en la práctica clínica habitual. La encuesta comprendía 33 preguntas que incluían diferentes ítems, organizadas en 4 secciones: a) Perfil del médico participante, b) Gestión del paciente en la consulta, c) Evaluación del paciente y d) Limitaciones encontradas en la práctica clínica (material suplementario 1). La encuesta fue respondida por una muestra de 105 reumatólogos seleccionados por el comité científico, con interés y experiencia demostrada en el manejo de la APs, miembros del Grupo para el Estudio de la Espondiloartritis de la Sociedad Española de Reumatología (GRESSER) y que representaban las distintas áreas regionales, durante los meses de octubre y noviembre de 2019 (tabla 1).
Perfil de participantes y distribución de la participación regional en las distintas fases del proyecto CREA
| Muestra total | Andalucía | Cataluña | Castilla y Léon, Castilla-La Mancha y Extremadura | Galicia | Islas Baleares | Islas Canarias | Madrid | Levantea | Zona Norteb | Valor de p | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Participación por fases | |||||||||||
| Fase 1: Encuesta de recursos y limitaciones, n (%) | 105 (100%) | 12 (11,4%) | 12 (11,4%) | 7 (6,7%) | 14 (13,3%) | 4 (3,8%) | 9 (8,6%) | 12 (11,4%) | 21 (20,0%) | 16 (15,2%) | — |
| Fase 2: Reuniones regionales, n (%) | 60 (100%) | 5 (8,3%) | 6 (10,0%) | 6 (10,0%) | 6 (10,0%) | 5 (8,3%) | 5 (8,3%) | 8 (13,3%) | 13 (21,6%) | 6 (10,0%) | — |
| Fase 3: Consenso de estrategias de manejo, n (%) | 85 (100%) | 9 (10,6%) | 13 (21,7%) | 6 (10,0%) | 9 (15,0%) | 1 (1,7%) | 8 (13,3%) | 10 (16,7%) | 19 (31,7%) | 10 (16,7%) | — |
| Descripción de los participantes | |||||||||||
| Edad, media (mín., máx.) | 48,3 (30, 67) | 48,6 (30, 67) | 48,7 (31, 65) | 50,7 (32, 60) | 49,9 (35, 65) | 53,3 (48, 63) | 48,9 (33, 61) | 48,8 (36, 60) | 44,7 (33, 67) | 48,4 (31, 60) | 0,722 |
| Tipo de centro | 0,873 | ||||||||||
| Hospital público | 94,0% | 100,0% | 100,0% | 100,0% | 93,0% | 100,0% | 89,0% | 92,0% | 95,0% | 88,0% | |
| Hospital privado | 3,0% | 0,0% | 0,0% | 0,0% | 0,0% | 0,0% | 11,0% | 8,0% | 0,0% | 6,0% | |
| Centro ambulatorio de especialidades | 3,0% | 0,0% | 0,0% | 0,0% | 7,0% | 0,0% | 0,0% | 0,0% | 5,0% | 6,0% | |
| Años de experiencia, media (mín., máx.) | 20 (5,40) | 18,5 (6, 35) | 20,1 (5, 36) | 24,3 (8, 35) | 21,8 (7, 40) | 24,8 (20, 34) | 21,2 (7, 33) | 21,2 (10, 35) | 16,0 (5, 36) | 21,8 (7, 40) | 0,424 |
| Pacientes atendidos en un año, media (mín., máx.) | 1.517,4 (400, 5.000) | 1.245,8 (500, 4.000) | 950 (800, 4.400) | 1.950 (450, 2.800) | 1.790 (150, 2.600) | 1.950 (100, 3.100) | 1.266,7 (500, 4.000) | 1.666,7 (100, 6.300) | 1.225,1 (720, 6.300) | 2.023,1 (200, 2.125) | 0,163 |
| Pacientes con APs atendidos en un año, media (% respecto el total de pacientes) | 250 (19,0%) | 351 (30,0%) | 273 (32,0%) | 231 (20,0%) | 372 (20,0%) | 304 (14,0%) | 390 (18,0%) | 290 (15,0%) | 246 (20,0%) | 243 (12,0%) | 0,999 |
| Recursos disponibles | |||||||||||
| APs | |||||||||||
| Visita inicial | |||||||||||
| Tiempo disponible en consulta, % | 21-30min, 46,7% | 16-20min, 66,7% | 21-30min, 75,0% | 21-30min,57,1% | 21-30min, 71,4% | 21-30min, 50,0% | 21-30min, 66,7% | 16-20min, 41,7% | 16-20min, 71,4% | 16-20min, 50,0% | 0,009 |
| Tiempo óptimo, media (min., máx.) | 33,9 (15, 60) | 31,3 (20, 50) | 36,7 (30,45) | 32,1 (30, 45) | 33,9 (25, 45) | 40,0 (30, 45) | 38,9 (30, 60) | 32,1 (20, 40) | 32,4 (20, 45) | 33,8 (15,45) | 0,230 |
| Visita de seguimiento | |||||||||||
| Tiempo disponible en consulta, % | 10-15min, 66,4% | 10-15min, 100,0% | 10-15min, 75,0% | 10-15min,42,9% | 10-15min, 71,4% | 10-15min, 50,0% | 16-20min, 55,6% | 10-15min, 58,3% | 10-15min, 66,7% | 10-15min, 62,5% | 0,056 |
| Tiempo óptimo, media (min., máx.) | 20,9 (10, 30) | 19,6 (15, 30) | 19,2 (15, 20) | 20,7 (15, 30) | 20,0 (15, 30) | 23,8 (20, 30) | 24,4 (20, 30) | 21,3 (15, 30) | 20,5 (10, 30) | 21,9 (15,30) | 0,169 |
| Residentes de reumatología, Sí % | 54,0% | 92,0% | 83,0% | 14,0% | 36,0% | 0% | 78,0% | 67,0% | 29,0% | 63,0% | <0,001 |
| Consulta monográfica de APs, Sí % | 43,0% | 66,7% | 58,3% | 28,6% | 21,4% | 50,0% | 22,2% | 41,7% | 52,4% | 37,5% | 0,281 |
| Tipo de consultas monográficas | 0,059 | ||||||||||
| Reuma-dermatolmología | 76,0% | 88,0% | 71,0% | 100,0% | 100,0% | 100,0% | 100,0% | 40,0% | 82,0% | 50,0% | |
| APs precoz | 44,0% | 38,0% | 43,0% | 67,0% | 50,0% | 60,0% | 46,0% | 50,0% | |||
| Disponibilidad de enfermero/a de reumatología, Sí % | 77,6% | 75,0% | 100,0% | 71,4% | 71,4% | 25,0% | 77,8% | 66,7% | 90,5% | 75,0% | 0,105 |
| Tareas desempeñadas por enfermero/a de reumatología | 0,068 | ||||||||||
| Educación tratamientos | 95,2% | 88,9% | 100,0% | 100,0% | 100,0% | 100,0% | 100,0% | 100,0% | 89,5% | 91,7% | |
| Controles analíticos de tratamientos | 62,7% | 44,4% | 58,3% | 40,0% | 60,0% | 100,0% | 71,4% | 50,0% | 78,9% | 66,7% | |
| Medición de factores de riesgo cardiovascular (peso, IMC, perímetro abdominal, TA) | 61,4% | 66,7% | 83,3% | 60,0% | 60,0% | 100,0% | 85,7% | 62,5% | 36,8% | 58,3% | |
| Realización índices evaluación EspAax, EspA periférica y APs | 51,8% | 22,2% | 83,3% | 40,0% | 40,0% | 100,0% | 28,6% | 50,0% | 63,2% | 50,0% | |
| Exploración articular y metrología espinal | 37,3% | 22,2% | 25,0% | 60,0% | 50,0% | 100,0% | 71,4% | 0,0% | 52,6% | 16,7% | |
| Formación de pacientes con charlas grupales | 24,1% | 0,0% | 33,3% | 0,0% | 30,0% | 0,0% | 14,3% | 25,0% | 47,4% | 8,3% | |
| Historia clínica informatizada, Sí % | 99,1% | 100,0% | 85,7% | 100,0% | 100,0% | 100,0% | 100,0% | 100,0% | 100,0% | 100,0% | 0,071 |
| Registro valoración pacientes con APs en base de datos digital, Sí % | 49,5% | 66,7% | 58,3% | 14,3% | 57,1% | 25,0% | 66,7% | 41,7% | 52,4% | 37,5% | 0,351 |
APs: artritis psoriásica; IMC: índice de masa corporal; TA: tensión arterial.
Se utilizaron tablas de frecuencias para describir las variables de tipo nominal y medidas de tendencia central y dispersión para las variables continuas. Los datos obtenidos fueron analizados de manera global y por región.
Reuniones regionalesEntre febrero y junio de 2020 se celebraron 10 reuniones regionales en las que se discutieron los resultados de la encuesta de recursos y limitaciones, y se propusieron y debatieron soluciones adaptables a la práctica clínica habitual y a la disponibilidad de recursos de cada área geográfica. Participaron un total de 60 reumatólogos (aproximadamente 6 expertos por reunión), que previamente habían participado en la encuesta. Se propusieron un total de 108 estrategias aplicables al seguimiento de los pacientes con APs, y se elaboró un cuestionario Delphi. Dichas estrategias se organizaron en 6 secciones diferenciadas: a) Índices de calidad de vida e impacto de la enfermedad, b) Exploración física y metrología, c) Evaluación de comorbilidades y manifestaciones extraarticulares, d) Índices de actividad y función, e) Pruebas de laboratorio y f) Pruebas de imagen (Material suplementario 2).
Consenso DelphiEl cuestionario Delphi se respondió en 2 oleadas, entre septiembre de 2020 y enero de 2021; en la primera oleada participaron 92 reumatólogos que habían participado previamente en la encuesta de recursos y limitaciones, y en la segunda oleada, 85 de ellos.
Las estrategias propuestas se valoraron como «altamente aconsejables», «aconsejables» o «prescindibles», y el nivel de acuerdo y la conveniencia fueron evaluados mediante una escala tipo Likert: las valoraciones del 1 al 3 se consideraron «desacuerdo»; del 4 al 6, «neutro»; y del 7 al 9, «acuerdo». Para considerar una estrategia como consensuada se estableció que el 70% o más de los participantes debían coincidir en una misma respuesta.
ResultadosPerfil de los participantesLa edad media de los participantes en la encuesta de recursos y limitaciones fue de 48,3 años y presentaban una media de 20 años de experiencia en su especialidad. El 55% eran mujeres. El 94% trabajaban en un hospital de ámbito público.
La media de pacientes visitados por año era de 1.517, siendo el 19,0% pacientes con APs. El 48% de los pacientes con APs procedían de atención primaria y el 32% de dermatología (tabla 1).
Encuesta de recursos y limitacionesRecursos disponiblesEl 54% de los participantes contaba con residentes en reumatología, con diferencias notables entre las distintas áreas (78% en Canarias, 0% en Baleares). El 43% disponían de consulta monográfica de APs y el 78%, de personal de enfermería especializado en reumatología, mayoritariamente a cargo de la educación del paciente acerca de los tratamientos. La historia clínica informatizada estaba disponible en el 99% de los casos y una base de datos digital de registro de la valoración de los pacientes, en el 47% (tabla 1).
Gestión del paciente en la consultaSegún el 47% de los participantes, el tiempo disponible para las primeras visitas de los pacientes con APs era de 21-30min, si bien la media del tiempo considerado óptimo fue de 33,9min. El 66% de ellos declararon que el tiempo disponible para las visitas de seguimiento era de 10-15min y la media del tiempo considerado óptimo, de 19,3min.
El 40% de los participantes coincidieron en valorar a los pacientes con APs activa cada 2 meses, y el 64%, en valorar aquellos con APs inactiva o con mínima actividad cada 6 meses.
Evaluación del pacienteLa exploración de caderas, la valoración cutánea y ungueal, y el recuento de entesis sintomáticas se llevaban a cabo en más del 80% de casos. Sin embargo, más del 50% de participantes no realizaban las siguientes pruebas: expansión torácica, test de Schöber o su versión modificada, distancia dedo-suelo, distancia intermaleolar, flexión lateral de tronco, o trago-pared. La exploración física y metrología de los pacientes con APs la realizaba principalmente el médico.
Según el 61 y el 63% de participantes, respectivamente, no se valoraban los puntos de fibromialgia ni el perímetro abdominal. Según el 21% y el 37%, respectivamente, no se valoraban peso/talla/ índice de masa corporal (IMC) ni la tensión arterial.
Los índices de actividad y función los valora generalmente el médico. Los índices utilizados por más del 80% de participantes fueron la escala visual analógica (EVA) global y de dolor. El DAPSA (del inglés, Disease Activity in psoriatic Arthritis Index) lo utilizaban el 67% de los participantes. Los índices utilizados por menos de la mitad de participantes fueron los siguientes: BASFI (del inglés, Bath Ankylosing Spondylitis Functional Index), BASDAI (del inglés, Bath Ankylosing Spondylitis Disease Activity Index), BSA (Body Surface Area), ASDAS (del inglés, Ankylosing Spondylitis Disease Activity Score), MDA (del inglés, Minimal Disease Activity), PASI (del inglés, Psoriasis Area Severity Index) y BASMI (del inglés, Bath Ankylosing Spondylitis Metrology Index).
Más del 90% indicaron utilizar la radiografía periférica de manos y pies, de columna lateral cervical/dorsal/lumbar, y la radiografía simple de pelvis en la valoración del paciente. La primera se utilizaba sobretodo en el momento del diagnóstico; la segunda, según clínica; y la tercera, en el momento del diagnóstico, periódicamente o según clínica. La resonancia magnética de articulaciones sacroilíacas o de columna y la ecografía resultaron ser utilizadas ocasionalmente, generalmente dependiendo de la clínica del paciente.
Todas las comorbilidades y manifestaciones extra-articulares propuestas eran evaluadas por el 60% de los participantes o más.
El PtGA (del inglés, Patient Global Assesment) resultó ser el índice más utilizado para valorar el estado general del paciente con APs (por un 49% de los participantes), mientras solo el 28% utilizaban el cuestionario PsAID-12 (del inglés, Psoriatic Arthritis Impact of Disease), en su mayoría cada 6-12 meses.
Limitaciones en la práctica clínicaLa falta de tiempo en consulta, la falta de personal de enfermería y/o de apoyo, y el retraso en la realización de pruebas de imagen fueron las limitaciones más destacadas en el manejo y evaluación de los pacientes con APs, mientras que la falta de acceso a las pruebas de imagen y el desconocimiento de índices y cuestionarios, las que menos (tabla 2).
Limitaciones reportadas entre los expertos respecto al manejo y evaluación de los pacientes con EspAax. Resultados de la encuesta nacional de recursos y limitaciones
| Muestra total (N=107) | Andalucía (n=12) | Cataluña (n=12) | Castilla y Léon, Castilla-La Mancha y Extremadura (n=7) | Galicia (n=14) | Islas Baleares (n=4) | Islas Canarias (n=9) | Madrid (n=12) | Levantea (n=21) | Zona Norteb(n=16) | Valor de p | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Falta de tiempo en consulta | 3,83 | 3,75 | 3,50 | 3,71 | 3,64 | 3,50 | 3,67 | 4,08 | 4,29 | 3,75 | 0,583 |
| Falta de personal de enfermería y/o apoyo | 3,62 | 4,00 | 3,00 | 3,29 | 3,43 | 4,25 | 3,89 | 3,75 | 3,71 | 3,56 | 0,533 |
| Retraso en la realización de pruebas de imagen | 3,32 | 3,17 | 3,25 | 3,14 | 3,86 | 4,00 | 3,56 | 3,50 | 2,81 | 3,31 | 0,379 |
| Falta de acceso a pruebas de imagen | 1,44 | 1,83 | 1,08 | 1,14 | 1,50 | 1,25 | 1,11 | 1,58 | 1,67 | 1,31 | 0,533 |
| Desconocimiento de los índices/cuestionarios para la valoración del paciente | 1,53 | 1,33 | 1,08 | 1,57 | 1,86 | 2,00 | 1,56 | 1,42 | 1,67 | 1,50 | 0,252 |
| Falta de recursos digitales adecuados para la recogida de información | 3,05 | 2,75 | 3,33 | 3,43 | 2,79 | 2,75 | 2,78 | 3,33 | 3,24 | 2,88 | 0,920 |
| Falta de comunicación con MAP | 2,9 | 3,08 | 2,92 | 3,29 | 2,79 | 2,75 | 2,33 | 3,50 | 2,76 | 2,75 | 0,216 |
| Falta de comunicación multidisciplinar con otras especialidades implicadas en estos perfiles de pacientes | 2,47 | 2,83 | 2,00 | 2,71 | 2,64 | 1,75 | 2,33 | 3,08 | 2,24 | 2,38 | 0,113 |
| Otros | 2,61 | 3,67 | 3,00 | 2,50 | 1,00 | 1,00 | 1,50 | 1,00 | 2,50 | 3,20 | 0,488 |
MAP: Médico de Atención Primaria.
Se definieron 97 estrategias específicas para el seguimiento de los pacientes con APs y 11 para los pacientes EspA (espondiloartritis), de las cuales se consensuaron 64 (84%) y 10 (91%), respectivamente (tabla 3). Entre todas ellas, 52 fueron consideradas altamente aconsejables en el seguimiento del paciente con APs (tabla 4). Por lo general, no existieron diferencias significativas de consenso en las diferentes áreas regionales (Material suplementario 2).
Consenso alcanzado en cada ola. Resultados del estudio Delphi
| Estrategias para el seguimiento del paciente con AP | |||||||
|---|---|---|---|---|---|---|---|
| Ola 1 | Ola 2 | ||||||
| Totala | Generales | AP | Generales | AP | |||
| Estrategias totales | 202 (100%) | 11 (100%) | 97 (100%) | 202 (100%) | 11 (100%) | 97 (100%) | |
| Consenso alcanzado (≥70% de acuerdo) | 154 (76%) | 10 (91%) | 76 (81%) | 171 (85%) | 10 (91%) | 64 (84%) | |
| Consenso en el acuerdo | 154 (76%) | 10 | 76 (81%) | 171 (85%) | 10 | 64 84%) | |
| Consenso en el desacuerdo | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | |
| Consenso no alcanzado (<70% de acuerdo) | 48 (24%)b | 1 (9%) | 21 (22%) | 31 (15%) | 1 (9%) | 11 (12%) | |
AP: artritis psoriásica.
Estrategias altamente aconsejables para el seguimiento del paciente con AP. Resultados del consenso Delphi
| En desacuerdo | Neutro | De acuerdo | ||
|---|---|---|---|---|
| Frecuencia | (1-2-3) | (4-5-6) | (7-8-9) | |
| Índices de calidad de vida/actividad de la enfermedad | ||||
| Evaluar al menos un índice de calidad de vida, al menos una vez al añoa | 1,10% | 4,30% | 94,60% | |
| Patient Global Assessment (PtGA) en cada visita | 4,70% | 15,30% | 80,00% | |
| Exploración física y metrología | ||||
| Exploración de caderas, al menos una vez al año | 2,40% | 4,70% | 92,90% | |
| En cada visita | Realizar un recuento de las articulaciones tumefactas/dolorosas (66/68) en cada visita | 3,50% | 5,90% | 90,60% |
| Valoración cutánea y ungueal, en cada visita | 2,40% | 8,20% | 89,40% | |
| Realizar un recuento de las entesitis sintomáticas en cada visita | 2,40% | 9,40% | 88,20% | |
| Realizar el recuento específico de dactilitis, en cada visita, y registrarla por separado del recuento articular | 2,40% | 9,40% | 88,20% | |
| Preguntar sobre antecedentes de ojo rojo, en cada visita | 2,40% | 17,60% | 80,00% | |
| Exploración de caderas, en cada visita | 9,40% | 11,80% | 78,80% | |
| Evaluación de comorbilidades y manifestaciones extra-articulares | ||||
| Evaluar factores de riesgo cardiovascular, independientemente de si la valoración la hace el servicio de reumatología, enfermería o viene hecha de atención primariaa | 0,00% | 1,20% | 98,80% | |
| Disponer de enfermería que realice la valoración de los factores de riesgo cardiovascular (peso, talla, IMC, tensión arterial)a | 0,00% | 5,90% | 94,10% | |
| Revisar la historia clínica del paciente en cada visita, para valorar las comorbilidades, aunque no se le pregunten directamente al paciente en consultaa | 1,20% | 8,20% | 90,60% | |
| Al menos una vez al año | Tensión arterial | 0,00% | 2,40% | 97,60% |
| Peso/talla/IMC | 0,00% | 3,50% | 96,50% | |
| Hígado graso no alcohólico | 1,20% | 4,70% | 94,10% | |
| Perímetro abdominal | 0,00% | 9,40% | 90,60% | |
| En cada visita, a través de la anamnesis | Enfermedad cardiovascular | 3,50% | 10,60% | 85,90% |
| Dislipemia | 3,50% | 10,60% | 85,90% | |
| Diabetes mellitus | 3,50% | 11,80% | 84,70% | |
| Insuficiencia renal | 3,50% | 12,90% | 83,50% | |
| Hipertensión arterial | 3,50% | 12,90% | 83,50% | |
| Obesidad/sobrepeso | 3,50% | 12,90% | 83,50% | |
| Hígado graso no alcohólico | 3,50% | 15,30% | 81,20% | |
| Síndrome metabólico | 4,70% | 15,30% | 80,00% | |
| Tabaco | 5,90% | 15,30% | 78,80% | |
| Uveítis (confirmada por un oftalmólogo) | 3,50% | 17,60% | 78,80% | |
| Sedentarismo, cantidad y tipo de ejercicio | 4,70% | 17,60% | 77,60% | |
| Enfermedad inflamatoria intestinal (CU y Crohn) | 3,50% | 20,00% | 76,50% | |
| Alcohol | 5,90% | 18,80% | 75,30% | |
| Depresión/ansiedad | 4,70% | 20,00% | 75,30% | |
| Úlcera gástrica | 9,40% | 20,00% | 70,60% | |
| Índices de actividad y función | ||||
| Impulsar el papel de enfermería especializada en reumatología para aumentar el uso de los índices de actividad y funcióna | 0,00% | 2,40% | 97,60% | |
| En cada visita | EVA dolor (0-1) | 1,20% | 7,10% | 91,80% |
| EVA global paciente | 1,20% | 7,10% | 91,80% | |
| EVA global medico (0-1) | 2,40% | 7,10% | 90,60% | |
| DAPSA | 2,40% | 9,40% | 88,20% | |
| En cuanto a la valoración cutánea del paciente con APs… | ||||
| Es altamente aconsejable realizar una valoración cutánea conjuntamente con el dermatólogo, en casos de afectación cutánea moderada o grave | 3,50% | 9,40% | 87,10% | |
| Es altamente aconsejable realizar una valoración cutánea en cada visita | 1,20% | 12,90% | 85,90% | |
| La valoración del PASI tendría que venir hecha de dermatología, en casos de afectación cutánea moderada o grave | 1,20% | 12,90% | 85,90% | |
| Si el dermatólogo ya evalúa la afectación cutánea, realizar un BSA es aconsejable Si no lo evalúa dermatología, la realización del BSA es altamente aconsejable | 2,40% | 16,50% | 81,20% | |
| se podría prescindir de realizar un PASI si ya se realiza el BSA | 3,50% | 23,50% | 72,90% | |
| Si BSA no está disponible, y no existe valoración cutánea por parte de dermatología, la valoración del PASI es altamente aconsejable | 12,90% | 14,10% | 72,90% | |
| Pruebas de laboratorio | ||||
| En cada visita | Proteína C reactiva | 0,00% | 2,40% | 97,60% |
| Hemograma | 0,00% | 2,40% | 97,60% | |
| Bioquímica general con perfil hepático | 0,00% | 2,40% | 97,60% | |
| Aclaramiento de la creatinina/filtrado (MMDR-4) | 0,00% | 11,80% | 88,20% | |
| Velocidad de sedimentación globular | 5,90% | 11,80% | 82,40% | |
| Cada 6-12 meses | Perfil lipídico, cada 6-12 meses, en función del perfil de riesgo | 0,00% | 2,40% | 97,60% |
| Ácido úrico cada 6-12 meses | 1,20% | 4,70% | 94,10% | |
| S, orina (sistemático de orina), mínimo una vez al año | 1,20% | 7,10% | 91,80% | |
| Pruebas de imagen | ||||
| Radiografías periféricas manos y pies en caso de clínica | 2,40% | 0,00% | 97,60% | |
| Realizar al menos una radiografía de la columna lateral cervical y/o dorsal y/o lumbar basal | 2,40% | 7,10% | 90,60% |
AP: artritis psoriásica; CU: colitis ulcerosa; DAPSA: Disease Activity in psoriatic Arthritis Index; EspAx: Espondiloartritis; EVA: escala visual analógica; IMC: índice de masa corporal; PASI: Psoriasis Area Severity Index.
El 80% de los participantes consideraron altamente aconsejable evaluar en cada visita el estado global del paciente mediante el PtGA. Un 94,6% estuvieron de acuerdo en que evaluar la CdV mediante algún índice específico una vez al año es altamente aconsejable.
Se consideró altamente aconsejable realizar al menos una vez al año la exploración de caderas y, en cada visita, el recuento de articulaciones tumefactas o dolorosas, el recuento de entesitis sintomáticas, el recuento de dactilitis con un registro independiente del recuento articular, la valoración cutánea y ungueal, y la evaluación de antecedentes de ojo rojo.
La evaluación de los factores de riesgo cardiovascular en los pacientes con APs fue considerada altamente aconsejable y la idoneidad del personal de enfermería para dicha función, también. Se determinó que las manifestaciones extraarticulares y las comorbilidades deberían evaluarse en cada visita. El peso, la talla, el IMC, el perímetro abdominal, la tensión arterial y la aparición de hígado graso deberían determinarse anualmente.
Se recomendó la evaluación global y del dolor mediante EVA en cada visita, así como la determinación del DAPSA. Asimismo, se recomendó la valoración cutánea en cada visita, y preferiblemente junto con dermatología en casos moderados o graves. Se consensuó que el PASI y el BSA deberían ser evaluados por el especialista en dermatología.
Se consideró altamente aconsejable determinar en cada visita la proteína C reactiva (PCR), la velocidad de sedimentación globular (VSG), el hemograma, la bioquímica general con perfil hepático, y el aclaramiento de creatinina o filtrado glomerular; la determinación del perfil lipídico y el ácido úrico debería realizarse cada 6 o 12 meses.
Se consideró altamente aconsejable contar con una radiografía de columna lateral cervical / dorsal / lumbar basal. Las radiografías periféricas de manos y pies se consideraron necesarias en caso de presencia de clínica.
DiscusiónEl óptimo seguimiento de los pacientes con APs es un proceso amplio y complejo. Si bien han surgido nuevas opciones terapéuticas durante los últimos años, la calidad de la atención al paciente en cuestión de diagnóstico, derivación, inicio del tratamiento y seguimiento sigue teniendo margen de mejora, hecho que puede afectar a los resultados clínicos y la CdV de los pacientes a largo plazo18.
La falta de recursos en práctica clínica es, sin duda, un factor limitante a la hora de realizar un seguimiento completo de los pacientes con APs. En este estudio se presentan un total de 52 estrategias consensuadas como altamente aconsejables, que conforman un cuadro de actuación mínimo y aseguran un seguimiento óptimo, aun en un entorno de alta carga asistencial, tiempo limitado en consulta y falta de recursos. Además, dichas estrategias son aplicables a todo el territorio nacional, puesto que no se hallaron diferencias significativas en el grado de consenso por regiones. Estas recomendaciones están dirigidas a todos los expertos que participan en la atención de pacientes con APs: reumatólogos, enfermeras especializadas en reumatología, médicos de atención primaria y dermatólogos; además, pueden ser de utilidad para gestores gubernamentales y hospitalarios, organizaciones de pacientes y agencias reguladoras.
En la primera fase del presente estudio, se identificaron la falta de tiempo en consulta, la falta de personal de enfermería y/o de apoyo, y el retraso en la realización de pruebas de imagen como limitaciones destacadas para el seguimiento de los pacientes con APs. Se observó cierta disparidad entre el tiempo deseable para las primeras visitas y las visitas de seguimiento y el tiempo que los expertos les dedicaban en realidad.
Dado que uno de cada cuatro participantes afirmó no contar con personal de enfermería especializada en reumatología y que el impacto positivo de dicha figura en los servicios de reumatología y en los pacientes ha sido demostrada19,20, se recomendó impulsar su papel para aumentar el uso de los índices de actividad y función, prestar soporte a los pacientes en la cumplimentación de los cuestionarios de CdV y de desenlaces informados por el paciente, y realizar la valoración de comorbilidades (factores de riesgo CV, depresión, etc.).
La elevada comorbilidad asociada a la APs y el consiguiente impacto en los pacientes que la padecen han propiciado el desarrollo de recomendaciones para su identificación, evaluación y manejo21. Parte de las estrategias altamente recomendables ofrecidas en este estudio tienen como objetivo la identificación de comorbilidades tales como enfermedades cardiovasculares o metabólicas, y de manifestaciones extraarticulares. El impulso del manejo multidisciplinar es también de vital importancia en este aspecto y para optimizar la eficiencia del sistema, la atención al paciente y la colaboración entre dermatólogos y reumatólogos22. A nivel nacional, se han definido los modelos de atención multidisciplinar existentes, y los estándares de atención e indicadores de calidad correspondientes13. Sin embargo, también se ha descrito que su grado de implementación es heterogéneo e insuficiente14. En concreto, el papel del dermatólogo es crucial en ciertos aspectos, como la detección precoz de la enfermedad23 y la existencia de unidades multidisciplinares de dermatología-reumatología han sido consideradas criterio de excelencia14. En el estudio presentado, su rol también se consideró indispensable en la valoración cutánea de la APs, sobre todo en aquellos pacientes con afectación moderada o grave.
Dado que el objetivo del tratamiento de la APs es la eliminación de la inflamación y la optimización de la capacidad funcional y de la CdV10, la actividad de la enfermedad y el estado del paciente deben evaluarse de manera regular y ajustar apropiadamente la terapia. A nivel nacional, se ha observado que la evaluación a través de índices de la afectación articular y de la función no se incluyen en una proporción importante de las historias clínicas24. En el estudio actual, más de un tercio de participantes no utilizaban el índice DAPSA, a pesar de haberse demostrado su utilidad11,25,26, y uno de cada 10 no utilizaba la EVA del estado general o el dolor, aunque se consideró necesario realizar ambas evaluaciones en cada visita. El cuestionario PsAID, es la única herramienta validada para recabar información del impacto de la enfermedad en el estado de salud del paciente en base a todos los dominios considerados relevantes según los propios pacientes con APs27. Además, junto con el DAPSA, se consideran las herramientas más adecuadas para valorar la respuesta a los tratamientos biológicos a los 3 meses del inicio del tratamiento17. Aun así, casi 3 de cada 4 participantes declararon no utilizarlo, evidenciando el espacio de mejora en la implementación del mismo. Las bases de datos digitales para el registro de la valoración de los pacientes con APs podrían ser herramientas para facilitar la valoración conjunta (actividad, función, afectación cutánea, CdV) aunque, según los resultados mostrados, no están disponibles en más de la mitad de los casos.
Los estándares de seguimiento del paciente con APs aquí descritos deben difundirse entre los profesionales que participan en su atención, para que puedan adaptarlas a las características de sus centros hospitalarios, reclamar los recursos necesarios, incrementar el abordaje multidisciplinar, y favorecer el control de la enfermedad y la prevención de comorbilidades asociadas. También se han publicado ciertos estándares de calidad asistencial28 que pueden ser útiles para organizar la actividad en las consultas externas de los servicios de reumatología y elevar propuestas de mejora a la gerencia del hospital o a otros estamentos de la administración. Por otro lado, los pacientes con APs deben poder entender la finalidad de una evaluación tan exhaustiva y que consume tanto tiempo, si bien es deseable el desarrollo de herramientas que permitan reducir el tiempo del paciente en consulta. El auge de la telemedicina acontecido en los últimos años, acelerado a raíz de la pandemia producida por la COVID-19, está emergiendo también en el ámbito de la reumatología, con nuevas herramientas desarrolladas29, estándares para su desarrollo e implementación30.
El estudio actual presenta limitaciones. En primer lugar, se trata de una encuesta de opinión y no un estudio basado en la revisión de historias clínicas de pacientes. La representatividad de la muestra de participantes en el consenso Delphi no está asegurada. Si bien se seleccionaron expertos de las diferentes regiones del territorio, no se realizó de forma homogénea, hecho que puede limitar la capacidad de detección de algunas diferencias entre regiones.
ConclusionesLas estrategias altamente aconsejables propuestas en el estudio CREA responden a las necesidades no cubiertas detectadas en la encuesta nacional y discutidas en las reuniones regionales, que posteriormente han sido consensuadas por un amplio grupo de reumatólogos. Estas estrategias implican el impulso del manejo multidisciplinar con un papel importante de los dermatólogos en la valoración cutánea de estos pacientes y del personal de enfermería especializada en reumatología para evaluar los índices de actividad y función, dar soporte a los pacientes en la cumplimentación de cuestionarios de CdV y valorar comorbilidades (factores de riesgo CV, depresión, etc.). De este modo, pueden liberarse recursos para centrarse en la exploración física, identificación y manejo de comorbilidades y manifestaciones extraarticulares, así como aplicar un tratamiento lo más individualizado posible en cada caso. Los datos de este estudio revelan también que actualmente, una proporción importante de reumatólogos no utilizan los índices de actividad recomendados. Las estrategias propuestas en este estudio implican una optimización de la eficiencia del sistema que se traduciría a una mejor atención a los pacientes. Estas estrategias son aplicables a todo el territorio nacional, conforman un cuadro de actuación mínimo y aseguran un seguimiento óptimo de los pacientes con APs.
FinanciaciónNovartis Farmacéutica S.A ha apoyado financieramente el desarrollo de este proyecto, la asistencia en la redacción médica y las tasas de procesamiento por parte de la revista de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los reumatólogos expertos que participaron en las reuniones regionales: Adela María Gallego Flores, Agustí Sellas i Fernández, Agustín Javier Alegre López, Alfonso Fernando Corrales Martínez, Ana Lafont Ruzafa, Ana Pérez Gómez, Ana Urruticoechea Arana, Àngels Martinez Ferrer, Antonio Álvarez de Cienfuegos Rodríguez, Antonio Juan Mas, Arantxa Conesa Mateos, Azucena Hérnandez Sanz, Beatriz González Álvarez, Carlos Alberto Montilla Morales, Carlos García Porrúa, Carlos Javier Rodríguez Lozano, Carlos Manuel González Fernández, Cristina Campos Fernández, Cruz Fernández, Delia Reina Sanz, Elisa María Trujillo Martín, Emma Beltrán Catalán, Erardo Ernesto Meriño Ibarra, Francisco José Maceiras Pan, Gloria Candelas Rodríguez, Jaime Calvo Alën, Javier Calvo Catalá, Jesús Rodríguez Moreno, José Ángel Hernández Beriain, José Antonio Mosquera Martínez, José García Torón, José Miguel Senabre Gallego, José Ramón Maneiro Fernández, Juan Moreno Morales, Laura González Hombrado, Luis Espadaler Poch, Luis Fernández Domínguez, Luis Francisco Linares Ferrando, Manuel José Moreno Ramos, María Concepción Castillo Gallego, María Cristina Lerin Lozano, María José Moreno Martínez, María Luz García Vivar, María Paz Martínez Vidal, Marta Valero Expósito, Meritxell Fernández Matilla, Mireia Moreno Martínez-Losa, Olga Sánchez González, Raquel Hernández Sánchez, Ricardo Gutiérrez Polo, Sara Manrique Arija, Sergio Antonio Rodríguez Montero, Sergio Ramon Machin García, Teresa Font Gayá, Tomás Ramón Vázquez Rodríguez, Vicente Aldasoro Cáceres, Yolanda Cabello Fernández, Julio Antonio Medina Luezas, Isabel de la Morena Barrio y José Campos Esteban.