Los agentes anti-TNFα han representado un notable avance en el control sintomático de los pacientes con espondilitis anquilosante y respuesta inadecuada a AINE. Los antagonistas del TNFα son eficaces y seguros a largo plazo pero es necesario su uso continuado para un adecuado control sintomático. Tras el fracaso a uno de ellos, el uso de un segundo agente anti-TNFα parece ser eficaz y seguro. Aun no se ha demostrado un efecto beneficioso del tratamiento con antagonistas del TNFα sobre la evolución radiológica en la espondilitis anquilosante, a pesar de la desaparición rápida y mantenida de la inflamación ósea, evidenciada mediante RM. Parece necesario explorar nuevas dianas moleculares implicadas en el proceso de osificación.
Anti-TNFα agents represent an outstanding advance in the symptomatic control of patients with ankylosing spondylitis presenting an inadequate response to non-steroidal anti-inflammatory drugs. Anti-TNFα antagonists have demonstrated efficacy and safety in the long-term but continuous therapy is needed for an adequate control of symptoms. After the failure to a first anti-TNFα agent, the use of a second TNFα antagonist seems to be effective and safe. Despite the fast and continuous suppression of bone inflammation, demonstrated by magnetic resonance imaging, the beneficial effect of treatment with TNFα antagonists on the radiological evolution has not been demonstrated to date in ankylosing spondylitis. It seems that insights into new therapeutic molecular targets implicated in the process of ossification are needed.
La espondilitis anquilosante (EA) es una enfermedad autoinmune inflamatoria crónica, caracterizada desde un punto de vista clínico por la presencia de dolor de ritmo inflamatorio y rigidez en la columna vertebral. Estructuralmente, la EA presenta una acusada tendencia a anquilosar la columna vertebral. Ambos elementos, el dolor axial y la anquilosis de la columna, condicionan un importante deterioro de la capacidad funcional del paciente.
Control sintomático con el tratamiento anti-TNF en la espondilitis anquilosanteHasta muy recientemente, el tratamiento de la EA se basaba en la utilización de antiinflamatorios no esteroideos (AINE) y terapia física. A mediados de los años 90 del siglo xx, se objetivó la expresión de una citocina proinflamatoria, el TNFα, en las biopsias de articulaciones sacroilíacas de pacientes con EA1. Es más, a finales de los 90 se evidenció que, en los pacientes con enfermedad de Crohn y EA asociada, el tratamiento con infliximab, un anticuerpo quimérico antagonista del TNFα con indicación para enfermedad de Crohn fistulizante, se producía una mejoría espectacular de la sintomatología dolorosa y de la rigidez axial. Estos datos fueron la base argumental para el desarrollo clínico de los agentes antagonistas del TNFα en la EA.
Todos los agentes antagonistas del TNFα comercializados en la actualidad para la indicación de EA con respuesta inadecuada a AINE han puesto de manifiesto en ensayos clínicos aleatorizados, doble-ciego, de 12–24 semanas de duración, una superioridad muy significativa frente a placebo, alcanzando una respuesta ASAS20 alrededor del 60% de los pacientes tratados con el antagonista del TNFα, en comparación con el 20% de los pacientes asignados a placebo2–4. Recientemente se ha publicado un ensayo clínico, con 24 semanas de seguimiento, comparando la eficacia y seguridad del golimumab, un anticuerpo monoclonal IgG1 humanizado antagonista del TNFα, en pacientes con EA, alcanzándose también una respuesta ASAS20 en alrededor del 60% de los pacientes5. Es más, los agentes anti-TNFα no solo son capaces de mejorar índices combinados de actividad de la enfermedad sino que también han mostrado su capacidad de mejorar los resultados autocomunicados por los pacientes mediante diferentes cuestionarios que exploran la calidad de vida relacionada con la salud, como el SF-36 o el EuroQol-5D6.
En una enfermedad crónica como la EA es de la máxima importancia saber si los agentes terapéuticos mantienen su seguridad y eficacia a medio y largo plazo. En este sentido, varios estudios han confirmado que los antagonistas del TNFα mantienen su seguridad y eficacia durante años en los pacientes con EA. De hecho, más del 60% de los pacientes procedentes de los ensayos clínicos aleatorizados doble-ciego controlados con placebo mantienen una respuesta ASAS40 con infliximab, a lo largo de 5 años de seguimiento abierto7. Por otra parte, durante un periodo de seguimiento abierto de 192 semanas, alrededor del 60% de los pacientes tratados con etanercept mantenía una respuesta ASAS408. En el caso del adalimumab, se han publicado los resultados del seguimiento abierto a 2 años de los pacientes procedentes del estudio ATLAS, un ensayo doble-ciego, aleatorizado y controlado con placebo, evidenciándose una respuesta ASAS40 en cerca del 60% de los pacientes a las 104 semanas de seguimiento9. Es más, recientemente se ha comunicado que la mayoría de los pacientes con EA continúan respondiendo a la terapia adecuadamente tras siete años de tratamiento con infliximab, alcanzando el 83% de los pacientes una respuesta ASAS20, sin problemas de seguridad o pérdida de eficacia10.
La eficacia y seguridad a largo plazo de los antagonistas del TNFα en la EA también queda patente por los datos del registro de agentes biológicos BIOBADASER11. La experiencia en la práctica clínica habitual pone de manifiesto que la retención al tratamiento con antagonistas del TNFα se acerca al 75% a los 4 años, una cifra claramente superior al 60% que presentan los pacientes con artritis reumatoide (AR), confirmando la impresión clínica de que la respuesta a los agentes anti-TNF es superior en la EA que en la AR11, así como de que es más infrecuente la aparición de efectos adversos que obliguen a la suspensión del tratamiento.
Una pregunta clínicamente muy relevante en los pacientes con EA en los que la enfermedad está controlada durante largos periodos de tiempo es si se puede interrumpir la terapia con antagonistas del TNFα. Dos trabajos han intentado responder a esta pregunta. En el primero de ellos, Baraliakos et al12 evaluaron 42 pacientes con EA controlados con infliximab durante al menos 3 años. Tras suspender el infliximab, se recogió la respuesta clínica y el tiempo transcurrido hasta la siguiente recaída, considerando como tal un BASDAI igual o superior a 4. El tiempo medio hasta la recaída fue de 17,5 semanas. De hecho, tan solo 12 semanas después de la interrupción del infliximab, una cuarta parte de los pacientes ya había recaído, el 90% lo había hecho a las 36 semanas y, al año de seguimiento, había recaído el 97% de los individuos. Los autores investigaron si alguna característica clínica en el momento de la suspensión condicionaba una recaída más precoz. Se objetivó una tendencia a recaer más pronto en los pacientes que no estaban en remisión (p=0,059). Tanto un BASDAI superior a 3 (p=0,039), como una proteína C reactiva >6mg/l (p=0,009) se asociaban significativamente a una recaída más temprana. Afortunadamente, todos los pacientes volvieron a responder satisfactoriamente a la reintroducción del infliximab13. La respuesta a la interrupción de etanercept en pacientes controlados satisfactoriamente es muy parecida. Brandt et al14 realizaron un estudio observacional, con un seguimiento de 54 semanas, en 26 pacientes con EA procedentes de un ensayo clínico aleatorizado. Suspendieron el etanercept y determinaron el tiempo transcurrido hasta la recaída, considerando como tal un BASDAI superior a 4. Ellos también observaron que a las 36 semanas habían recaído todos los pacientes pero que, afortunadamente, la reintroducción de etanercept se acompañaba de una rápida respuesta en todos los individuos.
Asimismo se ha investigado si es posible el control sintomático de los pacientes con terapia antagonista del TNFα a demanda de la reaparición de los síntomas axiales. Breban et al15 realizaron un ensayo clínico aleatorizado, con seguimiento de un año, en pacientes con EA activa, considerando como tal un BASDAI igual o superior a 3 y al menos uno de las siguientes tres condiciones: una proteína C reactiva elevada, una RM de sacroilíacas con señal de actividad o señal Doppler positiva en las entesis. Asignaron al azar 124 pacientes a recibir 5mg/kg de infliximab cada 6 semanas y los compararon con 123 pacientes asignados a recibir infliximab (en monoterapia o asociado a metotrexato) solo tras reaparición de los síntomas. El criterio de valoración primario fue la proporción de pacientes que alcanzaron una respuesta ASAS20 al año. Un porcentaje significativamente mayor de pacientes tratados con infliximab usando una pauta fija de administración alcanzó una respuesta ASAS20, un 75 vs. 46% del grupo tratado con infliximab a demanda más metotrexato o un 40% en el grupo tratado con infliximab sin metotrexato.
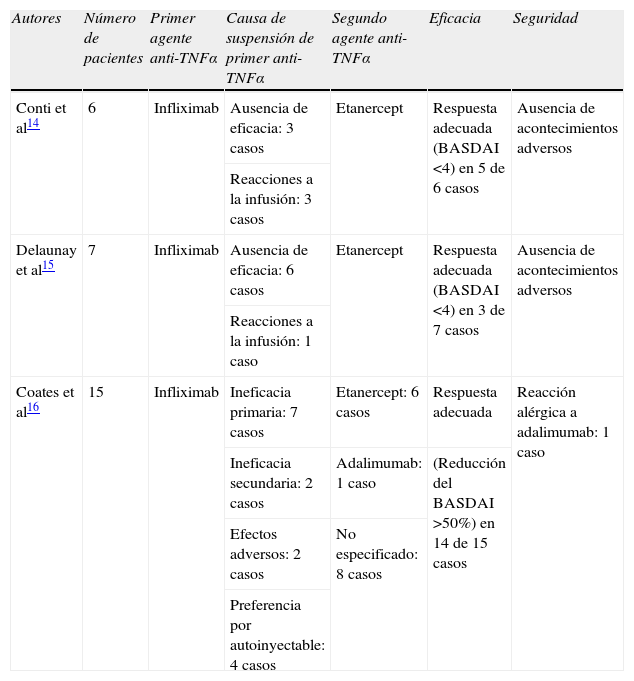
Algunos pacientes con EA no responden adecuadamente al primer agente anti-TNFα o desarrollan efectos secundarios que obligan a su suspensión. Podría parecer a priori que en estos pacientes intentar un segundo agente dirigido a la misma diana terapéutica no tendría sentido pero, por otra parte, está bien documentado que en la AR no es infrecuente una respuesta adecuada a un segundo antagonista del TNFα tras la retirada del primero. Los datos disponibles sobre el cambio entre agentes anti-TNFα en pacientes con EA aún son escasos. Conti et al16 describieron una serie de 6 pacientes con EA en los que se realizó el cambio de infliximab a etanercept por ineficacia o efectos adversos del primer agente. Observaron que cerca del 80% de los pacientes respondieron favorablemente a etanercept, alcanzando una reducción de al menos un 50% en el BASDAI. En el mismo sentido, Delaunay et al han publicado otra pequeña serie17 de 7 pacientes con EA y 6 pacientes con espondiloartropatía indiferenciada en los que hubo que suspender infliximab por respuesta inadecuada (9 pacientes) o aparición de efectos adversos (4 pacientes). Los pacientes fueron tratados con a etanercept y tras 10 meses de seguimiento observaron que 9 de los 13 pacientes tuvieron una respuesta adecuada etanercept, con un BASDAI inferior a 4 y sin toxicidad relevante. Por último Coates et al, utilizando un registro de 113 pacientes con EA tratados con agentes anti-TNF en la unidad de Reumatología del profesor Emery en Leeds, entre 1999 y 2006, identificaron solo 9 pacientes que suspendieron su primer agente anti-TNF por toxicidad y 15 por ineficacia. De estos 24 pacientes, 15 recibieron un segundo agente anti-TNF y, una vez más, se observó una excelente respuesta, ya que 14 de los 15 pacientes (un 93%) respondieron adecuadamente al tratamiento con el segundo antagonista del TNFα, alcanzando un BASDAI inferior a 418.
Los agentes anti-TNFα también pueden ser de utilidad en las fases prerradiológicas de la EA, como se demostró en un interesante ensayo controlado, aleatorizado, en pacientes con dolor lumbar inflamatorio, HLA-B27 positivos y hallazgos inflamatorios en el estudio mediante RM de las articulaciones sacroilíacas19. Estos pacientes, con diagnóstico clínico de EA pero que no cumplían los criterios de clasificación de Nueva York al no presentar sacroilitis radiológica, fueron aleatorizados a recibir infliximab o placebo, con un seguimiento de 12 semanas. El 55% de los pacientes tratados con infliximab alcanzaron una respuesta ASAS70, frente al 12% del grupo que recibió placebo (p=0,009). Por otra parte, parece que el tratamiento con agentes anti-TNFα en estas etapas prerradiológicas de la EA no es capaz de abortar de forma definitiva el proceso patogénico, ya que cuando se interrumpe el agente anti-TNFα reaparecen los síntomas en la mayoría de los pacientes20. Afortunadamente, el tratamiento con adalimumab en estos pacientes vuelve a ser eficaz al reintroducirlo tras la reaparición de los síntomas20.
En definitiva estos últimos años nos han enseñado cómo la utilización de antagonistas del TNFα en pacientes con EA y respuesta inadecuada a dosis plenas de AINE proporciona un excelente control sintomático de la enfermedad, mejora la calidad de vida de nuestros pacientes y mejora los índices funcionales de la enfermedad, manteniendo su efecto terapéutico a lo largo de los años, con un perfil de seguridad excelente.
Modificación del daño estructural con el tratamiento anti-TNF en la espondilitis anquilosanteAl igual que en la AR, sería de esperar que un control de la actividad inflamatoria de la enfermedad mantenido en el tiempo se tradujera en una modificación de la progresión radiológica de la EA, evitando su tendencia natural a la formación de sindesmofitos y a la anquilosis. La detención de la progresión estructural es de la máxima importancia, ya que la capacidad funcional de los pacientes parece estar en relación directa, no solo con la actividad inflamatoria presente, sino también, y de forma independiente, con el daño estructural radiológico acumulado. Landewé et al han publicado recientemente en versión electrónica un estudio en el que se demuestra que la función física en la EA está determinada independientemente tanto por la actividad de la enfermedad como por la lesión radiológica la columna vertebral21. Los investigadores utilizaron los datos basales y tras 2 años de seguimiento de la cohorte OASIS, formada por pacientes con EA seguidos prospectivamente y sin tratamiento con agentes biológicos. En estos pacientes se evaluó la función física como variable dependiente mediante el índice funcional de Dougados y el BASFI, mientras que la actividad inflamatoria se determinó mediante el BASDAI (actividad inflamatoria clínica autopercibida), la velocidad de sedimentación globular y los niveles de proteína C reactiva. El daño estructural se determinó mediante el Stoke Ankylosing Spondylitis Spine Score modificado (SASSSm). En el análisis multivariante, se objetivó la dependencia de la variable BASFI tanto con el BASDAI (p<0,001) como con el SASSSm (p<0,001). El índice funcional de Dougados también se asociaba independientemente al BASDAI (p<0,001) y al SASSSm (p<0,001). Aunque se evidenció una tendencia a la asociación entre el índice funcional de Dougados y la velocidad de sedimentación globular, la asociación no alcanzó significación estadística (p=0,065).
La RM es una técnica de imagen extraordinariamente informativa en la EA. Permite identificar lesiones inflamatorias agudas en los cuerpos vertebrales (lesión de Romanus, lesión de Anderson) y en las articulaciones interapofisarias, tanto en las secuencias STIR como en las T1 posgadolinio22. Asimismo, la RM sirve para identificar lesiones crónicas de sustitución grasa en las secuencias T1 sin gadolinio. En cambio, la RM no es una técnica óptima para la identificación de sindesmofitos, ya que el hueso compacto no se visualiza adecuadamente con ninguna secuencia de la RM. Durante los ensayos centrales de desarrollo de los antagonistas del TNFα en EA, se realizaron RM de columna vertebral antes y después del tratamiento, objetivándose una clara reducción del edema inflamatorio tras el tratamiento, tanto a nivel individual como en la valoración agrupada de los índices de actividad en RM23. Baraliakos et al24 evaluaron mediante RM de columna a pacientes con EA antes y después del tratamiento con etanercept. Se incluyeron 40 pacientes, aleatorizados a recibir etanercept o placebo. Se realizó RM de columna torácica inferior y columna lumbar antes del tratamiento y a las 12, 24 y 48 semanas de tratamiento con etanercept o placebo. Tras 24 semanas de estudio controlado, se permitió el paso a etanercept de los pacientes originariamente asignados al grupo placebo. El tratamiento con etanercept fue capaz de reducir drásticamente las señales de inflamación activa presentes en las RM basales. A nivel de grupo, los pacientes tratados con etanercept presentaron a las 12 semanas una reducción del 53% en la puntuación de edema óseo, frente a un aumento del 12% en el grupo placebo. A las 24 semanas, el grupo etanercept había reducido la señal de inflamación en un 72 vs. 4% del grupo placebo. A la semana 48, el grupo inicialmente asignado a placebo y que comenzó a recibir etanercept en la semana 24, presentó una reducción de la señal inflamatoria de un 40%.
Es más, se ha demostrado que el tratamiento con infliximab es capaz de reducir la inflamación de los cuerpos vertebrales, evaluada mediante RM, durante 2 años de tratamiento. Sieper et al25 estudiaron 20 pacientes con EA, 11 tratados con placebo y 9 tratados con infliximab. A las 12 semanas de seguimiento, los pacientes del grupo placebo pasaron a recibir infliximab. En todos los pacientes se realizó una RM basal, a los 3 meses y a los 2 años. Mientras que el tratamiento con placebo era incapaz de eliminar las señales de inflamación tanto en las secuencias STIR como en las secuencias T1 post-gadolinio, el tratamiento con infliximab reducía eficazmente la señal de edema óseo. A nivel de grupo, los pacientes tratados con infliximab presentaron a las 12 semanas una reducción del 48% en los índices de actividad inflamatoria en RM frente a solo un 9% en el grupo que recibió placebo. Las secuencias STIR a los 2 años pusieron de manifiesto una reducción del 70% en los pacientes tratados con infliximab.
Atendiendo al paradigma actual de la fisiopatogenia de la EA, la inflamación del hueso subcondral es seguida por procesos reparativos con fibrosis y a la aparición de células de estirpe osteoblástica que producen la aposición ósea y la formación de los sindesmofitos, la lesión estructural típica de la EA. Por tanto, cabría esperar que, en las lesiones de inflamación aguda objetivadas en las secuencias STIR y T1 post-gadolinio en la RM, aparecieran en el futuro sindesmofitos radiológicamente evidentes. Baraliakos et al26 estudiaron mediante RM y radiografías simples a 39 pacientes con EA tratados con agentes anti-TNFα, intentando relacionar el edema en la RM basal con la aparición de sindesmofitos en la radiología realizada 2 años después. Analizaron en total 922 márgenes vertebrales en columna cervical y lumbar. En las radiografías basales existían cambios estructurales en el 71% de los pacientes y en el 16% de los márgenes analizados. A los 2 años, se habían formado 26 nuevos sindesmofitos, en un 2,9% de todos los márgenes analizados. El 62% de estos sindesmofitos nuevos se localizaron en puntos en los que existía inflamación en la RM basal. De hecho, tanto en las secuencias STIR como en las T1 posgadolinio, la presencia de edema en la RM basal se asociaba significativamente al desarrollo de sindesmofitos en la radiografía realizada tras 2 años y cerca del 6% de los márgenes vertebrales con edema en las secuencias STIR desarrollaban sindesmofitos frente a solo el 2% de los márgenes sin edema en la RM basal, una diferencia estadísticamente significativa (p=0,006).
Tres trabajos han investigado la evolución radiológica del daño estructural en pacientes con EA tratados con agentes anti-TNFα (tabla 1). En el primero, Baraliakos et al27 estudiaron a 33 pacientes con EA tratados con infliximab durante 3 años, realizando radiografías basales, a los 2 y a los 4 años. A pesar del excelente control sintomático con infliximab, se evidenció progresión radiológica en el 30% de los pacientes. Aquellos individuos que ya tenían lesiones estructurales en las radiografías basales fueron los que presentaron una mayor progresión radiológica. Seguidamente, se compararon estos pacientes con los de la cohorte OASIS, no tratados con antagonistas del TNFα, observándose un aumento medio de 4,4 unidades del SASSSm en la cohorte OASIS frente a solo 1,6 unidades en la cohorte trataba con infliximab, lo que sugería un relativo freno de la progresión radiológica. En cambio, van der Heijde et al28 no pudieron demostrar diferencias con respecto a la cohorte OASIS en los 279 pacientes procedentes del estudio ASSERT tratados con infliximab durante 72 o 96 semanas. El tercer estudio valoró a los pacientes participantes en un ensayo clínico central de desarrollo de etanercept en EA29. Se compararon 257 pacientes tratados con etanercept durante 96 o 72 semana frente a los individuos de la cohorte OASIS y, de nuevo, no se pudo evidenciar diferencias estadísticamente significativas en la evolución radiológica de los 2 grupos de pacientes.
Estudios descriptivos sobre la seguridad y eficacia del cambio entre agentes anti-TNFα en espondilitis anquilosante
| Autores | Número de pacientes | Primer agente anti-TNFα | Causa de suspensión de primer anti-TNFα | Segundo agente anti-TNFα | Eficacia | Seguridad |
| Conti et al14 | 6 | Infliximab | Ausencia de eficacia: 3 casos | Etanercept | Respuesta adecuada (BASDAI <4) en 5 de 6 casos | Ausencia de acontecimientos adversos |
| Reacciones a la infusión: 3 casos | ||||||
| Delaunay et al15 | 7 | Infliximab | Ausencia de eficacia: 6 casos | Etanercept | Respuesta adecuada (BASDAI <4) en 3 de 7 casos | Ausencia de acontecimientos adversos |
| Reacciones a la infusión: 1 caso | ||||||
| Coates et al16 | 15 | Infliximab | Ineficacia primaria: 7 casos | Etanercept: 6 casos | Respuesta adecuada | Reacción alérgica a adalimumab: 1 caso |
| Ineficacia secundaria: 2 casos | Adalimumab: 1 caso | (Reducción del BASDAI >50%) en 14 de 15 casos | ||||
| Efectos adversos: 2 casos | No especificado: 8 casos | |||||
| Preferencia por autoinyectable: 4 casos |
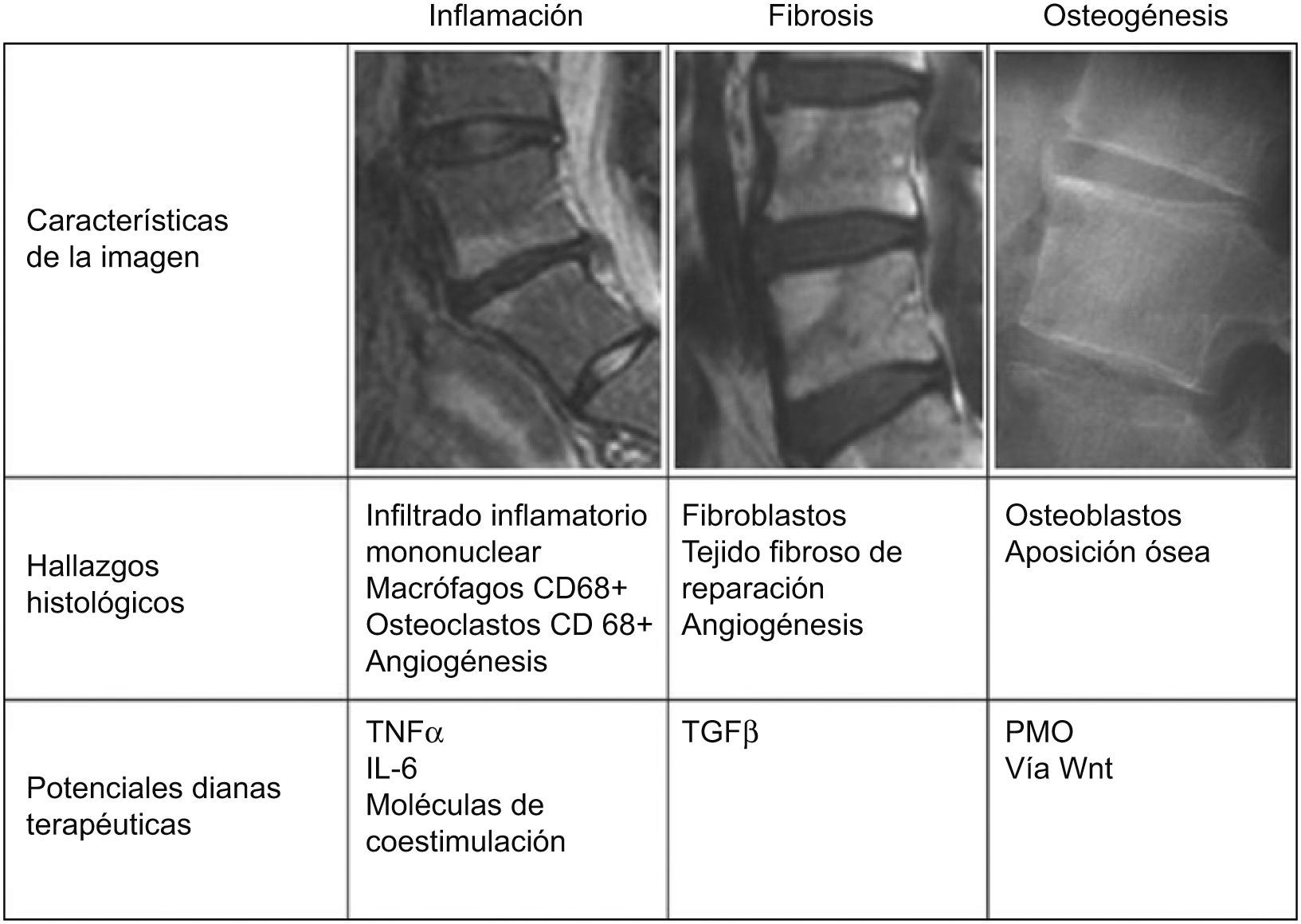
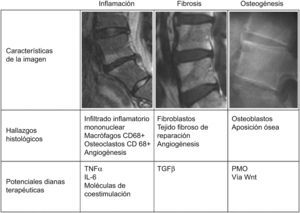
La explicación a esta disparidad entre el control mantenido de la actividad inflamatoria y la ausencia de modificación de la evolución de la lesión estructural podría deberse a que en la EA, tras la inflamación del hueso subcondral, típicamente fluctuante, se produce una destrucción ósea erosiva en la que se asientan fenómenos de reparación con tejido fibroso y fibroblastos, seguido de la aparición de osteoblastos y una neoosteogénesis que da lugar a los sindesmofitos. La citocina proinflamatoria TNFα produce resorción ósea mediante la inducción de la expresión de Dickkopf-1, que conduce a la supresión de la vía de señalización Wnt, esencial para comunicar señalización de osteoblastogénesis y neoosteogénesis30, y a un aumento de la expresión del ligando del receptor del activador nuclear factor-B, que es un potente estimulador de la resorción ósea al unirse al RANK sobre la superficie del osteoclasto. Cuando se inhibe Dickkopf-1, la señalización Wnt induce la formación de nuevo hueso y la expresión de osteoprotegerina, que bloquea la resorción ósea mediada por el ligando del receptor del activador nuclear factor-B. Por tanto, la inflamación debe desaparecer antes de que se inicie la aposición de nuevo hueso. Por ello, lo esperable es que los agentes anti-TNFα no solo no inhiban la formación de nuevo hueso, sino que la estimulen, al inhibir el efecto resortivo mediado por el TNFα. De hecho, esta acción se ha demostrado en un modelo murino de anquilosis31. En la figura 1 se representa un resumen de los fenómenos patogénicos que probablemente intervienen en la EA. En una primera fase, se produce la inflamación del hueso subcondral con una intensa infiltración por parte de linfocitos T CD3+ CD8+, osteoclastos, y neoangiogénesis. En esta primera fase, la dianas terapéuticas serían el TNFα, la interleucina-6, los linfocitos T, los macrófagos y osteoclastos CD68+ y los factores humorales implicados en la angiogénesis, como el factor de crecimiento de endotelio vascular. En una segunda fase tendrían lugar los fenómenos reparativos, con aparición de fibroblastos y fibrosis; en esta fase, la diana molecular fundamental sería el transforming grow factor -β. En una tercera fase, se produciría la aposición ósea con la aparición de osteoblastos en el foco reparativo. En esta última fase la dianas biológicas serían las proteínas de la matriz ósea y la vía proosteoblastogénica Wnt.
Correlación entre los hallazgos de imagen, características anatomopatológicas y potenciales dianas terapéuticas en las distintas fases evolutivas de la lesión primordial en la EA. En una primera fase inflamatoria, caracterizada por lesiones brillantes en las secuencias STIR y T1 posgadolinio, se produce un intenso infiltrado del hueso subcondral por linfocitos T CD3+ CD8+, osteoclastos, y neoangiogénesis. En esta primera fase, la dianas terapéuticas serían el TNFα, la interleucina-6, los linfocitos T, los macrófagos y osteoclastos CD68+ y los factores humorales implicados en la angiogénesis, como el factor de crecimiento de endotelio vascular. En una segunda fase de fibrosis, caracterizada en las secuencias T1 como áreas grises, se produce fibrosis reparativa, con presencia de fibroblastos; en esta fase, la diana molecular fundamental sería el transforming grow factor-α. En una tercera fase, se produciría la aposición ósea con aparición de osteoblastos en el foco reparativo. En esta última fase la dianas biológicas serían las proteínas de la matriz ósea y la vía proosteoblastogénica Wnt.
Además de estas dianas biológicas, conviene recordar que la utilización de AINE de forma continua frente a su uso a demanda de la sintomatología ha demostrado en un ensayo clínico aleatorizado la reducción del daño radiológico valorado mediante el SASSSm a los 2 años32. Se desconoce el mecanismo por el que los AINE podrían retrasar la anquilosis en la EA pero parece poco probable que se deba a un mejor control de la fase inflamatoria en comparación con los agentes anti-TNFα. Por otra parte, es conocido que la ciclooxigenasa-2 desempeña un papel relevante en la formación ósea, ya que los ratones knock-out para COX-2 muestran una reducción de la formación del callo óseo tras fractura33. Además, es bien conocida la propiedad de los AINE de reducir el riesgo de formación de hueso heterotópico hasta un 65%, tras artroplastia de cadera34,35. Quizás, como en La carta robada de Edgar Allan Poe, la solución al enigma se encuentra a la vista de todos, pero, por obvia, pasa desapercibida y, en este sentido, sería muy interesante realizar un ensayo clínico aleatorizado doble-ciego en el que se combinara la utilización de un agente antagonista del TNFα con un AINE utilizado de forma continua, controlado con placebo.
ConclusionesLos agentes anti-TNFα han revolucionado el tratamiento farmacológico de los pacientes con EA. Son agentes eficaces y seguros a medio y largo plazo pero es necesario su uso continuado para un adecuado control sintomático, apareciendo de nuevo la clínica dolorosa y la rigidez tras su suspensión. Aunque los datos disponibles son escasos, éstos sugieren que tras el fracaso a un agente anti-TNFα, el tratamiento con un segundo agente anti-TNFα es eficaz y seguro.
A pesar del excelente control sintomático mantenido, aún no se ha demostrado un efecto beneficioso del tratamiento con antagonistas del TNFα sobre la evolución radiológica en la EA, a pesar de la desaparición rápida y mantenida de la inflamación ósea, evidenciada mediante RM. Probablemente, el uso de agentes anti-TNFα en etapas más tempranas de la EA permita controlar no sólo la inflamación sino la formación de sindesmofitos. Quizás el estudio de nuevas dianas moleculares implicadas en las fases patogénicas de aposición de tejido fibroso y óseo en la EA abra nuevas vías terapéuticas, aunque medidas tan sencillas como el uso de un AINE de forma continuada durante la fase reparativa podría significar la detención de la osteogénesis que conduce al desarrollo de los sindesmofitos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.