Introducción
El implante de células con capacidad condrogénica o el acceso a la médula ósea son modalidades de terapia celular para reparar lesiones del cartílago articular. El objetivo final no es sólo "cicatrizar" el defecto condral (reparación), sino generar un tejido de nueva formación con una estructura, una composición bioquímica y un comportamiento funcional iguales a los del cartílago articular nativo (regeneración). Esta revisión aborda diferentes opciones de terapia celular del cartílago articular desde una perspectiva clínica y experimental.
Penetración del hueso subcondral
Cuando la lesión afecta al cartílago y el hueso subcondral (lesión osteocondral), se produce la migración de células mesenquimales de la estroma de la médula ósea, que protagonizan la reparación del defecto1. Esta reparación está limitada por el tamaño del defecto, de modo que la capacidad de reparación espontánea en lesiones osteocondrales de gran tamaño es prácticamente nula. La abertura del área vascular subcondral se lleva a cabo mediante distintas técnicas quirúrgicas, como la abrasión artroscópica2, las perforaciones del hueso subcondral3, la espongialización4 y la microfractura5, que es la que ofrece mejores resultados.
Estudios experimentales en conejo6,7 y perro8 han observado que el tejido de reparación así formado es de tipo fibrocartilaginoso (diferente del cartílago hialino articular en composición, organización estructural y propiedades mecánicas) y muestra con el tiempo signos de degeneración1,7. No obstante, los resultados clínicos parecen contradecir esta calidad del tejido de reparación. El tratamiento por microfractura de defectos os teocondrales de rodilla ha aportado a los 2 años unos buenos resultados clínicos9, que parecen depender de la edad y muestran más efectividad en pacientes menores de 40 años10. Aunque se ha indicado que un proceso de degeneración del tejido de reparación se inicia a los 18 meses de la microfractura11, se ha descrito a largo plazo (7-17 años) el mantenimiento de la mejoría funcional y la disminución del dolor12.
Injertos de periostio y pericondrio
Estas membranas contienen células madre mesenquimales que pueden experimentar condrogénesis13,14. El implante de periostio o de pericondrio forma un tejido de reparación fibrocartilaginoso que parece no madurar con el tiempo15,16. No obstante, los efectos clínicos del implante de pericondrio parecen ser similares a los de la perforación subcondral, pues a los 10 años de aplicar ambos procedimientos no se observaron diferencias significativas entre sus resultados17.
Injertos osteoperiósticos
El injerto de cilindros de hueso recubiertos de periostio produce en modelos animales un tejido neoformado fibroso18 que, con inductores condrogénicos, llega a adquirir un aspecto fibrocartilaginoso19. Probablemente, el sangrado de médula ósea en la lesión interfiere con la acción reparadora de la capa germinal del periostio. De hecho, en el conejo, cerca del 67% de las células del tejido de reparación tras el injerto osteoperióstico procedían de la médula ósea20. En contradicción con esta discreta calidad histológica del tejido de reparación, se ha descrito que este procedimiento aporta mejoría de la función articular y alivio del dolor21.
Mosaicoplastia
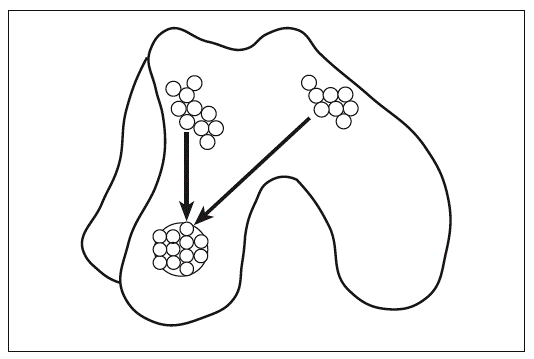
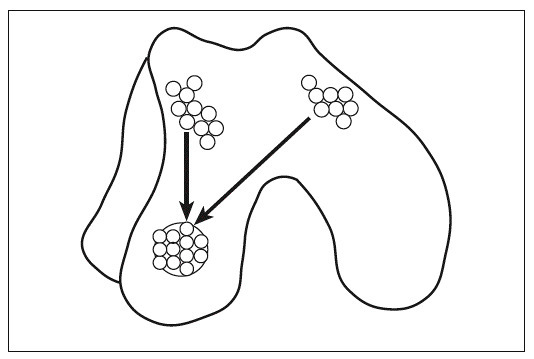
Se considera que este procedimiento es una prometedora alternativa para el tratamiento de defectos condrales y osteocondrales de pequeño y mediano tamaño22. Básicamente, consiste en la translocación al defecto articular de cilindros osteocondrales obtenidos de zonas poco comprometidas con la absorción de carga (fig. 1). La zona donante se autorrepara con células mesenquimales del estroma de la médula ósea que promueven un tejido fibrocartilaginoso. Con el seguimiento artroscópico hasta los 523 y los 10 años24 del implante, se ha observado supervivencia del cartílago hialino trasplantado, congruencia de las superficies articulares y reparación fiborcartilaginosa de las zonas donantes. No obstante, si los cilindros osteocondrales sobresalen de la superficie, producen problemas articulares. Así, pacientes con este problema manifestaron a los 4 meses de la mosaicoplastia sensación de pinzamiento e incluso dolor. Su valoración artroscópica reveló fisuras en los cilindros osteocondrales y fibrillas en la superficie articular anexa25.
Figura 1. Mosaicoplastia. Los cilindros osteocondrales obtenidos de zonas poco comprometidas con la absorción de cargas se implantan en la zona de la lesión.
La mosaicoplastia autóloga está limitada por el tamaño del defecto, que determina el número de cilindros osteocondrales necesarios. Por otra parte, el tejido implantado procede de una zona de poca carga, con menor grosor y diferente estructura histológica. El alotrasplante puede dar solución a estas cuestiones: se evita la lesión en la zona de poca carga de cartílago, es posible obtener un número elevado de cilindros osteocondrales y éstos pueden proceder de la misma zona de carga. Además, los problemas inmunitarios son escasos debido al carácter avascular del cartílago y el encapsulamiento de los condrocitos en la matriz extracelular. De hecho, el alotrasplante osteocondral en rodilla está bien integrado y ofrece una consistente mejoría funcional y del dolor a los 2 años26; después de 10 años la durabilidad es del 85% de los implantes27.
Autotrasplante de condrocitos
Actualmente, la alternativa terapéutica más eficaz para reparar lesiones focales del cartílago articular es el implante de condrocitos autólogos28-31. Este procedimiento también es aplicable a pacientes con osteocondritis disecante32, pero no a articulaciones artrósicas. El autotrasplante de condrocitos encuentra una limitación importante en la edad, y es recomendable utilizar esta técnica en pacientes menores de 55 años.
Este procedimiento consiste en obtener por artroscopia explantes de cartílago aticular de zonas poco comprometidas con la carga (fig. 2). Ya en el laboratorio, de los explantes se aíslan condrocitos, que proliferan in vitro hasta obtener un número apropiado para el implante (10-12 millones de células). En una segunda intervención quirúrgica, se cierra la cavidad del defecto con periostio del propio paciente y se inyectan los condrocitos.
Figura 2. Autotrasplante de condrocitos. A y B: toma de biopsia. C y D: los condrocitos se obtienen triturando el cartílago y procediendo a su digestión enzimática (tripsina y colagenasa tipo IV). E: las células proliferan en un frasco de cultivo a 37 °C. F: cóndilo femoral con lesión condral. G: en la cavidad del de-fecto, cerrada con una membrana (periostio, colágeno tipo I/III), se inyecta la suspensión con condrocitos.
Este tratamiento presenta algunas limitaciones: a) la obtención de explantes supone una intervención quirúrgica adicional y un daño añadido al cartílago articular que puede originar un proceso artrósico; b) la proliferación in vitro de los condrocitos debe ser limitada, pues con las divisiones celulares disminuye su capacidad de producir cartílago estable in vivo33; c) con el envejecimiento disminuye la densidad celular del cartílago, la capacidad de proliferación in vitro de los condrocitos34 y el potencial condrogénico del periostio35, y d) el proceso de cultivo celular resulta demasiado largo (3-6 semanas) y no está exento del riesgo de contaminación.
El primer artículo sobre el autotrasplante de condrocitos en pacientes data de 199428. La valoración clínica y artroscópica a los 2 años del implante femoral aportaba buenos resultados. Trabajos posteriores han demostrado la durabilidad del implante, con buenos resultados clínicos después de 5-11 años del tratamiento32.
El análisis histológico de biopsias del tejido neoformado ha mostrado una cierta heterogeneidad en la calidad del tejido de reparación. De 41 biopsias tomadas tras 1 año del implante, un 10% consistía en cartílago hialino; un 24%, una mezcla de cartílago hialino y fibrocartílago; un 61%, fibrocartílago, y un 5%, tejido fibroso36. Otros estudios han mostrado al año del implante la coexistencia en la misma biopsia de regiones con morfología fibrocartilaginosa y regiones con morfología hialina, ambas con proteoglucanos y colágeno tipo II29,31. Además, se observaba actividad de agrecanasa y metaloproteasas, con una mayor actividad de la agrecanasa en las regiones fibrocartilaginosas31, y la expresión en el ARNm de los procolágenos tipo IIA y tipo IIB37, característicos respectivamente del estado precondrocítico y de condrocitos diferenciados38. Estos datos indican que el autoimplante de condrocitos es capaz de inducir la regeneración del cartílago articular, probablemente por el reemplazo y la remodelación de una matriz inicial fibrocartilaginosa, mediante degradación enzimática y síntesis de colágeno tipo II. Se considera que este proceso continúa más allá de los 24 meses después del implante30,39 y se desarrolla en tres etapas clave: proliferación celular (abarca las primeras 6 semanas), transición (entre las semanas 7 y 26) y remodelamiento (más allá de 27 semanas)40.
Se ha cuestionado el uso de la membrana de periostio para retener la suspensión de condrocitos, utilizando como argumentos la necesidad de realizar una extensa incisión quirúrgica, la hipertrofia periférica del implante de periostio y su potencial de calcificación ectópica. Como alternativa, se propone la utilización de una membrana de colágeno tipo I/III41-43. Un reciente estudio comparativo entre ambas técnicas no aportó diferencias significativas en cuanto a la valoración clínica, aunque el análisis artroscópico demostró un significativo número de pacientes que necesitaron "rasurado" de la hipertrofia periférica en el implante de periostio44.
Otras alternativas terapéuticas son el alotrasplante45-47 y el xenotrasplante de condrocitos48,49. El alotrasplante está condicionado por la necesidad de donantes y las limitaciones del almacenamiento de cartílago o de condrocitos, pues la criopreservación modifica la supervivencia y la proliferación de los condrocitos50. Respecto al xenotrasplante, apenas se ha investigado. Ambos procedimientos encuentran en la barrera inmunitaria una de sus principales objeciones. No obstante, si bien los condrocitos aislados resultan inmunógenos, el aloimplante de condrocitos atrapados en su matriz extracelular47 o embebidos en geles de colágeno o agarosa45,46 produce nulas o escasas reacciones de rechazo. Por otra parte, tras el xenotrasplante in vivo de condrocitos de cerdo en defectos condrales de conejo cerrados con membrana de periostio, no se observaron signos de infiltración de células inmunitarias49.
Trasplante de células madre mesenquimales
Las células madre mesenquimales (MSC) pueden diferenciarse in vitro en una gran variedad de tipos celulares, como adipocitos, condrocitos y osteoblastos51. Estas células se aíslan desde una pequeña muestra de tejido, proliferan en cultivo hasta obtener cantidades apropiadas para aplicaciones clínicas y pueden ser implantadas en el mismo paciente. Así, las MSC constituyen una herramienta potencial para reparar tejidos eludiendo problemas relacionados con el rechazo inmunitario del alotrasplante y el conflicto ético por usar células madre embrionarias.
Las MSC están ampliamente distribuidas in vivo, de modo que se puede aislarlas de médula ósea52, periostio53, pericondrio54, membrana sinovial55, tejido conectivo de la dermis y del músculo esquelético56, grasa57, sangre del cordón umbilical58 y periférica59,60, membrana amniótica61 e incluso del propio cartílago articular62. Aunque la médula ósea es la fuente tisular de MSC más utilizada, la sangre de cordón umbilical se está revelando como fuente de gran cantidad de células madre, susceptibles de diferenciación a cualquier tipo celular y con ventajas derivadas de su estado inmunitario y sus telómeros sin acortar63.
Actualmente, no hay marcadores específicos para la determinación precisa de MSC. Los principales criterios para su identificación son su adherencia al plástico del frasco de cultivo y su morfología fibroblástica64, su capacidad de proliferación prolongada en cultivo manteniendo sus características de células madre, su capacidad para diferenciarse in vitro en células de origen mesodérmico (condrocitos, adipocitos, osteoblastos) y su carencia de expresión de antígenos hematopoyéticos típicos como CD34 y CD4565. Además, se ha relacionado diferentes marcadores de superficie con las MSC. Entre los más ampliamente utilizados están Stro-1, CD44, CD73, CD90, CD105 y CD166.
La escasa cantidad de MSC aisladas de una muestra de tejido hace necesaria su proliferación in vitro. Pero el número de divisiones mitóticas debe ser limitado, pues durante el cultivo in vitro las MSC envejecen y experimentan una marcada disminución de su capacidad proliferativa66,67 y una pérdida gradual del potencial de diferenciación múltiple66,68. El mantenimiento de fenotipo y capacidad de diferenciación es proporcional a la telomerización de los cromosomas69. Los telómeros se acortan en cada división celular, pero en las células madre embrionarias se restituyen por la acción de la enzima telomerasa. En las MSC, esta enzima muestra nula70 o baja actividad68,71,72. La edad del paciente también influye en las características de las MSC, ya que con el envejecimiento se reduce su capacidad proliferativa73.
Diversos estudios señalan que la población de MSC comprende subpoblaciones de células en diferentes estados de diferenciación y que la capacidad de diferenciación puede variar en función del tejido del que se las aísla. Así, las MSC procedentes de médula ósea muestran una mayor tendencia a la diferenciación osteogénica74, en tanto que las MSC de origen sinovial tienen mayor tendencia a la diferenciación condrogénica75.
En las mismas condiciones de cultivo y diferenciación, las MSC aisladas de membrana sinovial muestran más potencial condrogénico que las derivadas de médula ósea, periostio, músculo esquelético o tejido adiposo76.
La reparación en modelos animales de lesiones condrales con MSC embebidas en gel de colágeno45 o inyectadas en los defectos cerrados con periostio77 indica que las MSC son capaces de diferenciarse de acuerdo con el medio biológico en el que se encuentran. Trabajos realizados por diferentes grupos intentando determinar si las MSC inyectadas intraarticularmente se movilizan hacia el cartílago dañado y reparan el defecto obtuvieron resultados opuestos. En rodilla de cabra, con artrosis inducida por rotura meniscal y resección del ligamento cruzado anterior, se observó tras 6 semanas de la inyección intraarticular de MSC reparación del menisco, pero no del cartílago ni del ligamento78, lo que evidencia la movilización de las células hacia el menisco, pero no hacia el cartílago. En cambio, la inyección intraarticular de MSC en rodilla de rata mostró que estas células se movilizaban hacia todos los tejidos afectados, incluido el cartílago, y contribuían a la regeneración tisular79,80. Son escasos los trabajos sobre MSC utilizados para tratar lesiones condrales humanas. En rodillas con osteoartritis, se implantaron MSC embebidas en gel de colágeno en defectos condrales cerrados con membrana de periostio; tras 42 semanas, se observaron mejores resultados artroscópicos e histológicos que en los pacientes osteoartríticos sin implante, aunque esta mejoría no resultó significativa en el aspecto clínico81.
Todavía hay dudas sobre la utilización de MSC para tratar lesiones condrales, en gran medida porque no se conoce con suficiente detalle las etapas de diferenciación condrogénica de estas células y no se dispone de protocolos que garanticen la diferenciación hacia el fenotipo deseado. Así, la plasticidad de las células derivadas de MSC puede conducir a alteraciones no deseadas en el fenotipo82,83.
Terapia génica
La introducción de productos génicos en el ámbito del daño tisular puede favorecer el proceso de restauración del cartílago articular. Este proceso implica determinar los genes y las células adecuadas para la transferencia génica (condrocitos, células condrogénicas y células de la membrana sinovial) usando diferentes vectores para incorporar los ADNc84. Distintos factores anabólicos (miembros de la superfamilia de TGF-b, IGF-1, FGF y HGF) pueden inducir condrogénesis y síntesis de los componentes de la membrana extracelular, en tanto que las moléculas antiinflamatorias (interleucina [IL] 4, IL-10, IL-1Ra, TNFsR) pueden actuar como inhibidores de la degradación del cartílago85.
La membrana sinovial resulta apropiada para terapias condroprotectoras86. La transfección viral in vivo del gen IL-1Ra en articulaciones reumatoideas reduce la enfermedad en modelos animales87 y en pacientes se ha mostrado que esta técnica permite la expresión intraarticular del gen IL-1Ra de una manera segura88,89. Los condrocitos y las MSC resultan dianas preferentes para inductores de condrogénesis. Así, en modelos animales, el trasplante in vivo en lesiones condrales de MSC transfectadas con BMP-2 de ADNc aporta una mejor reparación, con una elevada producción de proteoglucanos y colágeno tipo II90.