Determinar el uso de recursos y el impacto económico de los pacientes con gota en un ámbito poblacional.
Pacientes y métodosDiseño observacional (multicéntrico) realizado a partir de registros pertenecientes a 6 centros de atención primaria y 2 hospitales. Se incluyó a pacientes ≥ 18 años con un episodio agudo de gota durante los años 2003-2007. El seguimiento de los pacientes fue de 2 años. Se confeccionaron 2 grupos de estudio: pacientes con 1-2 ataques/recurrencias agudas y con 3 o más. Principales variables: sociodemográficas, comorbilidad, síndrome metabólico (SM), y uso de recursos y costes sanitarios/no sanitarios. Análisis estadístico: regresión-logística, modelo de ANCOVA; p<0,05.
ResultadosSe incluyó a 3.130 pacientes con gota. Prevalencia: 3,3%; edad media: 55,8 años; varones: 81,1%. Por grupos: el 68,4% presentó 1-2 ataques agudos y el 31,6%, 3 o más, p<0,001. La prevalencia del SM fue del 28,8% (intervalo de confianza [IC] del 95%, 27,2-30,4%). El promedio/unitario del coste fue de 2.228,6 € (costes directos: 96,9%), el 90,8% en AP (visitas: 23,5%; medicamentos: 57,7%). Por grupos, en el modelo corregido el promedio/unitario de los costes totales por paciente fue de 2.130,6 € frente a 2.605,4 €, respectivamente (p<0,001). En todos los componentes del coste los resultados fueron mayores en el grupo con ≥ 3 ataques. El subgrupo de pacientes diabéticos (N=641; 20,5%) presentó un mayor coste (3.124,8 € frente a 1.997,8 €; p<0,001).
ConclusionesLa gota se asocia a una elevada morbilidad, presencia de SM y consumo de recursos. El estudio proporciona datos útiles sobre el coste de la enfermedad; siendo los costes de seguimiento ambulatorio los más elevados.
To determine the use of resources and economic impact of patients with gout at the population level.
Patients and methodsObservational design analysing records belonging to 6 primary care centers and 2 hospitals. We included patients’ ≥18 years with an acute episode of gout over the years 2003-2007. Patient follow-up was 2 years. It produced two study groups: patients with 1-2 attacks/acute recurrences and 3 or more events. Main variables were: demographic, co-morbidity, metabolic syndrome (MS), and resource use and health/non-health costs. Statistical analysis: logistic regression-model ANCOVA, P<.05.
Results3,130 patients with gout were included. Prevalence: 3.3%, mean age: 55.8 years male: 81.1%. Groups were distributed as follows: 68.4% had 1-2 acute attacks and 31.6% with 3 or more, P<.001. The prevalence of MS was 28.8% (confidence interval [CI] 95% CI 27.2 to 30.4%). The average/unit cost was € 2,228.6 (direct costs: 96.9%), 90.8% in primary care (visits: 23.5%; drugs: 57.7%). For groups, the average corrected model/unit total cost per patient was € 2,130.6 vs. € 2,605.4, respectively (P<.001). In all cost components, the results were higher in the group with ≥ 3 attacks. The subgroup of diabetic patients (N=641, 20.5%) had a higher cost (€ 3,124.8€ vs. € 1,997.8, P<.001).
ConclusionsGout is associated with substantial morbidity, presence of MS and resource consumption. The study provides useful data on the cost of the disease; the costs of outpatient follow up is the highest.
La gota es una de las causas más comunes de artritis en mayores de 40 años; su prevalencia oscila entre el 0,5 y el 5% de la población general1,2. Es una enfermedad que se caracteriza por la presencia de episodios inflamatorios, habitualmente monoarticulares y recurrentes, que suelen ser intensos y autolimitados3,4. Las manifestaciones clínicas de la gota se presentan en 3 fases diferenciadas: a) ataque agudo; b) periodo entre crisis (la visualización de tofos es un síntoma tardío de la enfermedad), y c) artropatía crónica (ataques múltiples y/o clínica persistente)5-8.
Los estudios disponibles ponen de manifiesto que en pacientes con obesidad, hipertensión arterial y/o diabetes (elevado riesgo cardiovascular), los niveles de urato sérico pueden ser considerados como un marcador de inflamación, isquemia y estrés oxidativo en el sistema cardiovascular9,10. La asociación entre la gota y el síndrome metabólico (SM) es conocida. Diversos estudios demuestran que los niveles de uratos séricos aumentan a medida que se incrementa el número de componentes del SM, incluso cuando se ajusta frente a factores de confusión como la edad, el género, el aclaramiento de creatinina, el uso de diuréticos y el consumo de alcohol11-13. En general, la prevalencia del SM según los criterios del National Cholesterol Education Program Adult Treatment Panel III (NCEP-ATP III)14 oscila entre un 19-71%.
Las evidencias disponibles en cuanto al uso de recursos y los costes de la gota son limitadas15,16. En EE. UU. se estima que los costes directos anuales para los casos nuevos de gota en hombres son de unos 27,4 millones de dólares17. En los escasos estudios revisados se observa una gran variabilidad en cuanto a la metodología empleada para su cálculo; además, han sido desarrollados en colectivos de pacientes muy diversos (cohorte de empleados, ancianos, etc.)18-21, circunstancia que dificulta la comparación y la validez externa de los resultados. Ante este escenario, y dada la ausencia de datos disponibles en nuestro país en el seguimiento de los pacientes con gota en situación de práctica clínica habitual, la realización de este estudio puede ser pertinente. El objetivo del estudio fue determinar el uso de recursos y el impacto económico (costes sanitarios y no sanitarios) de los pacientes con gota en un ámbito poblacional español durante un periodo de seguimiento de 2 años.
Pacientes y métodosPoblación de estudioSe realizó un diseño observacional multicéntrico, elaborado a partir de la revisión de historias clínicas informatizadas, en pacientes seguidos en régimen ambulatorio y hospitalario. La población de estudio estuvo formada por personas pertenecientes a 6 centros reformados de Atención Primaria (AP); gestionados por Badalona Serveis Assistencials (BSA). Se obtuvo información de los recursos de 2 centros hospitalarios de referencia: Hospital Municipal de Badalona y Hospital Germans Trias i Pujol (atención especializada). La población asignada a los centros fue, en su mayoría, urbana, de nivel socioeconómico medio-bajo, con predominio industrial. BSA es una organización sanitaria integrada que da cobertura a una población de referencia de unos 120.000 habitantes de Badalona (Barcelona, España) y cuenta con 6 centros de AP, el hospital de agudos (Hospital Municipal de Badalona) y un centro sociosanitario. Su modelo de financiación es público y la provisión de servicios privada; está concertada (contrato programa) con el Servicio Catalán de la Salud (CatSalut).
Criterios de inclusión y exclusiónSe incluyó en el estudio a todos los pacientes que demandaron atención por un episodio de gota (nuevo o recurrente) desde el 1/01/2003 hasta el 31/12/2007, y que reunían las siguientes características: a) edad ≥ 18 años; b) seguir de forma regular el protocolo/guía de práctica clínica establecido en los centros, y c) estar en el programa de prescripciones agudas y crónicas del centro. Fueron excluidos los sujetos trasladados a otros centros, los fallecidos y los desplazados o fuera de zona. El seguimiento de los pacientes fue de 24 meses (2 años) para el cálculo de los costes (sanitarios y no sanitarios). En función del número de brotes/recurrencias, se confeccionaron 2 grupos de estudio: pacientes con 1-2 brotes y pacientes con 3 o más brotes (ataques agudos).
Medidas relacionadas con la gotaEl diagnóstico de gota se obtuvo a partir de la Clasificación Internacional de la AP (CIAP-2), código T92, en el componente 7 de las enfermedades y problemas de salud22, y de la Clasificación Internacional de Enfermedades, 9.ª Revisión, Modificación Clínica (CIE-9-MC)23 (códigos: 274.x). Se efectuó una validación clínica de los casos de gota mediante su confirmación en los cursos clínicos de la historia clínica. La validación consistió en obtener una muestra aleatoria de 20 historias clínicas, donde se comprobó si el diagnóstico clínico de gota concordaba con los criterios de la ACR6. En todos los casos se constató la certeza diagnóstica.
Se estimó la prevalencia de la enfermedad como el porcentaje de individuos de la población asignada que presentaron un episodio de gota durante el periodo de estudio (prevalencia de periodo). La tasa de incidencia acumulada fue definida como la proporción de individuos sanos que desarrollaron la enfermedad (número de casos nuevos); la incidencia acumulada, proporciona una estimación de la probabilidad o el riesgo de que un individuo libre de una determinada enfermedad la desarrolle durante un periodo específico de tiempo. No se estandarizaron los resultados puesto que la pirámide poblacional distribuida por edad y género de los pacientes estudiados fue similar a la de la población de Cataluña (fuente: Instituto Nacional de Estadística). Además, se determinó la fecha de inicio de la enfermedad (años de evolución de la enfermedad), la presencia de hiperuricemia (dicotómica) y la procedencia de los pacientes (AP, urgencias hospitalarias y/o consultas externas).
Variables sociodemográficas y de morbilidadLas principales variables de estudio fueron: edad (continua y por rangos) y sexo, así como los antecedentes personales obtenidos a partir de la CIAP-222: hipertensión arterial (K86, K87), diabetes mellitus (T89,T90), dislipidemia (T93), obesidad (T82), tabaquismo (P17), alcoholismo (P15, P16), insuficiencia renal, accidente vasculocerebral (K90, K91, K93), enfermedad pulmonar obstructiva crónica (R95, obstrucción crónica del flujo aéreo), asma bronquial (R96), demencias o trastornos de memoria (P70, P20), enfermedades neurológicas: enfermedad de Parkinson (N87), epilepsia (N88), esclerosis múltiple (N86) y otras enfermedades neurológicas (N99); síndrome depresivo (P76) y neoplasias malignas (todos los tipos; A79, B72-75, D74-78, F75, H75, K72, L71, L97, N74-76, R84-86, T71-73, U75-79, W72-73, X75-81, Y77-79).
Como variable resumen de la comorbilidad general, para cada paciente atendido, se utilizaron: a) el índice de comorbilidad de Charlson24, como una aproximación a la gravedad del paciente, y b) el índice de casuística individual, obtenido a partir de los Adjusted Clinical Groups (ACG), un sistema de clasificación de pacientes por isoconsumo de recursos25. El aplicativo ACG proporciona las bandas de utilización de recursos (BUR), con lo que cada paciente en función de su morbilidad general queda agrupado en una de las 5 categorías mutuamente excluyentes (1: usuarios sanos o de morbilidad muy baja, 2: morbilidad baja, 3: morbilidad moderada, 4: morbilidad elevada, y 5: morbilidad muy elevada).
La definición del SM se estableció cuando se cumplían 3 de los 5 criterios del NCEP-ATP III modificado14: a) triglicéridos de 150mg/dl o mayor; b) colesterol unido a lipoproteínas de alta densidad menor de 40mg/dl en varones o menor de 50mg/dl en mujeres; c) presión arterial sistólica/diastólica de 130/85mmHg o mayor o en tratamiento antihipertensivo; d) glucemia basal en ayunas de 110mg/dl o más, o tratamiento hipoglucémico o diabetes mellitus previamente diagnosticada, y/o e) índice de masa corporal de 28,8kg/m2 o superior (este valor fue considerado equivalente al de obesidad o adiposidad abdominal: perímetro de cintura > 102cm en hombres y > 88cm en mujeres; criterio seguido por diferentes autores)26.
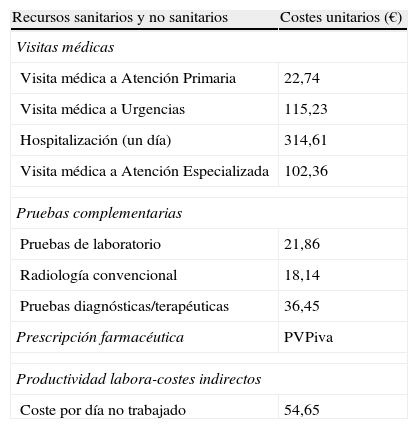
Uso de recursos y modelo de costesSe consideraron como costes no sanitarios o indirectos los relativos a las pérdidas de productividad laboral (número de bajas y días de incapacidad). El diseño del sistema de costes se definió teniendo en cuenta las características de las organizaciones y el grado de desarrollo de los sistemas de información disponibles. La unidad de producto que sirvió de base al cálculo final (durante el periodo de estudio) fue el paciente atendido y el coste fue expresado en coste medio por paciente (coste/unitario). Los diferentes conceptos de estudio y su valoración económica se detallan en la tabla 1 (correspondientes al año 2007). Las diferentes tarifas se obtuvieron a partir de la contabilidad analítica de los centros, excepto la medicación y los días de baja laboral. Las prescripciones se cuantificaron según el precio de venta al público por envase en el momento de la prescripción. Los días de incapacidad laboral o pérdidas de productividad se consideraron como costes no sanitarios (costes indirectos). El coste se cuantificó según el salario mínimo interprofesional (fuente: Instituto Nacional de Estadística)27. Los costes se determinarán a los 2 años de seguimiento de los pacientes.
Detalle de los costes/unitarios y de las pérdidas de productividad laboral
| Recursos sanitarios y no sanitarios | Costes unitarios (€) |
| Visitas médicas | |
| Visita médica a Atención Primaria | 22,74 |
| Visita médica a Urgencias | 115,23 |
| Hospitalización (un día) | 314,61 |
| Visita médica a Atención Especializada | 102,36 |
| Pruebas complementarias | |
| Pruebas de laboratorio | 21,86 |
| Radiología convencional | 18,14 |
| Pruebas diagnósticas/terapéuticas | 36,45 |
| Prescripción farmacéutica | PVPiva |
| Productividad labora-costes indirectos | |
| Coste por día no trabajado | 54,65 |
Fuente de los recursos sanitarios: contabilidad analítica propia. Valores expresados en euros. PVP: precio de venta al público.
Se respetó la confidencialidad de los registros marcada por la Ley Orgánica de Protección de Datos (15/1999, de 13 de diciembre), con disociación de los datos. El estudio fue clasificado por la Agencia Española de Medicamentos y Productos Sanitarios (EPA-OD) y, posteriormente, aprobado por el Comité de Ética de Investigación Clínica del Hospital Universitario Germans Trias i Pujol de Badalona.
Análisis estadísticoSe efectuó un análisis estadístico descriptivo-univariante con valores de media, desviación típica/estándar (DE) e intervalos de confianza (IC) del 95%, y se comprobó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. En el análisis bivariante se utilizaron las pruebas de ANOVA y de la ji al cuadrado, y correlación lineal de Pearson. Se efectuó un análisis de regresión logística para determinar las variables asociadas a la presencia de ≥ 3 brotes (variable dependiente), con procedimiento enter (estadístico: Wald). La comparación del coste ambulatorio y hospitalario se realizó según las recomendaciones de Thompson y Barber28 mediante el análisis de la covarianza (ANCOVA), con el sexo, la edad y las BUR, y el índice de Charlson como covariables (procedimiento: estimación de medias marginales; ajuste de Bonferroni). Se utilizó el programa SPSSWIN versión 18, estableciendo una significación estadística para valores de p<0,05.
ResultadosDe una selección inicial de 96.206 sujetos ≥ 18 años asignados a los centros, se reclutó a 3.130 pacientes con gota. La prevalencia global fue del 3,3% (IC del 95%, 2,7-3,9%). La estimación de la tasa de incidencia acumulada fue de 1,1 casos nuevos/1.000 habitantes/año. Por grupos de estudio, 2.142 (68,4%) presentaron 1-2 ataques agudos y 988 (31,6%) 3 o más recurrencias, p<0,001. La media ± DE de edad fue de 55,8 ± 12,2 años y el 81,1% fueron varones. Del conjunto de pacientes, el 43,6% fueron hipertensos, el 43,1% obesos y el 40,5% con dislipidemia. La prevalencia del SM fue del 28,8% (IC del 95%, 27,2-30,4%).
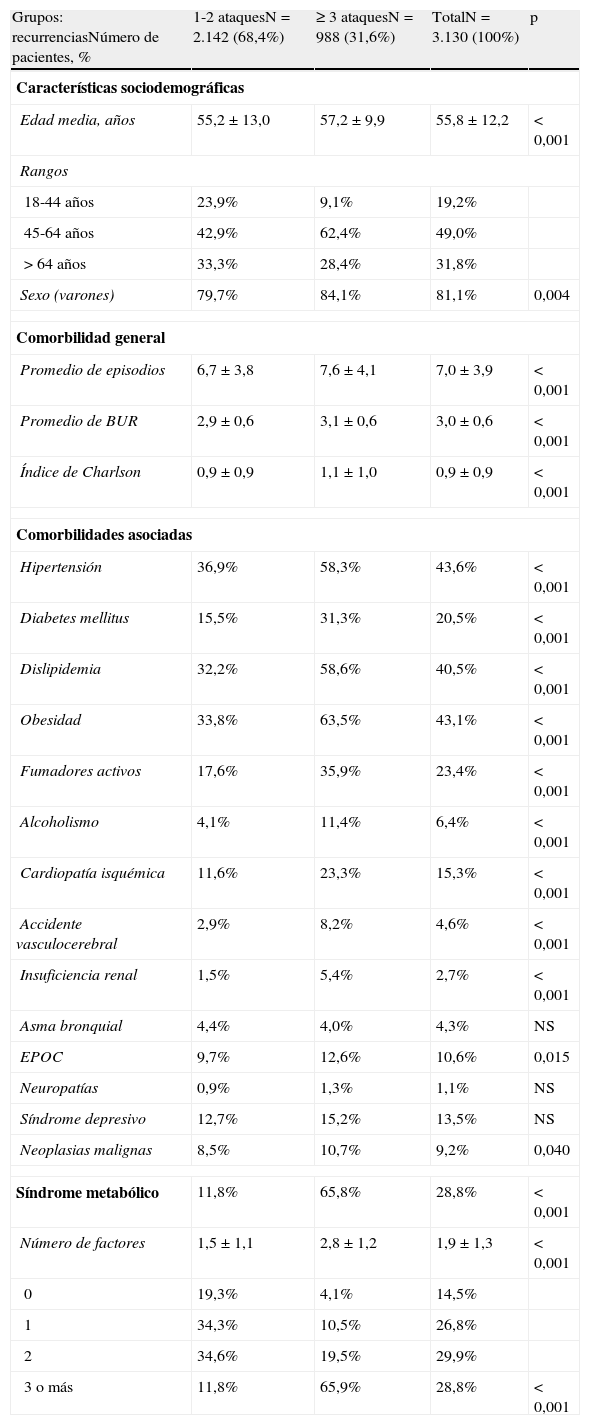
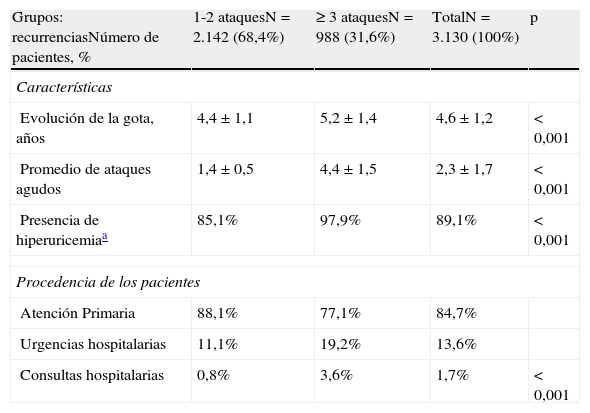
En la tabla 2 se describen las características generales de la serie y las comorbilidades asociadas a los pacientes con gota según los 2 grupos de estudio. Los sujetos con ≥ 3 ataques agudos/recurrencias mostraron una media de edad superior (57,2 frente a 55,2 años; p<0,001), y una mayor proporción de varones (84,1% frente a 79,7%; p=0,004). Estos sujetos presentaron una mayor proporción de comorbilidades: BUR (3,1 frente a 2,9; p<0,001) e índice de Charlson (1,1 frente a 0,9; p<0,001). En el modelo de regresión logística corregido, los sujetos con ≥ 3 ataques agudos/recurrencias se asociaron con el SM (odds ratio [OR]=6,2; IC del 95%, 4,6-8,3), la obesidad (OR=2,1; IC del 95%: 1,7-2,5) y la hipertensión arterial (OR=1,6; IC del 95%: 1,3-1,9), p<0,001. El SM tuvo una moderada correlación lineal con el número de ataques agudos (r=0,517), los años de evolución de la enfermedad (r=0,321) y los niveles iniciales de ácido úrico (r=0,278), p<0,001. Las características basales de la artropatía gotosa se detallan en la tabla 3; el 89,1% de los sujetos presentaron hiperuricemia y el 84,7% de los casos procedieron de AP. Los sujetos con ≥ 3 ataques agudos/recurrencias mostraron un mayor seguimiento en las consultas de reumatología (el 3,6 frente al 0,8%; p<0,001). Cabe destacar que únicamente en el 16,9% de los pacientes existió un diagnóstico de certeza de gota (visualización de cristales de urato monosódico en el microscopio). Por grupos de estudio, en sujetos con ≥ 3 ataques agudos/recurrencias fue del 29,0 frente al 11,3%, p<0,001.
Características basales de la serie estudiada
| Grupos: recurrenciasNúmero de pacientes, % | 1-2 ataquesN = 2.142 (68,4%) | ≥ 3 ataquesN = 988 (31,6%) | TotalN = 3.130 (100%) | p |
| Características sociodemográficas | ||||
| Edad media, años | 55,2 ± 13,0 | 57,2 ± 9,9 | 55,8 ± 12,2 | < 0,001 |
| Rangos | ||||
| 18-44 años | 23,9% | 9,1% | 19,2% | |
| 45-64 años | 42,9% | 62,4% | 49,0% | |
| > 64 años | 33,3% | 28,4% | 31,8% | |
| Sexo (varones) | 79,7% | 84,1% | 81,1% | 0,004 |
| Comorbilidad general | ||||
| Promedio de episodios | 6,7 ± 3,8 | 7,6 ± 4,1 | 7,0 ± 3,9 | < 0,001 |
| Promedio de BUR | 2,9 ± 0,6 | 3,1 ± 0,6 | 3,0 ± 0,6 | < 0,001 |
| Índice de Charlson | 0,9 ± 0,9 | 1,1 ± 1,0 | 0,9 ± 0,9 | < 0,001 |
| Comorbilidades asociadas | ||||
| Hipertensión | 36,9% | 58,3% | 43,6% | < 0,001 |
| Diabetes mellitus | 15,5% | 31,3% | 20,5% | < 0,001 |
| Dislipidemia | 32,2% | 58,6% | 40,5% | < 0,001 |
| Obesidad | 33,8% | 63,5% | 43,1% | < 0,001 |
| Fumadores activos | 17,6% | 35,9% | 23,4% | < 0,001 |
| Alcoholismo | 4,1% | 11,4% | 6,4% | < 0,001 |
| Cardiopatía isquémica | 11,6% | 23,3% | 15,3% | < 0,001 |
| Accidente vasculocerebral | 2,9% | 8,2% | 4,6% | < 0,001 |
| Insuficiencia renal | 1,5% | 5,4% | 2,7% | < 0,001 |
| Asma bronquial | 4,4% | 4,0% | 4,3% | NS |
| EPOC | 9,7% | 12,6% | 10,6% | 0,015 |
| Neuropatías | 0,9% | 1,3% | 1,1% | NS |
| Síndrome depresivo | 12,7% | 15,2% | 13,5% | NS |
| Neoplasias malignas | 8,5% | 10,7% | 9,2% | 0,040 |
| Síndrome metabólico | 11,8% | 65,8% | 28,8% | < 0,001 |
| Número de factores | 1,5 ± 1,1 | 2,8 ± 1,2 | 1,9 ± 1,3 | < 0,001 |
| 0 | 19,3% | 4,1% | 14,5% | |
| 1 | 34,3% | 10,5% | 26,8% | |
| 2 | 34,6% | 19,5% | 29,9% | |
| 3 o más | 11,8% | 65,9% | 28,8% | < 0,001 |
BUR: bandas de utilización de recursos; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; NS: no significativo; p: significación estadística.
Valores expresados en porcentaje o media ± desviación estándar.
Características basales de la artropatía gotosa
| Grupos: recurrenciasNúmero de pacientes, % | 1-2 ataquesN = 2.142 (68,4%) | ≥ 3 ataquesN = 988 (31,6%) | TotalN = 3.130 (100%) | p |
| Características | ||||
| Evolución de la gota, años | 4,4 ± 1,1 | 5,2 ± 1,4 | 4,6 ± 1,2 | < 0,001 |
| Promedio de ataques agudos | 1,4 ± 0,5 | 4,4 ± 1,5 | 2,3 ± 1,7 | < 0,001 |
| Presencia de hiperuricemiaa | 85,1% | 97,9% | 89,1% | < 0,001 |
| Procedencia de los pacientes | ||||
| Atención Primaria | 88,1% | 77,1% | 84,7% | |
| Urgencias hospitalarias | 11,1% | 19,2% | 13,6% | |
| Consultas hospitalarias | 0,8% | 3,6% | 1,7% | < 0,001 |
NS: no significativo; p: significación estadística.
Valores expresados en porcentaje o media ± desviación estándar.
Distribución del número de ataques/agudos: 1 (N=1.315; 42,0%), 2 (N=827; 26,4%), 3 (N=325; 10,4%), 4 (N=292; 9,3%), 5 (N=184; 5,9%), 6 (N=100; 3,2%), 7 (N=54; 1,7%), 8 (N=15; 0,5%), ≥ 9 (N=18; 0,6%).
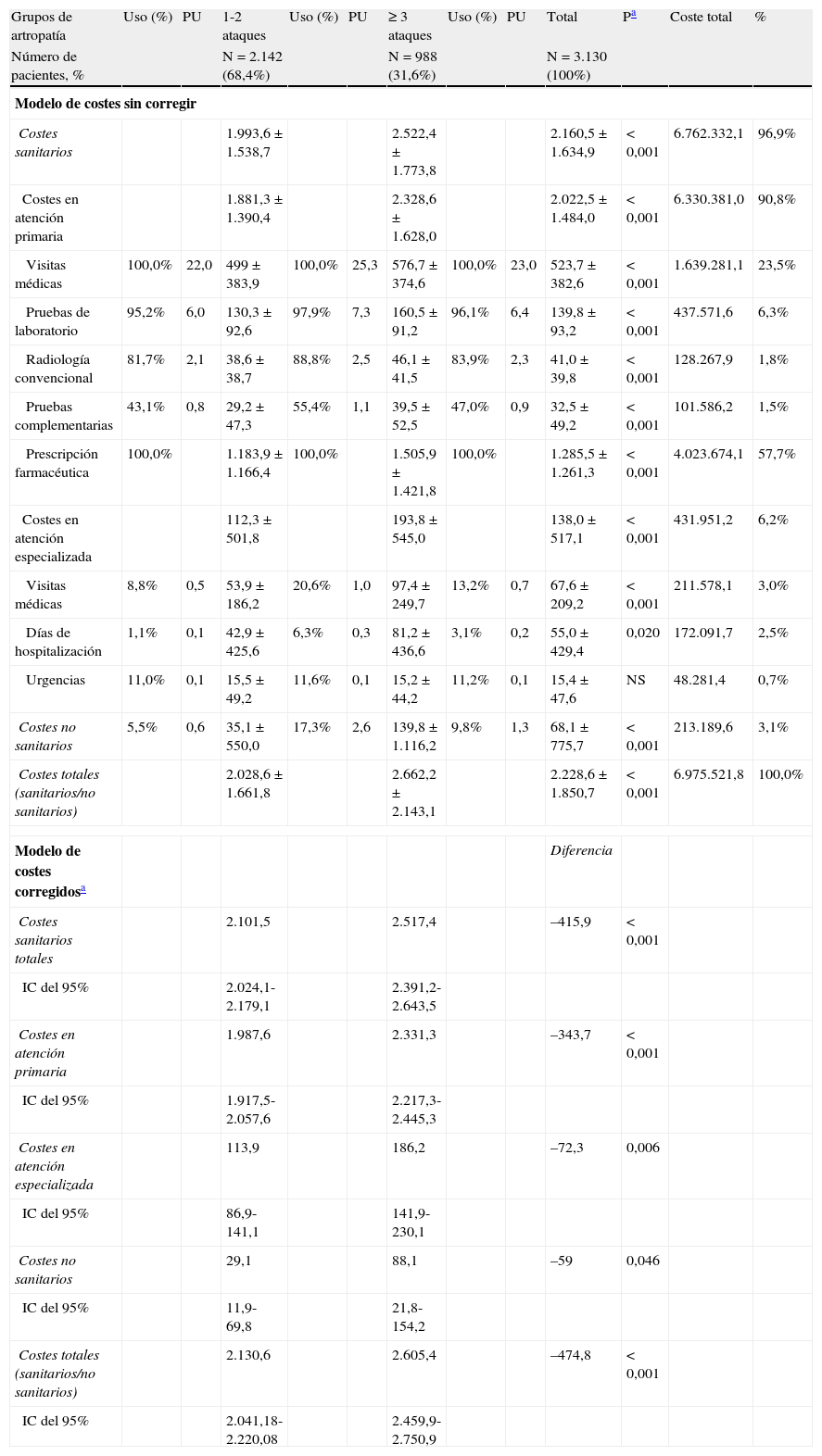
El modelo de costes brutos y corregidos prospectivos (seguimiento de 24 meses) asociados a la gota según los grupos de estudio se describe en la tabla 4. El coste total de los pacientes incluidos en el estudio ascendió a 7 millones de euros, de los cuales el 96,9% correspondió a costes sanitarios directos y el 3,1% a costes no sanitarios (pérdidas de productividad), con un promedio/unitario total de 2.228,6 €. Por grupos, los costes totales (sanitarios, no sanitarios) de los sujetos con 1-2 ataques de gota fueron inferiores en comparación con los que presentaron ≥ 3 ataques (2.028,6 € frente a 2.662,2 €). La distribución porcentual del coste representa el 90,8% en AP y el 6,2% en atención especializada; de estos, el 23,5% en visitas en AP y el 57,7% en prescripción farmacéutica. En el modelo multivariante corregido, los costes fueron inferiores en el grupo de 1-2 ataques, en especial los costes sanitarios totales (2.101,5 € frente a 2.517,4 €; p<0,001) y en AP (1.987,6 € frente a 2.331,3 €; p<0,001). El promedio/unitario corregido de los costes totales por paciente fue de 2.130,6 € frente a 2.605,4 €, respectivamente (p<0,001). En todos los componentes del coste los resultados fueron mayores en el grupo con ≥ 3 ataques. Durante el periodo de estudio, los pacientes con ≥ 3 ataques agudos/recurrencias mostraron un mayor promedio de número de bajas laborales (2,3 frente a 1,2; p<0,006) y días de incapacidad laboral (0,6 frente a 2,6 días; p<0,001).
Modelo de costes brutos y corregidos
| Grupos de artropatía | Uso (%) | PU | 1-2 ataques | Uso (%) | PU | ≥ 3 ataques | Uso (%) | PU | Total | Pa | Coste total | % |
| Número de pacientes, % | N = 2.142 (68,4%) | N = 988 (31,6%) | N = 3.130 (100%) | |||||||||
| Modelo de costes sin corregir | ||||||||||||
| Costes sanitarios | 1.993,6 ± 1.538,7 | 2.522,4 ± 1.773,8 | 2.160,5 ± 1.634,9 | < 0,001 | 6.762.332,1 | 96,9% | ||||||
| Costes en atención primaria | 1.881,3 ± 1.390,4 | 2.328,6 ± 1.628,0 | 2.022,5 ± 1.484,0 | < 0,001 | 6.330.381,0 | 90,8% | ||||||
| Visitas médicas | 100,0% | 22,0 | 499 ± 383,9 | 100,0% | 25,3 | 576,7 ± 374,6 | 100,0% | 23,0 | 523,7 ± 382,6 | < 0,001 | 1.639.281,1 | 23,5% |
| Pruebas de laboratorio | 95,2% | 6,0 | 130,3 ± 92,6 | 97,9% | 7,3 | 160,5 ± 91,2 | 96,1% | 6,4 | 139,8 ± 93,2 | < 0,001 | 437.571,6 | 6,3% |
| Radiología convencional | 81,7% | 2,1 | 38,6 ± 38,7 | 88,8% | 2,5 | 46,1 ± 41,5 | 83,9% | 2,3 | 41,0 ± 39,8 | < 0,001 | 128.267,9 | 1,8% |
| Pruebas complementarias | 43,1% | 0,8 | 29,2 ± 47,3 | 55,4% | 1,1 | 39,5 ± 52,5 | 47,0% | 0,9 | 32,5 ± 49,2 | < 0,001 | 101.586,2 | 1,5% |
| Prescripción farmacéutica | 100,0% | 1.183,9 ± 1.166,4 | 100,0% | 1.505,9 ± 1.421,8 | 100,0% | 1.285,5 ± 1.261,3 | < 0,001 | 4.023.674,1 | 57,7% | |||
| Costes en atención especializada | 112,3 ± 501,8 | 193,8 ± 545,0 | 138,0 ± 517,1 | < 0,001 | 431.951,2 | 6,2% | ||||||
| Visitas médicas | 8,8% | 0,5 | 53,9 ± 186,2 | 20,6% | 1,0 | 97,4 ± 249,7 | 13,2% | 0,7 | 67,6 ± 209,2 | < 0,001 | 211.578,1 | 3,0% |
| Días de hospitalización | 1,1% | 0,1 | 42,9 ± 425,6 | 6,3% | 0,3 | 81,2 ± 436,6 | 3,1% | 0,2 | 55,0 ± 429,4 | 0,020 | 172.091,7 | 2,5% |
| Urgencias | 11,0% | 0,1 | 15,5 ± 49,2 | 11,6% | 0,1 | 15,2 ± 44,2 | 11,2% | 0,1 | 15,4 ± 47,6 | NS | 48.281,4 | 0,7% |
| Costes no sanitarios | 5,5% | 0,6 | 35,1 ± 550,0 | 17,3% | 2,6 | 139,8 ± 1.116,2 | 9,8% | 1,3 | 68,1 ± 775,7 | < 0,001 | 213.189,6 | 3,1% |
| Costes totales (sanitarios/no sanitarios) | 2.028,6 ± 1.661,8 | 2.662,2 ± 2.143,1 | 2.228,6 ± 1.850,7 | < 0,001 | 6.975.521,8 | 100,0% | ||||||
| Modelo de costes corregidosa | Diferencia | |||||||||||
| Costes sanitarios totales | 2.101,5 | 2.517,4 | –415,9 | < 0,001 | ||||||||
| IC del 95% | 2.024,1-2.179,1 | 2.391,2-2.643,5 | ||||||||||
| Costes en atención primaria | 1.987,6 | 2.331,3 | –343,7 | < 0,001 | ||||||||
| IC del 95% | 1.917,5-2.057,6 | 2.217,3-2.445,3 | ||||||||||
| Costes en atención especializada | 113,9 | 186,2 | –72,3 | 0,006 | ||||||||
| IC del 95% | 86,9-141,1 | 141,9-230,1 | ||||||||||
| Costes no sanitarios | 29,1 | 88,1 | –59 | 0,046 | ||||||||
| IC del 95% | 11,9-69,8 | 21,8-154,2 | ||||||||||
| Costes totales (sanitarios/no sanitarios) | 2.130,6 | 2.605,4 | –474,8 | < 0,001 | ||||||||
| IC del 95% | 2.041,18-2.220,08 | 2.459,9-2.750,9 | ||||||||||
IC: intervalo de confianza; NS: no significativo; pa: significación estadística entre el coste de los 2 grupos de estudio.
Valores expresados en porcentaje o media ± desviación estándar.
Modelo de ANCOVA: cada prueba F contrasta el efecto simple de la presencia en cada combinación de dosis del resto de los efectos mostrados. Estos contrastes se basan en las comparaciones por pares, linealmente independientes, entre las medias marginales estimadas. Covariables: edad, BUR e índice de Charlson. Componente fijo: sexo. Uso: porcentaje de uso de recursos entre todos los pacientes. PU: promedio/unitario del uso recursos. Los costes no sanitarios se refieren a los días de pérdida de productividad laboral.
El subgrupo de pacientes diabéticos (N=641; 20,5%; IC del 95%, 19,1-21,9%), en comparación con los no diabéticos, presentó un mayor promedio unitario del coste total (3.124,8 € frente a 1.997,8 €; p<0,001); estos pacientes mostraron mayor edad (61,9 frente a 54,2 años; p=0,001), carga de morbilidad (3,1 frente a 2,8 BUR; p<0,001) y SM (63,2 frente a 20,1%; p<0,001).
DiscusiónLos resultados generales del estudio muestran una prevalencia de gota del 3,3%; con un mayor predominio en varones y con 1-2 ataques agudos. Estas características son similares a la mayoría de los estudios revisados de ámbito poblacional3,4. Aunque cabe destacar que la propia historia natural de la enfermedad puede dificultar su diagnóstico, especialmente en AP y en los servicios de urgencias, donde la presencia del ataque agudo articular puede enmascarar otras entidades nosológicas dificultando el diagnóstico diferencial3,6-8. Según los criterios del NCEP14, la prevalencia del SM fue del 28,8%, destacando su asociación con la obesidad, la hipertensión arterial y los niveles basales elevados de ácido úrico. Nuestros resultados son similares a los datos de otros estudios revisados7,8,11-13. Cabe considerar que en nuestro país la prevalencia del SM y su asociación con la gota podrían ser más altas. Algunos autores la sitúan en cifras alrededor del 50% en pacientes mayores de 60 años y del 35% en pacientes con gota en población general29.
En el estudio, el promedio/unitario del coste fue de 2.228,6 €. En el modelo corregido el promedio/unitario de los costes totales por paciente fueron de 2.130,6 € (1-2 ataques) frente a 2.605,4 € (≥ 3 ataques). En todos los componentes del coste los resultados fueron mayores en el grupo con ≥ 3 ataques y en el subgrupo de pacientes diabéticos. En este aspecto, para Brook et al.21 el coste total anual en una cohorte de empleados con gota fue de $ 6.870, 2 veces superior a los pacientes en ausencia de gota; destacando que solo el 1% de los empleados con gota generaron el 20% de los costes. Wu et al.18 en un excelente trabajo realizado en pacientes ancianos, en el que relacionan los niveles de ácido úrico sérico con el coste de los pacientes con gota fue de $ 2,555. En el estudio realizado por Mould-Quevedo et al.19, sobre las principales enfermedades reumáticas inflamatorias desde la perspectiva del paciente en México, el coste/anual fue de $ 1.006, mayoritariamente en los costes ambulatorios. Nuestros resultados estarían en consonancia con los aportados por Wu et al.18, donde la metodología empleada fue similar a la descrita en el presente trabajo, aun teniendo presente que sus pacientes eran mayores y seguramente con mayor comorbilidad. Los otros 2 estudios mencionados con anterioridad (Wu et al.18 y Mould-Quevedo et al.19) son de difícil comparación, puesto que están realizados con pacientes de mayor edad y, además, con metodologías de trabajo distintas. Todos los estudios son coincidentes en el peso de los costes ambulatorios. En nuestro estudio, el 96,9% fueron costes sanitarios directos y los mayores costes fueron debidos a las visitas de seguimiento y a la medicación. En este aspecto, un mayor seguimiento de estos pacientes en la AP podría reducir los costes de la enfermedad; aunque es indudable que la morbilidad asociada, la falta de cumplimiento y los posibles factores predisponentes pueden repercutir en el uso de los recursos y del coste de estos pacientes30.
Cabe destacar los escasos costes en pérdida de productividad laboral (bajas laborales) que genera la gota. Una posible explicación se debe a que se utilizó una fuente de información conservadora (el salario mínimo interprofesional en lugar del coste salarial medio, lo que ya en sí mismo es una limitación del estudio); además, es posible que se produzcan bajas de corta duración (inicios de tratamiento o descompensaciones) que no se registren en los partes de incapacidad laboral. Las evidencias disponibles en este terreno de los costes estarían en consonancia con Ferraz20 y Joish31, donde evidencian que los pacientes con ataques agudos de artritis gotosa pierden un promedio de 3-5 días de trabajo al año, ocasionando importantes repercusiones económicas por pérdidas de productividad laboral en algunos casos poco cuantificadas. Aunque, en general, los pacientes con 1-2 ataques son más jóvenes y, por tanto, tienen menor frecuencia de la mayoría de las enfermedades asociadas, ello por sí solo puede ser lo que determina el menor coste de la enfermedad en esos pacientes.
Las posibles limitaciones del estudio inciden en la categorización de la enfermedad, el posible sesgo de clasificación de los pacientes (por exceso) y en la medida operativa de los costes, atribuibles al sistema de información desarrollado. Por tanto, en el artículo se muestran las limitaciones propias de los estudios retrospectivos; como por ejemplo, el infrarregistro de los datos o la posible variabilidad de los profesionales y de los pacientes al ser un diseño observacional. Además, el número de ataques agudos atendidos puede verse comprometido debido a la posible automedicación de los pacientes. El estudio detalla el uso de los recursos y los costes asociados a los pacientes con artritis gotosa en situación de práctica clínica habitual. No obstante, cabe destacar que sin una adecuada estandarización de las metodologías en cuanto a las características de los pacientes, así como en el número y la medida de las variables estudiadas, los resultados obtenidos deben de interpretarse con prudencia obligándonos a ser cautelosos en la validez externa de los resultados.
Futuras investigaciones hacen necesario disponer de estudios de coste/efectividad y de eficacia diagnóstica y de tratamiento, además de replicar el estudio en otras organizaciones sanitarias. Por otra parte, la propiedad inflamatoria de los cristales no está aún completamente aclarada; podría estar vinculada a la habilidad de ligar inmunoglobulinas, complemento y lípidos. Se necesitan ensayos clínicos a largo plazo para probar la hipótesis de que la terapia hipouricemiante puede reducir el riesgo cardiovascular en estos pacientes. Tampoco se ha establecido una pauta terapéutica derivada de ensayos clínicos en el tratamiento de la inflamación articular aguda. El éxito de la atención a los pacientes con enfermedades crónicas como la gota debería de basarse en intervenciones de equipos pluridisciplinarios que promuevan intervenciones efectivas en las que los pacientes estén altamente comprometidos en su autocuidado. Es indudable que el diagnóstico y el tratamiento de la gota deben exigir una mayor estrategia de intervención y de seguimiento por parte de nuestros profesionales sanitarios. En conclusión, la gota está asociada a una elevada morbilidad, SM y consumo de recursos sanitarios. El estudio proporciona datos útiles sobre el coste de la gota en España. Los costes más destacados corresponden al seguimiento ambulatorio de los pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
AutoríaA. Sicras y R. Navarro realizaron la búsqueda bibliográfica, obtuvieron los datos, realizaron el análisis y la interpretación de los resultados iniciales. Todos los autores aportaron ideas, interpretaron los hallazgos y revisaron los borradores del manuscrito. Todos los autores aprobaron la versión final del artículo. A. Sicras es el responsable principal del estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los diferentes profesionales sanitarios de la organización.