Hasta el 1 de septiembre de 2008 se han registrado 9.352 pacientes procedentes de 100 centros que han aportado información sobre 12.136 tratamientos biológicos. El tratamiento se suspendió en 4.281 (35%) ocasiones: en igual proporción como resultado de un acontecimiento adverso (1.782 [42%]) que de ineficacia o pérdida de eficacia (1.816 [42%]). Se han comunicado 6.814 acontecimientos adversos, de los cuales el más frecuente es la infección (2.656 [39%]), seguido de las alteraciones relacionadas con la administración (1.009 [15%]) y de los trastornos de la piel y del tejido subcutáneo (521 [8%]).
As of September 1st, 2008 BIOBADASER has included 9352 patients from 100 centers that provide information on 12,136 treatments with biological therapies. Treatment was discontinued in 4281 (35%) occasions, in the same proportion as a result of an adverse event [1,782 (42%)] and inefficiency or loss of effectiveness [1,816 (42%)]. There have been reported 6814 adverse events, of which the most frequent are infections [2,656 (39%)], followed by disorders related to the administration [1,009 (15%)] and disorders of the skin and subcutaneous tissue [521 (8%)].
Desde su creación en febrero del año 2000, BIOBADASER (Registro Español de Acontecimientos Adversos de Terapias Biológicas en Enfermedades Reumáticas), sin variar sus objetivos, ha experimentado algunos cambios, algunos no bien entendidos pero todos encaminados a mejorar su calidad. En cuanto al sistema de recogida de la información, se ha pasado de los faxes del principio a BIOBADASER 2.0, que permite a los participantes descargar todos los datos por centro, entre otras cosas. Asimismo, se ha pasado de un registro abierto a todos los centros a un registro que ahora se nutre sólo de 14 centros, lo que ha permitido mejorar la monitorización que se hace in situ en todos los centros e incluir información sobre comorbilidad y tratamientos concomitantes en todos los pacientes y no sólo en los que presentaban acontecimientos adversos. Los sujetos incluidos o seguidos desde junio de 2006 además firmaron un consentimiento informado para que se pudiera realizar una comprobación externa de su estado vital y de sus posibles ingresos no identificados en la historia clínica y que, por tanto, no se hubieran comunicado a BIOBADASER. Por último, hay 2 cambios que han supuesto un gran avance: primero, la incorporación de la tasa de actividad de la enfermedad 28 (DAS28) o del índice de actividad de la espondilitis anquilosante de Bath (BASDAI) en los sujetos con artritis reumatoide y espondilitis anquilosante, respectivamente, como variables basales del tratamiento; segundo, la utilización del diccionario MedDRA (Diccionario Médico para las Actividades de Regulación de Drogas), que se ha implementado en la aplicación en lugar del tedioso diccionario de la Organización Mundial de la Salud. Todos estos cambios han contribuido significativamente a mejorar la calidad de los datos recogidos y a la certidumbre de los resultados obtenidos, hasta el punto que BIOBADASER se ha convertido en un registro de referencia, modelo para otros, como el BIOBADADERM (de la Academia Española de Dermatología y Venereología) o el BIOBADAMERICA (de PANLAR) y participante en la Biologics Taskforce de EULAR. Cabe destacar, además, que todo esto no hubiera sido posible sin la participación activa de muchísimos reumatólogos españoles que, con su entusiasmo y profesionalidad, han sabido aunar esfuerzos para un fin común, que no es otro que la seguridad del paciente.
Si bien los informes actualizados proporcionan una información muy relevante, es el análisis detallado de BIOBADASER el que está contribuyendo al conocimiento ya no sólo de la seguridad de los tratamientos biológicos, sino indirectamente también al de las enfermedades. Los análisis de BIOBADASER se inician a petición de reumatólogos, del comité científico o de las personas que trabajan directamente con el registro, de la Agencia del Medicamento o de otros especialistas. Muchos de estos análisis, realizados en la Unidad de Investigación de la Fundación Española de Reumatología y cedidos al investigador que los solicitaba, no han salido aún a la luz o lo han hecho en forma de pósters en congresos, pero otros han marcado claros hitos de información. Vale la pena reseñar los artículos sobre tuberculosis1 y sobre el efecto de las recomendaciones de la Sociedad Española de Reumatología para evitar la reactivación de ésta con el uso de tratamientos biológicos2,3, sobre el uso de tratamientos antagonistas del factor de necrosis tumoral (TNF) en espondiloartritis4, sobre el cambio entre antagonistas del TNF5, sobre la mortalidad observada6 o sobre las reacciones relacionadas con la administración7, así como los pósters sobre embarazos, infecciones, cáncer o neumonitis.
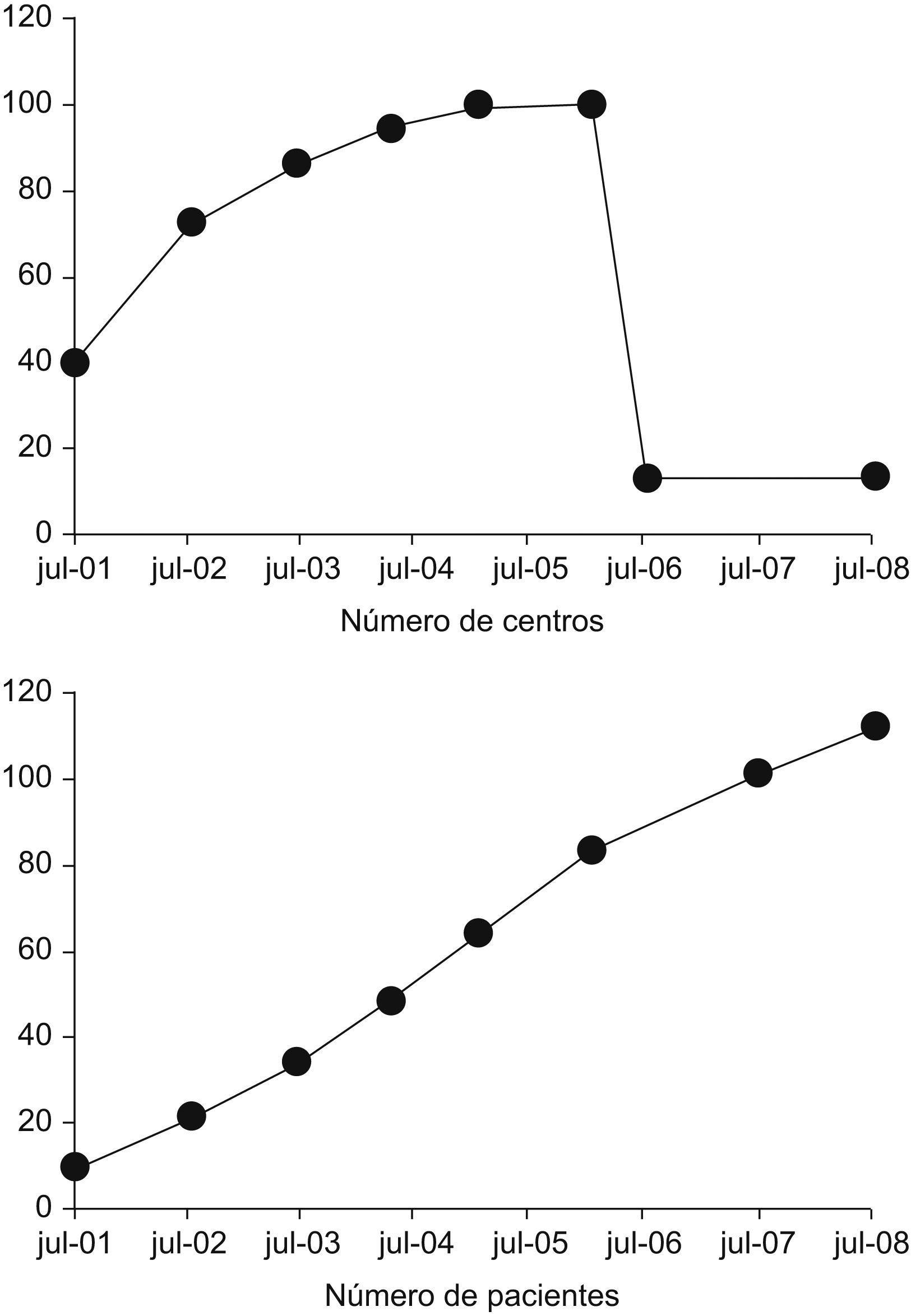
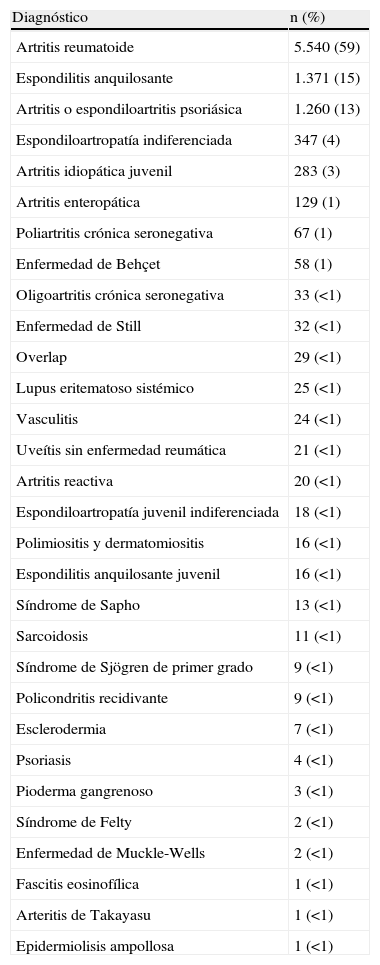
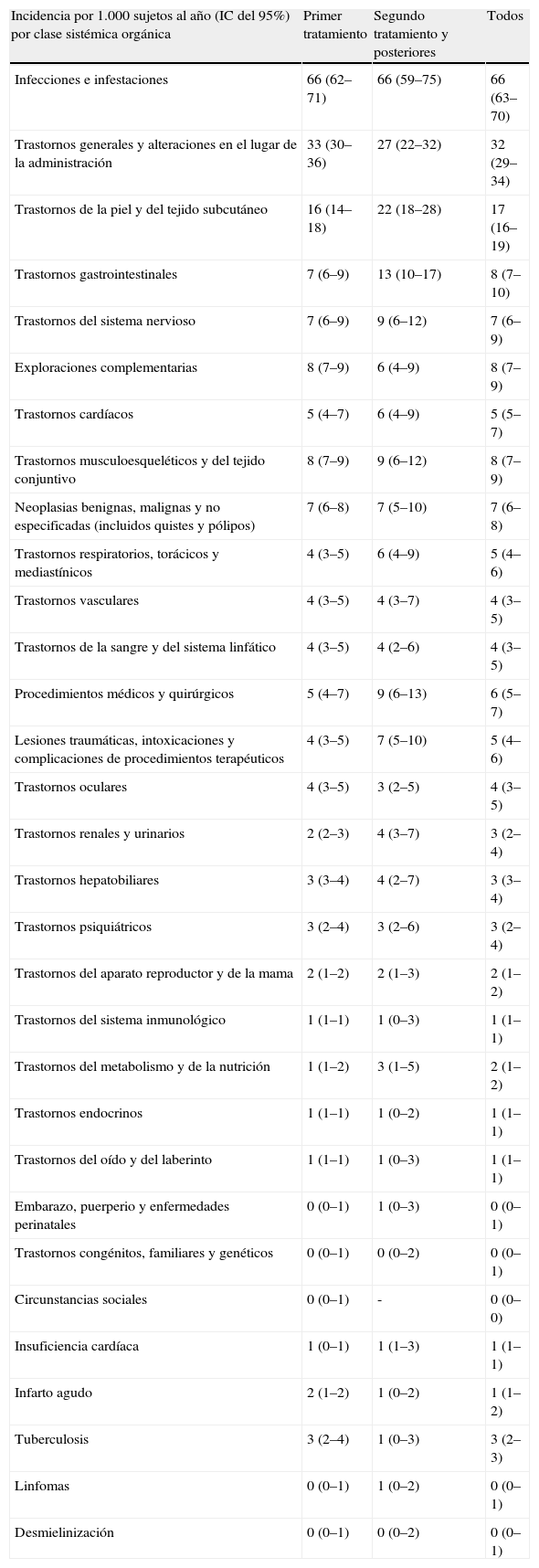
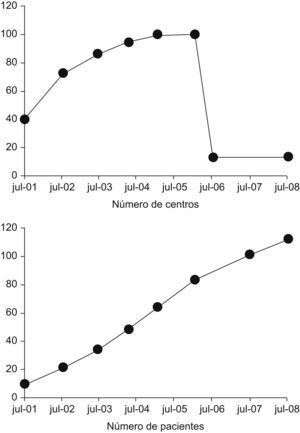
BIOBADASER al 1 de septiembre del año 2008En BIOBADASER hay registrados 9.352 pacientes, de los cuales 5.921 (63%) son mujeres, con una edad media actual de 55 ± 15 años y una edad al inicio del tratamiento biológico de 50 ± 15 años (duración media de la enfermedad de 11 ± 8 años). Si bien el número de centros ha disminuido drásticamente, el número de pacientes continúa incrementándose al mismo ritmo que antes (fig. 1). En cuanto a los diagnósticos de los sujetos con tratamientos biológicos, sigue siendo la artritis reumatoide el más frecuente, pero cada vez es más importante el grueso de sujetos con otros diagnósticos (tabla 1).
Diagnósticos de los pacientes incluidos en BIOBADASER hasta el 1 de septiembre de 2008
| Diagnóstico | n (%) |
| Artritis reumatoide | 5.540 (59) |
| Espondilitis anquilosante | 1.371 (15) |
| Artritis o espondiloartritis psoriásica | 1.260 (13) |
| Espondiloartropatía indiferenciada | 347 (4) |
| Artritis idiopática juvenil | 283 (3) |
| Artritis enteropática | 129 (1) |
| Poliartritis crónica seronegativa | 67 (1) |
| Enfermedad de Behçet | 58 (1) |
| Oligoartritis crónica seronegativa | 33 (<1) |
| Enfermedad de Still | 32 (<1) |
| Overlap | 29 (<1) |
| Lupus eritematoso sistémico | 25 (<1) |
| Vasculitis | 24 (<1) |
| Uveítis sin enfermedad reumática | 21 (<1) |
| Artritis reactiva | 20 (<1) |
| Espondiloartropatía juvenil indiferenciada | 18 (<1) |
| Polimiositis y dermatomiositis | 16 (<1) |
| Espondilitis anquilosante juvenil | 16 (<1) |
| Síndrome de Sapho | 13 (<1) |
| Sarcoidosis | 11 (<1) |
| Síndrome de Sjögren de primer grado | 9 (<1) |
| Policondritis recidivante | 9 (<1) |
| Esclerodermia | 7 (<1) |
| Psoriasis | 4 (<1) |
| Pioderma gangrenoso | 3 (<1) |
| Síndrome de Felty | 2 (<1) |
| Enfermedad de Muckle-Wells | 2 (<1) |
| Fascitis eosinofílica | 1 (<1) |
| Arteritis de Takayasu | 1 (<1) |
| Epidermiolisis ampollosa | 1 (<1) |
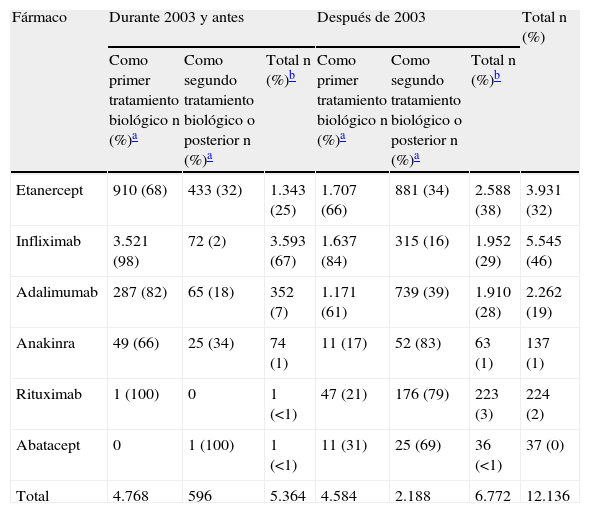
En total se ha recogido información de 12.136 tratamientos, de los cuales 2.784 (23%) corresponden al segundo o posterior tratamiento biológico utilizado. La tabla 2 muestra la distribución por tratamientos biológicos y por orden de tratamiento (primero o posterior); aquí llama la atención, o se confirma, que el año de introducción en el mercado de los tratamientos biológicos determina la mayor o menor utilización y en qué orden se administraron.
Frecuencia de fármacos biológicos registrados en BIOBADASER por orden de tratamiento
| Fármaco | Durante 2003 y antes | Después de 2003 | Total n (%) | ||||
| Como primer tratamiento biológico n (%)a | Como segundo tratamiento biológico o posterior n (%)a | Total n (%)b | Como primer tratamiento biológico n (%)a | Como segundo tratamiento biológico o posterior n (%)a | Total n (%)b | ||
| Etanercept | 910 (68) | 433 (32) | 1.343 (25) | 1.707 (66) | 881 (34) | 2.588 (38) | 3.931 (32) |
| Infliximab | 3.521 (98) | 72 (2) | 3.593 (67) | 1.637 (84) | 315 (16) | 1.952 (29) | 5.545 (46) |
| Adalimumab | 287 (82) | 65 (18) | 352 (7) | 1.171 (61) | 739 (39) | 1.910 (28) | 2.262 (19) |
| Anakinra | 49 (66) | 25 (34) | 74 (1) | 11 (17) | 52 (83) | 63 (1) | 137 (1) |
| Rituximab | 1 (100) | 0 | 1 (<1) | 47 (21) | 176 (79) | 223 (3) | 224 (2) |
| Abatacept | 0 | 1 (100) | 1 (<1) | 11 (31) | 25 (69) | 36 (<1) | 37 (0) |
| Total | 4.768 | 596 | 5.364 | 4.584 | 2.188 | 6.772 | 12.136 |
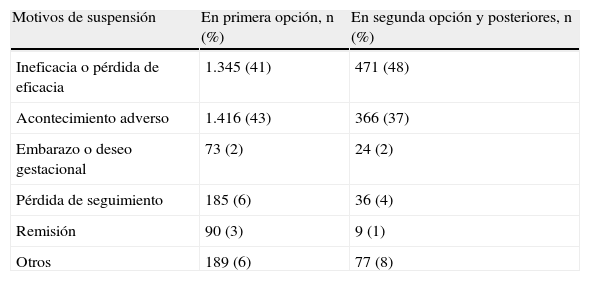
El tratamiento se suspendió en 4.281 (35%) ocasiones: en igual proporción como resultado de un acontecimiento adverso (1.782 [42%]) que de ineficacia o pérdida de eficacia (1.816 [42%]). La supervivencia del fármaco (o tasa de retención) fue del 78% (intervalo de confianza [IC] del 95%: rango de 77 a 79) en el primer año: ligeramente superior para los tratamientos biológicos utilizados en primer orden (el 79% [rango de 78 a 80]) que en segundo orden o posterior (el 72% [rango de 70 a 74]; p<0,001), aunque las causas de suspensión no variaron considerablemente respecto del orden en que se utilizó el tratamiento biológico (tabla 3).
Motivos de suspensión de los tratamientos biológicos, total y de acuerdo con el orden de tratamiento
| Motivos de suspensión | En primera opción, n (%) | En segunda opción y posteriores, n (%) |
| Ineficacia o pérdida de eficacia | 1.345 (41) | 471 (48) |
| Acontecimiento adverso | 1.416 (43) | 366 (37) |
| Embarazo o deseo gestacional | 73 (2) | 24 (2) |
| Pérdida de seguimiento | 185 (6) | 36 (4) |
| Remisión | 90 (3) | 9 (1) |
| Otros | 189 (6) | 77 (8) |
Se han comunicado 6.814 acontecimientos adversos, de los cuales el más frecuente es la infección (2.656 [39%]), seguido de las alteraciones relacionadas con la administración (1.009 [15%]) y de los trastornos de la piel y del tejido subcutáneo (521 [8%]). La incidencia de acontecimientos adversos de cualquier gravedad (IC del 95%) por 1.000 sujetos al año de seguimiento fue de 171 (rango de 165 a 178): de 168 (rango de 161 a 174) con el primer tratamiento biológico y de 188 (rango de 173 a 203) con el segundo o posterior tratamiento. La incidencia de acontecimientos graves (que causaran hospitalización, muerte o secuelas) fue de 40 (rango de 37 a 42): de 38 (rango de 35 a 41) con el primer tratamiento biológico y de 49 (rango de 42 a 56) con el segundo o posterior tratamiento. La incidencia de acontecimientos adversos mortales fue de 6 (rango de 5 a 7) por 1.000 sujetos al año de seguimiento: de 5 (rango de 5 a 7) con el primer tratamiento biológico y de 7 (rango de 5 a 10) con el segundo o posterior tratamiento. La tabla 4 muestra la incidencia de acontecimientos adversos por tipo, órgano o sistema afectado, así como algunos tipos concretos de interés, como cáncer o insuficiencia cardíaca, en total y por orden de tratamiento.
Incidencia por 1.000 sujetos al año de seguimiento de acontecimientos adversos de tratamientos biológicos según el tipo, órgano o sistema afectado y de acontecimientos seleccionados, en total y por orden de tratamiento
| Incidencia por 1.000 sujetos al año (IC del 95%) por clase sistémica orgánica | Primer tratamiento | Segundo tratamiento y posteriores | Todos |
| Infecciones e infestaciones | 66 (62–71) | 66 (59–75) | 66 (63–70) |
| Trastornos generales y alteraciones en el lugar de la administración | 33 (30–36) | 27 (22–32) | 32 (29–34) |
| Trastornos de la piel y del tejido subcutáneo | 16 (14–18) | 22 (18–28) | 17 (16–19) |
| Trastornos gastrointestinales | 7 (6–9) | 13 (10–17) | 8 (7–10) |
| Trastornos del sistema nervioso | 7 (6–9) | 9 (6–12) | 7 (6–9) |
| Exploraciones complementarias | 8 (7–9) | 6 (4–9) | 8 (7–9) |
| Trastornos cardíacos | 5 (4–7) | 6 (4–9) | 5 (5–7) |
| Trastornos musculoesqueléticos y del tejido conjuntivo | 8 (7–9) | 9 (6–12) | 8 (7–9) |
| Neoplasias benignas, malignas y no especificadas (incluidos quistes y pólipos) | 7 (6–8) | 7 (5–10) | 7 (6–8) |
| Trastornos respiratorios, torácicos y mediastínicos | 4 (3–5) | 6 (4–9) | 5 (4–6) |
| Trastornos vasculares | 4 (3–5) | 4 (3–7) | 4 (3–5) |
| Trastornos de la sangre y del sistema linfático | 4 (3–5) | 4 (2–6) | 4 (3–5) |
| Procedimientos médicos y quirúrgicos | 5 (4–7) | 9 (6–13) | 6 (5–7) |
| Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos | 4 (3–5) | 7 (5–10) | 5 (4–6) |
| Trastornos oculares | 4 (3–5) | 3 (2–5) | 4 (3–5) |
| Trastornos renales y urinarios | 2 (2–3) | 4 (3–7) | 3 (2–4) |
| Trastornos hepatobiliares | 3 (3–4) | 4 (2–7) | 3 (3–4) |
| Trastornos psiquiátricos | 3 (2–4) | 3 (2–6) | 3 (2–4) |
| Trastornos del aparato reproductor y de la mama | 2 (1–2) | 2 (1–3) | 2 (1–2) |
| Trastornos del sistema inmunológico | 1 (1–1) | 1 (0–3) | 1 (1–1) |
| Trastornos del metabolismo y de la nutrición | 1 (1–2) | 3 (1–5) | 2 (1–2) |
| Trastornos endocrinos | 1 (1–1) | 1 (0–2) | 1 (1–1) |
| Trastornos del oído y del laberinto | 1 (1–1) | 1 (0–3) | 1 (1–1) |
| Embarazo, puerperio y enfermedades perinatales | 0 (0–1) | 1 (0–3) | 0 (0–1) |
| Trastornos congénitos, familiares y genéticos | 0 (0–1) | 0 (0–2) | 0 (0–1) |
| Circunstancias sociales | 0 (0–1) | - | 0 (0–0) |
| Insuficiencia cardíaca | 1 (0–1) | 1 (1–3) | 1 (1–1) |
| Infarto agudo | 2 (1–2) | 1 (0–2) | 1 (1–2) |
| Tuberculosis | 3 (2–4) | 1 (0–3) | 3 (2–3) |
| Linfomas | 0 (0–1) | 1 (0–2) | 0 (0–1) |
| Desmielinización | 0 (0–1) | 0 (0–2) | 0 (0–1) |
IC: intervalo de confianza.
Para más información sobre BIOBADASER, se puede acudir a la página web http://biobadaser.ser.es.
Una peticiónBIOBADASER es un proyecto de la Sociedad Española de Reumatología (SER). Debéis hacerlo vuestro, barajar hipótesis y explotarlo como lo pueden hacer los que están más en contacto con el registro. El autor del presente trabajo no se cansará nunca de ofrecéroslo como algo vuestro.
Los autores agradecen en especial a todos aquellos que han tenido que lidiar con BIOBADASER desde adentro, entre los que se encuentran JJ Gómez-Reino, B Pérez Zafrilla, MA Descalzo, JM Barrio Olmos, MJ García Yébenes, J Maese, MJ Martínez Blasco y, como no podía ser de otra manera, a todos los que colaboran como grupo BIOBADASER: Agustí Sellas, Basilio Rodríguez y Mireia Barceló (Ciudad Sanitaria Vall d’Hebron); Laura Cebrián, María Montoro (Hospital Gregorio Marañón); Dolores Montesinos (Hospital Universitario Virgen Macarena); Eva Pérez-Pampín (Hospital Clínico Universitario de Santiago); Paloma Vela (Hospital General Universitario de Alicante); Olga Maiz (Hospital de Donostia-Edif. Guipuzcoa), Ana María Ortiz, (Hospital Universitario de La Princesa); Paloma Abreu, Isabel Granados (Hospital Ramón y Cajal); Francisco Javier Manero Ruiz, Chesús Beltrán, Eugenio Gimenez Úbeda, Fernando Jiménez Zorzo, Jesús Marzo, Marta Medrano, Ángela Pecondó (Hospital Universitario Miguel Servet); María Victoria Hernández, Raimon Sanmartí, Juan de Dios Cañete (Hospital Clinic I Provincial); Carlos Rodríguez Lozano, Antonio Naranjo, Soledad Ojeda, Félix Francisco Hernández, Celia Erausquin, Íñigo Rúa, (Hospital de Gran Canaria Dr. Negrín); Inmaculada Ureña, María Victoria Irigoyen, Laura Cano (Hospital General Carlos Haya); Ana Cruz Valenciano, Manuel Crespo Echeverria, Félix Cavero del Pozo (Hospital Severo Ochoa); Luis Francisco Linares (Hospital Virgen de la Arrixaca); Rosa Roselló Pardo, Carlos Vázquez Galeano (Hospital General San Jorge); Juan Carlos Vesga, Eduardo Cuende (Hospital Txagorritxu); Carmen Idalgo Tenorio (Hospital Virgen de las Nieves); Alexia de Juanes, Beatriz Joven, Javier García (Hospital 12 de Octubre); Delia Reina (Hospital de Bellvitge Princeps D’Espanya); Manuel Fernández Prada (Hospital General Universitario de Guadalajara); Joan Maymo Guarch (Imas. Hospital de L’Esperança y Hospital del Mar); Javier Calvo, Cristina Campos (Hospital General Universitario de Valencia); Isabel Ibero Díaz, Vega Jovani Casado (Hospital General de Elda); Trinidad Pérez Sandoval (Hospital Virgen Blanca); José Raúl Noguera Pons (Hospital General Universitario de Elche); Eduardo Rejón (Hospital Universitario de Valme); Raquel Almodóvar (Hospital Fundación Alcorcón); Manuel Rodríguez Gómez (Complejo Hospitalario de Ourense); Eduardo Collantes Estévez, María del Carmen Castro Villegas (Hospital Universitario Reina Sofia); José Ángel Cabezas Lefler (Complejo Hospitalario San Millán-San Pedro); Marta Larrosa Padro, Jordi Gratacos Masmitja, Enrique Casado (Consorci Hospitalari del Parc Tauli); María Teresa Ruiz Jimeno, Jaime Calvo Alén (Hospital Comarcal Sierrallana);María Ángeles Mora (Hospital Universitario de Canarias); Jesús Ibáñez Ruán (Policlínico Vigo, S.A. [Povisa]); Juan José García Borras, Rosa Negueroles, Luisa Muñoz, José Luis Valero, Desamparados Ybáñez (Hospital La Fe); Eva Tomero Muriel (Hospital General de Segovia); Amalia Sánchez-Andrade Fernández (Hospital Xeral-Calde); Encarnación Saiz Cuenca (Hospital General Morales Meseguer); Montserrat Centellas (Hospital de Mataró); Jordi Fiter Aresté, Luis Espadaler Poch (Hospital Son Dureta); Lucía Pantoja, María Valvanera Pinillos (Hospital del Bierzo); Julia García Consuegra, Rosa Merino (Hospital Infantil La Paz); Javier Rivera, Teresa González Hernández (Instituto Provincial de Rehabilitacion [IPR]); Vera Ortiz (Hospital Universitari Germans Trias I Pujol); Carmen Torres, Montserrat Corteguera (Hospital Nuestra Señora de Sonsoles); Javier Alegre (Hospital General Yagüe); Xavier Arasa (Hospital de Tortosa); Jordi del Blanco Barnusell (Hospital Sant Jaume de Calella); Anna Martínez Cristóbal (Hospital de La Ribera); Inmaculada Bañegil (Hospital de Mendaro); Ángel García Aparicio (Hospital Virgen de La Salud); Emilia Aznar (Hospital Reina Sofía); María Francisca Pina (Hospital Rafael Méndez); Miquel Ángel Belmonte, Juan Beltrán Fabregat (Hospital General de Castellón); Alberto Alonso Ruiz, Esther Uriarte Itzazelaia (Hospital de Cruces); Mauricio Minguez Vega, Gaspar Panadero Tendero (Hospital San Juan de Alicante); Miguel Ángel Abad Hernández, María Torresano (Hospital Virgen del Puerto); Ana Urruticoechea (Hospital Can Misses de Ibiza); José Ivorra (Hospital General de Onteniente y Lluis Alcanyis de Xátiva); Antonio Juan Mas; Jenaro Graña (Hospital Santa Teresa); Saúl Mario Gelman Aizen (Centre Hospitalari Manresa); José Carlos Rosas, Gregorio Santos, Raquel Martín (Hospital del S.V.S. de Villajoyosa); Cristina Hidalgo (Hospital de La Santísima Trinidad); Jaime Fernández Campillo; Víctor Eliseo Quevedo (Hospital Comarcal de Monforte); Isabel Rotes, Estefanía Moreno (Hospital de San Rafael).
BIOBADASER se desarrolla en colaboración con la División de Farmacoepidemiología y Farmacovigilancia de la Agencia Española de Medicamentos y Productos Sanitarios. Los siguientes laboratorios farmacéuticos con productos biológicos para las enfermedades reumáticas en el mercado apoyan económicamente el registro: Schering, Wyeth, Abbott, Roche y Bristol Myers Squibb. Según el acuerdo de colaboración, la aportación económica de todos es igual, y en ningún caso supera al doble de la aportación realizada por la SER o la AEMyPS (Agencia Española del Medicamento y Productos Sanitarios), lo que garantiza la independencia del registro.