El manejo de la artritis reumatoide ha tenido avances muy importantes en los últimos años. Las guías de práctica clínica requieren una actualización constante. Recientemente se han publicado diversas guías internacionales para el manejo farmacológico de la artritis reumatoide que difícilmente se adaptan a la realidad mexicana, en especial por la heterogénea disponibilidad de los medicamentos en las diversas instituciones del sector salud. Por ello, debido a la importancia de unificar el criterio de manejo con los tratamientos disponibles, el Colegio Mexicano de Reumatología decidió revisar las guías existentes e incorporar nueva evidencia actualizada y adaptada a la realidad del sistema de salud mexicano.
ObjetivoRevisar, actualizar y adaptar la guía del manejo farmacológico de la artritis reumatoide y emitir recomendaciones adaptadas al sistema de salud de México, de acuerdo con manejos disponibles hasta diciembre de 2012.
MétodoParticiparon en la elaboración de la guía 30 reumatólogos certificados con experiencia y juicio clínico. Las recomendaciones se basaron en niveles de evidencia de las guías de tratamiento previamente establecidas, ensayos clínicos controlados y guías estandarizadas para población adulta con artritis reumatoide.
ResultadosDurante la conformación del documento, cada grupo de trabajo estableció la evidencia existente sobre los diferentes temas a tratar según su campo de mayor experiencia clínica, siendo enriquecida por la opinión de los demás expertos. Al final, toda la evidencia y las decisiones tomadas se unificaron en un manuscrito, se desarrolló un algoritmo de tratamiento y se resumieron en tablas estandarizadas por medicamento.
ConclusionesLa actualización de la Guía Mexicana para el Tratamiento Farmacológico de la Artritis Reumatoide integra la mejor información disponible para la toma de decisiones y contextualiza su empleo al complejo y heterogéneo sistema de salud mexicano.
The pharmacologic management of rheumatoid arthritis has progressed substantially over the past years. It is therefore desirable that existing information be periodically updated. There are several published international guidelines for the treatment of rheumatoid arthritis that hardly adapt to the Mexican health system because of its limited healthcare resources. Hence, it is imperative to unify the existing recommendations and to incorporate them to a set of clinical, updated recommendations; the Mexican College of Rheumatology developed these recommendations in order to offer an integral management approach of rheumatoid arthritis according to the resources of the Mexican health system.
ObjectiveTo review, update and improve the available evidence within clinical practice guidelines on the pharmacological management of rheumatoid arthritis and produce a set of recommendations adapted to the Mexican health system, according to evidence available through December 2012.
MethodsThe working group was composed of 30 trained and experienced rheumatologists with a high quality of clinical knowledge and judgment. Recommendations were based on the highest quality evidence from the previously established treatment guidelines, meta-analysis and controlled clinical trials for the adult population with rheumatoid arthritis.
ResultsDuring the conformation of this document, each working group settled the existing evidence from the different topics according to their experience. Finally, all the evidence and decisions were unified into a single document, treatment algorithm and drug standardization tables.
ConclusionsThis update of the Mexican Guidelines for the Pharmacologic Treatment of Rheumatoid Arthritis provides the highest quality information available at the time the working group undertook this review and contextualizes its use for the complex Mexican health system.
La elaboración de la actualización de la Guía Mexicana para el Tratamiento Farmacológico de la Artritis Reumatoide tiene como meta mantener la vigencia de las recomendaciones establecidas por las guías previamente publicadas y ser un marco de referencia para la toma de decisiones clínicas sustentadas en la mejor evidencia disponible hasta la actualidad, teniendo como finalidad homologar las prácticas de tratamiento de la artritis reumatoide (AR) en el adulto con el objetivo de mejorar la calidad y la seguridad de la atención médica de dicho padecimiento.
JustificaciónLa AR constituye un problema de salud pública a nivel mundial debido a su alta prevalencia, a sus graves consecuencias funcionales y al alto impacto económico y social.
En México, se estima que la AR tiene una prevalencia del 1,6%1 y afecta principalmente al grupo etario con mayor capacidad laboral y productiva, lo que se ve reflejado en altos índices de discapacidad laboral y pensión por invalidez que generan un alto impacto en la economía, sin mencionar la disminución en la calidad de vida de los pacientes2.
Se estima que el costo médico directo en dólares de la AR en México es de $2.334, y el gasto de bolsillo de paciente es de $610. Se ha encontrado que el 15% del ingreso familiar se destina a gastos por AR, lo que se llega a considerar como gastos catastróficos en la economía familiar3. El costo médico directo anual por AR se estima en $5.9444.
Un tratamiento adecuado y oportuno aumenta la probabilidad de limitar la progresión del daño articular y, consecuentemente, mejorar la funcionalidad y la calidad de vida del paciente y disminuir el impacto socioeconómico que genera. Por eso, en México existe la necesidad de adaptar y difundir las recomendaciones sobre el tratamiento de la AR con base en las situaciones de la compleja realidad del sistema de salud mexicano.
En 2009, con la finalidad de mostrar la evidencia científica más actualizada y que ayudara a realizar una evaluación y un diagnóstico oportunos, así como orientar y estandarizar un tratamiento tanto farmacológico como no farmacológico efectivos basados en las mejores y más recientes evidencias científicas, fue elaborada una Guía de Práctica Clínica de Diagnóstico y Tratamiento de la Artritis Reumatoide del Adulto en México5. Sin embargo, debido a que los nuevos resultados de la investigación clínica proporcionan evidencias actualizadas que hacen necesaria la actualización de las mismas, el Colegio Mexicano de Reumatología decidió revisar las guías existentes e incorporar la nueva evidencia científica adoptando la base de la Guía Canadiense del tratamiento de la AR.
UsuariosLa actualización de la Guía Mexicana para el Tratamiento Farmacológico de la Artritis Reumatoide está dirigida a reumatólogos. Pudiera ser de utilidad para otros especialistas que eventualmente se involucran de manera interdisciplinaria en el manejo del paciente con AR.
MetodologíaConformación del grupo de trabajo- •
Agosto de 2012: reunión de expertos del Colegio Mexicano de Reumatología para definir los objetivos, evaluar el contenido de las recomendaciones y determinar el proceso de actualización a través de una metodología universal y consensuada para dicho objetivo.
- •
Septiembre 1.° de 2012: reunión de planeación donde se acordaron los temas relevantes y se hizo una selección dirigida de coordinadores con base en su pertenencia al Sistema Nacional de Investigadores, con experiencia en el tema, en el proceso de publicación, con balance geográfico, de género y posibles conflictos de interés. A cada uno de ellos se les solicitó que incorporasen a 3 reumatólogos a sus equipos tomando en cuenta, entre otros criterios, a los centros formadores de residentes, los diferentes sistemas de salud, la medicina privada, el perfil académico y las diferentes regiones del país.
- •
Septiembre 8 de 2012: se decidió adoptar y adaptar como base la Guía Canadiense del tratamiento de la AR, por ser una guía que resume las diferentes guías publicadas sobre el manejo de la AR6,7. Dicha guía se enriqueció con la incorporación de nuevas preguntas clínicas estructuradas que el grupo de coordinadores desarrolló de manera consensuada en dicha reunión.
Los participantes definieron los temas a evaluar y las preguntas a responder con base en los problemas más frecuentes de tratamiento que enfrenta el profesional de la salud, enfocado principalmente al tratamiento farmacológico de la AR en adultos.
Desarrollo de las recomendacionesProtocolo de búsquedaEl proceso de búsqueda abarcó: guías de práctica clínica (GPC), ensayos clínicos aleatorizados y metaanálisis, en el periodo comprendido entre enero de 2010 y septiembre de 2012, de documentos publicados en idioma inglés o español, en población adulta (mayores de 18años), sin considerar distinción de género.
La búsqueda se realizó en PubMed, Biblioteca Cochrane y sitios web especializados, y se realizó con el descriptor «Arthritis, Rheumatoid» en relación con los subencabezamientos MeSH «Therapy» y «Drug therapy».
Los sitios web especializados que se consultaron fueron los siguientes: National Guidelines Clearinghouse, Tripdatabase, NHS Evidence, Alberta Medical Association Guidelines, Australian Government, National Health and Medical Research Council, American College of Physicians, Scottish Intercollegiate Guidelines Network, Institute for Clinical Systems Improvement, Ministerio de Salud de Chile, Singapore MOH Guidelines, CMA Infobase, NZGG, NICE, Guía Salud y Canadian Rheumatology Association.
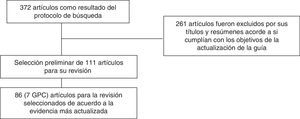
Como resultado de este proceso de búsqueda sistemática de información se obtuvieron 372 resultados. A continuación se establece el algoritmo del protocolo de selección de artículos:
Sin embargo, se trata de un documento basado en una revisión no sistemática que incluye recomendaciones prácticas sobre el tratamiento de la AR en México. No obstante son recomendaciones: no se evaluó el grado de acuerdo por los 30 reumatólogos que la realizaron, ni se sometió a evaluación por reumatólogos externos sobre cada una de las 37 situaciones clínicas a las que se da respuesta.
Desarrollo de evidencias y recomendacionesLa presentación de la evidencia y de las recomendaciones de la actualización de la presente guía corresponde a la información obtenida de GPC internacionales, donde los criterios utilizados para elegir fueron los utilizados por el Appraisal of Guidelines for Research and Evaluation II (AGREE II)8, de acuerdo con su calidad metodológica para su adopción y adaptación, tomando como punto de partida las siguientes guías:
| N.o | Título | Puntuación AGREE II (%) |
| 1 | The management of rheumatoid arthritis in adults. NICE | 83,3 |
| 2 | Management of early rheumatoid arthritis. SIGN | 81,9 |
| 3 | Canadian Rheumatology Association Recommendations for the Pharmacological Management of Rheumatoid Arthritis with Traditional and Biologic Disease-modifying Antirheumatic Drugs | 80,2 |
| 4 | Canadian Rheumatology Association Recommendations for the Pharmacological Management of Rheumatoid Arthritis with Traditional and Biologic Disease-modifying Antirheumatic Drugs: Part II Safety | 80,2 |
| 5 | EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying ant rheumatic drugs | 75,2 |
| 6 | EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases | 73,8 |
| 7 | Update of the clinical practice guidelines for the management of rheumatoid arthritis in Spain | 72,2 |
Las evidencias y recomendaciones provenientes de las GPC utilizadas como documentos de referencia mantuvieron la gradación de acuerdo con la escala original empleada. En el caso de no contar con GPC como documento de referencia, las evidencias y recomendaciones fueron elaboradas a través del análisis crítico de la literatura científica (revisiones sistemáticas, metaanálisis, ensayos clínicos aleatorizados y estudios observacionales), para lo cual se utilizó la escala del National Institute for Health and Care Excellence (NICE)9 para emitir el nivel de evidencia (NE) y el grado de recomendación (GR).
Los equipos de trabajo revisaron los siguientes temas: 1)analgésicos, antiinflamatorios no esteroideos y glucocorticoides; 2)papel de los fármacos antirreumáticos modificadores de la enfermedad (FARME) tradicionales; 3)terapia anti factor de necrosis tumoral (TNF, por sus siglas en inglés); 4)nuevos medicamentos biológicos (abatacept, rituximab, tocilizumab); 5)tofacitinib, y 6)seguridad y casos especiales.
Dos integrantes del equipo de seguridad (AGG, MVGR) hicieron un escrutinio de las publicaciones enviadas como resultado de la literatura identificada en la búsqueda, con el fin de seleccionar aquellos que contemplaran aspectos de seguridad y brindaran nueva información al respecto, identificando así 21 artículos. En 11 de ellos se encontraron datos que correspondieron a las preguntas, los mismos que son vertidos en las recomendaciones, independientemente de que estas hayan sido previamente establecidas en las de la Asociación Canadiense de Reumatología (CAR)6,7.
Además, se incluyeron 2 publicaciones más. Una correspondió a la publicación del Registro Mexicano (debido a que contiene datos nacionales y a que se publicó en el periodo en que se realizó la búsqueda): Terapia biológica: sobrevida y seguridad en padecimientos reumáticos. Resultados del Registro Nacional Biobadamex 1.010. La otra fue sobre una revisión sistemática acerca de embarazo y terapia biológica, publicado también durante el periodo de la búsqueda11.
Las evidencias fueron clasificadas de forma numérica y las recomendaciones con letras, ambas en orden decreciente de acuerdo al tipo de diseño del estudio y a la calidad metodológica.
Desarrollo de las recomendaciones- i.
Revisión de la evidencia siguiendo la metodología y el protocolo de búsqueda previamente propuesto.
- ii.
Reunión presencial para presentación, discusión y votación de cada una de las recomendaciones establecidas en la presente guía.
- iii.
Evaluación de las guías con método AGREE II.
- iv.
Realización de algoritmo de tratamiento farmacológico.
- v.
Resumen de información estandarizada por fármaco. Línea de tratamiento, estudios paraclínicos antes y durante su empleo, uso en monoterapia o combinaciones, tiempo para definir ajuste de dosis y retiro del medicamento, dosis mínima y máxima, contraindicaciones y su empleo en casos especiales. Incluye además información sobre ciclofosfamida, azatioprina y D-penicilamina (www.paracelsus.mx/algoritmo/anexo.docx).
- vi.
Evaluación y aprobación del documento final.
La guía está dirigida a personal de segundo y tercer nivel de atención con el objetivo de homogeneizar las acciones referentes al tratamiento farmacológico de la AR.
La aplicación de esta guía mejorará la efectividad, la seguridad y la calidad de la atención médica de esta población. Las diferentes fases de difusión e implementación de las recomendaciones clínicas deberán ser debidamente planeadas y supervisadas por las respectivas instancias normativas y regulatorias, así como de las agencias gubernamentales respectivas.
ExoneraciónEste documento presenta una serie de recomendaciones basadas en la mejor evidencia científica disponible en el momento de su desarrollo y pretende ser una herramienta útil que agilice la toma de decisiones para el tratamiento, de acuerdo con la mejor evidencia existente científica disponible, considerando siempre las necesidades y preferencias individuales del paciente, así como la disponibilidad de los recursos locales del consultorio y/o institución. Es importante considerar que los nuevos resultados de la investigación clínica proporcionarán evidencias actualizadas, por lo que de manera general, se recomienda llevar a cabo una actualización de las mismas cada 2años, y más ahora que los medicamentos biotecnológicos biocomparables inician su incorporación a nuestro sistema de salud.
Abreviaturas
AINE: antiinflamatorio no esteroideo
Anti-CCP: antipéptidos cítricos citrulinados
AR: artritis reumatoide
BH: biometría hemática
CLQ: cloroquina
EGO: examen general de orina
FARME: fármaco antirreumático modificador de la enfermedad
GR: grado de recomendación
HCQ: hidroxicloroquina
IFX: infliximab
IGRA: interferon gamma release assays
JAK: janus quinasa
LEF: leflunomida
MTX: metotrexato
NICE: National Institute for Health and Care Excellence
NE: nivel de evidencia
PFH: pruebas de función hepática
PFR: pruebas de función renal
PPD: derivado proteico purificado
QS: química sanguínea
RTX: rituximab
SSZ: sulfasalazina
TCZ: tocilizumab
TB: tuberculosis
TNF: factor de necrosis tumoral
VIH: virus de la inmunodeficiencia humana
La AR es una enfermedad autoinmune crónica que afecta al 1,6% de los adultos mexicanos1 y es más prevalente en mujeres, con una relación de 6:112. Si no se diagnostica de manera temprana ni se trata de manera oportuna puede llevar a la discapacidad, a la disminución de la calidad y la esperanza de vida, y puede producir elevados costos para el paciente, su familia y la sociedad13. El conocimiento de su fisiopatogenia ha producido un notable y continuo desarrollo farmacológico en los últimos 15años. Ello obliga a las sociedades médicas a revisar y actualizar periódicamente, de una manera crítica, el lugar que dichas opciones terapéuticas deberían tener en las decisiones médicas.
Las guías ofrecen al médico las evidencias actuales para proponer un tratamiento óptimo y más racional. El Colegio Mexicano de Reumatología, consciente de la necesidad de actualizar sus guías, presenta nueva información en forma de recomendaciones que incluyen a los últimos medicamentos aprobados para esta indicación y contextualiza su empleo tomando en cuenta la realidad del sistema de salud mexicano. Se analizan posibles barreras de implementación que pudiesen ser útiles para identificar limitaciones y tratar de optimizar el tratamiento de esta enfermedad.
El grupo de trabajo enfatiza la importancia del diagnóstico temprano y el tratamiento oportuno14 e identifica serias limitaciones que impiden que esos 2 conceptos sean una realidad en México. De la misma forma reconoce la relevancia del tratamiento por el médico reumatólogo con un objetivo que debe ser la remisión o al menos un estado de bajo nivel de actividad clínica15. Reconocemos la importancia del manejo integral de la AR, pero esta guía se enfoca en el tratamiento farmacológico, lo que pudiese ser una de sus limitantes.
Preguntas abordadas| Estrategias de tratamiento |
| 1. ¿Cuáles son los principios generales del manejo de la AR?2. ¿Cuáles son los principales objetivos del tratamiento? |
| Tratamiento con analgésicos, antiinflamatorios y glucocorticoides |
| 3. ¿Cuál es el papel de los analgésicos, antiinflamatorios no esteroideos, glucocorticoides y neuromoduladores en el tratamiento de la AR?4. ¿Se puede administrar un AINE o glucocorticoide con MTX? |
| Tratamiento con FARME convencional |
| 5. ¿Cuándo se debe iniciar tratamiento con un FARME?6. ¿Qué FARME debe ser considerado como de primera elección?7. ¿Qué estudios se requieren antes de iniciar tratamiento con MTX, así como durante su seguimiento?8. ¿Existe evidencia en la literatura de que la aplicación parenteral de MTX incremente la eficacia en comparación con la administración oral?9. En pacientes con neumopatía intersticial ¿es seguro el uso de MTX?10. ¿Cuándo deben combinarse los FARME tradicionales?11. ¿Existe evidencia en la literatura para pasar de terapia combinada con FARME a monoterapia una vez que la respuesta terapéutica ha sido alcanzada?12. ¿Cuál es el papel de la ciclofosfamida en el tratamiento de la AR? |
| Tratamiento con FARME biológico anti-TNF |
| 13. ¿Cuál es el papel de los anti-TNF en el tratamiento de la AR?14. En pacientes con AR activa que están utilizando anti-TNF ¿qué tiempo de lavado se requiere antes de cambiar a otro de diferente mecanismo de acción?15. ¿Cuándo y cómo hacer cambios entre TNF, hacia o desde otro mecanismo de acción?16. ¿Cuáles son los eventos adversos que deben ser considerados al administrar un anti-TNF?17. ¿Cuál debe ser el abordaje terapéutico en el paciente con hepatitisB que está recibiendo terapia con anti-TNF?18. ¿Cuál debe ser el abordaje terapéutico en el paciente con TB que está recibiendo terapia con anti-TNF?19. ¿Cuál debe ser el abordaje terapéutico en el paciente con VIH que está recibiendo terapia con anti-TNF?20. ¿Cuál es el riesgo de desarrollar neoplasias en el paciente con AR tratado con anti-TNF?21. ¿Cuál es el papel del certolizumab en el tratamiento de la AR?22. ¿Cuál es el papel del golimumab en el tratamiento de la AR? |
| Tratamiento con rituximab, abatacept y tocilizumab |
| 23. ¿Cuál es el papel del rituximab, el tocilizumab y abatacept en el tratamiento de la AR?24. ¿Existe alguna evidencia de que rituximab/tocilizumab/abatacept puedan ser usados como tratamiento de primera línea o como primer biológico en caso de falla a FARME tradicional?25. ¿Existe evidencia que establezca que rituximab/tocilizumab/abatacept tienen menor riesgo de TB comparado con los agentes anti-TNF? |
| Tratamiento con inhibidor de Jak |
| 26. ¿Tiene sustento el uso de tofacitinib en el tratamiento de la AR? ¿Ha demostrado beneficio clínico y/o imagenológico? |
| Recomendaciones de seguridad, farmacovigilancia y casos especiales |
| 27. En caso de programarse un embarazo en una paciente con AR, ¿con cuánto tiempo de anticipación es recomendado suspender MTX, otros FARME tradicionales y la terapia biológica?28. En aquellas pacientes con actividad de la enfermedad durante el embarazo ¿qué FARME tradicional puede ser recomendado?29. ¿Qué FARME tradicional puede ser usado durante la lactancia en pacientes con enfermedad activa?30. ¿Existe evidencia de que un FARME tradicional afecte la fertilidad?31. ¿Qué vacunas con agentes vivos atenuados o agentes inertes son recomendables en pacientes con AR? ¿Se pueden aplicar durante la enfermedad activa?32. En pacientes con infección por virus de hepatitisB, C o infección por VIH, ¿cuál de los FARME tradicionales y/o biológicos es recomendable utilizar?33. En pacientes con infecciones ¿qué FARME tradicionales y biológicos están indicados?34. ¿Es recomendable suspender leflunomida, MTX y otros FARME tradicionales y biológicos antes de una cirugía electiva y, de ser así, cuándo deberá ser reinstituido el fármaco?35. ¿Con qué terapias biológicas se recomienda el escrutinio para TB latente?36. ¿En qué pacientes debe considerarse el tratamiento profiláctico para TB?37. ¿Cuándo debe iniciarse el tratamiento con agentes biológicos en pacientes que están recibiendo profilaxis para TB? |
Se consideran 8 elementos claves que deben normar el manejo del paciente con AR:
- a)
Diagnóstico temprano.
- b)
Tratamiento oportuno.
- c)
Manejo por reumatólogo.
- d)
Dirigido hacia el objetivo (remisión o bajo nivel de actividad).
- e)
Individualizado.
- f)
Seguimiento periódico.
- g)
Considerar comorbilidad.
- h)
Adaptado a la realidad de la práctica clínica.
El principal objetivo del tratamiento en el paciente con AR es la remisión de la enfermedad o al menos alcanzar un bajo nivel de actividad clínica. La meta obligatoria en todo paciente es controlar la actividad de la enfermedad con el fin de mejorar los síntomas, disminuir el daño articular, prevenir la limitación funcional y mejorar la calidad de vida [NE: 1, GR: A]6,16.
3. ¿Cuál es el papel de los analgésicos, antiinflamatorios no esteroideos, glucocorticoides y neuromoduladores en el tratamiento de la AR?Los AINE son de utilidad para tratar el dolor y la inflamación. Sin embargo, no modifican el curso de la enfermedad [NE: 1++, GR: A]17.
Se utilizan al inicio de la enfermedad y deben ser prescritos en asociación con los FARME [NE: 1, GR: A]1. También se pueden utilizar en caso de una recaída y ante la persistencia de síntomas no controlados a pesar de existir una buena respuesta objetiva a un FARME. Los glucocorticoides en especial se usan como terapia «puente» en función del tiempo necesario para que el FARME alcance niveles terapéuticos eficaces, o bien durante una recaída [NE: 4, GR: D]6.
Los pacientes con riesgo de desarrollar úlceras gastroduodenales asociadas a AINE deben recibir gastroprotección a base de un inhibidor de bomba de protones [NE: 2, GR: A]17.
Cualquier AINE debe utilizarse a dosis máxima durante al menos una semana antes de considerar que existe un fracaso terapéutico. Una vez controlados los síntomas, el AINE debe utilizarse a la dosis mínima eficaz y durante el menor tiempo necesario, ya que los eventos adversos son dependientes de la dosis y de la duración del tratamiento [NE: 1++, GR: A]17.
En pacientes que continúan con actividad en pocas articulaciones a pesar de una buena respuesta terapéutica al régimen de FARME, los glucocorticoides de liberación lenta pueden infiltrarse de manera intraarticular con técnica estéril en cualquier momento de la enfermedad, descartando previamente un proceso de artritis séptica y durante un máximo de 3 a 4 veces al año [NE: 1, GR: A]18.
Debido a sus efectos secundarios, su uso deberá reducirse a la menor dosis posible y ser administrado por un corto periodo de tiempo, según como permita la actividad de la enfermedad [NE: 4, GR: D]18.
Cuando existe dolor grave, no hay respuesta a los tratamientos analgésicos previos y no existe opción quirúrgica, pueden administrarse analgésicos opiáceos. Existe evidencia limitada de la efectividad de los opiáceos orales débiles para el manejo analgésico efectivo en pacientes con AR, y desafortunadamente se presentan con frecuencia eventos adversos. Existe insuficiente evidencia del uso de opiáceos débiles por tiempos mayores de 6semanas o el papel potencial del uso de opiáceos potentes.
Si el dolor es de tipo neuropático, se pueden utilizar antidepresivos (amitriptilina o duloxetina) y algunos neuromoduladores (gabapentina, pregabalina o carbamacepina).
4. ¿Se puede administrar un AINE o glucocorticoide con MTX?El uso concomitante de MTX y AINE es seguro con la monitorización apropiada; el objetivo de su administración concomitante es alcanzar el objetivo terapéutico en el menor tiempo posible, e identificar los casos resistentes a la terapia inicial lo más pronto posible19.
En AR de reciente comienzo, el uso de dosis bajas de prednisona en combinación con FARME se asoció con un mayor índice de remisión clínica [NE: 1, GR: A]20.
5. ¿Cuándo se debe iniciar tratamiento con un FARME?Una vez establecido el diagnóstico de AR debe iniciarse un FARME. En México generalmente el diagnóstico no se hace de manera temprana [GR: A]21.
Existe evidencia de que la respuesta y la evolución de la enfermedad son superiores cuando se inicia un FARME en los primeros 3meses de evolución de la enfermedad comparado con el que se inicia después de los 12meses. Por lo anterior, se debe iniciar tratamiento con FARME lo antes posible [NE: 2b, GR: B]19.
6. ¿Qué FARME debe ser considerado como de primera elección?El MTX debe ser usado como FARME sintético de primera línea debido a que mejora la capacidad funcional y reduce la progresión radiográfica con un buen perfil de seguridad [NE: 1, GR: A]9.
Cuando haya contraindicación para MTX, se deberá utilizar LEF o SSZ [NE: 1a, GR: A]21.
La LEF, en estudios comparados con placebo, ha demostrado reducir la actividad de la enfermedad y retardar la progresión radiológica. Su eficacia fue observada al ser comparable a MTX en un metaanálisis [NE: 1+, GR: A]22.
La CLQ, la HCQ y la SSZ son fármacos que deben considerarse como de primera línea en las formas leves de la enfermedad o en la AR de inicio reciente sin factores pronósticos desfavorables (Factor Reumatoide [FR], o anti-CCP positivos) [NE: 1, GR: A]19.
Comentario del panelEl MTX, así como otros FARME (CLQ, SSZ), están ampliamente disponibles en los sistemas de salud pública en México. El panel considera que el uso de MTX como monoterapia inicial puede alcanzar éxito en un número importante de pacientes con suficiente factibilidad.
El grupo de trabajo sugiere que LEF puede ser recomendada como de primera línea en casos específicos en pacientes con contraindicación a MTX, especialmente en pacientes con manifestaciones extraarticulares graves; o bien en segunda línea de tratamiento en caso de falta de respuesta a MTX o en terapia combinada con este inductor de remisión. Se debe vigilar su riesgo de toxicidad hepática y gastrointestinal.
Otros FARME, como los antipalúdicos y la SSZ, pueden ser considerados en mujeres que deseen programar un embarazo.
En pacientes con infección por hepatitisB o C o por VIH puede considerarse el empleo de SSZ o antipalúdicos.
7. ¿Qué estudios se requieren antes de iniciar tratamiento con MTX así como durante su seguimiento?Antes del inicio de MTX debe realizarse BH, PFH, PFR y radiografía del tórax, así como pruebas de escrutinio para hepatitisB, C y VIH en pacientes con alto riesgo [NE: 2, GR: B]9. La monitorización postratamiento debe incluir BH [NE: 2]9, PFH [NE: 1]9 y PFR [NE: 2]9. La BH y la PFH se deben monitorizar cada 4semanas durante el tiempo de ajuste de la dosis, y después cada 8 a 12semanas. La dosis de MTX debe disminuirse en caso de elevación de transaminasas por arriba de 2 a 3 veces de su valor normal y suspenderse en casos de que esta medida no logre una reducción de las mismas. En casos excepcionales debe considerarse biopsia hepática si hay elevación persistente de las aminotransferasas por arriba de 2 a 3 veces sus valores normales superiores no atribuibles a otras causas y a pesar de la suspensión de MTX. Es importante descartar embarazo antes de iniciar MTX. Debe informarse al paciente en edad fértil y con vida sexual activa de los riesgos potenciales en caso de embarazo [NE: 4, GR: D]19.
8. ¿Existe evidencia en la literatura de que la aplicación parenteral de MTX incremente la eficacia en comparación con la administración oral?Debido a su mayor biodisponibilidad, la administración de MTX por vía parenteral tiene mayor eficacia que la administración por vía oral. Se sugiere considerar el cambio a la administración por vía parenteral en casos de respuesta aparentemente inadecuada o toxicidad gastrointestinal19.
9. En pacientes con neumopatía intersticial ¿es seguro el uso de MTX?La presencia de neumopatía crónica es una contraindicación relativa para el tratamiento con MTX, por lo que en caso de identificarse neumopatía intersticial en pacientes con AR que estén recibiendo MTX debe considerarse el cambio a otro FARME como LEF, CLQ, HCQ, SSZ o un agente biológico, ya sea de manera aislada o en combinación, de acuerdo al contexto individual del paciente23.
10. ¿Cuándo deben combinarse los FARME tradicionales?La terapia combinada con FARME deberá ser considerada una conducta justificada en las siguientes situaciones: en pacientes con enfermedad temprana activa de moderada a grave, con persistencia de sintomatología posterior a los 3meses del inicio de un FARME [NE: 1++, GR: A]21 y en presencia de varios factores de mal pronóstico21.
La terapia combinada con FARME debe incluir al MTX como fármaco eje. La terapia combinada de MTX con LEF, CLQ o HCQ y/o SSZ ha probado ser eficaz en la reducción de los signos o síntomas de enfermedad activa en casos de respuesta inadecuada a la monoterapia6.
La terapia combinada con LEF+MTX puede ser una opción terapéutica en pacientes con actividad articular persistente a pesar del uso de MTX como monoterapia. Existe evidencia que muestra superioridad en eficacia de LEF+MTX comparado con MTX+placebo [NE: 1++, GR: A]24.
La evidencia en la práctica clínica de la permanencia de la combinación LEF+MTX ha sido comparada con el uso de LEF como monoterapia, y se ha observado que alrededor de 65% de los pacientes permanecen con la combinación LEF+MTX a 30meses de su uso de manera similar con LEF como monoterapia, donde el 55% continuaron tratamiento en este lapso. En este mismo estudio el abandono por efectos adversos fue alrededor de 15%, lo que representa una tasa relevante pero no mayor a la esperada con monoterapia [NE: 2, GR: B]25.
En un metaanálisis se observó una mayor tasa de suspensión del tratamiento incluyendo toxicidad a fármacos en pacientes con AR recibiendo terapia combinada con FARME sintéticos que aquellos con un FARME como monoterapia. La terapia combinada que más se usó fue MTX+SSZ/antimaláricos26.
Comentario del panelLa terapia combinada con FARME sintético es una estrategia terapéutica ampliamente utilizada en México y tiene una mayor frecuencia de uso que los agentes biológicos, ya que hay una amplia disponibilidad y representa un menor gasto para las instituciones públicas de salud. Como experiencia clínica del grupo de trabajo, entre el 50 y el 70% de los pacientes con AR reciben en algún momento de su evolución tratamiento combinado con FARME sintéticos.
El grupo de trabajo considera que la combinación de 2 o más de los siguientes factores se asocia con mal pronóstico: persistencia de actividad moderada a grave de la enfermedad después de 3meses con monoterapia, falla a un segundo esquema de monoterapia con FARME sintético, erosiones tempranas en menos de un año de inicio de la enfermedad, títulos altos de factor reumatoide o anti-CCP positivos, o algunas manifestaciones extraarticulares como la neumopatía intersticial o la vasculitis reumatoide.
El grupo de trabajo recomienda que aunque existe evidencia que apoya la eficacia de la combinación MTX+LEF en pacientes con inadecuada respuesta a MTX, se recomienda que esta combinación sea considerada principalmente en los pacientes con actividad moderada a grave que han tenido falla a MTX. Se debe vigilar la toxicidad gastrointestinal y hepática. Cuando se prescribe esta terapia combinada se debe considerar la reducción de la dosis de uno de los 2 FARME, así como la administración concomitante de ácido fólico.
Barreras para su implementación. No existen barreras para su implementación. La mayor parte de los FARME sintéticos están disponibles en hospitales del sector público. Es recomendable vigilar la toxicidad que conlleva la terapia combinada con FARME sintéticos.
11. ¿Existe evidencia en la literatura para pasar de terapia combinada con FARME a monoterapia una vez que la respuesta terapéutica ha sido alcanzada?La recomendación general es usar el menor número de FARME posibles para obtener una mejoría significativa de la enfermedad y, una vez obtenida esta, puede intentarse el espaciamiento de la dosis de uno de los FARME hasta retirarlo.
12. ¿Cuál es el papel de la ciclofosfamida en el tratamiento de la AR?Se utiliza en pacientes con manifestaciones extraarticulares graves como neumonitis intersticial o vasculitis reumatoide. No se recomienda para tratar la actividad articular o la sinovitis debido a su alto perfil de toxicidad [NE: 1, GR: A]27.
13. ¿Cuál es el papel de los anti-TNF en el tratamiento de la AR?Están indicados en pacientes que tuvieron falla o intolerancia a FARME incluyendo un biológico [NE: 1, GR: A]6. El tratamiento con anti-TNF debe continuarse solo si existe una respuesta a los 6meses [NE: 2, GR: B]18.
14. En pacientes con AR activa que están utilizando anti-TNF ¿qué tiempo de lavado se requiere antes de cambiar a otro de diferente mecanismo de acción?La evidencia de esta recomendación es pobre. En relación con el tiempo de lavado, el clínico debería individualizar la decisión en casos de falta de respuesta de un anti-TNF antes de iniciar otro biológico con diferente mecanismo de acción.
15. ¿Cuándo y cómo hacer cambios entre TNF, hacia o desde otro mecanismo de acción?El tratamiento con anti-TNF debe continuarse solo si existe una respuesta adecuada a los 6meses [NE: 2, GR: B]18. En pacientes en quienes ha fallado a un anti-TNF debido a falta de eficacia a los 6meses o por toxicidad, se puede cambiar a otro anti-TNF [NE: 1, II]6, cambiar a otro biológico con diferente mecanismo de acción como RTX, abatacept y TCZ [NE: 1]6, o se puede añadir MTX u otro FARME en caso de que se haya administrado el anti-TNF como monoterapia inicial [NE: 1]6.
La posibilidad de buena respuesta a un segundo anti-TNF es mejor cuando el primer anti-TNF se suspendió por efectos secundarios y no por ineficacia [NE: 2+, GR: C]18.
Escalar dosis del anti-TNF no está recomendado [NE: 1, GR: A]18.
El tratamiento con RTX está recomendado como opción en casos de respuesta inadecuada, intolerancia o falla a FARME, incluyendo al menos un anti-TNF [NE: 2, GR: B]28. Sin embargo, RTX puede no ser tan eficiente en todos los pacientes con AR. Al menos un ensayo sugiere que son los pacientes seropositivos para factor reumatoide y anticuerpos anti-CCP los que responden mejor, mientras que los seronegativos no responden de forma tan evidente. La seropositividad deberá evaluarse en pacientes en quienes se esté considerando este cambio.
Adalimumab, etanercept, infliximab y abatacept en combinación con MTX son tratamientos recomendados en casos de inadecuada respuesta, intolerancia o falla a FARME, incluyendo al menos un biológico, y en quienes no pueden recibir RTX o este se tiene que retirar por efectos adversos [NE: 2, GR: B]29.
Los anti-TNF adalimumab, etanercept, infliximab, certolizumab pegol y el golimumab, en combinación con MTX, son recomendados como opción terapéutica en pacientes con actividad grave con DAS28 mayor de 5.1 y que han presentado falla a FARME convencionales, incluyendo el MTX [NE: 2, GR: B]30.
16. ¿Cuáles son los eventos adversos que deben ser considerados al administrar un anti-TNF?Existe un incremento de 2 veces el riesgo de desarrollar infecciones con el uso de anti-TNF. Los sitios más frecuentes de infecciones son las vías respiratorias, los huesos y las articulaciones, las vías urinarias y la piel [NE: 1, GR: A]31.
Los eventos adversos son más frecuentes en el grupo de tratamiento con biológicos, en especial en la reactivación de TB latente (OR: 4,68; IC95%: 1,18 a 18,6) en comparación con el grupo control. Certolizumab se ha asociado a un mayor riesgo de infecciones graves (OR: 2,04; IC95%: 1,43 a 2,91) comparado con otros anti-TNF. Abatacept, adalimumab, etanercept y golimumab demostraron tener menos eventos adversos que infliximab [NE: 1++, GR: A]32.
Con respecto a la TB (se considera un PPD o prueba de tuberculina positiva con induración de 5mm o más), datos disponibles mencionan un mayor riesgo de reactivación de la TB con infliximab que con etanercept [NE: 3]7.
La reactivación del virus de herpes zoster es común en pacientes durante el tratamiento con anti-TNF. Se han documentado pocos casos de varicela zoster [NE: 2, GR: B]7.
17. ¿Cuál debe ser el abordaje terapéutico en el paciente con hepatitisB que está recibiendo terapia con anti-TNF?En pacientes con virus de la hepatitisB, el tratamiento con anti-TNF se debe considerar en pacientes seleccionados y siempre con tratamiento antiviral y consultando dicha situación con el hepatólogo. El tratamiento debe ser iniciado 2 semanas antes del biológico y continuado durante 6 a 12meses7.
18. ¿Cuál debe ser el abordaje terapéutico en el paciente con TB que está recibiendo terapia con anti-TNF?El tratamiento profiláctico antituberculoso debe ser iniciado por lo menos 3semanas antes del inicio de anti-TNF [NE: 2, GR: B]6. El tratamiento consiste en rifampicina 10mg/kg/día más isoniazida 3 a 5mg/kg/día durante 3meses, una vez al día, o esquema alternativo de isoniazida 3 a 5mg/kg/día durante 9meses en pacientes con intolerancia a la rifampicina, cirrosis hepática y en pacientes ancianos [NE: 1, GR: A]6.
En pacientes con TB activa se debe otorgar el tratamiento completo de 6 a 18meses con rifampicina, isoniazida, etambutol y pirazinamida, y no iniciar el anti-TNF hasta completar el esquema [NE: 2, GR: B]6. En estos pacientes, solo si el beneficio es mayor que el riesgo se puede reiniciar el anti-TNF a los 2meses de presentar datos clínicos, radiográficos y serológicos de resolución de la enfermedad [NE: 2, GR: B]6.
19. ¿Cuál debe ser el abordaje terapéutico en el paciente con VIH que está recibiendo terapia con anti-TNF?La infección por VIH es una contraindicación relativa para el uso de todos los productos biológicos. Sin embargo, dados los nuevos tratamientos antirretrovirales, se debe considerar su uso en pacientes con enfermedad discapacitante y sin posibilidad de recibir otros tratamientos33.
20. ¿Cuál es el riesgo de desarrollar neoplasia en el paciente con AR tratado con anti-TNF?La información con respecto al riesgo de cáncer en pacientes con AR tratados con inhibidores del TNF es muy variable y se encuentra sesgada por factores que incluyen a la misma enfermedad de base que aumenta el riesgo de algunas variedades de cáncer (principalmente linfomas, asociados más con enfermedad grave y con elevada actividad inflamatoria), al alto grado de actividad de la enfermedad, a la dosis del tratamiento usada, al resto de tratamientos utilizados para el control de la enfermedad (que también pueden aumentar el riesgo de cáncer) y a otros factores propios de cada individuo (predisposición genética). En el Registro Español de Acontecimientos Adversos de Terapias Biológicas en Enfermedades Reumáticas (BIOBADASER) no se encuentra una asociación entre el uso de anti-TNF y la aparición de linfoma.
En una serie de 26 casos (18 con etanercept, 8 con infliximab) se observó mayor prevalencia de linfomas noHodgkin. El intervalo entre el inicio del tratamiento y el diagnóstico del linfoma fue muy corto (media de 8semanas) y en 2 pacientes (uno con cada fármaco) se observó una regresión del linfoma tras la suspensión del mismo. Dos pacientes tratados previamente por linfomas y que estaban en remisión, al iniciar el anti-TNF desarrollaron rápidamente una recurrencia34.
La asociación entre anti-TNF y tumores sólidos es menor, aunque parece existir un riesgo aumentado en relación con tumores cutáneos basocelulares (pero no melanoma)35. Recientemente se han comunicado 6casos de linfoma T hepatoesplénico de curso muy agresivo en pacientes jóvenes con enfermedad de Crohn tratados con infliximab junto con ASA o 6- mercaptopurina (comunicación de Centocor).
Se requieren datos de seguimiento a más largo plazo y con un mayor número de pacientes para aclarar la existencia o no de una asociación de los inhibidores del TNF con el desarrollo de tumores. Mientras tanto, se debe tener mucha precaución al indicar la utilización de estos fármacos cuando existe historia de tumores previos.
21. ¿Cuál es el papel del certolizumab en el tratamiento de la AR?Certolizumab reduce los síntomas de la enfermedad, retrasa la progresión radiográfica, mejora la calidad de vida y la capacidad funcional en pacientes con AR moderada a grave, y puede utilizarse en monoterapia o combinado con MTX en pacientes sin tratamiento previo con FARME, y refractarios a MTX y anti-TNF [NE: 2+, GR: D]36.
22. ¿Cuál es el papel del golimumab en el tratamiento de la AR?Golimumab reduce los síntomas de la enfermedad, retrasa la progresión radiográfica en pacientes con AR de moderada a grave, y puede utilizarse como monoterapia o combinado con MTX en pacientes sin tratamiento previo con FARME y refractarios a MTX y anti-TNF [NE: 2+, GR: D]37.
Barreras de implementación. Los anti-TNF etanercept, infliximab, adalimumab y certolizumab son medicamentos muy caros y no están disponibles en todas las instituciones de salud, solo en el Instituto Mexicano del Seguro Social (IMSS), en el Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE) y en los hospitales de Petróleos Mexicanos (PEMEX). A la fecha de elaboración de este documento el golimumab no se encuentra disponible en México.
23. ¿Cuál es el papel del rituximab, el tocilizumab y el abatacept en el tratamiento de la AR?Se recomiendan para los pacientes que tuvieron una respuesta inadecuada al tratamiento con FARME o con un anti-TNF [NE: 1, GR: A]6. Se recomiendan también en los pacientes que no han respondido al tratamiento con 2 agentes anti-TNF [NE: 2, GR: C].
En el caso del rituximab, la respuesta clínica es mejor en los pacientes que tienen Factor Reumatoide (FR) y/o anticuerpos anti-CCP positivos [NE: 1, GR: A]6.
24. ¿Existe alguna evidencia de que rituximab/tocilizumab/abatacept puedan ser usados como tratamiento de primera línea o como primer biológico en caso de falla a FARME tradicional?En general no se recomienda su uso como tratamiento de primera línea. Sin embargo, el abatacept sí se podría usar de primera línea, en combinación con MTX, de acuerdo con los resultados del estudio AGREE38 y del análisis post hoc de los datos de dicho estudio39. A pesar de ello, nuestro grupo no recomienda el uso de estos 3 medicamentos como de primera línea sin haber intentado MTX primero.
Con respecto a su uso como primer agente biológico, ya se mencionó que los 3 agentes se recomiendan en los pacientes que tuvieron una respuesta inadecuada al tratamiento con FARME6. El rituximab se puede usar antes de un agente anti-TNF, sobre todo en pacientes que tienen una contraindicación relativa o absoluta para recibir dicho tipo de agente, de acuerdo con las guías de la Sociedad Británica de Reumatología40, o en algunas situaciones especiales como el antecedente de un linfoma de célulasB, o la presencia de TB latente, esclerosis múltiple, vasculitis concomitante o síndromes de superposición, como lo recomiendan las guías de la Asociación Canadiense de Reumatología [NE: 1, GR: A]6.
Barreras de implementación. El rituximab, el tocilizumab y el abatacept son medicamentos muy caros y no están disponibles en todas las instituciones de salud. En algunos casos se requieren procedimientos administrativos especiales para obtenerlos.
25. ¿Existe evidencia que establezca que rituximab/tocilizumab/abatacept tienen menor riesgo de TB comparado con los agentes anti-TNF?No se ha reportado aumento en el riesgo de TB en pacientes tratados con rituximab por linfomas. El riesgo por el uso de tocilizumab y abatacept se desconoce [NE: 4, GR: B]7.
26. ¿Tiene sustento el uso de tofacitinib en el tratamiento de la AR? ¿Ha demostrado beneficio clínico y/o imagenológico?El tofacitinib ha demostrado beneficio clínico y radiográfico en pacientes con AR activa y que han fallado cuando menos a un FARME [NE: 2+, GR: C]41.
Los estudios muestran mayores respuestas de ACR20, 50, 70, mayor frecuencia de remisión por DAS28, así como mejor funcionalidad en pacientes que reciben tofacitinib que en los que reciben placebo [NE: 2+, GR: C]42.
Se debe de tener una estrecha vigilancia ante el descenso en los niveles neutrófilos, de la cuenta de linfocitos, del nivel de hemoglobina, así como del aumento de lípidos. Recientemente, los estudios de seguimiento a largo plazo con tofacitinib han alertado sobre la presencia de complicaciones graves (como infecciones oportunistas) y de difícil manejo como son ciertos tumores, hepatotoxicidad, perforación gastrointestinal e infecciones. Por lo anterior, la Agencia Europea Regulatoria de Medicamentos (EMA) ha denegado la aprobación para la comercialización de tofacitinib en Europa y la Food and Drug Administration (FDA) ha emitido una alerta internacional, si bien recomienda que los pacientes actualmente involucrados en los estudios a largo plazo pueden seguir recibiendo el medicamento43,44.
Barreras de implementación. Debe mencionarse que los datos de seguimiento a largo plazo son limitados, se prevé un costo alto (similar al de los anti-TNF), y como con otros FARME, hay mayor riesgo de infecciones graves, entre ellas TB, micosis e infecciones generadas por gérmenes oportunistas; por lo que se debe tener una estrecha vigilancia en los pacientes que reciben este fármaco43.
27. En caso de programarse un embarazo en una paciente con AR, ¿con cuánto tiempo de anticipación es recomendado suspender MTX, otros FARME tradicionales y la terapia biológica?Metotrexato. Durante el embarazo está formalmente contraindicado el uso de MTX. Debe suspenderse de preferencia 4meses antes de la gestación, y en caso de falta de planeación debe suspenderse de inmediato [NE: 4, GR: D]45.
Leflunomida. La mujer en tratamiento con LEF debe esperar 2años después de suspenderla para programar un embarazo. En mujeres que deseen embarazarse antes de los 2años, se recomienda realizar lavado con colestiramina 8g c/8h, o carbón activado 50g cada 6h durante 11días (en ambos casos), logrando con esto la eliminación del fármaco en 3meses. Después del lavado, es deseable cuantificar niveles plasmáticos del metabolito activo, que deberán ser menores a 0,02mg/l. Se verificará este nivel 14días después de la primera determinación [NE: 1, GR: A]45.
Una serie de casos (n=45) mostró 2 productos con malformaciones congénitas cuando la exposición fue en el primer trimestre (n=16) y ninguna malformación en las pacientes que suspendieron el tratamiento antes de la concepción (n=29). [NE: 4, GR: D]46.
Anti-TNF. La terapia con anti-TNF está contraindicada en el embarazo. El intervalo libre de anti-TNF para buscar concepción con infliximab es de 6meses; con adalimumab, de 5meses; con etanercept, sin recomendación [NE: 3, GR: C]10. En caso de ocurrir embarazo en mujeres con AR bajo tratamiento biológico, este tratamiento debe suspenderse inmediatamente [NE: 4, GR: C]45.
Algunas recomendaciones publicadas sugieren que el intervalo de seguridad entre la última dosis del anti-TNF y la concepción es de 5 vidas medias del medicamento.
28. En aquellas pacientes con actividad de la enfermedad durante el embarazo ¿qué FARME tradicional puede ser recomendado?No todas las pacientes con AR mejoran durante el embarazo. Tanto CLQ como HCQ47, azatioprina45 y SSZ47 son intervenciones farmacológicas seguras en pacientes con AR con actividad de la enfermedad durante el embarazo.
Se recomienda utilizar azatioprina con precaución durante el embarazo en caso de ser necesario suprimir la actividad de la AR [NE: 4, GR: D]45.
29. ¿Qué FARME tradicional puede ser usado durante la lactancia en pacientes con enfermedad activa?La HCQ y la CLQ son tratamientos farmacológicos seguros durante el periodo de lactancia en pacientes con AR [NE: 4, GR: D]45. La SSZ puede utilizarse en la lactancia con precaución. No se recomienda su uso si el lactante tiene afectada la función renal [NE: 4, GR: D]48.
Las Guías Británicas mencionan suspender el infliximab 6meses antes de iniciar la lactancia, y es la misma indicación para adalimumab y etanercept [NE: 2, GR: B]10.
30. ¿Existe evidencia de que un FARME tradicional afecte la fertilidad?En mujeres no hay reportes. Sin embargo, en hombres la SSZ genera oligospermia reversible.
31. ¿Qué vacunas con agentes vivos atenuados o agentes inertes son recomendables en pacientes con AR? ¿Se pueden aplicar durante la enfermedad activa?Dentro de la evaluación inicial del paciente con enfermedad reumática inflamatoria se sugiere evaluar el estatus de vacunación. Idealmente, la vacunación se debe administrar durante la fase estable de la enfermedad [NE: 4, GR: D]49. Deben revisarse las recomendaciones de vacunación por grupo etario y género. Barrera de implementación: ninguna.
La inmunización con microorganismos vivos atenuados se debe evitar siempre que sea posible en pacientes inmunodeprimidos con enfermedad reumática inflamatoria autoinmunitaria [NE: 4, GR: D]49. Barrera de implementación: ninguna
Cuando se requiere administrar inmunización con microorganismos vivos atenuados (sarampión, parotiditis, rubéola, fiebre tifoidea, poliomielitis [oral]), se sugiere administrar 2semanas antes e idealmente 4semanas previas al inicio de tratamiento con FARME o biológico [NE: 4, GR: D]7. Barrera de implementación: ninguna.
Se recomienda la vacunación contra la influenza y el neumococo en los pacientes con AR antes o durante el tratamiento con FARME o biológico. La vacuna contra neumococo debe reaplicarse cada 5años [NE: 2, GR: B]7,45,49. Barrera de implementación: ninguna.
En los pacientes que no han recibido inmunización contra neumococo y previo al inicio RTX, se debe administrar la vacuna antineumocócica polisacárida 23-valente, con 4 a 6semanas de anticipación [NE: 2, GR: B]40. Barrera de implementación: ninguna.
Se recomienda administrar la vacuna contra influenza antes del inicio de RTX y de forma anual, preferentemente antes del retratamiento [NE: 2, GR: B]40. Barrera de implementación: ninguna.
Los pacientes con enfermedad reumática inflamatoria autoinmunitaria deben recibir la vacuna con toxoide tetánico, de conformidad con las recomendaciones establecidas para la población general [NE: 4, GR: D]4,40. Barrera de implementación: ninguna.
Se sugiere administrar la vacuna contra herpes zoster en los pacientes que reciben MTX en dosis ≤25mg/semana y/o glucocorticoides en dosis <20mg/día [NE: 4, GR: D]7. Barrera de implementación: no disponible la vacuna en México.
El tiempo ideal para su aplicación sería entre 2 y 4 semanas previas al inicio del tratamiento biológico.
Se debe considerar aplicar la vacuna contra el herpes zoster en pacientes con AR mayores de 60años [NE: 4, GR: D]7. Barrera de implementación: depende de la disponibilidad de la misma en México.
También se debe aplicar la vacuna contra la hepatitisB.
32. En pacientes con infección por virus de hepatitis B, C o infección por VIH, ¿cuál de los FARME tradicionales y/o biológicos es recomendable utilizar?Previo al inicio del tratamiento con agentes biológicos, se recomienda investigar antecedentes de infección por virus de la hepatitis y VIH en los pacientes con factores de riesgo [NE: 4, GR: D]40,50,51.
En hepatitis viral C (activa o inactiva), los anti-TNF parecen ser seguros. Sin embargo, se deben usar con precaución si es que existe replicación viral.
Deberá evitarse el uso de biofármacos en pacientes con infecciones virales. En los pacientes bajo tratamiento deberá vigilarse cuidadosamente el desarrollo de procesos infecciosos virales. En caso de presentarse, se deberá suspender el biológico y el paciente recibirá el tratamiento específico de acuerdo al tipo y localización de la infección [NE: 1, GR: A]51.
Ante la sospecha de infección por varicela en el paciente que recibe agentes biológicos, se debe suspender el tratamiento e indicar tratamiento antiviral específico de forma inmediata [NE: 2, GR: B]45.
33. En pacientes con infecciones ¿qué FARME tradicionales y biológicos están indicados?El perfil de seguridad de inhibidores del TNF es similar. En el Registro Mexicano Biobadamex 1.0 se identificó un incremento en el riesgo para infecciones (RR: 2,05; IC95%: 1,5 a 2,7; p< 0,001) en los sujetos en terapia biológica vs. los que recibían FARME tradicionales. En pacientes con infecciones debe evitarse el uso de anti-TNF [NE: 2, GR: C]7,31,52,53.
34. ¿Es recomendable suspender leflunomida, MTX y otros FARME tradicionales y biológicos antes de una cirugía electiva y, de ser así, cuándo deberá ser reinstituido el fármaco?Sí es recomendable, ya que el tratamiento con FARME tradicionales y biológicos es inmunosupresor, por lo que hay un riesgo mayor de complicaciones infecciosas alrededor de un proceso quirúrgico. Las guías revisadas resumen la evidencia acerca de la seguridad de mantener el tratamiento con MTX en cirugías electivas, así como la suspensión una semana antes de la cirugía.
En cuanto a la suspensión de la terapia biológica, esta dependerá de la circunstancia individual de cada paciente, así como la naturaleza de la cirugía y la vida media de los fármacos. La evidencia que sustentan las guías canadienses menciona que 1 a 2meses antes de la cirugía se debe suspender el anti-TNF. En cuanto a RTX, el tiempo se define más por la cuenta de célulasB y en situaciones donde la enfermedad esté bien controlada.
La restauración del fármaco biológico depende del escenario clínico (actividad de la AR y evolución postoperatoria libre de infección) [NE: 4, GR: B]45,51.
35. ¿Con qué terapias biológicas se recomienda el escrutinio para TB latente?Para todos los biológicos debe realizarse anamnesis, Combe, intradermorreacción y radiografía del tórax. Otra prueba empleada para TB latente, denominada IGRA (INFγ release assays), que evalúa la producción de IFN in vitro ante a la presencia de antígenos específicos de Mycobacterium tuberculosis por medio de Enzyme-Linked ImmunoSorbent Assay (ELISA) y Enzyme-Linked Immunosorbent Spot (ELISPOT), ha demostrado mayor sensibilidad y especificidad frente a la tuberculina, en especial en pacientes que han recibido de manera previa la vacuna del bacilo Calmette-Guérin (BCG)54.
Barrera de implementación: ninguna para el tamizaje tradicional, pero el IGRA no se encuentra fácilmente disponible en México.
36. ¿En qué pacientes debe considerarse el tratamiento profiláctico para TB?Todos los que presenten PPD igual o mayor de 5mm, independientemente de que hayan sido vacunados o no con BCG o que sea Combe positivo con radiografía del tórax con datos sugerentes de TB.
Comentario del panelDebido a la prevalencia de TB en México, cuando haya alta sospecha de enfermedad, aun con negatividad de las pruebas anteriores, se recomienda realizar prueba de quantiferón, cuando el recurso pueda ser utilizado [NE: 4, GR: B]6,45,50.
Barreras para implementación: acceso limitado a IGRA.
37. ¿Cuándo debe iniciarse el tratamiento con agentes biológicos en pacientes que están recibiendo profilaxis para TB?No está definido con claridad. Se recomienda de uno a 2meses antes de iniciar con agentes biológicos, o bien se pueden iniciar al mismo tiempo, si el caso lo ameritara [NE: 4, GR: D]50.
Comentario del panelSe recomienda iniciar con anti-TNF de 3 a 4semanas de haber iniciado la profilaxis [GR: D].
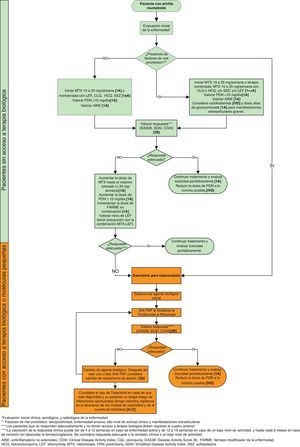
Algoritmo de manejoComentario general- •
Las recomendaciones sobre seguridad de la farmacoterapia en la práctica clínica cotidiana son limitadas y relacionadas con la población mexicana.
- •
Es recomendable fortalecer los métodos de farmacovigilancia pasiva (notificación de reacciones adversas) y farmacovigilancia activa (estudios de cohorte, registros, diseños farmacoepidemiológicos) dirigidos a la estimación de riesgos y toma de decisiones en beneficio del paciente.
- •
Para la notificación de reacciones adversas a medicamentos (reporte de caso) a la autoridad sanitaria (NOM-220-SSA1-2002) se deben incluir: datos relevantes del paciente (edad, sexo, función hepática y renal, peso/talla en población pediátrica, alergias, etc.), datos del medicamento causante de la reacción adversa (dosis, intervalo de dosificación, farmacoterapia concomitante, lote, caducidad y laboratorio productor [es útil para determinar diferencias de calidad entre productores]), la descripción de la reacción adversa (tipo, tratamiento utilizado para tratarla, consecuencias en el paciente y en apego).
- •
El Colegio Mexicano de Reumatología apoya la realización de actividades de farmacovigilancia para disponer de datos generados en nuestra población con el fin de prevenir o limitar los riesgos relacionados a la farmacoterapia en pacientes con AR.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl Colegio Mexicano de Reumatología recibió un apoyo educacional irrestricto por la empresa SANOFI.
El personal que labora en SANOFI no tuvo ninguna injerencia con la información vertida en este manuscrito ni participó en las reuniones que tuvo el grupo de trabajo.
Conflicto de interesesDr. Mario H. Cardiel: investigador principal en estudios clínicos con Roche, Bristol-Myers Squibb, Pfizer, Astellas, Anthera, Astra Zeneca, Lilly, Amgen, La Jolla Pharmaceutical Company. Asesor de Pfizer, Lilly, MSD, Amgen.
Dr. Alejandro Díaz Borjón: conferencista de UCB.
Dra. Mónica Vázquez del Mercado Espinosa: ninguno.
Dr. Jorge Iván Gámez-Nava: ninguno.
Dra. Leonor A. Barile Fabris: conferencista de Roche, Pfizer, UCB, Novartis, GSK.
Dr. César Pacheco Tena: conferencista de Roche, BMS, Janssen, Abbot (Abvie), UCB y Pfizer.
Dr. Luis H. Silveira Torre: investigador principal de ensayos clínicos con Roche y Bristol-Myers Squibb.
Dra. Virginia Pascual Ramos: ninguno.
Dra. María Victoria Goycochea Robles: ninguno.
Dr. Jorge Enrique Aguilar Arreola: ninguno.
Dra. Verónica González Díaz: ninguno.
Dr. Jose Álvarez Nemegyei: consultante de UCB de México.
Dra. Laura del Carmen González-López: ninguno.
Dr. Mario Salazar Páramo: ninguno.
Dra. Margarita Portela Hernández: conferencista de MSD, Roche, Pfizer, UCB, Janssen, Grünenthal.
Dra. Zully Castro Colín: ninguno.
Dr. Daniel Xavier Xibillé Friedman: conferencista de Pfizer y realización de ensayos clínicos con Pfizer, AztraZeneca, Celltrion.
Dr. Everardo Álvarez Hernández: ninguno.
Dr. Mario Salazar Páramo: ninguno.
Dr. Julio Casasola Vargas: ninguno.
Dr. Miguel Cortés Hernández: ninguno.
Dra. Diana E. Flores Alvarado: conferencista de AztraZeneca y UCB. Subinvestigadora en Quintiles.
Dra. Laura Aline Martínez Martínez: ninguno.
Dr. David Vega Morales: ninguno.
Dr. Luis Felipe Flores-Suárez: ninguno.
Dr. Gabriel Medrano Ramírez: ninguno.
Dr. Antonio Barrera Cruz: ninguno.
Dr. Adolfo García González: ninguno.
Dra. Susana Maricela López López: ninguno.
Dra. Alejandra Rosete Reyes: ninguno.
Dr. Rolando Espinosa Morales: conferencista de Lilly y SANOFI.
Los autores agradecen al Dr. Eduardo Barreira Mercado, Presidente del Colegio Mexicano de Reumatología, por el apoyo logístico para concluir esta iniciativa colegiada. Además agradecen al Dr. Jorge Aldrete y la Dra. Ana Cantú el apoyo al trabajo editorial de este manuscrito.