Los avances terapéuticos en la artritis reumatoide obligan a revisión periódica de las guías de tratamiento.
ObjetivoActualizar las guías del Colegio Mexicano de Reumatología del tratamiento farmacológico de la artritis reumatoide.
MétodoParticiparon reumatólogos certificados de diferentes instituciones de salud y regiones del país. Se conformaron equipos de trabajo que revisaron las guías previas, elaboraron nuevas preguntas, revisaron la literatura y calificaron la evidencia, que fue presentada y discutida en sesión plenaria. Las conclusiones se comentaron con infectólogos, ginecobstetras y pacientes. Se emiten recomendaciones basadas en niveles de evidencia de acuerdo con la metodología GRADE.
ResultadosSe presentan recomendaciones actualizadas para el empleo de los medicamentos disponibles en México hasta 2017 para el tratamiento de la artritis reumatoide. Se enfatiza la importancia del control adecuado y sostenido de la enfermedad y se describen aspectos relevantes de seguridad. Se incluyen conflictos bioéticos y se invita a la acción gubernamental para fortalecer el tratamiento adecuado de la enfermedad.
ConclusionesLa actualización de las recomendaciones del Colegio Mexicano de Reumatología del tratamiento farmacológico de la artritis reumatoide integra la mejor información disponible para ser utilizada en el sistema de salud de México.
Therapeutic advances in rheumatoid arthritis require periodic review of treatment guidelines.
ObjectiveTo update the Mexican College of Rheumatology guidelines on the pharmacological treatment of rheumatoid arthritis.
MethodBoard certified rheumatologists from different health institutions and regions of the country participated. Work teams were formed that reviewed the previous guidelines, elaborated new questions, reviewed the literature, and scored the evidence that was presented and discussed in plenary session. The conclusions were presented to infectologists, gynaecologists and patients. Recommendations were based on levels of evidence according to GRADE methodology.
ResultsUpdated recommendations on the use of available medications for rheumatoid arthritis treatment in Mexico up to 2017 are presented. The importance of adequate and sustained control of the disease is emphasized and relevant safety aspects are described. Bioethical conflicts are included, and government action is invited to strengthen correct treatment of the disease.
ConclusionsThe updated recommendations of the Mexican College of Rheumatology on the pharmacological treatment of rheumatoid arthritis incorporate the best available information to be used in the Mexican health care system.
En agosto de 2017 se reunió un comité de expertos del Colegio Mexicano de Reumatología (CMR) para la actualización de sus guías de tratamiento farmacológico de la artritis reumatoide (AR). Participaron reumatólogos y asesores metodológicos de diversas instituciones de salud. Se asignaron coordinadores si el tema no representaba un conflicto de interés. Se definió el marco analítico con la revisión de la versión anterior1, algunas preguntas se eliminaron, otras se mantuvieron o se reestructuraron y se agregaron otras en virtud de la disponibilidad de nuevos tratamientos. Se identificaron las palabras MeSH (Medical Subject Heading); cuando estas no existían, se incluyeron las palabras clave para la búsqueda bajo el término «All fields». En la búsqueda se utilizó la metodología PICO, que identifica la población (P), la intervención (I), el comparador (C) y el desenlace (O: Outcomes). Se consideraron ensayos clínicos aleatorizados, revisiones sistemáticas y metaanálisis en el periodo comprendido entre enero de 2012 y septiembre de 2017, publicados en inglés o español, en población adulta. En caso de falta de evidencia se incluyeron estudios observacionales u otras guías de práctica clínica como fuente de información. La búsqueda se realizó en PubMed, Biblioteca Cochrane y sitios web.
Los artículos fueron tamizados por título, resumen y finalmente por texto completo. Se capacitó a los participantes en la metodología GRADE para la estandarización de la calificación de la calidad de la evidencia y la fuerza de la recomendación2. En abril de 2018 se realizó una reunión presencial para discutir las recomendaciones hasta alcanzar consenso. Las secciones pertinentes se comentaron con infectólogos, ginecobstetras y pacientes. La nueva versión estuvo expuesta electrónicamente en la página del CMR por 10días para comentarios. Se integró la versión final y se actualizó el algoritmo de tratamiento. La calidad de la evidencia por GRADE se clasificó como muy baja, baja, moderada o alta. La opinión de expertos fue clasificada de muy baja calidad3. La fuerza de las recomendaciones se calificó como fuerte o débil. Las recomendaciones que fueron consideradas importantes pero no pudieron ser calificadas en cuanto a calidad de evidencia ni fuerza de la recomendación, fueron clasificadas como «buenas prácticas clínicas»4.
Resultados¿Cuáles son los principios generales del tratamiento de la artritis reumatoide?- -
Diagnosticar en fases iniciales.
- -
Tratar oportunamente.
- -
Manejo preferentemente por reumatólogo.
- -
Buscar alcanzar y mantener la remisión o un bajo nivel de actividad clínica.
- -
Individualizar tratamiento.
- -
Vigilar de manera periódica.
- -
Atender la comorbilidad.
- -
Adaptar el manejo a la práctica clínica.
- -
Tomar decisiones en conjunto con el paciente.
El principal objetivo del tratamiento en AR es lograr y mantener la remisión de la enfermedad o al menos un bajo nivel de actividad clínica tomando en consideración la perspectiva del paciente5-18.
¿Cuál es la eficacia de los glucocorticoides para reducir el dolor y la progresión radiográfica?Se revisaron 20 artículos y se incluyeron siete: 1)glucocorticoides agregados a la terapia con fármaco antirreumático modificador de la enfermedad (FARME) sintético convencional (FARMEsc) en AR temprana19; 2)comparación de terapia triple con FARMEsc vs metotrexato en monoterapia y con dosis bajas de glucocorticoides20; 3)comparación de dexametasona vs metilprednisolona en pulsos para el control de las recaídas21; 4)seguimiento radiográfico a 2años de pacientes con AR temprana tratados con glucocorticoides en decremento vs incremento de dosis seguido de control estricto22; 5)respuesta a glucocorticoides a las 2semanas como predictor de efectividad de terapia de inducción con FARMEsc a 3meses23; 6)glucocorticoides intraarticulares y FARMEsc en tratamiento por objetivos en AR temprana24, y 7)utilidad de los glucocorticoides para disminuir la progresión radiográfica en AR25.
Los glucocorticoides pueden ser usados en diferentes dosis y vías de administración en AR22,23. Se prefiere usar las dosis más bajas por el menor tiempo posible.
Los glucocorticoides en combinación con FARMEsc se pueden utilizar como terapia «puente» para alcanzar la remisión rápida19.
En los pacientes que no se alcance la remisión completa con FARMEsc se puede considerar el uso de glucocorticoides intraarticulares, sobre todo en caso de monoartritis persistente24.
Deben vigilarse las reacciones adversas potenciales a largo plazo25.
Recomendaciones- -
Se recomienda el uso de prednisona =10mg/día o equivalente como terapia «puente» con FARMEsc en pacientes con diagnóstico de AR. Calidad de la evidencia alta. Recomendación fuerte.
- -
En AR temprana (menos de 6meses de evolución) con factores de mal pronóstico (seropositividad, alta actividad clínica, erosiones) se recomiendan dosis bajas de glucocorticoides (prednisona <10mg/día o equivalente) para disminuir la actividad clínica y la progresión radiográfica. Calidad de la evidencia alta. Recomendación fuerte.
- -
Se recomienda el uso de dosis altas (pulsos de metilprednisolona) de glucocorticoides por vía intravenosa (i.v.), solamente en pacientes con manifestaciones extraarticulares graves (mononeuritis múltiple, vasculitis reumatoide). Calidad de la evidencia alta. Recomendación fuerte.
La evidencia para esta recomendación proviene de estudios en AR temprana cuyos objetivos fueron alcanzar la remisión o baja actividad de la AR y frenar la progresión radiográfica con el uso de FARMEsc.
Los resultados de uno de los estudios muestran que entre el 8,7 y el 22,5% de los participantes alcanzaron remisión y entre el 35,5 y el 42,7% baja actividad a 3 y 6meses, respectivamente, con FARMEsc26. Se observó remisión a la semana 17 en el 77% de los participantes27. Otro estudio mostró que en el grupo con FARMEsc se alcanzó remisión en el 49%, en comparación con el 21% en el grupo sin tratamiento28. Otra publicación29 reportó que, en AR temprana, el empleo de metotrexato en combinación con otro FARMEsc no fue superior al metotrexato en monoterapia para obtener remisión, si al mismo tiempo se empleaban glucocorticoides. La remisión temprana predice remisión clínica sostenida en pacientes con AR de reciente inicio (OR=1,95; IC95%: 1,02-3,74)30,31.
Recomendación- -
Recomendamos el empleo de FARMEsc tan pronto como sea posible. Calidad de la evidencia alta. Recomendación fuerte.
El metotrexato sigue siendo considerado la piedra angular del tratamiento de la AR. Las recomendaciones realizadas se basan en un metaanálisis de ensayos clínicos en el que se incluyeron 1.432 usuarios de leflunomida, 922 de metotrexato, 133 de sulfasalazina y 312 de placebo32. La recomendación acerca de la vía de administración del metotrexato se basa en una revisión sistemática que incluyó estudios con diferentes diseños en los que se comparó la vía oral contra la parenteral33. La eficacia y la toxicidad del metotrexato están relacionadas principalmente con la dosis absorbida y no con la vía de administración. La biodisponibilidad es mayor con metotrexato parenteral que con la vía oral33.
Consideraciones adicionalesSe prefiere administrar metotrexato por vía oral sobre la vía parenteral por su facilidad de administración.
Recomendaciones- -
Se recomienda el uso de metotrexato como primera línea de tratamiento; en caso de contraindicación a metotrexato recomendamos leflunomida. Calidad de la evidencia alta. Recomendación fuerte.
- -
Se sugiere el inicio de metotrexato por vía oral debido a la facilidad de administración. En caso de requerir dosis >15mg/semana debe considerarse el uso de metotrexato parenteral. Calidad de la evidencia alta. Recomendación fuerte.
Un metaanálisis reportó mayor probabilidad de lograr ACR50 con la terapia combinada (56-67%) vs metotrexato como monoterapia (41%); adicionalmente, los pacientes que no habían recibido metotrexato y que fueron tratados con terapia combinada tuvieron menor progresión radiográfica, y la triple terapia (metotrexato, sulfasalazina e hidroxicloroquina) tuvo una probabilidad de lograr ACR50 del 61% vs metotrexato y biológicos, que tuvieron respuestas entre el 24 y el 64%34. Hubo mayor tasa de eventos adversos (EA) en los grupos de terapia combinada34.
Consideraciones adicionalesEn pacientes con AR que no responden a FARMEsc en monoterapia se obtienen resultados similares con el empleo de la triple terapia de FARMEsc (metotrexato, sulfasalazina e hidroxicloroquina) o de la terapia combinada con metotrexato y FARME biológico (FARMEbo). En nuestro medio, la triple terapia debería ser la primera opción de terapia combinada35.
Recomendación- -
Recomendamos el uso de monoterapia con FARMEsc en pacientes con AR activa sin exposición previa a FARME. Calidad de la evidencia moderada. Recomendación fuerte.
- -
Sugerimos el uso de terapia combinada con FARMEsc en pacientes con AR activa con factores de mal pronóstico o con falla previa a algún FARMEsc. Calidad de la evidencia baja. Recomendación débil.
Los FARME biológicos (FARMEbo) y los inhibidores de JAK disponibles en México son los medicamentos innovadores anti-TNF como etanercept, infliximab, adalimumab, certolizumab pegol y golimumab; anti-receptor de IL6 (tocilizumab); abatacept, que es inhibidor de co-estimulación, y rituximab (anti-célulasB). También se encuentran disponibles biosimilares de etanercept e infliximab. Los inhibidores de JAK son el tofacitinib y el baricitinib.
Se consideraron los datos de eficacia y seguridad de los ensayos clínicos de FARMEbo o inhibidores de JAK en los diferentes escenarios clínicos en AR. Se tomó en cuenta la AR temprana o establecida, sin tratamiento previo o con respuesta inadecuada a FARMEsc o a terapia biológica, su empleo en monoterapia o en combinación con FARMEsc. Ya que las indicaciones y sus precauciones son similares, se describen de manera general y se mencionan de forma independiente las consideraciones especiales con alguno de ellos. La presunción de que la eficacia de las diferentes terapias biológicas y los inhibidores de JAK es similar proviene no solo de comparaciones indirectas de los ensayos clínicos realizados36-39, sino de estudios de comparación directa: ADACTA, AMPLE, EXXELERATE, ACTION, ORAL STRATEGY, RA-BEAM40-45.
El uso de FARMEbo o de inhibidores de JAK en pacientes con AR establecida, con actividad clínica de moderada a intensa, que han tenido respuesta insuficiente a FARMEsc ha demostrado ser eficaz. Se reportan porcentajes similares en respuestas ACR20, 50 y 70, con respuestas promedio del 70, del 40 y del 25%36, respectivamente, a las 24semanas de tratamiento, y reducción de la actividad por DAS28>1,2 hasta en 70% a 2años38,39. Las tasas de respuesta ACR20, 50 y 70 son ligeramente menores: 60, 30 y 15%, respectivamente, cuando la población tiene historia de falta de respuesta a la terapia biológica. En pacientes con AR temprana las respuestas clínicas son mejores, lográndose baja actividad hasta en el 40% de los pacientes y remisión en el 25%, que se mantiene hasta por 5años36. Asimismo, los ensayos clínicos controlados y de extensión han demostrado que la terapia biológica o con inhibidores de JAK, combinada en ambos casos con FARMEsc (en general metotrexato), es superior a la monoterapia para la detención del daño estructural36-39. En general, las mejores respuestas clínicas se logran al administrar estos tratamientos combinados con metotrexato, en especial en el caso de los anti-TNF46-49.
Algunos estudios con tocilizumab e inhibidores de JAK han demostrado que el tratamiento con monoterapia es superior a metotrexato y equivalente a la terapia combinada con metotrexato50,51.
Las instituciones de salud en México tienen una disponibilidad no equitativa de estas opciones terapéuticas, ya que en la Secretaría de Salud y el Seguro Popular es limitada. Es deseable que todas las instituciones tengan algunos de estos medicamentos, con diferente mecanismo de acción y vía de administración, para los pacientes con actividad clínica de moderada a alta, sin respuesta al tratamiento con FARMEsc a dosis adecuada por el tiempo suficiente.
Consideraciones adicionalesNingún FARMEbo tiene ventaja terapéutica evidente sobre otro.
Recomendaciones- -
Recomendamos el uso de FARMEbo o inhibidores de JAK en pacientes con AR con actividad de moderada a alta con respuesta inadecuada a tratamiento con FARMEsc. Calidad de la evidencia alta. Recomendación fuerte.
- -
En pacientes con falla al primer anti-TNF puede utilizarse un segundo anti-TNF o puede cambiarse a un FARMEbo con diferente mecanismo de acción. Calidad de la evidencia alta. Recomendación fuerte.
- -
Recomendamos cambio de mecanismo de acción en pacientes con AR con actividad moderada o grave con respuesta inadecuada a FARMEbo o inhibidores de JAK. Calidad de la evidencia alta. Recomendación fuerte.
- -
Recomendamos el uso de tocilizumab o inhibidores de JAK en pacientes con AR con actividad de moderada a grave en los que se decida monoterapia. Calidad de la evidencia alta. Recomendación fuerte.
- -
En pacientes que requieran tratamiento biológico, la decisión sobre la terapéutica con los productos biológicos aprobados (innovador o biocomparable) debe estar dictada por una evaluación individual del riesgo/beneficio y no basarse únicamente en aspectos económicos. Buena práctica clínica52.
Infecciones. En pacientes con AR que reciben anti-TNF se ha descrito mayor riesgo de infecciones, y algunas de ellas fueron graves53. El riesgo ajustado de cualquier infección grave, comparado con el uso de FARMEsc, oscila entre 1,1 y 1,854,55, que parece mayor durante el primer año56. Los registros británico y japonés muestran que el etanercept puede tener menor riesgo de infecciones graves que los anticuerpos monoclonales38,57,58. La evidencia indica que los pacientes que usan anti-TNF deben ser vigilados en forma estrecha ante el riesgo de infecciones, que deben ser tratados en forma temprana cuando adquieren alguna infección y que estos medicamentos deben suspenderse mientras la infección esté activa.
Tuberculosis (Tb). El riesgo ajustado de Tb en pacientes con AR que emplean anti-TNF oscila entre 2,7 y 12,554. Todos los pacientes deben ser sometidos a escrutinio para Tb, y aquellos con diagnóstico de la enfermedad latente o activa deben recibir tratamiento adecuado. Estudios retrospectivos han mostrado que es seguro reiniciar el anti-TNF en pacientes que reciben tratamiento adecuado para Tb latente o activa59,60 (tabla 1).
Escrutinio y manejo de la tuberculosis
| Recomendación | Calidad de la evidencia | Fuerza de la recomendación |
|---|---|---|
| Escrutinio de tuberculosis (Tb) | ||
| • Se recomienda el escrutinio para Tb por medio de la realización de historia clínica donde se interrogue la historia de convivencia con personas con Tb activa, exploración física, prueba de la tuberculina (o IGRA) y radiografía de tórax, en todos los pacientes con AR que vayan a ser protocolizados para el uso de FARMEbo o inhibidores de JAK | Muy baja | Buena práctica clínica |
| • Se sugiere repetir el escrutinio anualmente en pacientes que se encuentren en tratamiento con FARMEbo e inhibidores de JAK ante el riesgo de reactivación de Tb latente o infección de novo | Muy baja | Buena práctica clínica |
| • Se recomienda iniciar terapia profiláctica para Tb en todos los pacientes que presenten PPD positivo =5mm o IGRA positivo, independientemente de haber sido vacunados o no con BCG, y en aquellos pacientes COMBE positivo con radiografía de tórax y datos sugerentes de Tb antes de iniciar terapia con FARMEbo (sobre todo con fármacos de tipo anti-TNF)61,62 o inhibidores de JAK | Muy baja | Buena práctica clínica |
| Inicio del tratamiento con FARMEbo o inhibidores de JAK en pacientes que están recibiendo profilaxis o tratamiento para Tb establecida | ||
| • En pacientes con Tb latente se recomienda iniciar o reiniciar el tratamiento con FARMEbo o inhibidores de JAK después de un mes de tratamiento con fármacos antituberculosos62,63 | Muy baja | Buena práctica clínica |
| • En pacientes con Tb activa se recomienda el inicio o reinicio con FARMEbo/bs o inhibidores de JAK al completar el tratamiento antituberculoso | Muy baja | Buena práctica clínica |
| • Los pacientes con Tb latente con resultados positivos de tuberculina o IGRA requieren seguimiento clínico para diagnóstico oportuno en caso de reactivación, ya que las pruebas repetidas no ayudan en el diagnóstico de Tb recurrente | Muy baja | Buena práctica clínica |
Gérmenes oportunistas. En cuanto a otras infecciones específicas, estudios recientes no demuestran mayor riesgo de infección por virus del herpes zoster54,64, y una revisión sistemática encuentra mayor riesgo de infecciones oportunistas64.
Reacciones a la aplicación. Ocurren entre el 5,8 y el 53,8%; la mayoría son leves o moderadas y en muy pocos casos obligan a suspender el medicamento65.
Cáncer. Diversos metaanálisis recientes han concluido que no existe mayor riesgo de cáncer asociado al uso de fármacos anti-TNF en pacientes con AR54-68. Un metaanálisis de 2012 encontró ligero incremento en el cáncer de piel no melanoma, que no ha sido confirmado en otros metaanálisis y estudios poblacionales más recientes55,58,66,67,69. En cuanto al melanoma, existen evidencias de incremento leve en el riesgo (aHR 1,5)54.
El uso de adalimumab o certolizumab durante el embarazo parece ser seguro; estudios recientes muestran que el uso de estos medicamentos no se asocia con mayor riesgo de teratogenicidad, abortos o muertes fetales comparado a lo esperado para la población general70-72.
RituximabLos aspectos de seguridad más relevantes con el uso de rituximab se asocian a su efecto terapéutico y a su vía de administración. El estudio de seguridad a largo plazo de rituximab con seguimiento a más de 11años resume la información derivada de 8ensayos clínicos controlados, 2estudios de extensión a largo plazo y un estudio observacional prospectivo con experiencia en 14.816 pacientes-año. La mayor parte de las suspensiones de rituximab se presentaron en los dos primeros ciclos de infusión; el motivo principal de descontinuación no estuvo relacionado con la seguridad del medicamento (22%) y solo un 7% descontinuó por la presencia de eventos adversos (EA). La mayor parte de estos EA se presentaron en los primeros 6meses y la frecuencia y naturaleza de los eventos no cambió a lo largo del seguimiento. Se presentaron 78 muertes (0,53 pacientes-año) en el grupo de rituximab y 7 en el grupo placebo (0,63 pacientes-año). Las infecciones más frecuentes son respiratorias y similares al resto de los FARMEbo58. La frecuencia de infecciones no se incrementó con el tiempo de seguimiento ni con el número de aplicaciones. La infección grave más frecuente fue la neumonía (2%). La incidencia de infecciones graves por microorganismos oportunistas fue infrecuente (0,05 eventos/100 pacientes-año). Se reportaron dos casos de Tb pulmonar no complicada y un caso nuevo de hepatitisB. El infarto al miocardio tuvo una tasa de 0,39 eventos/100 pacientes-año, lo cual es similar a lo descrito en pacientes con AR. No se encontró evidencia de un riesgo incrementado para el desarrollo de neoplasias. El tumor sólido más frecuente fue el cáncer de mama, y su frecuencia no representa un incremento con respecto a la población con AR de referencia73.
Debido a la inhibición de los linfocitosB (CD20) y la disminución secundaria de inmunoglobulinas, se recomienda la medición de IgG, IgM e IgA previamente a la administración de cada ciclo de rituximab. Las guías europeas sobre el uso de rituximab recomiendan vigilar los niveles de inmunoglobulinas, con seguimiento cercano por la posibilidad de infección en los pacientes con niveles bajos de IgG74.
El rituximab aumenta el riesgo de reactivación de hepatitisB (OR: 7,2; IC95%: 5,3-9,9), por lo que debe vigilarse su administración en dichos pacientes y evitar su empleo en casos de infección activa75.
La leucoencefalopatía multifocal progresiva se ha asociado con la administración de rituximab en 9 casos de ˜351.396 pacientes con AR tratados con rituximab hasta el año 2015. De esos casos se considera que la tasa de incidencia de leucoencefalopatía en pacientes con AR que reciben rituximab es de 2,56 por cada 100.000 pacientes.
Consideración especial: el rituximab se puede utilizar como biológico de primera opción en los pacientes con antecedente de cáncer.
AbataceptAunque el abatacept ha demostrado tener un mejor perfil de seguridad que otros biológicos en el tratamiento de la AR, el caso de la infección por virus de la hepatitisB (VHB) merece especial mención. Esto se ha analizado en diversos estudios; en uno de ellos, 72 pacientes recibieron abatacept; 47 eran portadores inactivos, 21 ocultos y 4 activos crónicos de VHB, todos con pruebas de función hepática normales basales y niveles bajos o indetectables de ADN del VHB, excepto en aquellos con hepatitis crónica activa; 13 pacientes recibieron profilaxis con lamivudina y 4 con adefovir o tenofovir, y posterior a 316 visitas de seguimiento ningún paciente experimentó reactivación de la hepatitisB y no hubo EA relacionados de interés76.
Un estudio mostró asociación de mayor edad del paciente con mayor tasa de interrupción por EA por 100 pacientes-año, especialmente infecciones graves (1,73 en muy jóvenes, 4,65 en edad media, 5,90 en ancianos y 10,38 en muy ancianos, p<0,001)77. En 219 pacientes con abatacept combinado con metotrexato en estudio de extensión a largo plazo, 114 (52,1%) completaron 7años, y la seguridad fue consistente con los períodos iniciales del estudio. Otro estudio de extensión a largo plazo llevado a cabo en pacientes con AR no respondedores a metotrexato, recibiendo abatacept subcutáneo (s.c.), identificó a 1.385 pacientes que completaron la etapa de doble ciego; 1.372 entraron al análisis de la extensión a largo plazo y 945 (68,8%) completaron =5años de tratamiento. Durante el estudio de extensión, 97 (7,1%) pacientes descontinuaron el tratamiento debido a un EA. La tasa de incidencia (evento/100 pacientes-año de exposición) para EA de interés fueron: EA serios 7,73 (IC95%: 6,96-8,58), infección 38,60 (IC95%: 36,24-41,12), infecciones graves 1,68 (IC95%: 1,35-2,07), malignidad 1,09 (IC95%: 0,84-1,42), y enfermedad autoinmune 1,33 (IC95%: 1,05-1,69), manteniéndose estable a lo largo del tiempo. No se observó asociación entre inmunogenicidad y un empeoramiento de la seguridad de abatacept o pérdida de la eficacia. Este estudio a 5años estableció la seguridad de abatacept s.c. (125mg/semana), mostrando un perfil de seguridad consistente y una eficacia duradera en el tratamiento a largo plazo de pacientes con AR y respuesta inadecuada a FARMEsc78. Aunque se ha demostrado la presencia de anticuerpos antidroga asociados a abatacept, estos no son neutralizantes y no se asocian a pérdida de la eficacia, como se ha visto con otros fármacos biológicos79. Con base a lo anterior, consideramos que el abatacept mantiene seguridad constante, además de eficacia sostenida durante 7años en pacientes con AR establecida y respuesta inadecuada a metotrexato80, con menos interrupciones por EA (3,8% frente a 9,5%), EA graves (1,6% frente a 4,9%) e infecciones graves (0/12 frente a 9/19 pacientes) que en el grupo de comparación42.
El empleo de abatacept no se ha asociado con enfermedad pulmonar intersticial81.
TocilizumabTocilizumab i.v. y s.c. como monoterapia o en combinación con otros FARMEsc ha sido generalmente bien tolerado en los ensayos clínicos y en la práctica clínica después de 9años de experiencia en el tratamiento.
Los EA más comunes (>10%) fueron infecciones respiratorias e hipercolesterolemia82. En ensayos clínicos a 6meses la tasa de infecciones con tocilizumab i.v. (8mg/kg) más FARMEsc fue de 127 eventos/100 pacientes/año, siendo la tasa de infecciones graves de 5,3 eventos/100 pacientes/año. En la exposición a largo plazo la tasa general de infecciones con tocilizumab fue de 108 eventos/100 pacientes/año y la de infecciones graves, de 4,7 eventos/100 pacientes/año82.
Los EA más comunes fueron «infecciones e infestaciones» con una frecuencia del 7 al 43% en el grupo de monoterapia y del 6 al 42% en el grupo de tratamiento combinado, siendo la más frecuente la nasofaringitis. Se suspendió el medicamento por EA en un 6,2% de los pacientes, 9% en monoterapia y 5,5% en combinación con FARMEsc. Las causas de suspensión del tratamiento fueron trastornos cutáneos y subcutáneos con monoterapia (1,4%) y anormalidades de laboratorio en el combinado con FARMEsc (1,1%). En 29 pacientes (1,6%) se retiró el fármaco por falta de eficacia. Adicionalmente se ha reportado cefalea (7%) e hipertensión arterial (6%)82,83.
Se han reportado casos de perforación diverticular. Los ensayos clínicos a 6meses muestran tasas de 0,26/100 personas/año y la exposición a largo plazo muestra tasas similares, de 0,28/100 personas/año82.
En estudios con análisis post hoc y en estudios a largo plazo el tratamiento con tocilizumab i.v. (promedio de 3,7años de seguimiento) se asoció a una tasa de evento cardiovascular de 3,4eventos/100 personas/año, con un tiempo promedio para el primer evento de 680 días. En análisis multivariado se encontró que los factores predictores de ECV fueron: edad avanzada (HR: 1,07), historia de enfermedad cardiaca (HR: 2,32), DAS28 elevado (HR: 1,36) y una elevación en la relación colesterol total/colesterol HDL (HR: 1,33)82.
Los EA graves que ocurrieron entre el 3 y 5% del total de la población estudiada fueron neumonía, herpes zoster, aumento de las aminotransferasas, hipersensibilidad y eritema en el sitio de punción83. Adicionalmente se han reportado dislipidemia/hipercolesterolemia y trastornos gastrointestinales: dolor, distensión y hemorragia intestinal y foliculitis84.
Los EA hepáticos tuvieron una tasa de 0,78 eventos/100 pacientes/año. El 2,5% de los pacientes tuvieron que suspender el fármaco por elevación de las aminotransferasas85.
El tocilizumab no debe utilizarse durante el embarazo. Existe el riesgo de abortos espontáneos y de muerte fetal con la exposición a altas dosis en animales, sin conocer con certeza el riego para los humanos. De los casos prospectivos y retrospectivos, el 21,7 y el 28,7% resultaron en abortos espontáneos, respectivamente. Se han reportado malformaciones en el 4,5% y nacimientos prematuros en el 31,2%82.
Inhibidores de JAKTofacitinib y baricitinib comparten aspectos de seguridad que es importante vigilar.
Debido a que este grupo de medicamentos es de uso reciente en nuestro medio, muchas recomendaciones aquí expuestas están basadas en recomendación de experto y no necesariamente en información de estudios pivotales. El clínico debe familiarizarse con las siguientes recomendaciones generales sobre inhibidores de JAK:
Infecciones. Son los EA más frecuentemente reportados. La mayoría suelen ser leves o moderadas, siendo las principales las de vías respiratorias altas (14-17%), tracto urinario (3,4-11%) y bronquitis (hasta el 11%)86-88. El herpes zoster se ha reportado en el 3,9% de los pacientes tratados con baricitinib y en el 4,39% de los tratados con tofacitinib en el programa global y el 3,39% en América Latina86,89. La frecuencia de infecciones graves oscila del 1,1 al 3,1%40,89. Si bien las infecciones oportunistas (específicamente la Tb) se han reportado en pacientes tratados con inhibidores de JAK, la frecuencia suele ser la misma que para FARMEbo no anti-TNF. En general, se han descrito los siguientes factores de riesgo para infecciones: edad >65años, comorbilidades como diabetes mellitus, obesidad y enfermedad pulmonar obstructiva crónica, así como el uso de prednisona >7,5mg/día88,90. Se sugiere detener la administración de estos medicamentos en caso de sospecha o confirmación de infección moderada o grave y reanudarlo una vez resuelta.
Linfopenia. La linfopenia =500células/ml3 puede conferir un mayor riesgo de infecciones graves. Se sugiere suspender temporal o definitivamente el tratamiento con inhibidores de JAK si se alcanza dicha cifra40,90.
Alteraciones en pruebas de función hepática. Se ha observado elevación de ALT y/o AST con inhibidores de JAK, pero las elevaciones =3 veces por encima de límite superior ocurren con poca frecuencia (1,4%), siendo por lo general asintomáticas y transitorias. Son más frecuentes en terapia combinada con metotrexato. Se recomienda vigilancia periódica86,88,91-93.
Perfil de lípidos y seguridad cardiovascular. Se ha descrito elevación de colesterol total, colesterol LDL y colesterol HDL, sin cambios en la relación colesterol total/HDL, hasta en el 49% de los pacientes tratados con inhibidores de JAK, siendo más frecuente durante los primeros 3meses de tratamiento94. Estas alteraciones por lo general revierten con estatinas95. Se desconoce la relevancia clínica del riesgo cardiovascular a largo plazo.
- •
Trombosis. Existe un evento de especial interés en el perfil de seguridad de baricitinib, debido a un aumento de trombosis venosas profundas y/o tromboembolia pulmonar. Se recomienda especial precaución con el uso de baricitinib en pacientes con factores de riesgo para trombosis venosa profunda o tromboembolia pulmonar. En caso de presentarse alguno de estos eventos, se debe interrumpir baricitinib, evaluar con prontitud e instituir un tratamiento apropiado. En México contamos con aprobación de las presentaciones de 2 y 4mg cada 24h96. Sin embargo, la Food and Drug Administration (FDA) en los Estados Unidos de Norteamérica solamente aprobó la presentación de 2mg, considerando los eventos de trombosis97.
- •
Otras alteraciones de laboratorio. Se han descrito con ambos medicamentos y con muy baja frecuencia pueden provocar anemia, neutropenia, elevación no significativa de creatinina86,92,93 y elevaciones transitorias de CPK. Hasta el 2% de los pacientes que reciben baricitinib presentan trombocitosis.
- •
Neoplasias. Hasta el momento los inhibidores de JAK no han demostrado un incremento en el riesgo de neoplasias. Sin embargo, se recomienda, como en el resto de los medicamentos, un seguimiento a largo plazo con registros internacionales y la vigilancia estrecha ante la sospecha elevada98,99.
- -
Recomendamos en pacientes con AR que reciben FARMEbo o inhibidores de JAK vigilancia estrecha para un diagnóstico y tratamiento oportuno de infecciones. Calidad de la evidencia alta. Recomendación fuerte.
- -
No se recomienda el uso de FARMEbo o inhibidores de JAK en pacientes con infección activa. Calidad de la evidencia alta. Recomendación fuerte.
- -
Recomendamos considerar otras opciones de tratamiento en pacientes con alto riesgo de infecciones recurrentes. Calidad de la evidencia alta. Recomendación fuerte.
- -
Recomendamos la vigilancia de EA relacionados con el perfil de seguridad y mecanismo de acción de cada FARMEbo o inhibidor de JAK. Calidad de la evidencia alta. Recomendación fuerte.
- -
Recomendamos escrutinio y vigilancia para la detección de cáncer de piel en pacientes con AR en tratamiento con FARMEbo. Calidad de la evidencia alta. Recomendación fuerte.
De manera consistente, la información revisada muestra una mayor tasa de recaída en los pacientes con AR en quienes se disminuye o suspende el tratamiento con FARMEsc o FARMEbo100-105. La incidencia de recaída es menor con la disminución de la dosis que con la suspensión del FARMEbo. La incidencia de recaída en pacientes con disminución de FARMEsc fue del 41% y de FARMEbo del 37%100.
Factores de riesgo de recaídaLos siguientes se consideran predictores de recaída: la positividad de anticuerpos anti-PCC o del factor reumatoide, mayor duración de la enfermedad y el inicio tardío del tratamiento. Otro predictor de recaída es el grado de remisión, confiriendo un menor riesgo el tener remisión intensa con DAS28 <1,98; también se han propuesto marcadores serológicos, como los niveles de interleucina6 y de metaloproteinasa-3 de la matriz, así como la detección de sinovitis con dopplerpoder por ultrasonido musculoesquelético102,104,106-111.
Recomendaciones- -
Sugerimos optimizar el tratamiento en pacientes en remisión clínica sostenida (al menos 6meses). La optimización debe ser individualizada y consensuada. Debe tomar en cuenta la logística del centro hospitalario1,6,106,112,113. Calidad de la evidencia moderada. Recomendación débil.
- -
Sugerimos la reducción secuencial del tratamiento bajo la consideración de iniciar con los fármacos que generan un mayor riesgo de EA a corto o largo plazo y un incremento en los costos100,101,106,113. Es deseable iniciar con la disminución y suspensión del glucocorticoide. Calidad de la evidencia moderada. Recomendación débil.
- -
Sugerimos la reducción de la dosis del 20 al 50% de los FARMEsc o los FARMEbo, o incremento en el intervalo de tiempo de aplicación, en pacientes que se hayan mantenido en remisión (DAS28 <2,6 o equivalente) por al menos 6meses5,104,112-116. Calidad de la evidencia moderada. Recomendación débil.
- -
Sugerimos la suspensión de los FARMEbo en pacientes con AR temprana o establecida si el paciente se encuentra en remisión, preferentemente intensiva (DAS28 <1,98) por al menos 6meses, si reciben la dosis mínima de FARMEbo y cuando no hay evidencia de progresión por imagen114,116-119. Calidad de la evidencia moderada. Recomendación débil.
- -
Recomendamos vigilancia estrecha para detectar recaída, al menos cada 12-16semanas, y medición de la actividad mediante escalas estandarizadas6,102,113,114. Calidad de la evidencia moderada. Recomendación débil.
- -
Recomendamos, en caso de recaída, ajustar la dosis o el intervalo de los FARME, con el objetivo de alcanzar nuevamente la remisión113,114,116. Calidad de la evidencia moderada. Recomendación débil.
El tratamiento de la AR en el embarazo debe ser un manejo de equipo en el que la paciente, el ginecobstetra y el reumatólogo mantengan una comunicación adecuada antes, durante y después del mismo. Deben evaluarse con cuidado en consulta preconcepcional la actividad de la enfermedad, las modificaciones terapéuticas, las opciones de tratamiento en caso de actividad de la AR durante la gestación, el puerperio y la lactancia. Se debe priorizar el control de la enfermedad y considerar los riesgos potenciales para la madre y el feto tanto por el uso como por la suspensión de algún fármaco. La tabla 2 resume las recomendaciones sobre embarazo, lactancia y fertilidad.
Embarazo y lactancia y fertilidad
| Suspensión de FARME en embarazo planeado | |||
|---|---|---|---|
| Fármaco y referencias | Tiempo de suspensión previo a la concepción | Calidad de la evidencia | Fuerza de la recomendación |
| Metotrexato129-133 | Al menos 3 meses | Alta | Fuerte |
| Leflunomida131,132,134,135 | Al menos 2 años o lavado con colestiramina | Alta | Fuerte |
| Rituximab136,137 | 12 meses | Alta | Fuerte |
| Tocilizumab133,136,138,139 | 3 meses (5 vidas medias) | Baja | Débil |
| Abatacept132,140,141 | 10 semanas | Baja | Débil |
| Anti-TNF132,142-146 | Pueden continuar | Baja | Débil |
| Tofacitinib132,136,145 | 2 meses | Baja | Débil |
| Control de la actividad clínica en el embarazo | ||||
|---|---|---|---|---|
| Fármaco y referencias | Se recomienda, sugiere o contraindica | Etapa gestacional en la que se puede utilizar | Calidad de la evidencia | Fuerza de la recomendación |
| Prednisona132-134,147-149 | Recomendado | Todo el embarazo | Alta | Fuerte |
| Antimaláricos150 | Recomendado | Todo el embarazo | Alta | Fuerte |
| Sulfasalazina <2g/día +5 mg/d de ácido fólico151 | Recomendado | Todo el embarazo | Alta | Fuerte |
| Azatioprina132,134 | Recomendado | Todo el embarazo | Alta | Fuerte |
| Certolizumab pegola,152 | Sugerido | Todo el embarazo | Alta | Débil |
| Infliximab | Sugerido | Primeras 20 semanas | Baja | Débil |
| Adalimumab72 | Sugerido | Todo el embarazo | Moderada | Débil |
| Etanercept | Sugerido | Hasta la semana 30 | Baja | Débil |
| Golimumab | Contraindicado | Toda la gestación | Muy baja | Debil |
| Anti-TNF biocomparable | Contraindicado | Toda la gestación | Muy baja | Debil |
| Tratamiento durante la lactancia en pacientes con AR activa | |||
|---|---|---|---|
| Fármaco y referencias | Consideraciones adicionales | Calidad de la evidencia | Fuerza de la recomendación |
| Prednisona130,149 | Dosis 7,5-10mg | Alta | Fuerte |
| AINE133 | Preferir los de vida media corta como ibuprofeno y paracetamol y administrarlos después de cada amamantamiento | Moderada | Débil |
| Antimaláricos130,133 | Hidroxicloroquina y cloroquina | Alta | Fuerte |
| Sulfasalazina130,132,133 | Precaución con lactantes prematuros, con deficiencia de la G6PD o hiperbilirrubinemia | Moderada | Débil |
| Azatioprina | Precaución en pacientes con deficiencia de la tiopurina metiltransferasa | Moderada | Débil |
| Certolizumab pegola,153,154 | Bajo responsabilidad del médico | Moderada | Débil |
| Metotrexato y leflunomida130-133 | Están contraindicados | Moderada | Fuerte |
| Fertilidad | ||
|---|---|---|
| Recomendación y referencias | Calidad de la evidencia | Fuerza de la recomendación |
| • Evaluar desde el diagnóstico de AR, y regularmente, el deseo gestacional | Baja | Buena práctica clínica |
| • Brindar consejo preconcepcional sobre la fertilidad, la actitud ante un embarazo no previsto y la planificación preconcepcional con fármacos no teratogénicos155-157 | Baja | Buena práctica clínica |
| • Recomendar el control de la enfermedad previo a la concepción | Baja | Buena práctica clínica |
| • Evitar el uso de AINE | Baja | Buena práctica clínica |
En pacientes embarazadas con actividad de moderada a alta a pesar de tratamiento y en casos de lactancia, el panel discutió y concluyó que es necesaria la precaución con la administración de certolizumab pegol, que los estudios que muestran poca biodisponibildad en el producto y en la leche no garantizan la ausencia de toxicidad, que se debe considerar el riesgo beneficio y vigilar cuidadosamente la posibilidad de infecciones.
Una de las principales causas de morbimortalidad en los pacientes con AR son las infecciones, y algunas pueden prevenirse con vacunación. Se estima que la cobertura de vacunación en el paciente con AR es subóptima y se enfatiza el papel del reumatólogo como promotor de esta, preferentemente antes del inicio de una terapia inmunosupresora120. La tabla 3 describe las principales recomendaciones sobre vacunación en pacientes con AR.
Vacunación en pacientes con AR
| Vacuna | Recomendación | Calidad de la evidencia | Fuerza de la recomendación |
|---|---|---|---|
| Todas | Cuando sea posible, administrarse en la fase estable de la enfermedad o previo a terapia farmacológica | Baja | Débil |
| Influenza24,158 (anual en temporada especificada) | Se recomienda su aplicación antes de la estación. Se prefiere la aplicación tetravalente sobre la trivalente. La vacuna de virus vivos (por inhalación) esta contraindicada.En el caso de uso de metotrexato se recomienda la suspensión 2semanas antes de su aplicación.En el caso de rituximab se recomienda un intervalo entre la vacuna y el biológico de al menos 6meses.Vacuna de alta dosis (high dose vaccine) para mayores de 65 años | Baja | Débil |
| Neumococo158 | PCV 13 (pocos estudios aún). Aplicar dosis única preferentemente antes del inicio del tratamiento inmunosupresor, seguido por PPV23 una dosis 8semanas después de la dosis inicial de PCV13, y una dosis más de PPV23 5años depués de la primera dosis de PPV23161 | Baja | Débil |
| Herpes zoster75,159-163(virus vivos atenuados) | Aplicar antes de la terapia con FARME sintético. Se sugiere aplicar 2 semanas antes del inicio de la terapia biológica y 4 semanas antes de los inhibidores de JAK | Baja | Débil |
| VPH | Se sugiere su administración en mujeres menores de 26años y hombres menores de 21años | Baja | Débil |
| Hepatitis B | Se sugiere su aplicación en pacientes con AR con antígeno de superficie negativo y en aquellos con factores de riesgo para adquirirlo | Baja | Débil |
| TDAP (tétanos, difteria, tosferina) | Dosis única a mayores de 19años que no la hayan recibido | Baja | Débil |
Las recomendaciones de buena práctica clínica sobre el escrutinio para Tb se basan en el estudio TBNET121, que se limita a la positividad de la intradermorreacción o del Interferon Gamma Release Assay (IGRA) en pacientes con AR; sin embargo, no se buscó Tb en los casos positivos. Se recomendó el uso del Enzyme-Linked ImmunoSorbent Assay (ELISA) y del Enzyme-Linked Immunosorbent Spot (ELISPOT) ante una supuesta mayor sensibilidad y especificidad frente a la tuberculina en pacientes que han recibido previamente la BCG122.
El IGRA no se encuentra fácilmente disponible en México, y además tiene un costo alto como prueba de escrutinio. La sensibilidad para Tb latente en general es similar para PPD y para IGRA. En caso de Tb activa se recomienda el uso del IGRA123.
En caso de positividad de PPD (>5mm) o IGRA, se recomienda el uso de terapia profiláctica con isoniazida por 9meses62, aunque un estudio reciente mostró que el uso de rifampicina por 4meses no fue inferior en eficacia al uso de isoniazida por 9meses63.
Consideraciones adicionalesPor la prevalencia de Tb en México y la baja disponibilidad del IGRA como prueba de escrutinio, se recomienda el inicio de profilaxis para Tb latente en pacientes con AR tratados con FARMEbo o inhibidores de JAK con PPD positivo.
Aspectos bioéticosEn las recomendaciones emitidas, las necesidades y preferencias individuales de cada paciente tienen un espacio prioritario, privilegiando el principio de autonomía124. En el contexto de enfermedades crónicas como la AR el paciente no solamente autoriza, sino que, junto con el equipo médico, se vuelve parte fundamental en la ejecución del plan de tratamiento (autonomía de decisión)125.
Por otra parte, es necesario reconocer el impacto de las disparidades en salud en los desenlaces de los pacientes con AR. En particular nos referimos a la ausencia de justicia distributiva125,126, y una de las dimensiones de dicho problema es el acceso inexistente o limitado a medicamentos de alto costo como los FARMEbo y los inhibidores de JAK. La reflexión bioética al respecto debe retomar dos aspectos. El primer aspecto es la decisión (o no) de solo incluir en las actuales guías de tratamiento escenarios clínicos ideales (si bien irreales) en los cuales se asume una cobertura total en salud, con la finalidad de señalar a las autoridades pertinentes el camino a seguir. No obstante, no debemos dejar de lado que la bioética también debe dar respuestas concretas a situaciones reales y no limitarse a una ética de máximos inalcanzables127; en este sentido, los reumatólogos hemos aprendido que la identificación temprana de los pacientes con AR y el tratamiento con FARMEsc modifica favorablemente los desenlaces de los pacientes; implica mayor esfuerzo y dedicación, pero su implementación es factible, necesaria y éticamente justificada, ya que en muchos contextos clínicos puede incluso solventar la falta de medicamentos de alto costo. El segundo aspecto, ligado al anterior, tiene que ver con el esfuerzo que debemos hacer para sensibilizar a las autoridades correspondientes e incluir a la AR como una enfermedad con gastos catastróficos128.
Por último, en la planeación y el desarrollo de este documento no han pasado inadvertidos los posibles conflictos de interés (https://es.unesco.org/). Muchos de los autores han sido seleccionados con base en su experiencia en el tema asignado, lo cual implica eventualmente participación y autoría con algunas de las opciones terapéuticas evaluadas o con ciertos trabajos revisados. Consideramos que esa experiencia es valiosa, pero tiene un potencial conflicto de intereses que se declara en este artículo.
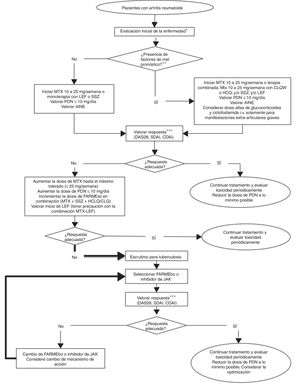
ConclusionesAunque existen diferentes guías terapéuticas actualizadas para el tratamiento de la AR, es muy importante que las recomendaciones que se emitan consideren el sistema de salud al cual van dirigidas. El CMR ha actualizado sus recomendaciones de tratamiento en AR, así como el algoritmo de tratamiento (fig. 1). Las principales aportaciones de esta actualización son las siguientes: se unificaron las recomendaciones de FARMEbo e inhibidores de JAK en una misma línea de tratamiento, se incluye en el texto la información sobre embarazo, lactancia, fertilidad, vacunación y se actualizó el algoritmo de manejo. Esta actualización se ha elaborado con fines aspiracionales y puntualiza la importancia de contar con al menos algunos de estos medicamentos de alto costo en los diferentes subsistemas de salud.
Algoritmo de tratamiento de la artritis reumatoide.
AINE: antiinflamatorio no esteroideo; CDAI: Clinical Disease Activity Index; CQL: Cloroquina; DAS28: Disease Activity Score 28; FARMEsc: fármaco modificador de enfermedad sintético convencional; FARMEbo: fármaco modificador de la enfermedad biológico; HCQ: hidroxicloroquina; LEF: leflunomida; MTX: metotrexato; PDN: prednisona; SDAI: Simplified Disease Activity Index; SSZ: sulfasalazina.
* Evaluación inicial clínica, serológica y radiológica de la enfermedad.
** Factores de mal pronóstico: seropositividad, enfermedad erosiva, alto nivel de actividad clínica y manifestaciones extraarticulares.
*** La valoración de la respuesta clínica puede ser de 4 a 12 semanas en caso de enfermedad activa, cada 12 semanas en caso de un bajo nivel de actividad y hasta cada 6 meses en caso de remisión sostenida sin descuidar la farmacovigilancia. Se considera respuesta adecuada a la remisión clínica o un bajo nivel de actividad.
El tratamiento adecuado de la AR debe incluir sistemas y procesos más eficientes, con un número óptimo de reumatólogos comprometidos, con el tiempo suficiente para brindar la atención adecuada, así como contar con las opciones farmacológicas que permitan el buen control de la enfermedad. Nada de lo anterior se puede lograr sin el apoyo gubernamental y el compromiso de todos los participantes.
FinanciaciónEste proyecto fue financiado por el Colegio Mexicano de Reumatología AC. El Colegio Mexicano de Reumatología agradece a Lilly, Roche, Sanofi y UCP por el apoyo financiero a través de un fondo educativo irrestricto.
Conflicto de interesesMario H. Cardiel declara haber sido investigador principal, asesor y conferencista para Abbvie, Astellas, Eli-Lilly, Janssen, Gilead, Pfizer, Roche.
Sandra M. Carrillo-Vázquez declara haber sido conferencista con Roche, Eli Lilly, Pfizer, Janssen, Novartis, Abbvie, Bristol. Ha recibido patrocinio para acudir a congresos en los últimos 3años por Roche, Pfizer, Novartis, Asofarma, UCB, y ha colaborado en protocolos de investigación con Genentech, GSK, Pfizer, SunPharma, Mallinkrodt ARD, Anthera Pharmaceuticals, Celgene.
Leonardo Limón-Camacho declara haber colaborado con Pfizer, Lilly, BMS, Roche, Janssen, UCB, Abbvie, Amgen y Novartis. Sergio R. Gutiérrez Ureña declara haber sido asesor, conferencista o patrocinado para eventos académicos por Pfizer, Lilly, Abbvie, Amgen, Takeda. Sergio Duran-Barragán declara haber colaborado con: AMGEN, BMS, Eli Lilly, Glaxo, Merck, Pfizer, Mallinckrodt, Amylin, R-Pharm Speaker: BMS, Roche, Eli Lilly.
Lilia Andrade Ortega declara ha sido patrocinada por Bristol Myers Squibb, Celgene, Janssen, Novartis, Pfizer, Roche y UCB.
Sandra Araceli Sicsik Ayala declara haber sido conferencista para Roche, UCB, Pfizer, Bristol, Novartis, Abbvie y Probiomed. Como investigadora ha recibido patrocinio por Abbvie, Eli Lily y GlaxoSmithKline.
Leonor Barile Fabris declara ser conferencista y asesora para UCB, Pfizer, Abbvie, Roche, Celgene.
María Azucena Ramos Sánchez declara haber sido patrocinada por Abbvie farmacéutica, Novartis, Pfizer, Roche y UCB.
Daniel Octavio Grageda Portes declara ser conferencista de Roche.
Margarita Portela Hernández declara haber recibido patrocinio de Roche, Pfizer, Bristol, UCB, Abbvie, Janssen y Lily.
José Luis García-Figueroa declara haber sido patrocinado por Expanscience y por Bristol Myers Squibb.
Cesar Pacheco-Tena declara haber colaborado con Abbvie, Roche, Bristol-Myers-Squibb, UCB, Merck-Serono, Astra-Zeneca, Novartis, Eli-Lilly, R-Pharm, Actelion, Sanofi, Janssen, Pfizer y Sandoz.
Mauricio Montero Luna declara haber sido patrocinado para asesorías, eventos académicos y conferencias organizadas por Novartis, Bristol-Myers-Squibb, Roche, Pfizer, UCB, Abbvie, Janssen, Expanscience y MSD.
Fedra Consuelo Irazoque Palazuelos declara haber sido patrocinada por Roche, Novartis, Celgene, Takeda, Pfizer, Lily, Janssen, Expanscience, Sanofi y Abbvie.
Carlos Abud-Mendoza declara haber participado como asesor y conferencista de Pfizer BMS, UCB, Lilly y Roche.
Virginia Pascual Ramos declara haber sido investigadora en proyectos de Pfizer y con UCB.
Sergio Cerpa Cruz declara haber participado como investigador para Sanofi, Astra Zeneca y Neovacs.
Jorge Enrique Aguilar Arreola declara haber participado como conferencista para Roche y Pfizer y haber recibido apoyo para asistir a congresos de Pfizer, Roche, Lilly, Abbvie y Asofarma.
Alina Hernández-Bedolla declara haber recibido beca para congresos por Bristol y ABBVIE, también ser conferencista para conferencias para Roche.
Luis H. Silveira declara haber recibido beca de Novartis para asistir a los dos últimos congresos mexicanos de Reumatología.
Alejandra López Rodríguez declara haber participado como conferencista para Roche, Eli Lilly, Pfizer, Celgene, BMS y en investigación clínica con Pfizer, Novartis, Eli Lily, Glaxo; también asesora con: Roche, Novartis, UCB, Eli Lily.
Greta Reyes-Cordero declara conflicto de intereses con Pfizer, UCB, Novartis, Bristol-Myers Squibb, Roche.
Humberto Alfredo Ricardez Puente declara conflicto de intereses con Bristol-Myers Squibb como subinvestigador y para asistencia a congresos y/o actualizaciones por Abbive, Pfizer, Janssen, Lilly.
María Fernanda Hernández Cabrera declara conflicto de intereses con Roche y Abbvie.
Javier Merayo-Chalico fue conferencista de Pfizer y recibió patrocinio para acudir a dos eventos académicos.
Daniel Xibillé Friedmann declara haber sido investigador principal, asesor o conferencista para Abbvie, BMS, Eli-Lilly, Janssen, Pfizer, Roche.
Sandra Muñoz López, Istar Guzmán Sánchez, María Esther Pérez-Bastidas, Marco Ulises Martínez Martínez, David Herrera van Ostdam, Guadalupe Olvera-Soto y Marcela Pérez declaran no tener ningún conflicto de intereses.
El Colegio Mexicano de Reumatología agradece las valiosas aportaciones y sugerencias de Concepción Cazariego de AMEPAR, Dra. Cecilia Guerrero Almeida, Dra. Polita del Rocío Cruz Cruz, Dra. Sara Morales Hernández y Dr. Alejandro E. Macías, quienes en su papel de paciente, infectólogos y ginecobstetras mejoraron el contenido de nuestras guías.
Los constantes avances terapéuticos en la artritis reumatoide (AR) obligan a revisar periódicamente las guías de tratamiento para ofrecer al médico tratante recomendaciones actualizadas, basadas en la evidencia y adaptadas a la realidad de la práctica clínica.