La ecografía es una técnica de imagen no invasiva, inocua, reproducible y coste-eficiente, que aporta información inmediata al poder realizarla en nuestras consultas. El buen perfil de la técnica y los avances tecnológicos acontecidos en los últimos años, que han permitido una mejora sustancial en la resolución de la imagen hasta hacerla casi anatómica, han impulsado la investigación sobre su aplicación al estudio integral de las enfermedades inflamatorias sistémicas. En la actualidad, se ha traspasado el umbral de utilizar la ecografía para investigar exclusivamente las manifestaciones músculo-esqueléticas, para aplicarla también al estudio de las manifestaciones extraarticulares y las comorbilidades asociadas a las enfermedades reumáticas. En la presente revisión repasaremos su utilidad para el diagnóstico de la afectación glandular en el síndrome de Sjögren, la enfermedad pulmonar intersticial o la arteritis de células gigantes y para la estratificación del riesgo cardiovascular en pacientes con enfermedades reumáticas inflamatorias crónicas.
Ultrasound is a non-invasive, innocuous, reproducible, cost-efficient imaging technique that provides immediate information, as it can be performed in our consultations. The good profile of ultrasound and the technological advances that have taken place in recent years, which have allowed a substantial improvement in the resolution of the image to make it almost anatomical, have promoted research on its application in the comprehensive study of systemic inflammatory diseases. At present, the threshold of using ultrasound to exclusively investigate musculoskeletal manifestations has been crossed, to also apply it to the study of extra-articular manifestations and comorbidities associated with rheumatic diseases. In this review we will revise its usefulness for the diagnosis of glandular involvement in Sjögren's syndrome, interstitial lung disease or giant cell arteritis and for stratification of cardiovascular risk in patients with chronic inflammatory rheumatic diseases.
Las enfermedades inflamatorias articulares, cuyo paradigma por prevalencia y avances en el conocimiento es la artritis reumatoide (AR), pueden presentar manifestaciones extraarticulares y/o comorbilidades asociadas al proceso inflamatorio a lo largo de su curso evolutivo, que incluso pueden acontecer en las fases precoces de la enfermedad o como manifestación de inicio. Estos procesos asociados no solo repercuten de forma negativa en la calidad de vida de los pacientes, sino que en ocasiones pueden comprometer la función de un órgano o la expectativa de vida del paciente. En el caso de vasculitis sistémicas como la arteritis de células gigantes (ACG), el compromiso visual en las formas predominantemente craneales o el compromiso vital o de órgano cuando se afectan los grandes vasos, hace indispensable un diagnóstico precoz.
La inocuidad y buena tolerancia de la ecografía por el paciente junto con el esfuerzo investigador y los avances tecnológicos acontecidos en los últimos años han convertido esta técnica en una de las herramientas diagnósticas de primera línea para la detección precoz de algunas manifestaciones extraarticulares y comorbilidades como el riesgo cardiovascular (RCV) en los pacientes con enfermedades inflamatorias sistémicas, por lo que en la presente revisión nos centraremos en los aspectos más relevantes y útiles para su aplicación con finalidad diagnóstica en la práctica clínica diaria.
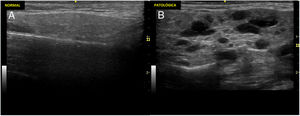
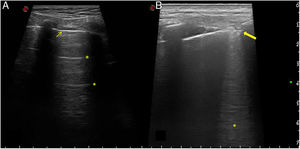
Ecografía de glándulas salivales mayores para diagnóstico del síndrome de SjögrenLa ecografía de glándulas salivales mayores (EcoGS), parótidas y glándulas submandibulares, ha demostrado ser capaz de detectar alteraciones estructurales típicas en el parénquima glandular de los pacientes con síndrome de Sjögren primario (SSp), que presentan afectación más frecuente y grave que los controles sanos y otras conectivopatías1,2. En la figura 1 se muestran ejemplos de ecografía de glándula parótida normal y patológica en síndrome de Sjögren. Aunque no se han identificado hallazgos ecográficos claramente diferenciales entre el SSp y el resto de conectivopatías, se ha descrito una potencial afectación predominante en glándula submandibular versus parótida en estas últimas frente a la frecuente afectación de ambas glándulas en el SSp2.
Ecografía de parótida normal y de paciente con síndrome de Sjögren.
Imágenes ecográficas representativas de glándulas parótidas con un parénquima normal y patológico. A). Imagen ecográfica de parótida normal. B). Cambios marcados de grado 3 según el índice OMERACT: pérdida difusa de la homogeneidad del parénquima con áreas hipo/anecoicas que ocupan toda la superficie glandular, sin tejido normal.
En cuanto a su efectividad diagnóstica, la EcoGS ha demostrado ser comparable a otras técnicas empleadas como la sialografía y la gammagrafía salival, y muy cercana a la resonancia magnética (RM), que si bien ha mostrado una sensibilidad y especificidad discretamente superiores a la EcoGS para la valoración de las parótidas, el menor coste y la mayor disponibilidad de la ecografía la sitúan en un lugar preferencial para su aplicación en la práctica clínica diaria3.
Con respecto a la relación entre la EcoGS y la biopsia de glándula salival menor (BioGS), estudios de comparación directa de ambas técnicas han mostrado una correlación moderada (r = 0,412), en una cohorte de 103 pacientes con sospecha de SSp en los que se comparó la EcoGS (parótida) con la biopsia de parótida y BioGS4; y buena (r = 0,61; p < 0,01), en un subestudio del ensayo TEARS, en los 24 pacientes en los que se realizaron ambas técnicas5.
El papel de la EcoGS en la clasificación del SSp se ha investigado evaluando el impacto de añadirla como un ítem adicional en diferentes criterios de clasificación, incluidos los recientes criterios de ACR-EULAR6, estimándose un peso de la ecografía patológica de 1, equivalente al de sus criterios menores. En este contexto y sin modificar el punto de corte para la clasificación, la EcoGS consigue un aumento de sensibilidad (97,3 vs. 95,9%) con una mínima reducción de especificidad (de 92,2 a 90,2%). Sin embargo, su uso en sustitución de ítems de estos criterios es más controvertido. Mientras que la sustitución de ítems menores por la EcoGS no parece afectar al rendimiento de los criterios, se desaconseja la sustitución de los ítems mayores (BioGS o anticuerpos anti-Ro) al disminuir sustancialmente su sensibilidad6.
La principal limitación para la aplicación de la EcoGS en práctica clínica hasta la fecha ha venido marcada por la gran heterogeneidad entre estudios, especialmente en la definición de lesiones e índices, junto con datos de fiabilidad no del todo robustos. Para solventar estas limitaciones, el Grupo de Sjögren de EULAR ha identificado las lesiones elementales más fiables, homogeneidad y ecogenicidad del parénquima glandular, tanto para imágenes estáticas como adquiridas7 y los elementos que contribuyen de forma independiente a predecir la clasificación por los criterios ACR-EULAR, ecogenicidad y presencia de focos hipo/anecoicos en parénquima (AUC = 0,857; R2= 0,539)8. La fuerte correlación existente entre la ecogenicidad y las áreas hipo/anecoicas, y entre los hallazgos glandulares de cada lado, a diferencia de la variabilidad interglandular, permite circunscribir la evaluación ecográfica al estudio de áreas hipo/anecoicas en una glándula parótida y una glándula submandibular, manteniendo la precisión (AUC = 0,846; R2= 0,498) y aumentando la factibilidad de la exploración8.
Sobre estas premisas, un amplio panel internacional de expertos, tras tres rondas Delphi, ha consensuado las definiciones de normalidad ecográfica y de las lesiones elementales, el protocolo de exploración y un índice ecográfico semicuantitativo (0-3) siguiendo la normativa OMERACT, con la posibilidad de aplicar una valoración cualitativa de glándula con degeneración grasa o fibrosa cuando no sea cuantificable (tabla 1). La fiabilidad, tras evaluación de vídeos en una plataforma web, fue excelente a nivel intraobservador y buena para interobservador (Light's kappa 0,79 y 0,62, respectivamente)9.
Índice ecográfico de glándulas salivales mayores (parótidas y submandibulares) del Grupo OMERACT
| Ítems evaluados | Hallazgos ecográficos | Puntuación |
|---|---|---|
| Índice semicuantitativo | ||
| 0 = normal | Parénquima normal | 0 |
| 1 = cambios mínimos | Pérdida leve de homogeneidad del parénquima sin áreas hipo/anecoicas | 1 |
| 2 = cambios moderados | Pérdida moderada de homogeneidad del parénquima con áreas hipo/anecoicas focales, rodeadas por tejido normal | 2 |
| 3 = cambios marcados | Pérdida de homogeneidad del parénquima difusa con áreas hipo/anecoicas que ocupan toda la superficie glandular, sin tejido normal | 3 |
| Índice cualitativo | ||
| Glándula grasa | Glándula difusamente hiperecogénica con respecto a los tejidos blandos circundantes | 1 |
| Glándula fibrosa | Glándula fibrótica con bandas hiperecoicas glandulares que la hacen indistinguible de los tejidos blandos circundantes | 3 |
OMERACT: Outcome Measures in Rheumatology.
En un intento de mejorar la fiabilidad y factibilidad de la EcoGS con el objetivo de convertirla en una herramienta diagnóstica no invasiva y efectiva que pueda sustituir a los test diagnósticos actuales, el Proyecto HarmonicSS de la Comunidad Europea, está sometiendo las imágenes ecográficas a un proceso de segmentación y análisis automático por algoritmos de inteligencia artificial. Un análisis preliminar de 600 EcoGS, obtenidas y puntuadas por ecografistas expertos de dos cohortes de SSp, ha identificado al algoritmo MLP (Multilayer perceptron) como mejor clasificador (κ = 0,7), con una fiabilidad intraobservador en el rango humano (κ = 0,71) y superando la fiabilidad interobservador media humana (κ = 0,67)10. Estos avances pueden llegar a ser de mayor calado conforme aumente el tamaño de la cohorte final.
El tiempo de exploración descrito para la evaluación ecográfica de las glándulas salivales mayores oscila entre 11 y 27 minutos para las valoraciones más extensas en cuanto a parámetros y a número de glándulas a explorar7. Sin embargo, el nuevo índice ecográfico propuesto por OMERACT9 aumenta su factibilidad al reducir el tiempo de exploración a la mitad.
Ecografía para el estudio de la enfermedad pulmonar intersticial difusaEl retraso en la aplicación de la ecografía pulmonar (EcoPulm) en Reumatología viene condicionado porque está limitada por barreras acústicas, dado que el aire y el hueso no conducen los ultrasonidos, y porque supone un cambio de concepto. Se basa en la interpretación de hallazgos relacionados con cambios en las propiedades físicas del pulmón, que no son anatómicos sino artefactos, que siempre hemos intentado evitar en la ecografía músculo-esquelética.
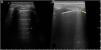
Los estudios sobre la utilidad de la EcoPulm para el screening de la enfermedad pulmonar intersticial difusa (EPID) se han centrado en la evaluación de las líneas B y la línea pleural (tabla 2). Las líneas B o «cometas» son unos artefactos que se originan cuando el contenido de aire del parénquima pulmonar disminuye parcialmente y/o el espacio intersticial se expande volumétricamente. No conllevan un diagnóstico etiológico, pues se producen también en otras patologías como el edema, ni permiten discriminar entre una fase inflamatoria o fibrótica de la EPID. La línea pleural patológica puede mostrar irregularidades, engrosamiento, fragmentación y nódulos subpleurales. En la figura 2 se muestran ecografías de pulmón sano y afectado por EPID.
Patrones ecográficos pulmonares de normalidad y en enfermedad pulmonar intersticial difusa
| Tipos de patrón | Hallazgos ecográficos | Descripción y origen de los artefactos |
|---|---|---|
| Patrón pulmonar normal | Línea pleural fina y regular | Línea hiperecoica horizontal visible entre rebordes costales, situada 0,5 cm por debajo. Producida por la interfase pleuro-pulmonar |
| Deslizamiento pulmonar | Movimiento oscilante de la línea pleural, sincronizado con la respiración. Se corresponde con el desplazamiento pulmonar a lo largo de su eje craneocaudal | |
| Líneas A | Líneas hiperecoicas, horizontales, situadas por debajo de la línea pleural a intervalos regulares. Representan artefactos de reverberación de la musculatura intercostal | |
| Patrón en enfermedad pulmonar intersticial difusa | Líneas B | Líneas hiperecoicas verticales, bien definidas, tipo rayo láser, que surgen de la línea pleural y se extienden hasta la profundidad sin desvanecerse, borrando las líneas A. Derivadas del engrosamiento de los septos interlobulares subpleurales |
| Alteraciones de la línea pleural | Irregularidad, engrosamiento, fragmentación, nódulos subpleurales |
Ecografía pulmonar normal y con enfermedad pulmonar intersticial.
Imágenes ecográficas representativas de pulmón normal y patológico. A). Patrón pulmonar normal. Se aprecia una línea pleural fina y regular (flecha fina), visible entre los rebordes costales, que dejan sombra posterior, así como la presencia de líneas A (asteriscos), que son las líneas hiperecoicas, horizontales, situadas por debajo de la línea pleural a intervalos regulares. B). Patrón pulmonar patológico. La línea pleural muestra irregularidad, engrosamiento y fragmentación (flecha gruesa). Se observan líneas B (asterisco), que son las líneas hiperecoicas verticales que surgen de la línea pleural y se extienden hasta la profundidad sin desvanecerse, borrando las líneas A.
Las evidencias más sólidas se han publicado en esclerodermia donde la evaluación de la validez de aspecto, criterio y constructo está más avanzada, tanto en formas evolucionadas como en las fases más precoces de la enfermedad. En este sentido se ha descrito una buena correlación de las líneas B con otras técnicas diagnósticas de EPID como la tomografía axial computarizada de alta resolución (TACAR) (r = 0,81; p < 0,0001) y los parámetros de las pruebas de función respiratoria como la capacidad de difusión pulmonar para el monóxido de carbono (DLCO) (r = -0,60; p < 0,05) y la capacidad vital forzada (CVF) (r = -0,48; p < 0,001)11,12. También se ha descrito su correlación con parámetros clínico-analíticos como los anticuerpos antitopoisomerasa-1 (Scl70), el subtipo de afectación cutánea difusa, la progresión del daño en capilaroscopia, las úlceras digitales o el índice de gravedad12. La precisión publicada es alta, con elevados valores de sensibilidad (83,9%), especificidad (87%) y odds ratio (OR) diagnóstica (42,9)13 y una buena fiabilidad intra- e interobservador11, lo que postula a la EcoPulm como un potencial método de screening de EPID en esclerodermia.
Entre las limitaciones de la técnica destacan la gran heterogeneidad de la evidencia publicada en lo que se refiere a recuentos ecográficos e índices de líneas B, a los puntos de corte establecidos para definir enfermedad, al equipamiento (desde ecógrafos de alta gama a otros de bolsillo), a las sondas empleadas (cardiológica, lineal o cónvex) o a la experiencia del explorador. Desde el primer índice de 72 espacios intercostales11, se han ido comunicando recuentos progresivamente más reducidos de hasta 10 espacios intercostales14, en busca de una mayor factibilidad, intentando mantener la precisión. Sin embargo, aún no se ha consensuado ni la curva de aprendizaje, ni el procedimiento ni un índice validado que faciliten su implementación en la práctica clínica con las garantías necesarias.
Con respecto a la evaluación de la línea pleural, algunos autores sugieren que presenta un mejor valor predictivo negativo (VPN) de EPID que las líneas B y una mejor discriminación frente a controles sanos, ya que mientras que las líneas B están presentes en el 35% de los pacientes con esclerodermia que no muestran evidencias de EPID en el TACAR y en el 7% de los controles, no encuentran alteraciones de la línea pleural en ninguno de esos dos contextos15.
En otras enfermedades como SSp, AR o síndrome antisintetasa los estudios están en una fase preliminar y limitados por el pequeño tamaño muestral, aunque los resultados parecen ir en la misma línea que en la esclerodermia16-18.
Aunque los datos son prometedores, en el momento actual no disponemos de evidencias que nos permitan usar la EcoPulm de forma alternativa a las pruebas diagnósticas convencionales ni tampoco sustituirlas en el seguimiento, a la espera de completar su validación como medida de desenlace.
En cuanto al tiempo necesario para la exploración e interpretación de la ecografía pulmonar, éste va a depender del índice empleado con rangos que oscilan entre los 5-6 minutos para los más reducidos, 9 minutos para los abreviados y 23-24 minutos para para los más extensos11,14.
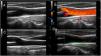
Ecografía de arterias temporales y axilares para el estudio de la ACGLas evidencias sobre la utilidad de la ecografía para el diagnóstico de la ACG se han ido acumulando en los últimos 20 años y su validez se ha confirmado en varios metaanálisis. Esto ha llevado a que en las recientes recomendaciones EULAR sobre el uso de la imagen en las vasculitis de grandes vasos en la práctica clínica19, la ecografía de las arterias temporales y/o axilares se sitúe como la primera modalidad de imagen recomendada en pacientes con sospecha de ACG predominantemente craneal, considerándose el «signo del halo» no compresible como el hallazgo más sugestivo. El signo de la compresión positivo se caracteriza por la persistencia de la visibilidad de la pared vascular (halo) al ejercer presión con la sonda cuando su engrosamiento es vasculítico. Es sencillo, rápido, fiable (Krippendorff'sα interobservador 0,92) y tiene una elevada sensibilidad (75-79%) y especificidad (100%) para el diagnóstico de ACG20. En la figura 3 se muestra el característico signo del halo en una ecografía de un paciente con ACG y su comparación con una ecografía de arteria temporal normal.
Ecografía de arteria temporal normal y con arteritis de células gigantes.
Signo del halo de arteria temporal en corte longitudinal (A) y transversal (B). Se aprecia el engrosamiento de la pared de la arteria temporal (asteriscos). En las imágenes C y D se muestran imágenes ecográficas de arteria temporal normal en corte longitudinal y transversal, respectivamente.
La preferencia de la ecografía, siempre que esté disponible de forma precoz y se garantice la pericia del explorador, sobre la biopsia de arteria temporal (BAT) se debe a su menor invasividad, la inmediatez de los resultados, los altos niveles de evidencia de su validez y su menor coste19. La elección de las arterias temporales y axilares como exploración rutinaria ante la sospecha de ACG se debe a que siempre han mostrado halo de forma adicional a los hallazgos vasculíticos en las otras áreas vasculares cuando se han realizado evaluaciones extensas de grandes vasos periféricos, y al ser el tiempo de exploración más reducido, aumenta su factibilidad en la práctica clínica21.
El inicio del tratamiento esteroideo nunca debe retrasarse por la prueba de imagen, siendo preferible realizarla en la primera semana porque, aunque la media de tiempo hasta la resolución del halo suele ser de dos a tres semanas, siendo más prolongado a mayor número de ramas afectadas22, algunos autores refieren una disminución más rápida de la sensibilidad a partir de los cinco días19.
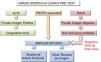
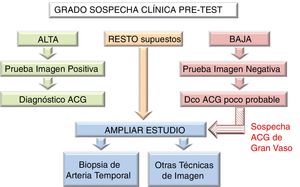
La necesidad de emplear técnicas diagnósticas adicionales, como BAT u otras técnicas de imagen (RM, TAC y PET-TAC), o de ampliar la exploración ecográfica a otros territorios vasculares, va a venir marcada por el grado de sospecha clínica pre-test y el resultado de la primera técnica de imagen. De tal forma que si la sospecha es alta y la imagen es positiva, o la sospecha clínica es baja y la imagen es negativa, se puede hacer o excluir el diagnóstico de ACG, respectivamente, sin necesidad de pruebas adicionales. En el resto de las situaciones o si existe sospecha de arteritis extracraneal, se recomienda ampliar el estudio19 (figura 4).
Algoritmo diagnóstico de la arteritis de células gigantes.
Algoritmo aplicable a centros en los que la ecografía pueda realizarse precozmente y con adecuada calidad. Sin embargo, en centros en los que la ecografía no pueda estar disponible de forma precoz o la pericia del explorador sea cuestionable, se dará prioridad a la biopsia de arteria temporal como primer test diagnóstico.
ACG: arteritis de células gigantes; DCO: diagnóstico.
El impacto clínico de la aplicación de la ecografía con fines diagnósticos en el seno de circuitos de derivación rápida se ha estudiado comparando los desenlaces obtenidos frente a la práctica clínica convencional y a cohortes históricas. El beneficio es evidente consiguiendo reducir significativamente el tiempo de evolución hasta el diagnóstico (79% en 24 horas vs. 64,6%, p = 0,023) y la pérdida de visión permanente (9 vs. 37%), en circuito rápido versus práctica clínica convencional, respectivamente23.
Los avances se dirigen hacia la medición del grosor íntima-media (IMT) de los distintos territorios vasculares afectados para un diagnóstico más precoz y preciso de ACG, siendo necesarios equipos ecográficos de alta gama. Se han identificado puntos de corte de IMT que se asocian con afectación vasculítica: 0,29-0,42 mm para las distintas ramas de las arterias temporales y 1 mm para las arterias axilares24.
Por otro lado, parece aconsejable realizar una valoración integral de estos enfermos, ya que del 12 al 50% de ellos van a presentar afectación extracraneal21 y las técnicas de imagen pueden ayudarnos a identificar subtipos clínicos de pacientes, según sea su afectación de arterias temporales y extracraneales. En los pacientes con afectación exclusiva de arterias temporales predominan los síntomas visuales e isquémicos craneales, mientras que si se afectan principalmente los vasos extracraneales, la enfermedad predomina en mujeres, más jóvenes, con poca clínica visual e isquémica craneal y más síntomas pulmonares y vasculares en miembros superiores e inferiores. La afectación combinada es más frecuente en hombres mayores, con importantes alteraciones analíticas, síntomas craneales y vasculares, sobre todo en miembros inferiores25.
Por último, en 2011 se inició un estudio observacional internacional bajo los auspicios de EULAR y ACR, el DCVAS (Diagnostic and Classification Criteria for Vasculitis), diseñado para desarrollar y validar criterios diagnósticos y para mejorar y validar los criterios de clasificación de seis formas de vasculitis sistémicas entre las que se encuentra la ACG26. El estudio ha incorporado datos detallados clínicos, analíticos, de biopsia e imagen, incluida la ecografía. Se ha presentado una propuesta preliminar en forma de comunicación oral en el Congreso ACR de 2018, pero están aún pendientes de validación y publicación.
El tiempo necesario para detectar cambios vasculíticos en las arterias temporales mediante el signo de compresión positivo del halo es corto, 6,4 ± 2,1 minutos20, pudiendo aumentar a unos 10 a 15 minutos si fuese necesario evaluar también las arterias axilares.
Ecografía de carótidas para la estratificación del RCVLa AR y otras enfermedades inflamatorias crónicas mediadas inmunológicamente están fuertemente asociadas a la aterosclerosis, interviniendo en este proceso tanto las características de la enfermedad como los factores de riesgo cardiovascular (FRCV) tradicionales. Por eso, para tener en cuenta el peso de la inflamación, en las últimas recomendaciones EULAR para el manejo del RCV en estos pacientes, se aconseja emplear un SCORE (Systematic Coronary Risk Evaluation) modificado (mSCORE) que incluye un factor multiplicador de 1,5 en todos los pacientes con AR27.
Además del SCORE y del índice de Framingham28, éste último más utilizado en Estados Unidos, existen otros sistemas para predecir el RCV. Estos modelos predictivos difieren en los FRCV que incluyen y en los umbrales y objetivos terapéuticos. No disponemos de evidencias que indiquen la superioridad de uno frente a otro, siendo su rendimiento parecido cuando se aplican a poblaciones con unas características similares a las de las poblaciones a partir de las cuales se derivó su cálculo. Por esta última razón, las guías europeas de prevención de la enfermedad cardiovascular29 y las recomendaciones EULAR para el manejo del RCV en las enfermedades reumáticas27 aconsejan el uso del SCORE en Europa, ya que este sistema se basa en los datos obtenidos a partir de 12 cohortes europeas representativas. Además, se ha recalibrado en algunos países en los que el RCV es bajo (entre los que se encuentra España) y ha sido validado externamente, lo que incrementa su interés en la práctica clínica.
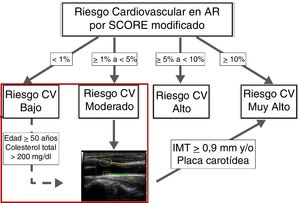
Sin embargo, las evidencias disponibles provenientes de un estudio de base poblacional en pacientes con AR de nuestro entorno sin diabetes mellitus, enfermedad renal ni otros FRCV, indican que este mSCORE infraestima el RCV, presentando una sensibilidad del 18% (IC 95%, 12-25). Mientras que el mSCORE sólo reclasifica a riesgo alto o muy alto a cinco de las 327 AR estudiadas, el hallazgo de placas y/o el incremento del IMT carotideo (cIMT) en la ecografía de carótidas (EcoCar) reclasifica a riesgo muy alto al 13% de los pacientes catalogados de bajo riesgo y al 63% de los de riesgo moderado30. En un estudio posterior centrado exclusivamente en AR con bajo riesgo por el mSCORE, en los modelos de regresión multivariante se han identificado como factores predictores de la presencia de placa a la edad y la concentración sérica de colesterol total, con un punto de corte óptimo para la edad de 50 años y para el colesterol de 200 mg/dL31. Con estas evidencias, se podría actualizar un algoritmo previo de estratificación del RCV en AR que incorpora la EcoCar32, recomendándola para la evaluación de los pacientes con riesgo moderado por el mSCORE y en casos seleccionados de riesgo bajo. Los pacientes que presenten un cIMT ≥ 0,9 mm o placa carotídea serán reclasificados a RCV muy alto (figura 5).
Algoritmo de estratificación del riesgo cardiovascular en artritis reumatoide.
En la imagen ecográfica se muestran placas carotídeas enmarcadas por círculos. El grosor íntima-media se corresponde con el área sombreada en verde entre la íntima y la adventicia en la pared lejana de la carótida.
AR: artritis reumatoide; CV: cardiovascular; IMT: grosor íntima-media (intima-media thickness); SCORE: índice para la evaluación sistemática del riesgo coronario (Systematic Coronary Risk Evaluation).
Modificada de: González-Gay MA. Ann Rheum Dis. 201232.
Con respecto a otras enfermedades inflamatorias articulares crónicas, encontramos datos superponibles en artritis psoriásica, con un aumento de prevalencia de placas y cIMT elevado, así como una mayor capacidad de reclasificación del RCV de la EcoCar frente al mSCORE33.
La placa es reconocida como marcador de enfermedad cardiovascular y factor modificador de la clasificación del RCV en todas las guías de prevención, incluidas las de EULAR en las que se recomienda considerar el screening de placas ateroescleróticas asintomáticas mediante EcoCar en pacientes con AR27. Sin embargo, el valor del cIMT es objeto de intenso debate, habiéndose desaconsejado su uso para valorar el riesgo de un primer evento cardiovascular en práctica clínica en las últimas guías para la valoración del RCV del Colegio Americano de Cardiólogos y de la Asociación Americana del Corazón y las Guías Europeas de Prevención de la Enfermedad Cardiovascular en la Práctica Clínica. Actualmente existen estudios poblacionales longitudinales en marcha que ayudarán a clarificar este aspecto crucial. En la figura 6 se muestran imágenes ecográficas de carótidas con placas y normales, y de medición del cIMT por radiofrecuencia.
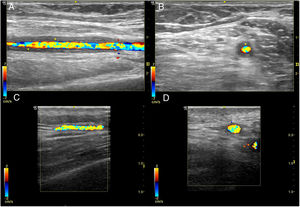
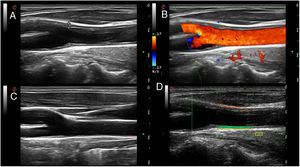
Ecografía de carótida normal y con placas, y medición del cIMT.
En las imágenes A y B se representa una arteria carótida con placas de ateroma blandas (asterisco) en la bifurcación carotídea, en escala de grises (delimitada por símbolos de medida «+») y Doppler color, respectivamente. Las placas de ateroma se visualizan como protrusiones focales en la luz vascular. En el ejemplo de la imagen A la placa mide 1,7 mm desde la interfase media-adventicia a la interfase íntima-luz vascular. En la imagen C se muestra una carótida normal. En la imagen D se presenta la medición del cIMT carotídeo mediante radiofrecuencia. El cIMT está representado por el área de color verde comprendida entre la interfase íntima-luz vascular y la interfase media-adventicia (línea naranja), en la pared lejana de la carótida.
En cuanto a la utilidad de la implementación en práctica clínica de estrategias T2T frente a los FRCV clásicos en la AR, los resultados de un estudio recientemente publicado asocian esta estrategia con una disminución significativa de la progresión del cIMT, de los valores séricos de colesterol LDL y de los eventos cardiovasculares fatales y no fatales a los cinco años de seguimiento cuando se comparan con la práctica clínica habitual34. Estos resultados sugieren que el reumatólogo deber tener un papel más proactivo en el manejo del RCV de sus pacientes, máxime cuando el tiempo de exploración para la evaluación de la presencia de placas y la medición del cIMT está entre 10 a 15 minutos, según la pericia del explorador.
En resumen, la EcoGS parece aumentar la sensibilidad de los Criterios de Clasificación del SSp. La evaluación de líneas B y línea pleural es prometedora para el screening de las EPID. La ecografía de arterias temporales y/o axilares está recomendada como primera prueba de imagen ante la sospecha de ACG. La ecografía carotídea mejora la estratificación del RCV en artritis reumatoide y posiblemente en otras enfermedades inflamatorias crónicas.
La agenda futura de investigación para la aplicación de la ecografía al estudio de las manifestaciones extraarticulares de las enfermedades inflamatorias sistémicas reumáticas es amplia y apasionante. En el terreno diagnóstico se requiere completar el proceso de consenso de índices ecográficos factibles que se puedan incorporar como elemento de valor añadido a los criterios de clasificación y diagnóstico de las respectivas enfermedades. Asimismo, es necesario seguir investigando sobre el papel de la ecografía como potencial biomarcador de actividad subclínica y de respuesta terapéutica, especialmente con el advenimiento de tratamientos biológicos altamente eficaces, pero que conllevan un alto coste y que no están exentos de efectos secundarios. Otra área de gran interés es la relativa al papel de la ecografía como herramienta para la evaluación del daño y el seguimiento de los pacientes, siendo precisos estudios multicéntricos con un tamaño muestral adecuado que permitan obtener conclusiones que sean aplicables a la práctica clínica. Por último, los avances en el terreno de la aplicación de la inteligencia artificial en la evaluación de las exploraciones obtenidas mediante técnicas de imagen pueden suponer un salto cualitativo que mejore el proceso diagnóstico de estas enfermedades. Sin olvidarnos de que hay nuevos campos de interés como la evaluación de la piel en enfermedades como la esclerodermia o la enfermedad psoriásica. Todo ello abre importantes retos a afrontar. El primero de ellos es el tecnológico, ya que se van a precisar equipos ecográficos de alta gama que incorporen sondas de distinto tipo (lineales convencionales y de huella pequeña, convexas), que abarquen un mayor rango de frecuencias (desde bajas a altas o muy altas), a escoger según la estructura a examinar y con el objetivo de obtener imágenes de máxima resolución. Por otro lado, el reto humano, siendo necesario establecer programas de formación supervisada, que garanticen la adquisición de experiencia y pericia por el explorador.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno. Esta revisión fue presentada parcialmente como comunicación oral en el XXIII Congreso de la Sociedad de Reumatología de la Comunidad Autónoma de Madrid (SORCOM), celebrado en Madrid en diciembre de 2019.