En la actualidad el estudio del líquido sinovial (LS) es una herramienta que se utiliza con frecuencia en los laboratorios especializados y que permite establecer el diagnóstico de artropatías por cristales, apoya el diagnóstico de las artritis sépticas y ayuda a establecer otros diagnósticos reumatológicos como la monoartritis o los derrames articulares. El estudio completo del LS incluye los siguientes análisis: 1) macroscópico, 2) microscópico y 3) uso de tinciones específicas. Cada uno de los estudios proporciona información del estado de la articulación y ayuda a establecer el diagnóstico y tratamiento. Las características que se deben describir en el análisis macroscópico son: color, volumen y viscosidad. El estudio microscópico, confirma la existencia de un proceso inflamatorio, infeccioso y la presencia de cristales. El microscopio de luz polarizada es una herramienta fundamental para el estudio del LS y la diferenciación de los cristales, la cual no solo depende de la forma, sino también de la birrefringencia. Es importante mencionar que en el análisis microscópico los artefactos pueden confundir al observador inexperto. Una adecuada interpretación del análisis del LS requiere de la observación de por lo menos 2 observadores capacitados. La información que proporciona el análisis del LS al clínico da los elementos necesarios para establecer el diagnóstico del paciente así como el tratamiento del mismo. Las tinciones en el análisis del LS ayudan a la identificación de cristales no birrefringentes, como son los de hidroxiapatita de calcio. Actualmente, en el estudio del LS se están explorando nuevos campos que incluyen cuantificación de citocinas, quimiocinas e inmunoglobulinas y la caracterización de las estirpes celulares.
At present, the study of the synovial fluid (SF) is a tool that is used frequently in specialized laboratories because it allows the establishment of diagnosis of crystal associated arthropathies, supports the diagnosis of septic arthritis and helps establish other rheumatologic diagnoses such as monoarthritis or joint effusion.
The complete study of the SF includes the following analyses: 1. Macroscopic; 2. Microscopic; and 3. Specific stains. Each one provides information of the joint's state and helps in the establishment of diagnosis and treatment. The characteristics that must be described in the macroscopic analysis are: color, volume and viscosity. Microscopic analysis of the SF confirms the presence of an inflammatory or infectious processes and allows for the detection and identification of crystals. Polarized light microscope is a fundamental tool for the analysis of SF and for the identification of the crystals present in the samples, which not only depend on the form, but also of their birefringence. It is important to mention that in the microscopic analysis, artifacts can confuse the inexperienced observer. A suitable interpretation of the analysis of SF requires the observation by at least two experienced observers. The information that the analysis of SF provides to the clinicians gives them the necessary elements to establish the diagnosis and to decide on treatment. Specific stains in the analysis of SF help in the identification of non-birefringent crystals as those of calcium hydroxypatite. In SF analysis, new fields are being explored that include quantification of cytokines, chemokines, immunoglobulins and the characterization of cell lineages.
El estudio del líquido sinovial (LS) mediante microscopia de luz polarizada inició en 1961, con los trabajos de Daniel J. McCarty y Joseph Lee Hollander1,2. En sus trabajos identificaron cristales de urato monosódico en pacientes con gota y cristales de pirofosfato de calcio en pacientes con pseudogota. Debido a que el estudio implica la toma de muestra por un método invasivo, su uso en el diagnóstico es bajo por el temor de causar daño, a pesar de que el análisis proporciona elementos que permiten hacer el diagnóstico de gota u otras artropatías por cristales. En los últimos años se ha ido modificando el procedimiento y en la actualidad sabemos que, siendo la articulación el microambiente donde se desarrolla la inflamación, con todos sus efectos, el estudio del LS proporciona información importante para establecer los diagnósticos y en su caso iniciar el tratamiento.
Por otro lado, el estudio del LS ha permitido establecer criterios para el diagnóstico de gota. En el 2009, Malik y colaboradores realizaron un estudio comparativo en el que concluyeron que la identificación de los cristales de urato monosódico sigue siendo el estándar de oro para el diagnóstico definitivo de gota3. El análisis del LS es una prueba sencilla cuya mayor complicación es contar con un microscopio de luz polarizada, reactivos y personal capacitado.
En 1995 el Colegio Americano de Reumatología estableció los criterios para el análisis de LS4.
En relación a la metodología, el análisis del LS comprende 3 análisis básicos: 1) macroscópico, el cual permite definir las características físicas de la muestra (vg. volumen, color y viscosidad); 2) microscópico, el cual incluye: la cuenta de leucocitos totales y la búsqueda y definición de cristales mediante luz polarizada; y 3) uso de tinciones diferenciales (vg. Gram, Wright, Rojo Alizarina y Negro Sudán entre otras).
Análisis macroscópicoEl LS normal es de color amarillo paja. Si se coloca en un tubo de ensayo se puede leer un texto a través de él. Tiene una viscosidad similar a la de la clara de huevo. El LS se incluye entre los fluidos no newtonianos y dentro de estos como un fluido pseudoplástico. Una forma práctica y sencilla de medir la viscosidad del LS es colocar una gota en un portaobjetos y con un aplicador de madera levantarla lentamente. El LS normal debe hacer una hebra de 3–6cm de longitud. A esta propiedad se le conoce como fílancia. La fílancia se define como la capacidad de una mucosidad de extenderse hasta formar hilos. El tamaño de la hebra del LS disminuye en procesos inflamatorios. Se pueden hacer mediciones más exactas utilizando un viscosímetro, en cuyo caso el valor normal de la viscosidad del LS es G″=45±8Pa5. La observación macroscópica es el primer análisis que se debe realizar. El análisis muestra cuando el líquido es normal o contiene sangre, grasa, elementos formes o artefactos, la viscosidad y la claridad permiten establecer si es un líquido normal o inflamatorio. La medición del volumen proporciona datos importantes en relación al tipo de LS que se está estudiando (ver tabla 1). El volumen máximo de LS que se puede obtener de una articulación normal es de aproximadamente 3,5ml (entre 0,1 y 3,5ml)6. Si se obtiene un volumen mayor es indicativo de un proceso inflamatorio. En ausencia de derrame articular es poco probable obtener volúmenes grandes de LS, por ello es importante reportar la cantidad de líquido obtenido en la artrocentesis. El análisis macroscópico permite definir los estudios posteriores que se deben realizar a la muestra.
Análisis microscópicoCuenta celular. La cuenta celular debe realizarse dentro de las 2 primeras horas posteriores a la toma de la muestra, lecturas posteriores influyen en los resultados, debido a la fragilidad de las células fuera de la articulación. La cuenta de células se debe realizar de manera manual en cámara de Neubauer diluyendo la muestra en solución hipotónica (0,3%) de cloruro de sodio, debido a que los equipos automatizados pueden dar valores erróneos a causa de la viscosidad del líquido o a la presencia de artefactos. La dilución del LS se hace en una pipeta de Thoma para células blancas, la cual tiene 2 marcas de llenado o afores, la primera es 0,5 y corresponde a 20μL, hasta la cual se debe llenar con el LS y la segunda es 11 y corresponde a 200μL, hasta la cual se debe llenar con solución salina. Se homogeniza suavemente por inversión durante un minuto aproximadamente y posteriormente se coloca en la cámara de Neubauer. Se cuentan en el microscopio los 4 cuadrantes para leucocitos. La cuenta de leucocitos del LS normal debe ser menor de 200 células/μL (tabla 1). La fórmula que se utiliza para conocer el número de células es: 4N×50=células/μL
Donde:
4N=número de células blancas contadas en los 4 cuadrantes
50=factor de dilución
Identificación de cristales. El análisis microscópico incluye la búsqueda de cristales y la caracterización de su refringencia, lo cual se hace en un microscopio de luz polarizada.
La luz polarizada se genera con el uso de un lente polarizado sobre una fuente de luz visible. El lente polarizado o polarizador filtra la luz, dejando pasar aquella que está en un solo plano, posteriormente un segundo polarizador (también conocido como analizador) ubicado sobre el primer filtro, orienta la luz de manera perpendicular a este, haciendo que la luz sea bloqueada y que el campo que se observa a través del ocular sea oscuro. Si un cristal birrefringente es colocado entre los polarizadores, la luz es separada en longitudes de onda corta y larga. Algunos de estos rayos atraviesan el segundo polarizador y hacen que los cristales se observen brillantes en el campo oscuro. La luminosidad es una característica de los materiales birrefringentes. Generalmente se usa un compensador rojo para eliminar la luz verde, lo que produce un fondo rosa en lugar del campo oscuro. El compensador rojo tiene una longitud de onda de 540nm. Cuando el plano de luz generado por un cristal es paralelo al plano del compensador, hace que ciertos cristales se observen de color azul, si este mismo cristal es rotado 90°, su plano de luz será paralelo al analizador y se observará amarillo. Cuando un cristal se orienta en forma paralela al compensador y se observa azul se dice que tiene elongación positiva. Si el cristal se orienta en forma paralela al compensador y se observa de color amarillo entonces tiene elongación negativa4. Otra característica de los cristales birrefringentes verdaderos es que tienen un ángulo de extinción, el cual es un fenómeno que se observa cuando se gira la platina del microscopio para orientar los cristales de manera perpendicular al compensador con lo que se pierden los colores amarillo y azul y se tiene un efecto como si desaparecieran los cristales que se están analizando. El ángulo de extinción varía dependiendo de la naturaleza de los cristales.
El análisis microscópico de los LS debe incluir la descripción de la forma (aguja, romboideo, cuadrado con muesca, forma de puro, bipiramidal, cruz de malta, etc.), birrefringencia, localización (intracelulares o extracelulares) y cantidad (escasos o abundantes) de los cristales observados.
Debido a que el costo de los microscopios de luz polarizada es alto, existe una alternativa que puede ayudar a convertir un microscopio de luz visible en microscopio de luz polarizada. Lo anterior se hace poniendo 2 filtros con una longitud de onda mayor a 600nm, uno directamente sobre la fuente de luz y otro entre la muestra y el observador. Se debe colocar también sobre el primer filtro un portaobjetos al cual se le pone a lo largo un pedazo de celofán adhesivo transparente, con el cual se obtiene una longitud de onda entre 250 y 350nm7. Con el sistema «casero» no es posible determinar el tipo de birrefringencia de los cristales, pero usando como controles cristales de composición conocida, es posible establecer por comparación el tipo de cristal observado.
Identificación de cristales mediante el uso de colorantesTinción con rojo alizarina. Los cristales de hidroxiapatita de calcio (Ca10[PO4]6-[OH]2) y otros cristales de fosfato de calcio, se disponen en cúmulos pequeños o grandes pleomórficos que llegan a medir entre 0,5–10μm8–10. Generalmente no son birrefringentes y se pueden observar en el microscopio de luz visible. Tienen gran avidez por el colorante rojo alizarina, el cual se une al calcio y otros cationes9. La tinción de alizarina puede detectar hasta 0,005μg/ml de hidroxiapatita en el LS, pero es poco específica y solo se utiliza como tamizado inicial. La tinción se hace colocando en un portaobjetos limpio una gota de colorante rojo alizarina al 2% y una gota de LS, se homogeniza la mezcla y se observa en el microscopio de luz normal. Se deben buscar cúmulos de partículas teñidas de rojo o bien partículas redondas pequeñas, de tamaño similar a los leucocitos. La tinción debe realizarse independientemente de la presencia de cristales birrefringentes.
Tinción diferencial con colorante de Wright. Esta tinción permite identificar las células presentes en las muestras de LS. Se debe realizar en líquidos con cuentas mayores a 1.000cel/μl. La metodología consiste en extender una gota de líquido en un portaobjetos la cual se fija mediante evaporación al medio ambiente y posteriormente se tiñe con el colorante de Wright. Los tiempos de tinción deben ajustarse y estandarizarse dependiendo de la metodología propuesta por el fabricante del colorante.
Tinción con negro Sudán. Cuando se observan en la muestra de LS estructuras lipídicas o inclusiones intracelulares, se debe hacer una tinción con negro Sudán, con la cual se observan los lípidos como acúmulos pleomórficos o inclusiones negras. La tinción se realiza mezclando en un portaobjetos limpio una gota del colorante negro Sudán al 0,07% con una gota de LS, se mezcla suavemente y se coloca un cubreobjetos4. Finalmente, se incuba por un minuto a temperatura ambiente y se observa al microscopio.
Tinción de Gram. Es importante realizar la tinción cuando el número de células es mayor o igual a 75.000/μl con la finalidad de buscar bacterias. Con dicha cuenta celular se tiene una alta probabilidad de que el líquido sea séptico. La tinción de Gram se realiza de acuerdo a las especificaciones del fabricante. Como todas las pruebas de laboratorio, es importante tener en cuenta las manifestaciones clínicas del paciente, además, cuando se sospeche de una artritis séptica se deben hacer cultivos de la muestra.
Tinción con rojo Congo. La tinción positiva con rojo Congo apoya el diagnóstico de amiloidosis, la cual constituye un grupo heterogéneo de enfermedades caracterizadas por el depósito extracelular de material proteico fibrilar. La estructura molecular característica y propia de la sustancia amiloide tipo A es la responsable de la insolubilidad de los depósitos amiloides y de su resistencia a la digestión proteolítica. Como consecuencia de la estabilidad molecular de la proteína, el depósito de amiloide provoca de forma progresiva la sustitución y destrucción del parénquima de los órganos afectos, condicionando alteraciones funcionales diversas según la localización e intensidad del depósito. El criterio histológico actual más utilizado en el diagnóstico de la amiloidosis es la afinidad de la proteína por el rojo congo conocida también como congofilia. En el microscopio se observan cúmulos con refringencia verde manzana característica. La tinción se debe realizar en fresco, colocando en un portaobjetos una gota del LS y una gota de la solución saturada de rojo congo (rojo congo al 0,19% en etanol). Se homogeniza la mezcla suavemente y se observa al microscopio de luz polarizada. La presencia de amiloide se observa como cúmulos de color verde manzana formados por el amiloide y el colorante.
Identificación de cristalesCristales de urato monosódico (UMS). La presencia de cristales de UMS en articulaciones y tejido conjuntivo es la prueba de laboratorio que confirma el diagnóstico de gota1,9. Los cristales de UMS tienen forma de aguja y cuando se observan en el microscopio de luz polarizada muestran birrefringencia negativa (fig. 1). Su ángulo de extinción es de 0–45°, su tamaño va de 3–40μm aproximadamente. Pueden presentarse dentro o fuera de las células de la serie blanca en el LS. En ataques agudos de gota se pueden tener cuentas celulares de 2.000–100.000células/μl con predominio de polimorfonucleares9,10. En el análisis microscópico es importante descartar procesos infecciosos, debido a que pueden coexistir ambas patologías. En los tofos de gota, los cristales son abundantes y grandes, sin embargo, en la gota crónica las cuentas celulares pueden estar por debajo de las 2.000células/μL11 y los cristales de UMS pueden ser escasos, por lo que su identificación se dificulta, por ello es importante hacer una búsqueda cuidadosa aún cuando las cuentas celulares sean normales. Además, es posible observar cristales parcialmente digeridos dentro de las células, lo cual puede generar confusión debido a que no presenta la morfología característica. Los cristales de UMS pueden estar presentes junto con otros cristales, por ejemplo de pirofosfato de calcio o de colesterol e incluso con cruces de malta. Los estudios muestran que después de un ataque agudo de gota mono u oligoarticular, algunos pacientes pueden desarrollar sinovitis deformante crónica, lo que puede confundir al clínico con el diagnóstico de artritis reumatoide.
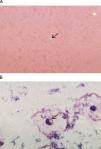
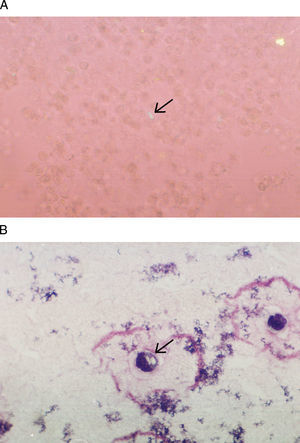
Cristales de pirofosfato de calcio dihidratado (CPPD). Están presentes en articulaciones de pacientes con pseudogota o enfermedad por depósito de CPPD. Por sus características radiológicas la enfermedad fue inicialmente descrita como condrocalcinosis articular12, debido a que da la apariencia de depósitos de calcio en los espacios articulares. Los CPPD son pleomórficos, típicamente forman bastones cortos, rectangulares o cuadrados pequeños. En el microscopio de luz polarizada se observan como cristales débilmente birrefringentes positivos, su tamaño va de 2–20μm aproximadamente (fig. 2A). Su identificación requiere que el observador tenga experiencia, debido a que pueden pasar desapercibidos por su birrefringencia débil. Es importante hacer la búsqueda en el interior de las células, rotando la platina constantemente, ya que dependiendo de la posición algunas veces no parecen tener birrefringencia. En los ataques agudos de pseudogota la cuenta celular puede ir de 2.000–80.000células/μL con predominio de polimorfonucleares con cristales intracelulares (fig. 2B). En pacientes con artritis crónica o en recuperación, la cuenta leucocitaria puede ser menor de 2.000células/μL con predominio de células mononucleares con cristales intra y extracelulares. La identificación de cristales no excluye otras causas de inflamación articular como: infecciones, gota, oxalosis o artritis reumatoide debido a que estas enfermedades pueden presentarse juntas13,14.
Las fotografías muestran cristales de pirofosfato de calcio. A) Cristales extracelulares de forma rectangular con birrefringencia positiva, preparación en gota gruesa observada en microscopio de luz polarizada 400×. B) Tinción de Wright magnificada 100×, la flecha muestra un cristal intracelular. La muestra de LS es de un paciente con pseudogota.
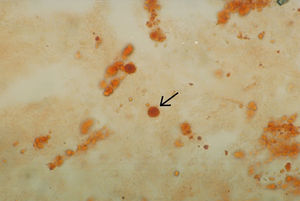
Cristales de hidroxiapatita de calcio. La mayoría de los depósitos de hidroxiapatita se encuentra en el tejido blando periarticular y articular, su presencia se asocia con inflamación sintomática aguda. La cuenta de leucocitos en el líquido sinovial de pacientes que tienen cristales de hidroxiapatita es generalmente baja y en algunas articulaciones se observa artritis destructiva. Al microscopio de luz visible cuando se tiñen con el colorante rojo alizarina se observan cúmulos grandes o pequeños, con forma de moneda china (fig. 3) o son irregulares. Su tamaño va de los 0,5–10μm aproximadamente y cuando se observan en el microscopio de luz polarizada generalmente no son birrefringentes. Cuando se observan en el microscopio electrónico, los cristales individuales miden entre 50–200Å15,16 de diámetro y tienen forma de aguja o de bastón. Como se mencionó anteriormente, los cristales de hidroxiapatita se ponen de manifiesto cuando se mezclan con el colorante rojo alizarina. El método es sensible pero poco específico. La forma de confirmar su identidad es mediante microscopia electrónica, difracción de rayos X o análisis elemental17.
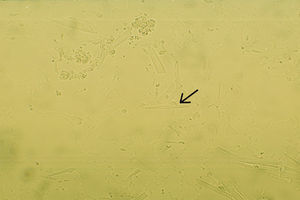
Cristales de colesterol. Los cristales de colesterol se encuentran en los LS inflamatorios y en aquellos líquidos que se drenan de bursas de pacientes con artritis reumatoide, lupus eritematoso generalizado y espondiloartropatías seronegativas. Son raros en el LS de pacientes con osteoartritis y gota18,19. Generalmente son cristales grandes cuadrados con una muesca en una de las esquinas (fig. 4). Su tamaño va de 8–100μm aproximadamente y pueden tener birrefringencia positiva o negativa. De lado se ven como rectángulos grandes o agujas curvadas.
Cristales de lípidos. Estos cristales se encuentran en el LS de pacientes con monoartritis aguda, poliartritis crónica y sinovitis villonodular pigmentada. Se les conoce también como cruces de Malta, debido a la forma que presentan cuando se observan en el microscopio de luz polarizada. Tienen birrefringencia positiva y miden entre 2–8μm de diámetro aproximadamente. Estos cristales están formados por múltiples capas de fosfolípidos, colesterol y agua20,21. En el microscopio de luz visible se ven como pequeñas burbujas de color verdoso.
Cristales de oxalato de calcio. Los cristales de oxalato de calcio se presentan casi exclusivamente en pacientes con daño renal y oxalosis22. Tienen forma de cuadrado bipiramidal, cuadrados irregulares, bastones cortos u ovalados (fig. 5). Cuando son abundantes forman cúmulos, su tamaño va de los 5–30μm aproximadamente. La mayoría de estos cristales en el microscopio de luz polarizada muestran una fuerte birrefringencia con elongación positiva y algunos pueden no presentar birrefringencia. Las manifestaciones clínicas de los pacientes que tienen cristales de oxalato de calcio en el LS se parecen a las de gota, pseudogota o enfermedad por depósito de cristales de hidroxiapatita.
Cristales de Charcot-Leyden. Estos cristales son poco comunes, se presentan en el LS de pacientes con sinovitis eosinofílica y eosinofilia asociada a vasculitis23. Tienen forma de puro y su birrefringencia puede ser positiva o negativa. Miden entre 17–25μm aproximadamente (fig. 6), están formados de lisofosfolipasa o fosfolipasa B. Pueden depositarse en articulaciones y riñón24.
Cristales de hematoidina. Los cristales de hematoidina se pueden detectar en el LS de pacientes con hemartrosis. Son el producto de la degradación de la hemoglobina. Son de forma romboidea o rectangular y miden entre 8–10μm aproximadamente4. En el microscopio de luz visible se ven de color café u oro y cuando se les hace incidir luz polarizada muestran birrefringencia positiva o negativa (fig. 7). Pueden confundirse con los cristales de pirofosfato de calcio. Es importante enfatizar que deben observarse los LS primero en el microscopio de luz visible (fig. 7A) y posteriormente en el de luz polarizada (fig. 7B).
Otros cristales que se pueden identificar en las muestras de LS son los de esteroides. Los cristales de corticosteroides son pleomórficos y fuertemente birrefringentes positivos o negativos. Los cristales de betametasona tienen forma de aguja y son birrefringentes negativos. Se pueden confundir con cristales UMS, en cuyo caso, la experiencia del observador juega un papel muy importante para la identificación de uno u otro tipo de cristales presente en la muestra.
El análisis de LS es una herramienta útil que realizado de manera oportuna ayuda al reumatólogo en el diagnóstico de las artropatías por cristales. En la actualidad se han incorporando nuevas determinaciones al análisis del LS, como la detección de proteínas (vg. gamma globulina y β2-microglubulina), actividades enzimáticas (vg. aldolasa-deshidrogenasa y fosfatasa), glucosa y ácido hialurónico entre otras, las cuales permiten detectar alteraciones como inflamación articular, sepsis, actividad articular y traumatismos que sufren las articulaciones de los pacientes con patologías como artritis reumatoide, artrosis, hipotiroidismo, tumores o lupus eritematoso generalizado.
ConclusionesEl análisis del LS es una herramienta que ayuda en el diagnóstico y tratamiento de las artropatías. La gama de estudios que se pueden realizar es muy amplia. Es necesario definir las características macroscópicas y la cuenta de células antes de proceder con la búsqueda de cristales y si es necesario con el cultivo. El análisis del LS establece en base a la identificación de cristales, bacterias, células, cambios químicos y físicos; los medios para hacer un diagnóstico oportuno y seguimiento adecuado de las diversas enfermedades.
La investigación de los cambios en el LS de pacientes con artropatías por cristales ha cobrado mayor importancia debido a que se están aplicando nuevas técnicas para la cuantificación de citocinas, moléculas de activación, inmunoglobulinas, estirpes celulares, todo ello para entender lo que está ocurriendo en las articulaciones afectadas de los pacientes.