El calcio (Ca2+) es un catión con capacidad multifuncional como segundo mensajero en diferentes grupos celulares del sistema inmunitario que incluyen los linfocitos T y B, los macrófagos, los mastocitos, entre otras. Los recientes descubrimientos en relación con la entrada de Ca2+ dependiente de depósito (SOCE por su sigla en inglés, store operated calcium entry) han abierto nuevos caminos en la investigación de cómo este catión dirige el destino celular, en especial en los linfocitos T y B. La SOCE actúa a través de canales CRAC (del inglés Ca2+ release-activated Ca2+ channels) y su mecanismo de activación depende de la interacción de dos moléculas reguladoras: un sensor del Ca2+ del retículo endoplásmico o molécula de interacción estromal (STIM-1, del inglés stromal interaction molecule) y una subunidad poro del canal CRAC (Orai1).
Esta revisión se centra principalmente en las funciones del Ca2+ en los linfocitos B y T, así como las alteraciones de estas vías implicadas en el desarrollo de enfermedades autoinmunes.
Calcium (Ca2+) is an important cation able to function as a second messenger in different cells of the immune system, particularly in B and T lymphocytes, macrophages and mastocytes, among others. Recent discoveries related to the entry of Ca2+ through the store-operated calcium entry (SOCE) has opened a new investigation area about the cell destiny regulated by Ca2+ especially in B and T lymphocytes. SOCE acts through calcium-release-activated calcium (CRAC) channels. The function of CRAC depends of two recently discovered regulators: the Ca2+ sensor in the endoplasmic reticulum or stromal interaction molecule (STIM-1) and one subunit of CRAC channels called Orai1.
This review focuses on the role of Ca2+ signals in B and T lymphocytes functions, the signalling pathways leading to Ca2+ influx, and the relationship between Ca2+ signals and autoimmune diseases.
El calcio (Ca2+) es un catión con capacidad multifuncional como segundo mensajero en diferentes grupos celulares del sistema inmunitario que incluyen linfocitos T y B, macrófagos, mastocitos, etc.1-3. Su distribución en los espacios intra y extracelular hace que para su utilización y movilización se requiera de bombas y canales especializados, y la influencia del estado de despolarización o repolarización celular. Además, la cantidad y la duración del flujo de Ca2+ van a determinar el tipo y la duración de sus efectos en la señalización intracelular. Los recientes descubrimientos en relación con la entrada de Ca2+ dependiente de depósito (SOCE por su sigla en inglés, store operated calcium entry) han abierto nuevos caminos en la investigación de cómo este catión dirige el destino celular, en especial en los linfocitos T y B. Esta revisión se centra principalmente en las funciones del Ca2+ en estos 2 últimos grupos celulares y su implicación en autoinmunidad.
Calcio como elemento de señalización intracelularPara el normal funcionamiento celular, en especial en el sistema inmunitario, se debe partir de un principio básico consistente en la presencia de los siguientes elementos:
- –
Una señal externa.
- –
Un receptor.
- –
Una señal interna, la cual depende a su vez de las modificaciones experimentadas por el receptor en contacto con la señal externa y de los cofactores que amplifican la señal recibida.
- –
Un factor de transcripción que se desplaza al núcleo.
- –
Transcripción del ácido ribonucleico (ARN) y traducción para generar la(s) proteína(s) inducida(s) por la señal externa.
Los estudios en biología molecular y las recientes descripciones de nuevas proteínas4 han permitido avanzar en el entendimiento de cómo funcionan estos componentes de la señalización celular. Las señales externas están constituidas por diferentes proteínas o derivados peptídicos (citocinas, quimiocinas, péptidos asociados a patógenos, etc.), que son captados por un receptor ubicado en la membrana celular. En el caso del linfocito T y B, estos receptores requieren del concurso de otros elementos o co-receptores, que permiten una sinapsis adecuada con la señal extracelular y así poder activar la cascada de señalización intracelular. La señal interna (o segundo mensajero) es generada por múltiples mecanismos (generalmente fosforilación y desfosforilación), a través de diferentes vías, como la JAK-STAT, la vía de la MAP-cinasa, la vía de la proteína G, etc.5.
El Ca2+ actúa como segundo mensajero y su importancia cada vez es más conocida gracias a los últimos hallazgos en relación con la SOCE y sus implicaciones en la durabilidad de las respuestas celulares al flujo de Ca2+. Las señales inducidas por Ca2+ ya se conocían desde hace varias décadas, gracias a su importancia en la síntesis de ARN y en la división celular de los leucocitos y timocitos6,7. Actualmente, se conocen diversas funciones dependientes de la cantidad de Ca2+ presente a nivel intracelular. Cuando los niveles de Ca2+ aumentan durante un corto período, pueden reducir la movilidad del linfocito, favoreciendo así la sinapsis inmunológica. En el caso de otros grupos celulares, estos altos niveles de Ca2+ de corta duración dan lugar a otros fenómenos como citotoxicidad mediada por linfocitos T, liberación de gránulos líticos y/o reconocimiento celular en procesos de apoptosis. En contraste, cuando los niveles de Ca2+ aumentan en forma prolongada, pueden regular respuestas transcripcionales que van a marcar el destino celular de los linfocitos T y B (p. ej., producción de citocinas, diferenciación celular, funciones efectoras, estados de no respuesta, etc.)8. Estos niveles de Ca2+ son regulados en los linfocitos en forma dinámica por diferentes canales, entre los cuales tenemos9:
- –
Canales receptores intracelulares, como el receptor del inositol-1,4,5-trifosfato (IP3) ubicado en el retículo sarcoplásmico.
- –
Canales de membrana plasmática, incluyendo canales de Ca2+ activados por liberación de Ca2+ (CRAC, del inglés Ca2+ release-activated Ca2+ channels).
- –
Canales de potasio activados por Ca2+ dependientes de voltaje.
- –
Canales transportadores dependientes de energía.
- –
Canales de cationes no selectivos (en inglés non-selective cation channels).
- –
Las bombas sarco-endoplasmic reticulum adenosine triphosphatase (SERCA) y plasma membrane Ca2+ ATPase (PMCA).
Además de estos canales, la misma concentración de Ca2+ intracelular ayuda a regular la entrada del ión vía canales CRAC e IP3, al igual que el estado de repolarización de la membrana celular. Una vez se incrementen los niveles intracelulares de Ca2+, se activan otras cascadas de señalización que definen el destino celular de los linfocitos como se revisa más adelante.
Calcio y señalización en linfocitosUna vez el linfocito T o B es activado por su receptor y por el proceso de coestimulación, se produce el reclutamiento y una activación de un grupo de proteínas tirosincinasas, unidas a otras proteínas adaptadoras que llevan a la fosforilación y activación de la fosfolipasa C-γ (PLCγ1 en linfocitos T y PLCγ2 en linfocitos B). Esta enzima, a su vez, hidroliza el fosfatidilinositol-3,4-bifosfato (PIP2) de la membrana celular a 2 segundos mensajeros:
- –
IP3.
- –
Diacilglicerol (DAG).
El IP3 se desplaza entonces y se une a su receptor ubicado en la membrana del retículo endoplásmico (RE), causando la salida del Ca2+ almacenado en su interior y la activación de otras señales intracelulares (figs. 1 y 2). Sin embargo, el agotamiento rápido del Ca2+ en el RE llevaría a una respuesta a este ión de corta duración. Para facilitar la prolongación de las respuestas celulares, se debe activar otra vía de entrada del Ca2+, denominada SOCE, la cual fue recientemente descubierta por búsquedas a gran escala de ARN de interferencia. La SOCE actúa a través de canales CRAC y su mecanismo de activación depende de la interacción de 2 moléculas reguladoras10:
- –
Un sensor del Ca2+ en el RE o molécula de interacción estromal (STIM-1, del inglés stromal interaction molecule).– Una subunidad poro del canal CRAC (Orai1).
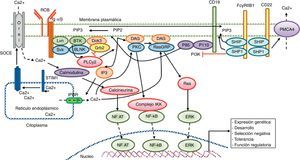
Señalización cálcica en el linfocito B. El reconocimiento antigénico por el receptor de linfocito B activa diferentes proteínas cinasas, como Lyn, Syk y BLNK, llevando a la activación de la PLCγ2, la cual hidroliza el PIP2 unido a la membrana en pequeñas cantidades de DAG e IP3. El IP3 se une a su receptor IP3R, ubicado en la membrana del retículo endoplásmico, favoreciendo la liberación del calcio almacenado. Posteriormente, la disminución del calcio a nivel luminar en el retículo endoplásmico genera la translocación de STIM1, la cual lleva a la apertura del canal cálcico Orai1 para inducir la entrada de calcio dependiente de depósito (SOCE). El receptor CD19 facilita la activación de la subunidad p110 de la PI3K. Esta enzima fosforila el PIP2 para producir PIP3. El receptor Fc para IgG de baja afinidad (FcgRIIB1) y el CD22 son ambos reguladores negativos de la señalización cálcica durante la estimulación del receptor de Linfocito B. La función negativa de estos receptores está mediada por SHIP y SHP1. Adicionalmente, el CD22 inhibe la señalización cálcica por medio de un eflujo cálcico mediado por la proteína PMCA4. La entrada de calcio genera activación de factores de transcripción responsables de la inducción de nuevas proteínas encargadas de las funciones de proliferación, diferenciación y respuesta inmunitaria.
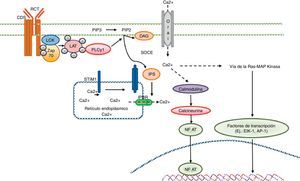
Señalización cálcica en el linfocito T. El reconocimiento antigénico por parte del receptor de linfocito T genera la activación de tirosincinasa en el interior del linfocito T tales como LCK y ZAP70, lo cual resulta en la fosforilación y la activación de la proteína PLCγ1. Esta última hidroliza el PIP2 en IP3 y DAG. El IP3 abre los receptores IP3R ubicados en el retículo endoplásmico y permite la salida de calcio desde los depósitos del retículo. Los sensores cálcicos STIM1 y STIM2 detectan la reducción de los depósitos cálcicos por medio de la región N-terminal de la luz del retículo. Las proteínas STIM se agregan en pequeños grupos en la membrana del retículo endoplásmico y generan la entrada de calcio extracelular por medio del canal CRAC, el Orai1. La concentración de calcio intracelular activa la vía de la calcineurina-NFAT, así como la vía Ras-MAP cinasa.
El funcionamiento de este mecanismo se ha descrito así: una vez el sensor de Ca2+ STIM detecta la disminución de la concentración del Ca2+ al interior en el RE, experimenta un cambio conformacional (por oligomerización y agregación) en forma de «punta», en yuxtaposición al canal CRAC ubicado transmembrana. Esta conformación hace que entre en contacto con la subunidad poro Orai1 del canal, permitiendo la apertura del canal y la entrada del Ca2+. Esto aumenta los niveles intracelulares del ión y permiten perpetuar las respuestas generadas por la activación de los linfocitos y sus respectivos receptores. Se han descrito otros mecanismos de regulación de la actividad de los canales CRAC, que incluyen la actividad de otros canales permeables de Ca2+ como los miembros de la familia TRPC, pero este mecanismo no está totalmente claro. También se han postulado otros mecanismos reguladores de la unión STIM-Orai1, donde el citoesqueleto y la carga negativa de los fosfolípidos de membrana pueden influir11.
Activación de vías de señalización posterior al influjo de calcioUna vez se logra incrementar el nivel del Ca2+ intracitoplasmático, se activan otras vías de señalización y factores de trascripción que finalmente se unen al ADN y dan lugar a la producción de todas las proteínas, citocinas, etc., relacionadas con la cascada inflamatoria. Dentro de estas vías tenemos12-14:
- –
La vía de la calmodulina —calcineurina, con activación final del factor nuclear de células T activadas (NFAT, del inglés nuclear factor of activated T cells).
- –
La vía de la cinasa dependiente de Ca2+ —calmodulina (CaMK), que tiene como factores de trascripción la proteína unida al elemento de respuesta al monofosfato de adenosina cíclico (CREB, del inglés cyclic-adesnosime monophosphate-responsive element binding protein) y el factor aumentador del miocito 2 (en inglés, myocite enhancer factor 2).
- –
La vía del factor nuclear κB (NF-κB)
Al momento de la hidrólisis del PIP2, también se obtiene DAG, el cual a su vez puede activar 2 vías adicionales de señalización:
- –
La vía de la proteína cinasa (PKC, del inglés protein kinase C) activada por mitógeno Ras (en inglés, Ras-mitogen-activated protein kinase).
- –
La vía de la PKC, protein kinase C.
Estas vías finalmente activan factores de transcripción, como el AP-2 (complejo transcripcional formado por c-Fos y c-Jun) y el NF-κB. Los diferentes elementos y vías relacionadas con el flujo de Ca2+ se resumen en la tabla 1.
Calcio y función celular en linfocitos B y T
| Molécula | Señal de calcio | Biología celular |
| BTK | Induce salida de Ca2+ del RE | Desarrollo temprano de linfocito B, respuesta inmunitaria, inmunodeficiencia por pérdida de función |
| BLNK (SLP-65) | Induce salida de Ca2+ del RE | Desarrollo temprano de linfocito B, respuesta inmunitaria, inmunodeficiencia por pérdida de función |
| PLCγ2 | Induce salida de Ca2+ del RE | Desarrollo temprano de linfocito B, respuesta inmunitaria, autoinmunidad por ganancia de función |
| PLCγ1 | Induce salida de Ca2+ del RE | Desarrollo de linfocito T, respuesta inmunitaria, inmunodeficiencia por pérdida de función |
| CD19 | Aumenta salida de Ca2+ del RE | Desarrollo de linfocito B, respuesta inmunitaria, inmunodeficiencia por pérdida de función |
| SHP1 | Inhibe incremento de Ca2+ | Autoinmunidad por pérdida de función |
| SHIP | Inhibe incremento de Ca2+ | Desarrollo de linfocito B |
| CD22 | Inhibe incremento de Ca2+ | Autoinmunidad por pérdida de función |
| FcγRIIB | Inhibe incremento de Ca2+ | Autoinmunidad por pérdida de función |
| Itpkb | Inhibe SOCE | Desarrollo de linfocito T, respuesta inmunitaria |
| Grb2 | Inhibe (IgM linfocitos B) o aumenta (Ig G linfocitos B) salida de Ca2+ | Desarrollo de linfocito B, respuesta inmunitaria, producción de autoanticuerpos por pérdida de función |
| STIM-1/2 | Incrementa SOCE | Supresión de inflamación autoinmune |
| Zap70 | Induce salida de Ca2+ del RE | Activación linfocito T, expresión genética |
| LCK | Induce salida de Ca2+ del RE | Activación linfocito T, expresión genética |
La señalización del Ca2+ a nivel intracelular se ha visto implicada en la patogénesis de enfermedades autoinmunes e inmunodeficiencias congénitas. Enfermedades como el lupus eritematoso sistémico (LES), la artritis reumatoide (AR), la esclerosis múltiple (EM) y la diabetes mellitus tipo 1 están relacionadas en su fisiopatología con la presencia de células T y B autorreactivas, que contribuyen en forma indiscutible en la generación del proceso inflamatorio. En el LES, las células T autorreactivas reemplazan el CD3-ζ por la cadena común FcR-γ, dando lugar a una señalización intracelular vía Syk (tirosincinasa esplénica) y no vía ZAP-70, como es lo usual. Esto, asociado a la agrupación de balsas lipídicas en la membrana citoplasmática de la célula T, incrementa el Ca2+ intracelular como respuesta a la activación del receptor de célula T (RCT) por un autoantígeno. Se activa la vía de la PKC iv dependiente de calmodulina (CaMK4), que se une al CREB y aumenta la producción de interleucina 17 (IL-17) en detrimento de la producción de la IL-215. Este fenómeno también se ha descrito en enfermedades como la AR y la EM. Sin embargo, en estas afecciones la hipótesis planteada es que la autorreactividad de las células T obedece a mutaciones de la cinasa ZAP-70, las cuales reducen marcadamente la señalización dependiente del RCT, incluyendo las señales de Ca2+, permitiendo que los RCT autorreactivos «escapen» del proceso de selección negativa en el timo pero se conviertan en artritogénicos en los tejidos periféricos. Se plantea entonces que la señalización del Ca2+ participa en el proceso de selección tímica de las células T16. En las células B, la ausencia o la falta de respuesta a SHP1, CD22 o FcγRIIB1 genera respuestas aumentadas al influjo de Ca2+ y, como consecuencia, hiperreactividad de los linfocitos B y autoinmunidad. En el LES, los defectos del FcγRIIB1 están relacionados con mayor respuesta al Ca2+ en linfocitos B17. Aunque estas enfermedades como el LES se caracterizan por un componente sistémico, las alteraciones de la señalización cálcica han sido descritas en los linfocitos T y B, y aún no se han relacionado con susceptibilidad a presentar manifestaciones específicas de la enfermedad (p. ej., mayor riesgo de nefritis). Sin embargo, derivado del modelo murino Orai1K1/K1 (expuesto posteriormente), las falta de señalización cálcica en las células del sistema inmunitario protegen del desarrollo de colitis en el modelo de transferencia de enfermedad inflamatoria intestinal.
Como se ha mencionado previamente, en los linfocitos T, la entrada de Ca2+ luego de la estimulación antigénica es fundamental para la activación del factor de transcripción NFAT. Se ha demostrado que un grupo de pacientes presentan mutaciones, bien sea de STIM 1 u Orai1, que afectan a la función proteica o la expresión, derivando en un defecto del influjo de Ca2+ almacenado y la función del canal CRAC, resultando en disminución de la activación del linfocito T. Estos mecanismos llevan a la presentación de una forma hereditaria de inmunodeficiencia combinada severa, demostrando la importancia de estos canales en la función normal de los linfocitos T en humanos. Igualmente, el defecto en la señalización cálcica puede conllevar a linfocitos T autorreactivos a un estado de activación que puede derivar en la aparición de enfermedades autoinmunes. Teniendo en cuenta el papel de la activación cálcica en fenómenos de autoinmunidad, Lin et al. han publicado recientemente la creación de anticuerpos monoclonales humanizados de alta afinidad dirigidos contra Ora1 humana. Estos anticuerpos mostraron disminución de la entrada de Ca2+, la transcripción de NFAT y liberación de citocinas, pudiendo representar un nuevo blanco terapéutico en el tratamiento de enfermedades autoinmunes18. Esta aproximación es de reciente descripción y los efectos sobre los diferentes tejidos que involucran señalización cálcica, diferentes del sistema inmunitario, deben ser bien estudiados.
En un modelo animal desarrollado por McCarl et al., el papel de Orai1 en la autoinmunidad fue descrito. En este estudio, los linfocitos T y B derivados del modelo murino Orai1K1/K1 expresan una proteína Orai1 mutada y no funcional. Estas células mostraron una severa disminución de la entrada de Ca2+ y la función del canal CRAC, resultando en la disminución de la expresión de varias citocinas, incluyendo la IL-1, IL-4, IL-17, interferón gamma y el factor de necrosis tumoral alfa en los linfocitos T CD4 y CD8. Este modelo mostró mayor tolerancia a injertos de piel comparada con el animal sin la mutación y fallaron en desarrollar fenómenos autoinmunes tipo colitis. Estos hallazgos confirman la importancia de estos canales y el influjo de Ca2+ en la activación de las células del sistema inmunitario adaptativo19.
El Ca2+ también se encuentra relacionado con el desarrollo de inmunodeficiencias congénitas. En la inmunodeficiencia común severa, por ejemplo, existe una mutación en el linfocito T, más específicamente en el dominio transmembrana de Orai1 en el CRAC, que no permite la entrada de Ca2+ vía SOCE, dando lugar a linfocitos T con poca capacidad de proliferación y producción de citocinas. Este defecto en el SOCE también puede afectar a células B y fibroblastos en esta enfermedad20. En la agammaglobulinemia ligada a X hay un déficit hereditario en las células B, que se caracteriza por mutaciones de la tirosincinasa de Bruton, enzima encargada de la activación de PLCγ2, teniendo como consecuencia la disminución de la entrada de Ca2+ vía SOCE, por baja generación de IP321. Finalmente, la inmunodeficiencia común variable presenta también alteraciones en el funcionamiento de los linfocitos B, especialmente por mutaciones a nivel de CD19, lo cual disminuye el influjo de Ca2+ al interior de esta célula, comprometiendo la respuesta frente a antígenos y reduciendo la generación de células B de memoria CD27 positivas22.
ConclusionesLa señalización del Ca2+ a nivel intracelular es un componente más de las cascadas de señales que se generan en las diferentes células luego de la exposición de sus receptores a un estímulo específico. En el caso de los linfocitos T y B, estas señales dan lugar a múltiples cambios intracelulares y en la expresión de ADN, con la consecuente producción de diferentes marcadores inflamatorios. Las diferentes investigaciones en este campo también han permitido establecer la importancia de las vías de Ca2+ en el desarrollo de enfermedades autoinmunes, tanto por sobreproducción como por inactividad. En la medida en que se avance en el estudio de todos estos conceptos, se podría considerar la intervención sobre estas vías y receptores con fines terapéuticos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.