La identificación de la propiedad antitóxica del suero en 1890 por Emil von Behring y la introducción del término “Antikörper” por Paul Ehrlich en 1891 para referirse a uno de los mecanismos de defensa más relevantes del sistema inmunitario adaptativo, es decir, los mediadores de la respuesta inmunitaria humoral, marcan el inicio de la etapa de la inmunología moderna. La estructura en “Y” fue descrita hace cincuenta años por Gerald M. Edelman y Rodney R. Porter. Así, al cumplirse el cincuentenario de la descripción de la estructura química de los anticuerpos, consideramos oportuno no dejar pasar inadvertido el hecho a través de una breve remembranza y la revisión de dichos hallazgos.
The identification of the antitoxic property of serum in 1890 by Emil von Behring and the introduction of the term “Antikörper” by Paul Ehrlich in 1891 referring to one of the most relevant mechanisms of defense of the adaptive immune system, i.e., the humoral immune response mediators, mark the beginning of modern immunology. The “Y” structure was described 50 years ago by Gerald M. Edelman and Rodney R. Porter. Thus, on the fiftieth anniversary of the description of the chemical structure of antibodies, we consider it appropriate to celebrate this fact by sketching a brief outline and review of these epoch-making achievements.
La ciencia ha creado su propia heráldica, un conjunto de insignias que han ejemplificado sus logros, sus campos, sus modas y sus rumbos. En la biología de nuestro tiempo, los dos emblemas más elegantes y de mayor estilo son la doble hélice del ADN y la Y de la molécula de inmunoglobulina. La Y es una de las moléculas mejor caracterizadas, y podríamos escribir un libro extenso acerca de ella. Pero ahora sólo nos concentraremos en los caminos y obstáculos que se tuvo que acometer para llegar a elucidar su estructura química, ahora hace cincuenta años.
AntecedentesPodríamos situar el inicio de la historia de la inmunidad adquirida en el año 400 aC cuando Tuscídides, en su libro La Guerra del Peloponeso, refiriéndose a la peste que azotó Atenas, hacía notar que: “… los que habían sobrevivido a la enfermedad mostraron más compasión hacia los muertos y los enfermos, ya que la conocían bien y ahora se sentían seguros. Porque una segunda vez no la sufría nadie, al menos no como para morir de ella”1.
Por los siguientes 2.300 años se consideró que a consecuencia de una enfermedad el cuerpo se volvía inmune, porque perdía un nutriente esencial para un determinado miasma, precisamente porque ese efluvio maligno lo habría consumido en su primera —y necesariamente no mortal— visita. Este concepto fue capaz de explicar satisfactoriamente el origen, la especificidad y la variable duración de la inmunidad en distintas enfermedades. Pero la inmunología, en ese lapso, aún no era ciencia.
En 1890 Emil Behring y Shibasaburo Kitasato descubrieron la seroterapia mediante el empleo del suero de conejos inmunizados contra tétanos y contra difteria (fig. 1), y con esto descubrieron que la inmunidad es la adquisición de algo —que se puede transferir—, y no la pérdida de algo que indiscutiblemente no se puede transferir a un organismo sano2. Un año después, en la noche de navidad, se llevó a cabo la primera aplicación de la seroterapia a un niño con difteria. Esto valió a Behring recibir un título nobiliario (el von que precede a su apellido) y el primer premio Nobel de Fisiología o Medicina en 1901, injustamente no otorgado también a Kitasato.
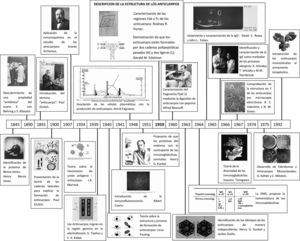
Principales contribuciones en la caracterización y la identificación de los anticuerpos con el paso del tiempo. La figura muestra los sucesos más importantes en el devenir de la historia de los anticuerpos. Ciertamente hay omisiones y no todos los aspectos que se muestran son tratados en el texto.
El experimento de Kitasato y Behring es único en su género por dos razones: a) mostró que la resistencia a enfermedades microbianas puede ocurrir a través del poder del suero, y b) demostró la inmunidad pasiva: la adquisición de resistencia a patógenos mediante la transferencia de esa propiedad proveniente de un donador inmunizado. El experimento, por lo demás, abrió de par en par la puerta a la inmunología moderna, al proveer un sustrato concreto de estudio que, aunque de estructura química aún desconocida, al menos estaba ahí expectante, en la sangre, en el suero. Cabe mencionar que Kitasato y Behring sólo hablaron de una propiedad específica antitóxica del suero. La existencia de una sustancia (una globulina que precipitaba con sal) fue descubierta en 1891 por dos italianos especialistas en la toxina tetánica, Guido Tizzoni y Guiseppina Cattani, quienes acuñaron el término antitoxina3. Ese mismo año, Paul Ehrlich llegó a la conclusión de que cuando dos toxinas diferentes (ricina y abrina) son administradas a animales de experimentación, se originan dos antikörper diferentes, e introdujo así el término (anticuerpo) que se sigue empleando hasta ahora4.
La inmunoquímicaSi bien la inmunología fue fundada por el químico Louis Pasteur, el padre de la inmunoquímica sin duda fue el médico Paul Ehrlich. En 1897 puso particular hincapié en la necesidad de estandarizar las cuantificaciones de las antitoxinas5. Su elaborado modelo (que incluía la presencia hipotética de toxoides) se basaba en su concepción de grupos atómicos singulares (funcionales-estructurales) en una molécula de toxina. Uno de los grupos era tóxico; el otro adyacente presentaba una configuración complementaria a la célula huésped. La porción venenosa podría desnaturalizarse para formar un toxoide inocuo al tiempo que mantenía su capacidad para unirse a la célula o a un anticuerpo. La variación de la avidez de la reacción antígeno-anticuerpo, por lo tanto, era cuestión de complementariedad de los contornos moleculares y ejemplificaba claramente el abordaje fundamental de Ehrlich en todas sus investigaciones: corpora non agunt nisi fixata, las sustancias no reaccionan a menos que se fijen.
En 1900 presentó ante la Royal Society de Londres su sorprendente teoría de las cadenas laterales, en la que los anticuerpos vienen siendo estructuras proteínicas membranales preformadas que, al ser seleccionadas (no inducidas) por el antígeno, aumentan su síntesis y se vierten en exceso en el suero. Si bien fue la primera teoría sobre la formación de anticuerpos, ésta tuvo muchos detractores entre sus contemporáneos6. Así y todo, Ehrlich obtuvo el premio Nobel de Fisiología o Medicina en 1908 por sus múltiples aportaciones a la inmunología.
Aunque la inmunología aún se encontraba en sus albores, fue una de las primeras disciplinas biológicas que adquirieron formalmente un sólido apoyo en la química. En 1907, Svante Arrhenius (premio Nobel de Química en 1903) acuñó el término inmunoquímica para referirse a la unión de la química con la inmunología biomédica, ciencia que perduraría unos cincuenta años obsesionada por la reacción antígeno-anticuerpo7. Arrhenius no estaba del todo de acuerdo con el énfasis que ponía Ehrlich en el contorno molecular y, en cambio, postulaba que los antígenos y anticuerpos se combinaban mediante una forma de unión electrostática coloidal. Creía que la unión antígeno-anticuerpo compartía semejanzas con la interacción de ácidos débiles con bases. Este pionero fisicoquímico, cuyos experimentos fueron muy sonados en la época —a pesar de tener fundamentos erróneos—, introdujo en la inmunoquímica aspectos termodinámicos, las constantes de equilibrio, los coeficientes de viscosidad y otros parámetros cuantitativos, con lo que no sólo unieron, sino que literalmente fusionaron la química con la inmunología.
La primera evidencia experimental del modelo de grupos atómicos de Ehrlich fue llevada a cabo por Karl Landsteiner (premio Nobel de Fisiología o Medicina en 1930). Él midió meticulosamente la especificidad de la reacciones antígeno-anticuerpo a compuestos sintéticos con variaciones tan sutiles que disiparon toda duda sobre su exquisita especificidad y culminarían en un libro seminal aún vigente a pesar de los años8. Landsteiner descubrió las funciones de los haptenos y el efecto acarreador (carrier effect)9. Con sus experimentos logró dar a la idea de antigenicidad una contraparte material que era propia de la especificidad de los anticuerpos.
En esa época prevalecía la idea de que sólo las proteínas, y acaso también las glucoproteínas, eran las únicas estructuras químicas capaces de despertar la producción de anticuerpos, ya que esto jamás sucedía cuando se inmunizaban animales con azúcares. Sin embargo, en 1923, Michael Heidelberger y Oswald T. Avery, mientras estudiaban el polisacárido del neumococo, descubrieron lo contrario10. Inicialmente se consideraba que el polisacárido capsular del neumococo era reconocido como hapteno, capaz de unirse a un anticuerpo pero incapaz de inducir la producción de éste por sí solo. Posteriormente, con las dosis adecuadas y los huéspedes favorables, se demostró que los polisacáridos eran antigénicos y, más aún, inmunogénicos. Heidelberger, quien era químico orgánico de formación, utilizó el neumococo y otros hidratos de carbono complejos como herramientas para el microanálisis cuantitativo de la especificidad inmunológica que, como él decía: “liberaron de la tiranía de los títulos a la reacción antígeno-anticuerpo”11.
Pero la inmunología, que por todo el primer cuarto del siglo XX había sido considerada una disciplina médica con claras aspiraciones terapéuticas, llegó a convertirse al final de la década de los años veinte en una mina de oro de investigación para los químicos. La química coloidal se encontraba en su cénit de popularidad, aunque ya se iniciaban las nociones sobre enlaces polares e hidrófilos. De importancia capital sobre esto último fue el modelo atómico de Niels Bohr, con su imagen de capas de electrones que introdujo la idea de electrón-valencia.
Ya en la siguiente década, en 1934, el médico inglés John R. Marrack propuso que las fuerzas hidrofílicas (enlaces o puentes de hidrógeno) eran la causa de la unión antígeno-anticuerpo. Más aún, describió que si los antígenos y algunos anticuerpos en particular pudieran tener una valencia mayor a la unidad, se lograría explicar satisfactoriamente varios enigmas inmunológicos como la floculación, la precipitación y la solubilidad de los complejos antígeno-anticuerpo en zonas de exceso de antígeno o de anticuerpo. Su hipótesis, basada en el modelo del átomo de Bohr, combatió la ya para entonces herida de muerte, pero aún prevalente, teoría coloidal y el consenso general de que los anticuerpos eran monovalentes12.
Los siguientes años fueron enteramente de avances tecnológicos que brindaron a la inmunoquímica cierta certidumbre sobre la naturaleza física del anticuerpo, y todo esto se dió en Escandinavia. En el lapso entre las dos guerras mundiales, Theodor Svedberg, en Suecia, estampó el sello de creatividad en la tecnología química. Obtuvo el premio Nobel de Química en 1926 y se lo conoce principalmente por ser el inventor de la ultracentrífuga13. De hecho, los coeficientes de sedimentación se miden en unidades Svedberg (S) en su honor. Entre 1925 y 1932 Svedberg tuvo como alumno y posteriormente íntimo colaborador a Arne Tiselius, que a su vez obtuvo el premio Nobel de Química en 1948 por el descubrimiento de otro método analítico: la electroforesis. Un destino lleva a otro y así, un discípulo de Heidelberger, Elvin Kabat, realizó una estancia posdoctoral con Tiselius en Uppsala, Suecia. Esta relación tuvo como resultado el descubrimiento de extraordinarias y novedosas técnicas de separación física de anticuerpos de entre todas las proteínas del suero, como el isoelectroenfoque y la inmunolectroforesis de dos dimensiones. Tiselius y Kabat sometieron a electroforesis el suero de conejos inmunizados con albúmina de huevo y demostraron que la actividad de anticuerpo se encontraba en el tercer pico del desplazamiento electroforético de las proteínas, también conocido como pico gamma, por lo que muy pronto se llamó gammaglobulinas a los anticuerpos14. Cuando se llegó a conocer que ciertas globulinas del pico gamma no eran anticuerpos, se introdujo el nombre inmunoglobulinas, con lo que se generó el término inmunoglobulina gamma (IgG). El análisis por ultracentrifugación estableció que las gammaglobulinas tenían un coeficiente de sedimentación de 7S, con un peso molecular de cerca de 150.000 Da. Sin embargo, no todos los anticuerpos son de esta categoría. A los que migraban más rápidamente al pico beta se los llamó primeramente β2-macroglobulinas de γM, ahora conocidas como inmunoglobulina macro (IgM). Éstas tienen un coeficiente de sedimentación de 19S y un peso molecular aproximado de 900.000 Da. También se encontraron cambios en el patrón electroforético del suero durante un periodo de inmunización. Así, con la primera exposición a un antígeno se iniciaba la formación de IgM, que disminuía después de unos días, al tiempo que la IgG aumentaba. Los siguientes contactos con el antígeno típicamente producían una misma respuesta IgM, pero inmediatamente después aparecía mayor cantidad de IgG, de ahí el término booster shot.
Un hallazgo de particular importancia en las investigaciones de Tiselius y Kabat fue que los anticuerpos no son uniformes en sus cargas eléctricas ni en sus coeficientes de sedimentación, lo que resultó ser el primer indicio de la heterogeneidad física de los anticuerpos.
En 1950 Tiselius recibió a quien llegaría a ser el padre de la inmunología clínica moderna, el Dr. Henry Kunkel, proveniente del Rockefeller Institute for Medical Research (hoy Rockefeller University), que llegó a Uppsala para realizar una breve estancia de investigación. En poco tiempo Kunkel asimiló toda la metodología del laboratorio de Tiselius y llegó a hacerla suya. A su regreso a Nueva York, tenía en mente cómo resolver el análisis de la estructura de los anticuerpos. Como ya se mencionó, su estudio resultaba sumamente complejo debido a su heterogeneidad, lo que hacía que el planteamiento de estudios analíticos con moléculas homogéneas fuera prácticamente imposible. En 1951 realizó un descubrimiento de enorme alcance. En ese tiempo se consideraba que los pacientes con mieloma múltiple secretaban productos derivados de las células malignas. En una serie de experimentos, de asombrosa simplicidad, demostró que la elevación de proteínas en el suero de pacientes con mieloma múltiple tiene relación con las gammaglobulinas normales15. Este hallazgo brindó a los inmunoquímicos la posibilidad de estudiar moléculas homogéneas para analizar y comparar e hizo posible, a la postre, la identificación de las clases de anticuerpos, las cadenas de inmunoglobulinas, sus genes y sus regiones constantes y variables.
A finales de la década, Kunkel realizó una aportación clásica a la reumatología al demostrar la presencia de complejos inmunitarios en la artritis reumatoide. Demostró que el factor reumatoide es un autoanticuerpo del tipo IgM de 19°S dirigido contra una IgG de 7°S16. También descubrió la presencia de complejos inmunitarios de ADN y otros componentes celulares en el suero de pacientes con lupus eritematoso17. La gravedad de la enfermedad podía relacionarse con la presencia de complejos inmunitarios circulantes. Tanto el factor reumatoide como los complejos inmunitarios estaban relacionados, aparentemente, con la patogenia de la artritis y el lupus. Más aún, esto sirvió como ejemplo convincente de la existencia de autoanticuerpos en un tiempo en que la autorreactividad se encontraba lejos de ser establecida. Por último, cabe mencionar que la percepción de Kunkel de que las proteínas del mieloma (los productos monoclonales de células plasmáticas malignas) eran el equivalente de anticuerpos normales producidos por células plasmáticas normales demostró que la teoría de selección clonal de Frank Macfarlane Burnet de 1959 era correcta18.
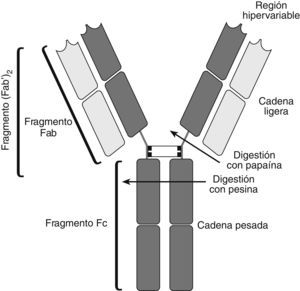
La estructura química de los anticuerposCuando Rodney R. Porter (1917–1986) se decidió por hacer cirugía molecular al anticuerpo, no sabía que estaba encendiendo el petardo que iniciaría una feria pirotécnica en la inmunología. Hoy por hoy, el renacimiento explosivo de ésta ciencia ya no muestra signos de que algún día vaya a menguar. Porter estudió en las Universidades de Liverpool y Cambridge. Entre 1949 y 1960 trabajó en el National Institute for Medical Research, en Mill Hill. Su último puesto fue como profesor de bioquímica en el Trinity College de Oxford. Para cuando inició su trabajo en Mill Hill, la bioquímica había florecido, sobre todo en metodología: compuestos conjugados con radioisótopos, cromatografía de dos dimensiones en papel y cromatografía líquida en columnas, tanto de intercambio iónico como de discriminación por peso molecular. Se sabía, además, que las enzimas proteinolíticas disgregaban las proteínas al hidrolizar los enlaces peptídicos, siempre en un lugar preciso según la enzima que se empleara. Porter empleó gammaglobulina de conejo y decidió escoger la papaína (enzima que requiere que un agente reductor la active) para digerir la estructura, y así logró aislar, mediante cromatografía líquida de intercambio iónico con carboximetilcelulosa, dos fracciones (I y II) aparentemente similares y un fragmento (fracción III) completamente diferente19. Si bien su trabajo mostraba datos turbios y confusos, logró demostrar que dos de sus fragmentos (I y II) presentaban afinidad para unirse al antígeno. Los datos experimentales indicaban firmemente bivalencia (los primeros dos fragmentos capaces de unirse al antígeno sin formar precipitados, como predecían las estructuras monovalentes), por lo que Porter pensó en la posibilidad de que las fracciones I y II podrían localizarse a cada lado de la fracción III. Sin embargo, no consideró la posibilidad de dos cadenas diferentes unidas covalentemente, ya que todas las estructuras de las proteínas conocidas en ese tiempo están compuestas por una sola cadena polipeptídica. Hoy conocemos las fracciones I y II de Porter como “Fab” (del inglés fragment antigen binding). Puesto que el fragmento III podía ser cristalizado, se lo conoció como “Fc” o fragmento cristalino. Los cristales indicaban que los fragmentos Fc provenientes de anticuerpos de diferentes especificidades eran prácticamente homogéneos. Por el contrario, la incapacidad de las fracciones I y II de formar cristales correlacionaba la especificidad antigénica con la heterogeneidad estructural, o sea, diferencias en su secuencia de aminoácidos. Si Porter hubiera empleado pepsina sin un agente reductor, habría obtenido un gran fragmento y una gran variedad de pequeños péptidos. Lo encontrado en la gran fracción habría sido capaz de precipitar antígenos. Mediante la adición de un agente reductor, el fragmento se habría dividido en dos fracciones, como ocurrió con la papaína. Los resultados difieren, puesto que los enlaces peptídicos susceptibles a la pepsina se encuentran más allá de los puentes disulfuro que unen al fragmento Fc, mientras que los de la papaína se encuentran por arriba de la unión disulfuro. Los fragmentos producidos por la pepsina se designan Fab’, en tanto que los no reducidos que presentan un receptor de antígeno dual se conocen como F(ab’)2.
Rodney Porter compartió el premio Nobel de Fisiología o Medicina en 1970 con Gerald M. Edelman (1929), quien empleó una estrategia similar pero con diferente táctica para resolver el problema de la estructura de los anticuerpos. El primer trabajo publicado sobre este tema también apareció en 195920. Sin embargo, uno más desarrollado y definitivo apareció en 196121. Éste, a diferencia del de Porter, es extraordinariamente elegante y su lectura resulta una delicia, sobre todo por la metodología bioquímica empleada. Edelman se graduó de médico cirujano en la Universidad de Pennsylvania y su entrenamiento clínico lo realizó, en el Massachusetts General Hospital. Obtuvo su doctorado en el Rockefeller Institute en 1960 bajo la tutela de Henry Kunkel. En su publicación de 1961 fue asistido por el checoslovaco Miroslav Dave Poulik, quien había emigrado a Canadá, donde obtuvo su grado de médico en 1960 en la Universidad de Toronto. Edelman y Poulik suponían que el anticuerpo estaba compuesto por más de una sola proteína. Si su sospecha fuera cierta, las cadenas deberían estar unidas por puentes disulfuro como ocurre en el aminoácido cisteína. Porter de hecho empleó la cisteína, por su propia naturaleza un agente reductor débil, para activar la papaína. Edelman y Poulik escogieron un reactivo sulfhidrilo más potente, el mercaptoetanol, que rompería los enlaces disulfuro si los había, y agregaron urea como un solvente de disociación de las posibles fracciones resultantes. El problema de la heterogeneidad de los anticuerpos lo tenían resuelto a priori gracias a los clarividentes hallazgos de su tutor Henry Kunkel: emplearon proteínas monoclonales de pacientes con mieloma múltiple. De hecho, al año siguiente Edelman y su estudiante Joseph A. Gally demostraron que las proteínas urinarias de Bence-Jones eran en realidad las cadenas de bajo peso molecular de las proteínas del mieloma22, con lo que resolvieron un misterio que se había iniciado en 1845 con su descubrimiento por el químico y médico inglés Henry Bence-Jones (fig. 1)23. Pero regresemos al clásico trabajo de Edelman y Poulik. Mediante el empleo de ultracentrifugación, cromatografía líquida y electroforesis, demostraron que en cada anticuerpo hay de 3 a 5 proteínas. En trabajos ulteriores en los siguientes años, Porter, Edelman y Alfred Nisonoff, entre otros24–26, establecieron la estructura básica de la IgG (fig. 2). Nisonoff, al tratar la molécula de IgG de conejos con pepsina, observó la generación de un solo fragmento bivalente (Fab’)2 y péptidos pequeños, esto es, un fragmento con capacidad de unirse a dos determinantes antigénicas, hallazgos que en conjunto vendrían a confirmar las ideas propuestas 25 años antes por John R. Marrack12, cuando señaló que los anticuerpos deberían de tener al menos dos sitios de unión al antígeno. El modelo aceptado actualmente de esta molécula consiste en cuatro cadenas: dos ligeras (L, del inglés light) y dos pesadas (H, del inglés heavy). Se propuso una configuración en forma de Y que luego se confirmó por microscopio electrónico y estudios de difracción de rayos X. Al poco tiempo se describieron dos tipos antigénicos de cadenas ligeras denominados κ y λ. Se observó que la macroglobulina IgM estaba constituida por cinco estructuras semejantes a la IgG, con una configuración en forma de estrella donde sus respectivos fragmentos Fc estaban unidos por una pequeña cadena polipeptídica denominada cadena J. Como indicaban los datos de Edelman y Poulik, algunos enlaces disulfuro no estaban directamente involucrados en uniones intercatenarias, sino que más bien servían para plegar la proteína lineal y así formar una sólida estructura terciaria en la que cada dominio globular ejercía su propia función.
En 1965 David S. Rowe y John L. Fahey descubrieron una nueva clase de anticuerpos, la IgD, que se encuentra primariamente restringida a la inmunorregulación en la superficie de las células beta27. Todas las clases de anticuerpos son funcionalmente distintas y la últimas dos que se aislaron eran extraordinariamente especializadas. El añejo acertijo inmunológico de la inmunidad local contra microorganismos patogénicos se resolvió cuando Thomas B. Tomasi y sus colaboradores determinaron que la IgA (que en un principio se había encontrado en el suero) podía incorporar un componente proteínico y ser secretada a varios fluidos en la zona donde llegan a confluir el huésped y su medio ambiente, es decir, tracto digestivo y vías respiratorias. La IgA se encuentra en forma de unidades monoméricas de 7°S, como dímero de 11°S y en su forma secretora de 18°S28. Por último, la IgE, descrita en 1966, es una inmunoglobulina con actividad reagínica y la encargada de iniciar la cascada inflamatoria derivada de la desgranulación de las células cebadas29,30.
EpílogoDespués de esta visión panorámica sobre la historia de cómo se llegó a establecer la estructura química de los anticuerpos, se podría concluir que la pesquisa inmunoquímica virtualmente se completó. Empero, quedaban aún muchos datos por aclarar, pero los principios estaban establecidos y, lo que es más, confirmados. La inmunoquímica continuó teniendo un papel preponderante en los diseños de vacunas y métodos diagnósticos.
A cincuenta años de distancia, podemos aseverar que los anticuerpos son unas estructuras extraordinarias, mucho más complicadas, diversas e interesantes de lo que se imaginaba en 1959. Los trabajos pioneros de Porter y Edelman y Poulik brindaron información acerca de la estructura elemental de estas moléculas. Su estructura fina, los mecanismos de su variabilidad y de la especificidad de sus receptores, la relación de las secuencias de aminoácidos con su función y otros problemas relacionados ocuparon a los investigadores por el resto del siglo. Como la cabeza de la hidra, el sistema inmunitario responde con dos preguntas por cada una que se le hace.