El rituximab se ha empleado con éxito en el tratamiento de la artritis reumatoide (AR). Sin embargo, su particular mecanismo de acción, así como la ausencia de pautas concretas en su manejo, hace que se hayan generado dudas sobre su utilización.
ObjetivoEstablecer recomendaciones que faciliten el empleo de rituximab en la práctica clínica habitual.
MétodosEn una primera ronda Delphi, se reunieron nueve reumatólogos expertos que desarrollaron preguntas sobre los temas con mayor duda sobre eficacia y seguridad del fármaco. Estas se adecuaron para hacer una revisión sistemática de la evidencia, que se presentó en una segunda reunión. Se formaron grupos nominales para dar respuesta a cada pregunta y emitir la recomendación. Estas recomendaciones fueron presentadas en una segunda ronda Delphi a un grupo ampliado de reumatólogos expertos. De nuevo se discutieron, se modificaron y se votaron las recomendaciones. Una vez aprobada cada recomendación, se votó el grado de acuerdo.
ResultadosSe establecieron 17 recomendaciones: diez de eficacia y siete de seguridad. Todas las recomendaciones de eficacia, excepto tres, presentaron un nivel de evidencia bueno o moderado. Entre las recomendaciones de seguridad, tres presentaron un nivel de evidencia bueno o moderado, mientras que para el resto la evidencia fue indirecta, escasa o nula y son producto de las recomendaciones de los expertos. El grado de acuerdo entre expertos fue elevado para la mayoría de las recomendaciones.
ConclusionesEstas recomendaciones pretenden aclarar dudas sobre el uso de rituximab y establecer pautas de empleo en la práctica clínica. Las recomendaciones de eficacia tienen un nivel de evidencia alto y permiten guiar al médico en decisiones terapéuticas. Las recomendaciones de seguridad tienen un nivel de evidencia menor.
Rituximab has been employed successfully for the treatment of Rheumatoid Arthritis (RA). However, its particular mechanism of action, as well as a lack of concrete guidelines for its management have generated doubts on its use.
ObjectiveTo establish recommendations that facilitates the use of rituximab in common clinical practice.
MethodsIn a first Delphi round, 9 expert rheumatologists got together to develop questions on those subjects generating most doubts on the efficacy and safety of the drug. These were adapted to perform a systematic review of the evidence, which was presented in a second meeting. Nominal groups were formed to respond to each question and give a recommendation. These recommendations were presented in a second Delphi round to a larger group of experts in rheumatology. Once again recommendations were discussed, modified and voted upon. Once approved, a vote on the degree of agreement for each recommendation was carried out.
Results17 recommendations were established, 10 regarding efficacy and 7 safety. All of the efficacy recommendations except 3 presented a good or moderate degree of evidence. Among the safety recommendations, 3 had a good or moderate degree of evidence while in the rest it was indirect, scarce or non-existent and a product of expert recommendation. The degree of agreement between experts was elevated for most of the recommendations.
ConclusionsThese recommendations attempt to clear doubts on the use of rituximab and establish guidelines for its use in daily practice. Efficacy recommendations have a high degree of evidence, allowing the clinician to be guided in therapeutic decisions. Safety recommendations have a lower degree of evidence.
La artritis reumatoide (AR) es una enfermedad articular inflamatoria crónica asociada a discapacidad, pérdida de calidad de vida e incremento de mortalidad. En los últimos años el arsenal terapéutico de la AR se incrementado con nuevos fármacos, los agentes biológicos que, junto con los fármacos tradicionales como el metotrexato (MTX), han supuesto un avance considerable en el tratamiento de esta enfermedad.
De las nuevas terapias biológicas, el rituximab (RTX), un anticuerpo monoclonal quimérico anti CD20 que ya se había comercializado para el tratamiento del linfoma no hodgkiniano de linfocitos B, se ha utilizado con éxito en el tratamiento de la AR. El RTX produce una profunda depleción mantenida de linfocitos B (CD20+), que abarca el espectro de las células pre-B hasta los linfocitos B maduros, sin afectar a las células madre ni a las células plasmáticas1,2.
La primera evidencia de su utilidad en la AR fue un estudio piloto que demostró que la depleción de linfocitos B producía una mejoría persistente en los pacientes con AR3. Posteriormente, otro estudio llevado a cabo por los mismos investigadores confirmó el beneficio terapéutico4. Sin embargo, el desarrollo clínico de RTX ha sido distinto que el de otros agentes biológicos. Este hecho, unido a un mecanismo de acción diferente, la ausencia de un esquema posológico concreto y el efecto que a largo plazo podría originar una depleción persistente de linfocitos B, supuso que el RTX ya en 2007 fuera motivo de unas recomendaciones internacionales de uso5 que durante este año se están revisando.
En lo que se refiere a la reumatología de nuestro país, la Sociedad Española de Reumatología ha publicado recientemente una actualización del documento consenso sobre uso de terapias biológicas6. Dado que en ese documento no se profundiza en las peculiaridades del RTX, un grupo de reumatólogos con experiencia en el uso de agentes biológicos considera importante llevar a cabo una revisión que plasmara unas recomendaciones que facilitaran el uso de RTX. Para ello se han basado en la evidencia existente y además han elaborado recomendaciones de experto para las situaciones en que la evidencia sea escasa o nula.
MétodosPara realizar este consenso, se utilizó una modificación de la metodología de RAND/UCLA7. Se crearon grupos nominales y se realizaron encuestas Delphi y revisiones sistemáticas de las recomendaciones.
Primera fase: elaboración de las preguntas y primera ronda DelphiEl encargado del proyecto (EMM) seleccionó a ocho reumatólogos expertos, según los siguientes criterios: a) al menos 5 años de experiencia en la consulta de AR y biológicos, entre ellos RTX; b) artículos publicados sobre AR y terapias biológicas en MEDLINE, Reumatología Clínica y/o Revista Española de Reumatología; c) representación geográfica del territorio español. Se realizaron reuniones de grupo nominal, así como una encuesta Delphi con la que se decidieron los temas más controvertidos y de mayor interés para el consenso. La primera reunión tuvo lugar en julio de 2009. En ella, se generaron preguntas sobre los puntos controvertidos y finalmente se elaboraron 17 enunciados sobre preguntas frecuentes en la práctica clínica para el manejo de pacientes con RTX. Los 17 enunciados contenían 21 preguntas (algún enunciado incluía más de una pregunta), y se sometieron a revisión de redacción y reelaboración con el fin de realizar la revisión sistemática; quedaron al final diez preguntas de eficacia, doce preguntas de seguridad y cuatro preguntas de seguimiento. Se realizó una primera ronda Delphi, en la que los expertos puntuaron el grado de relevancia de cada pregunta.
Segunda fase: revisión sistemática de la evidenciaCon las preguntas definidas y su relevancia asignada, se procedió a realizar una revisión sistemática de la evidencia (BHC, MGA), según metodología Cochrane.
Los criterios para considerar estudios para esta revisión fueron ensayos clínicos y estudios observacionales de RTX. La población diana fueron los pacientes con AR del adulto según criterios de clasificación del American College of Rheumatology de 1987.
Intervención: tratamiento con RTXMedidas de desenlace: se seleccionaron las propuestas por Outcome Mesurements in Reumatoid Arthritis Clinical Trials (OMERACT)8.
- –
Eficacia: ACR50, ACR70, DAS28, remisión según DAS28, criterios EULAR de respuesta, mejoría en el HAQ.
- –
Desenlace radiográfico: porcentaje de pacientes sin progresión radiográfica, cambio medio en el índice radiográfico.
- –
Seguridad: defunciones, infecciones graves, eventos adversos graves, retiradas del estudio por cualquier causa y retirada del estudio por efectos adversos graves.
Búsquedas electrónicas: PubMed, EMBASE, Cochrane library. Otras fuentes de obtención de datos: búsqueda manual de los resúmenes de los congresos de EULAR y ACR de 2003 a 2009. Solicitud de datos a Roche Pharma. Ficha técnica Mabthera 2009.
Periodo de búsqueda: enero de 2003 a septiembre de 2009.
Análisis estadístico: se realizó el cálculo del número de pacientes que es necesario tratar (NNT), el número necesario de pacientes para hallar toxicidad (NNH) y los intervalos de confianza (IC), mediante modelo de efectos fijos, técnica de metaanálisis siguiendo la metodología Cochrane. El análisis estadístico se realizó con los programas STATA10.0 y RevMan 5. En los casos en que no fue posible realizar una revisión sistemática, se hizo una revisión no sistemática de la literatura. El grado de acuerdo entre los expertos se definió como el porcentaje de consenso entre las votaciones de cada una de las recomendaciones. El nivel de evidencia y el grado de recomendación de la evidencia se emitieron según lo recomendado por el Center for Evidence Based Medicine de Oxford9.
Tercera fase: presentación y discusión de la evidencia. Elaboración de recomendacionesEn una segunda reunión (noviembre de 2009), se presentaron los resultados de la evidencia y se discutieron diferentes puntos de interés. Mediante grupos nominales, se discutieron y se elaboraron las recomendaciones pertinentes. Cada experto de este grupo inicial propuso al menos dos recomendaciones, una para cada pregunta, que se seguía de una discusión breve, la cual argumentaba la recomendación propuesta. Con este material se hizo un primer documento (borrador), que se distribuyó entre todos los expertos iniciales y un grupo más extenso de expertos (20 reumatólogos) que cumplían unas características similares a las de los expertos iniciales y acudieron a la reunión final del consenso.
Cuarta fase: segunda ronda DelphiFinalmente, en abril de 2010, se realizó la reunión final del grupo de expertos inicial y los 20 expertos restantes. En dicha reunión, se presentó la evidencia existente sobre RTX y posteriormente, en grupos pequeños, las recomendaciones propuestas se discutieron y, si se consideró necesario, se modificaron. Más tarde, en una reunión conjunta de todos los expertos, se presentaron las recomendaciones que se proponían como definitivas pero, dado que había expertos que no habían podido estar presentes en la discusión de todas las recomendaciones, se habilitó un tiempo para que estos, si lo creían necesario, postularan una recomendación alternativa. La aprobación de una recomendación como definitiva en una primera votación requirió al menos el 75% de los votos, y si esto no se conseguía, se volvía a discutir hasta reformularla. Para ser aprobada en segunda votación, se exigió al menos el 67% de los votos y, finalmente, si esto no hubiese ocurrido, en una tercera reformulación se habría exigido al menos mayoría simple. Sin embargo, en ningún caso se llegó a esta situación, ya que la mayoría de las recomendaciones fueron aprobadas en primera o, en algún caso, segunda votación. Al mismo tiempo y una vez aprobada la recomendación en cuestión, se votó el grado de acuerdo. Este proceso de votación está basado en una modificación de la técnica Delphi10.
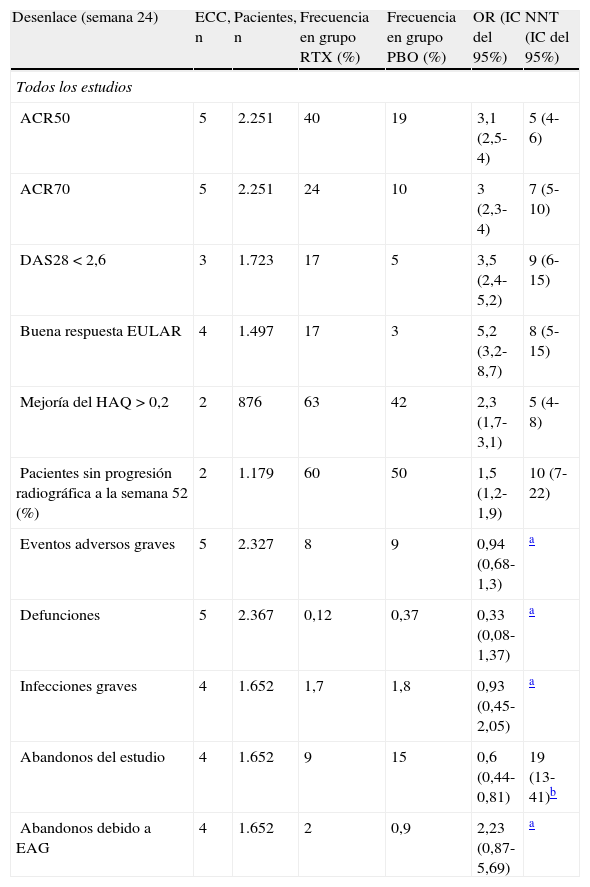
Resultados de la revisión sistemática sobre la eficacia y seguridad de RTX en los ensayos clínicosEn la tabla 1 se muestran los principales resultados de eficacia del tratamiento con RTX frente a placebo en diversos escenarios de pacientes con AR, básicamente en fracaso con fármacos modificadores de enfermedad (FAME)11-13 o inhibidores del factor de necrosis tumoral (anti-TNF)19 y en pacientes sin exposición previa a metotrexato (MTX)14.
| Desenlace (semana 24) | ECC, n | Pacientes, n | Frecuencia en grupo RTX (%) | Frecuencia en grupo PBO (%) | OR (IC del 95%) | NNT (IC del 95%) |
| Todos los estudios | ||||||
| ACR50 | 5 | 2.251 | 40 | 19 | 3,1 (2,5-4) | 5 (4-6) |
| ACR70 | 5 | 2.251 | 24 | 10 | 3 (2,3-4) | 7 (5-10) |
| DAS28<2,6 | 3 | 1.723 | 17 | 5 | 3,5 (2,4-5,2) | 9 (6-15) |
| Buena respuesta EULAR | 4 | 1.497 | 17 | 3 | 5,2 (3,2-8,7) | 8 (5-15) |
| Mejoría del HAQ>0,2 | 2 | 876 | 63 | 42 | 2,3 (1,7-3,1) | 5 (4-8) |
| Pacientes sin progresión radiográfica a la semana 52 (%) | 2 | 1.179 | 60 | 50 | 1,5 (1,2-1,9) | 10 (7-22) |
| Eventos adversos graves | 5 | 2.327 | 8 | 9 | 0,94 (0,68-1,3) | a |
| Defunciones | 5 | 2.367 | 0,12 | 0,37 | 0,33 (0,08-1,37) | a |
| Infecciones graves | 4 | 1.652 | 1,7 | 1,8 | 0,93 (0,45-2,05) | a |
| Abandonos del estudio | 4 | 1.652 | 9 | 15 | 0,6 (0,44-0,81) | 19 (13-41)b |
| Abandonos debido a EAG | 4 | 1.652 | 2 | 0,9 | 2,23 (0,87-5,69) | a |
EAG: efectos adversos graves; ECC: ensayos clínicos controlados; NNT: número de pacientes que es necesario tratar; PBO: placebo; RTX: rituximab.
El NNT con RTX frente a placebo, para tener una respuesta clínica o radiográficamente significativa, fue 5-10 (IC del 95%, 4-22). En el NNH para tener un evento adverso grave, una infección grave, defunción o abandono del ensayo por eventos adversos graves, no se registraron diferencias significativas entre el grupo tratado con RTX y el placebo. La estimación de odds ratio (OR) incluye la unidad y, por lo tanto, no es posible calcular un NNH, excepto para abandonos del estudio por eventos adversos. Hubo más abandonos en el grupo que recibió placebo y la causa fueron los brotes de actividad de la AR (tabla 1).
RecomendacionesLa tabla 2 resume las recomendaciones con nivel de evidencia y grado de acuerdo de la recomendación.
Resumen de las recomendaciones con nivel de evidencia9 y grado de acuerdo de la recomendación
| Recomendación | Nivel de evidencia | Categoría | Acuerdo final (%) |
| Eficacia | |||
| Pregunta 1. ¿Cuál es la eficacia de rituximab como primer agente biológico? | |||
| El rituximab ha demostrado ser eficaz como primer agente biológico en la artritis reumatoide, aunque esta indicación no está actualmente aprobada. A la dosis recomendada, retrasa el daño estructural en pacientes sin tratamiento previo con metotrexato | 1a | A | 96 |
| Pregunta 2. ¿Cuál es la eficacia de rituximab cuando se administra como segundo o tercer biológico, tras fallo con uno o más anti-TNF, respectivamente? ¿Existen diferencias de eficacia al administrarlo como segundo o tercer biológico? | |||
| Rituximab es eficaz en pacientes con respuesta inadecuada a anti-TNF | 1c | A | 96 |
| Su eficacia es menor cuando se utiliza en escalones terapéuticos más tardíos | 2a | C | 96 |
| Pregunta 3. ¿Cuál es la eficacia de rituximab en pacientes con FR y ACPA negativos? | |||
| La ausencia de FR y ACPA no descarta la respuesta a rituximab. Si se administra a esta población, la respuesta terapéutica es inferior a la que se obtiene en los pacientes con FR y/o ACPA positivos | 1c | B | 82 |
| Pregunta 4. ¿Cuál es la eficacia de rituximab en monoterapia comparado con rituximab combinado con metotrexato? ¿Cuál es la eficacia de rituximab más metotrexato comparado con rituximab más otro/s FAME? | |||
| El tratamiento con rituximab parece más eficaz si se combina con metotrexato u otro FAME, especialmente leflunomida | 2b | B | 85 |
| Pregunta 5. ¿Cómo se comporta rituximab (500 mg×2) frente a rituximab (1 g×2)? | |||
| La dosis eficaz de rituximab en pacientes con AR que no han respondido a anti-TNF es 1.000 mg×2. Actualmente no se puede recomendar la dosis de 500 mg×2 porque no hay datos que respalden su eficacia en estos pacientes | 2b | B | 100 |
| Pregunta 6. ¿Cuál es la eficacia de rituximab después de dos o más ciclos de rituximab? | |||
| Los pacientes con artritis reumatoide que han tenido una respuesta satisfactoria a un primer ciclo de rituximab (1.000 mg×2) pueden beneficiarse de nuevos ciclos de tratamiento | 1c | B | 100 |
| Seguimiento | |||
| Pregunta 7. ¿Existen ventajas del tratamiento con rituximab siguiendo un esquema fijo (cada 6 meses) con respecto al tratamiento a demanda? | |||
| Rituximab se ha mostrado eficaz tanto en los pacientes a los que se administró siguiendo un esquema posológico fijo (cada 6 meses) como en los que lo recibieron a demanda. La administración siguiendo un esquema fijo podría contribuir a mantener a los pacientes con un nivel de actividad menor | –2b | C | 74 |
| Pregunta 8. ¿Qué datos de eficacia hay con el retratamiento de los pacientes sin respuesta previa a rituximab comparados con los que tuvieron una respuesta moderada o buena (criterios EULAR)? | |||
| La eficacia de la administración de un nuevo ciclo de rituximab en pacientes que no han respondido previamente es cuestionable | –2b | D | 89 |
| Pregunta 9. ¿Es útil monitorizar las células B en los pacientes que reciben rituximab? | |||
| En la práctica clínica, la eficacia del tratamiento con rituximab o la necesidad de nuevos ciclos tienen que determinarse con base en índices de actividad clínica y no según la concentración de células B en sangre periférica | 4 | D | 100 |
| Pregunta 10. ¿Cuál es el tiempo óptimo para evaluar la respuesta de un paciente al que se ha tratado con rituximab (12 frente a 16 semanas)? | |||
| Se considera que el momento más adecuado para evaluar la respuesta del tratamiento con rituximab debe ser en torno a la semana 16 | 1c | A | 100 |
| Seguridad | |||
| Pregunta 11. En los pacientes que reciben rituximab, ¿cuál es la frecuencia de descenso de inmunoglobulinas y qué relación existe entre este descenso y la aparición de infecciones graves? | |||
| Los pacientes que reciben tratamiento con rituximab pueden presentar descensos de IgG e IgM en algún momento del tratamiento | 1a | A | 96 |
| Se ha observado una posible tendencia a un número mayor de infecciones graves tras descensos de IgG. Se recomienda cuantificar periódicamente las inmunoglobulinas | 1c | B | 96 |
| Pregunta 12. ¿Cuál es la eficacia de la vacunación en pacientes que reciben rituximab? | |||
| Los pacientes que a los que se va a tratar con rituximab deben recibir las mismas vacunas que los pacientes inmunodeficientes. La respuesta a la vacunación está disminuida en ellos. Se recomienda vacunar preferiblemente antes de iniciar el tratamiento con rituximab o lo más lejos posible del ciclo anterior | –1c | B | 96 |
| Pregunta 13. En los pacientes que reciben rituximab, comparado con placebo, ¿hay un incremento de las infecciones graves? | |||
| El riesgo de infecciones graves en pacientes con artritis reumatoide tratados con 1.000 mg×2 de rituximab está aumentado en comparación con pacientes similares que han recibido placebo. Los ciclos repetidos no aumentan este riesgo | 2b | B | 89 |
| Pregunta 14. En los pacientes con neoplasia sólida previa y que posteriormente reciben rituximab, ¿cuál es el riesgo de que se desarrolle un nuevo tumor sólido? | |||
| Aunque el tratamiento con rituximab no parece aumentar el riesgo de una nueva neoplasia sólida, se recomienda un control estrecho de todos los pacientes que reciban este agente biológico | –4 | D | 100 |
| Pregunta 15. En los pacientes tratados con rituximab, ¿cuál es el riesgo de enfermedad pulmonar intersticial? | |||
| No hay datos que indiquen que se desarrolle enfermedad pulmonar intersticial difusa con rituximab en artritis reumatoide. No hay datos suficientes de seguridad que avalen o contraindiquen la administración de rituximab en pacientes con artritis reumatoide y enfermedad pulmonar intersticial difusa | 5 | C | 93 |
| Pregunta 16. En los pacientes tratados con rituximab, ¿cuál es el riesgo de insuficiencia cardíaca congestiva? | |||
| No hay datos de que la administración de rituximab favorezca el desarrollo de insuficiencia cardíaca congestiva. Rituximab se puede administrar a pacientes con insuficiencia cardíaca bien controlada. En los pacientes con insuficiencia cardíaca congestiva grave (clase IV) o enfermedad cardíaca grave no controlada, el uso de rituximab está contraindicado | 5 | D | 96 |
| Pregunta 17. ¿Cuál es el riesgo de fallo hepático fulminante en pacientes que tienen infección por virus de la hepatitis B y reciben rituximab? | |||
| Existe riesgo de reactivación de una hepatitis por virus B, incluida una hepatitis fulminante, en pacientes con infección crónica por este virus que reciben rituximab. Se recomienda no tratar con rituximab a pacientes con infección crónica por virus B, salvo circunstancias muy excepcionales, en las que se deberá realizar un seguimiento estricto del paciente y el tratamiento antiviral adecuado | –4 | D | 100 |
ACPA: anticuerpos antiproteínas citrulinadas; FR: factor reumatoide; TNF: factor de necrosis tumoral.
Según las recomendaciones del Center for Evidence Based Medicine de Oxford9, se debe añadir un signo – para indicar que el nivel de evidencia no es concluyente si se trata de un ensayo clínico aleatorizado con intervalo de confianza amplio y no estadísticamente significativo o una revisión sistemática con heterogeneidad estadísticamente significativa.
Pregunta 1. ¿Cuál es la eficacia de rituximab como primer agente biológico?
El rituximab ha demostrado ser eficaz como primer agente biológico en la artritis reumatoide, aunque esta indicación no está actualmente aprobada. A la dosis recomendada, retrasa el daño estructural en pacientes sin tratamiento previo con metotrexato.
a) Categoría de la evidencia: 1a; b) fuerza de la recomendación: A; grado de acuerdo: 7,8/9 (86%).
Votos a favor entre dos proposiciones: 73%. Votos a favor siendo sólo una opción: 96%.
Esta es una de las recomendaciones con mayor grado de evidencia (1a), y el grado de acuerdo alcanzó un 86%. Esta recomendación tuvo que ser elegida entre dos opciones, alcanzando finalmente un 96% de votos a favor de la recomendación.
Comentario a la recomendación
El estudio DANCER investigó el efecto de dos dosis de RTX (500mg×2 y 1.000mg×2) y de la pauta de esteroides en pacientes con AR y respuesta insuficiente a FAME, lo cual incluyó también, aproximadamente, un 30% de pacientes tratados previamente con anti-TNF. El análisis de eficacia sólo se llevó a cabo en los pacientes con factor reumatoide (FR) positivo, aunque, según se comenta en el artículo, la inclusión de los pacientes con FR negativo no habría alterado los resultados. No hubo diferencias en la respuesta ACR20 y ACR50 entre las dos dosis de RTX a las 24 semanas. Aunque no hubo diferencias significativas en la respuesta ACR70, numéricamente la respuesta de 1.000mg×2 fue mayor. Además, este estudio demostró que la pauta de esteroides no influye en la eficacia a largo plazo del RTX, pero que administrados antes de la infusión reducen las reacciones relacionadas con la infusión. Este estudio no aporta datos sobre daño estructural11. En el estudio SERENE, cuyo objetivo era evaluar la eficacia de RTX en pacientes con AR y respuesta insuficiente a MTX que no habían recibido previamente agentes biológicos, los pacientes que recibieron ambas dosis —500mg×2 o 1.000mg×2— consiguieron una mejoría significativa de todos los índices de respuesta: ACR20, ACR50, ACR70, EULAR y escalas HAQ de discapacidad, fatiga y calidad de vida. La respuesta inicial no fue claramente superior en el grupo seropositivo, aunque sí lo fue al repetir el ciclo. Tampoco este estudio aportó datos sobre daño estructural12. El estudio MIRROR investigó el efecto de tres pautas de RTX en pacientes con AR activa y respuesta insuficiente a FAME, y se podía incluir a pacientes que habían recibido como máximo un agente biológico. Se utilizaron las dosis de 500mg×2 y retratamiento con 500mg×2 (reducida), dosis 500mg×2 y retratamiento con 1.000mg×2 (escalada) y, finalmente, dosis de 1.000mg×2 y retratamiento con 1.000mg×2 (aprobada). A la semana 48 no había diferencias significativas en la respuesta ACR, pero la dosis aprobada (1.000mg×2) tenía respuestas numéricamente mayores que la reducida o la escalada. Sí que hubo diferencias, sin embargo, a favor de la dosis aprobada en la respuesta EULAR. La respuesta en pacientes sin tratamiento biológico previo fue numéricamente superior a la de los pacientes que habían recibido un anti-TNF previo. Este estudio tampoco aportó datos sobre el daño estructural13. Finalmente, en el estudio IMAGE, en el que se incluyó a pacientes con AR de menos de 4 años de evolución, seropositivos o con erosiones, a las dosis de 1.000mg×2 o 500mg×2, ambas dosis demostraron una eficacia similar en las medidas clásicas de respuesta. No obstante, al año de tratamiento la dosis de 1.000mg×2 reducía de manera significativa la progresión del daño estructural comparada con 500mg×2 o placebo14. La aparición de algunos casos de leucoencefalopatía multifocal progresiva (LMP) en distintas situaciones clínicas ha supuesto que Hoffman La Roche haya decidido no proseguir la indicación de RTX en este tipo de pacientes: AR sin tratamiento previo con FAME.
No hay estudios clínicos en pacientes con contraindicación a un anti-TNF, aunque sí hay descripciones observacionales que refieren mejorías similares a las descritas anteriormente15-18.
Pregunta 2. ¿Cuál es la eficacia de rituximab cuando se administra como segundo o tercer biológico, tras fallo de uno o más anti-TNF, respectivamente? ¿Existen diferencias de eficacia al administrarlo como segundo o tercer biológico?
Rituximab es eficaz en pacientes con respuesta inadecuada a antagonistas del TNFa. Su eficacia es menor cuando se utiliza en escalones terapéuticos más tardíosb.
aa) Categoría de la evidencia, 1c; b) fuerza de la recomendación, A; grado de acuerdo: 7,8/9 (86%).
ba) Categoría de la evidencia, 2a; b) fuerza de la recomendación, C; grado de acuerdo: 7,8/9 (86%).
Votos a favor entre dos proposiciones: 78%; votos a favor siendo sólo una opción 96%.
Comentario a la recomendación
La evidencia de esta recomendación se ha dividido en dos partes, ya que tocaban aspectos ligeramente diferentes. La evidencia era superior para la primera parte de la recomendación (1c) y el grado de acuerdo (86%) y su aceptación, una vez eliminada otra posibilidad, fue elevado (96%).
El RTX ha demostrado ser eficaz y seguro en pacientes con AR y respuesta inadecuada a anti-TNF19,20. De hecho, actualmente esta situación clínica es la única indicación de RTX en la ficha técnica. En estos pacientes, el RTX es más eficaz cuando se administra como segundo agente biológico que en escalones terapéuticos más tardíos. Esto se basa fundamentalmente en los resultados de un subanálisis del estudio REFLEX presentados en el ACR 200621, donde se mostró que la tasa de respuesta ACR en la semana 24 en pacientes que reciben RTX fue un 10% mejor en los pacientes en quienes había fallado un solo anti-TNF que en quienes habían fallado más de dos. Estos resultados se han confirmado en estudios con diferentes diseños17,22,23 y reflejan fundamentalmente la selección de un grupo de pacientes con enfermedad más refractaria. Sin embargo, en otro estudio no se ha encontrado relación entre la respuesta clínica al tratamiento con RTX y el número de anti-TNF previos16. Al igual que en otros trabajos, en este último la respuesta a RTX está determinada sobre todo por el motivo de suspensión del anti-TNF: mejor respuesta a RTX por ineficacia previa a anti-TNF que cuando este se suspendió por otros motivos, por ejemplo, la seguridad16.
Pregunta 3. ¿Cuál es la eficacia de rituximab en pacientes con (ambos) FR y anticuerpos antiproteínas citrulinadas (ACPA) negativos?
La ausencia de FR y ACPA no descarta la respuesta a rituximab. Si se administra a esta población, la respuesta terapéutica es inferior a la que se obtiene en los pacientes con FR y/o ACPA positivos.
a) Categoría de la evidencia, 1c; b) fuerza de la recomendación, B; grado de acuerdo: 7,4/9 (82%).
Votos a favor entre dos proposiciones: 58%; votos a favor siendo sólo una opción: 96%.
Comentario a la recomendación
Esta recomendación supone un grado de evidencia buena (1c) con un grado de acuerdo también elevado (82%).
No existe ningún estudio dirigido específicamente a responder si el RTX es efectivo en el subgrupo de pacientes con AR y ambos anticuerpos, FR y ACPA, negativos. Los estudios aleatorizados y controlados de RTX frente a placebo, como los estudios DANCER11 o REFLEX19, incluyeron a un número relativamente pequeño de enfermos seronegativos. En el estudio DANCER, la tasa de respuesta ACR20 en el grupo de pacientes con FR negativo fue similar a la del placebo (el 48 frente al 52%). En este estudio el número de pacientes seronegativos fue muy pequeño (n=63 en el grupo con RTX y n=21 en el grupo a placebo) y llama la atención la tasa sorprendentemente alta de respuesta con placebo11. En el estudio REFLEX, las respuestas ACR fueron superiores en los pacientes con FR positivo en en los pacientes FR negativo. Las tasas de respuesta ACR20 en la semana 24 en los pacientes tratados con RTX fueron del 54% en los pacientes con FR negativo y el 41% en los pacientes con FR negativo19. Un subanálisis de este estudio, en el que se analiza la tasa de respuestas de RTX frente a placebo en el pequeño subgrupo (29 con RTX y 16 con placebo) de pacientes seronegativos para ambos autoanticuerpos, pone de manifiesto que la respuesta ACR 20, pero no ACR50 o ACR70, es superior con RTX que con placebo (el 28 frente al 6%), al igual que la respuesta EULAR (el 44 frente al 14%)24,25. No se completó el estudio estadístico por ser una muestra muy pequeña.
Isaacs et al26 analizan datos conjuntos de los estudios de RTX fase III MIRROR y SERENE y comparan los porcentajes de respuesta a RTX en pacientes seropositivos a FR y/o ACPA frente a los pacientes sin los anticuerpos mencionados. Las tasas de respuestas ACR20, 50 y 70 en la semana 48 fueron estadísticamente superiores en los seropositivos. También la disminución del DAS28 fue superior en el grupo seropositivo que en el seronegativo (–2,48 frente a –1,72). El estudio concluye que la probabilidad de respuesta en los seropositivos respecto a los seronegativos es 2-3 veces superior26.
En un subanálisis del estudio IMAGE, que se llevó a cabo en pacientes con AR de inicio no previamente tratados con MTX, se analizó la respuesta clínica y radiológica de RTX (+MTX) frente a placebo (+MTX) y se compararon los resultados entre pacientes seropositivos (FR y/o ACPA positivos) y seronegativos (FR y ACPA negativos). La respuesta ACR50 al año de tratamiento en el grupo de seropositivos fue superior en los que recibieron RTX (+MTX) (el 66 frente al 46%), mientras que en el grupo seronegativo no hubo diferencias (el 54% de respuestas en ambos grupos). En cuanto a la progresión radiológica, hubo diferencias significativas a favor de RTX en los seropositivos, pero no en los seronegativos27.
Pregunta 4. ¿Cuál es la eficacia de rituximab en monoterapia comparado con rituximab combinado con metotrexato? ¿Cuál es la eficacia de rituximab más metotrexato comparado con rituximab más otro/s FAME?
Votos a favor entre dos proposiciones: no realizada, por no haber otras propuestas; votos a favor siendo sólo una opción: 85%.
Comentario a la recomendación
Esta recomendación aporta una evidencia aceptable (2b) con un grado de acuerdo que sobrepasa el 75%.
Sólo hay un estudio aleatorizado que compara RTX en monoterapia con la asociación a MTX, aunque el número de pacientes estudiado es sólo de 404. Se encontró una respuesta numéricamente superior en el grupo que recibió RTX+MTX frente a los tratados con RTX en monoterapia, aunque carecía de significación estadística. No obstante, en un estudio prospectivo abierto con 107 pacientes, se trató a 19 con RTX en monoterapia, por no haber tolerado previamente el MTX. La respuesta se comparó con la de los demás pacientes que habían recibido RTX y MTX. Al cabo de 6 meses, el DAS28 de los pacientes que recibieron la combinación era significativamente inferior que el de los pacientes tratados en monoterapia28. En un estudio observacional abierto de casos y controles con 20 pacientes en cada grupo, la eficacia medida según DAS28 fue similar en ambos grupos a la semana 1629. Un registro de 50 pacientes tratados con RTX establece una respuesta superior en los pacientes tratados en combinación con MTX (88%) respecto a los tratados con RTX en monoterapia (53%)30. Sin embargo, esta diferencia no se aprecia en otro registro de 108 pacientes, de los que 95 fueron evaluables, ya que la respuesta EULAR fue similar en los que recibían RTX, con o sin MTX31. Estas discrepancias pueden tener base en las diferencias existentes entre las distintas poblaciones estudiadas, al no proceder los pacientes de estudios controlados.
En lo que concierne al efecto en la depleción de linfocitos B, en el estudio original de Edwards no se observan diferencias entre RTX en monoterapia y en combinación4. No obstante, en un estudio posterior, en el cual los linfocitos B se determinaron por citometría de flujo de alta sensibilidad, se evidenció que los valores de linfocitos B eran significativamente inferiores en los pacientes tratados con la combinación de RTX y MTX28.
Los estudios fundamentales están realizados con MTX, ya sea como comparador o como fármaco asociado a RTX. En un estudio alemán multicéntrico, prospectivo y sin intervención, que ha incluido a 2.400 pacientes con AR, se realizó un análisis provisional de los datos con 995 pacientes de 124 centros. Después de 4 meses de tratamiento, se observó una respuesta numéricamente superior (p>0,05) en los pacientes en tratamiento con RTX+LFN frente a RTX+MTX frente a RTX en monoterapia. No se evidenció una tasa diferente de acontecimientos adversos al fármaco. Sin embargo, este estudio no aclara las características de los pacientes32. Otros estudios también respaldan el uso de leflunomida asociada a RTX, como alternativa a MTX cuando este está contraindicado. Así, en un estudio retrospectivo de 10 pacientes de Henes et al33, 7 alcanzaron una respuesta EULAR buena o moderada a los 6 meses de tratamiento combinado. Asimismo, en otro estudio reciente34 trataron a 15 pacientes (5 de ellos ya tratados con anti-TNF) con AR activa que habían tenido resistencia al tratamiento con leflunomida en monoterapia. La combinación de RTX y leflunomida indujo una respuesta EULAR en el 80% de los pacientes tratados con la combinación, sin un aumento significativo de acontecimientos adversos.
Pregunta 5: ¿Cómo se comporta rituximab (500mg×2) frente a rituximab (1g×2)?
La dosis eficaz de RTX en pacientes con AR que no han respondido a anti-TNF es 1.000mg×2. Actualmente no se puede recomendar la dosis de 500mg×2 porque no existen datos que confirmen su eficacia en estos pacientes.
a) Categoría de la evidencia, 1b; b) fuerza de la recomendación, A; grado de acuerdo: 8/9 (89%).
Votos a favor entre dos proposiciones: 85%; votos a favor siendo sólo una opción: 100%.
Comentario a la recomendación
Esta recomendación es una de las que presenta mayor evidencia (1a) y grado de acuerdo (89%). Asimismo, una vez elegida entre dos propuestas, el 100% de los expertos votó a favor.
El RTX ha sido aprobado para usarlo tras fallar con FAME, de los que al menos uno tiene que ser un anti-TNF. El estudio REFLEX19, en el cual descansa esta indicación, se llevó a cabo en pacientes con AR activa en los que había fracasado al menos un anti-TNF. El estudio tuvo dos brazos; en uno los pacientes recibían MTX más placebo y en el otro, MTX más 1.000mg×2 de RTX. Todas las medidas de eficacia fueron superiores en el brazo activo. No hubo brazo con una dosis menor.
Otros estudios con poblaciones diferentes sí han empleado, sin embargo, RTX a dosis de 500 y 1.000mg. Así, el estudio IMAGE14,35 comparó las dosis de 500mg×2 y 1.000mg×2 de RTX en pacientes con AR que no habían recibido MTX. En este estudio, los resultados de la mejoría de función medidos con SF-36 y la progresión radiográfica del daño articular al año del tratamiento fueron significativamente más favorables con la dosis de 1.000mg×2 que con la de 500mg×2. Sin embargo, la mejoría de signos y síntomas y HAQ no fueron diferentes con ninguna de las dos dosis. En el estudio DANCER11, los porcentajes de pacientes que alcanzaron respuestas ACR20/50/70 no fueron diferentes a las 24 semanas en los pacientes tratados con 500mg×2 que en los tratados con 1.000mg×2. El estudio DANCER no estaba diseñado para comparar las dos dosis e incluía a pacientes que habían respondido de forma incompleta a FAME no biológicos o biológicos. En el estudio MIRROR13 en pacientes con AR que no habían respondido a MTX (algunos de ellos se habían tratado también con anti-TNF), se comparó la eficacia de tres regímenes diferentes de RTX: dos cursos de 500mg×2, dos cursos de RTX 1.000mg×2 y un curso de 500mg×2 seguido de un curso de 1.000mg×2. A las 48 semanas, los porcentajes de pacientes que alcanzaron respuestas ACR20/50/70 no fueron significativamente diferentes. Todos los datos juntos indican que la dosis de RTX que ha demostrado ser eficaz en pacientes con AR que han respondido de forma incompleta a los anti-TNF es la de 1.000mg×2. Sin embargo, en otras poblaciones de AR las dosis de 500mg×2 podrían ser tan eficaces como las de 1.000mg×2.
Pregunta 6. ¿Cuál es la eficacia de rituximab después de dos o más ciclos de tratamiento?
Votos a favor entre dos proposiciones: 93%; votos a favor siendo sólo una opción: 100%.
Comentario a la recomendación
Esta recomendación nuevamente presenta un grado de evidencia alto (1c) y un grado de acuerdo elevado (89%).
El estudio SUNRISE36, aleatorizado, a doble ciego y controlado con placebo, valora el efecto de un segundo ciclo de RTX frente a placebo en un grupo de pacientes en que previamente había fallado al menos un anti-TNF. Los pacientes recibieron un primer ciclo de RTX y, a partir de la semana 24, a los que no estaban en remisión se les administraba placebo o una nueva infusión de RTX. De un total de 559 pacientes iniciales, se aleatorizó a 475, y se observó una respuesta clínica persistente e incluso superior a la observada inicialmente en los pacientes que recibieron un segundo ciclo de RTX. De hecho, los pacientes que en el primer ciclo consiguieron una importante respuesta (ACR 70) tuvieron mayor probabilidad de beneficiarse de un segundo ciclo (OR=4,5; p=0,037).
En un estudio abierto de pacientes en que había fracasado al menos un anti-TNF provenientes de una extensión de ensayos clínicos en fases II y III con RTX, los que habían presentado respuesta clínica a un primer ciclo de RTX recibieron nuevos ciclos al menos cada 4 meses si presentaban actividad clínica (más de 8 articulaciones tumefactas y dolorosas o DAS 28>2,6). Los pacientes presentaron una respuesta clínica superior a la observada tras el primer ciclo; de hecho, los resultados de baja actividad o de remisión alcanzados (DAS 28) doblaron a los observados tras el primer ciclo. No obstante, uno de los criterios de inclusión para un nuevo ciclo fue que hubieran tenido respuesta clínica al primero, lo cual nos dice que se trata de un grupo de pacientes respondedores a RTX37.
Los resultados obtenidos en los dos estudios anteriores se observan en pacientes con AR con fracaso terapéutico previo de al menos un anti-TNF. Sin embargo, se dispone de información de un trabajo abierto en 570 pacientes con AR activa después de una fase de respuesta clínica; hasta el 41% del total eran pacientes con fracaso de FAME que nunca habían recibido terapia biológica. En esta población, se observó una eficacia similar que en los trabajos comentados previamente. No se observaron diferencias en la respuesta según hubieran recibido previamente anti-TNF o no38.
Pregunta 7. ¿Existen ventajas del tratamiento con rituximab siguiendo un esquema fijo (cada 6 meses) con respecto al tratamiento a demanda?
El RTX se ha mostrado eficaz tanto en los pacientes a los que se administró siguiendo un esquema posológico fijo (cada 6 meses) como en los que lo recibieron a demanda. La administración siguiendo un esquema fijo podría contribuir a mantener a los pacientes con un nivel de actividad menor. No obstante, esta estrategia supone administrar más ciclos de RTX, lo cual debe tenerse en cuenta en el balance riesgo/beneficio.
a) Categoría de la evidencia, –2b; b) fuerza de la recomendación, C; grado de acuerdo: 6,7/9 (74%).
Votos a favor entre dos proposiciones: 70%; votos a favor siendo sólo una opción: 93%.
Comentario a la recomendación
Esta recomendación presenta un grado de evidencia discreto (–2b) con un grado de acuerdo aceptable (74%).
No existe ningún estudio controlado que haya comparado la administración de RTX a demanda con la administración fija cada 6 meses. Por lo tanto, no existe una recomendación establecida para la utilización de RTX en la AR. De hecho, la ficha técnica del producto39 únicamente indica cuál debe ser la dosis del ciclo de tratamiento (1g con 15 días de intervalo, hasta un total de 2g), pero no indica cuándo se debe volver a tratar a estos pacientes. Establecer un esquema posológico definido tendría la ventaja para el reumatólogo de facilitar la organización estructural de su servicio. El problema de tratar a demanda es que depende mucho del acceso del paciente al servicio y de las posibilidades organizativas que ese servicio tiene para poder administrar RTX con prontitud.
Durante el desarrollo clínico del fármaco, los pacientes fueron retratados siguiendo dos esquemas terapéuticos diferentes: a) a demanda, y b) con un esquema terapéutico fijo cada 6 meses. En cualquier caso, con ambos esquemas los pacientes que recibieron nuevos ciclos de RTX fueron, en general, los que habían respondido inicialmente al RTX. En el tratamiento a demanda, se administraba el RTX según criterio del médico a partir de la semana 16 del último tratamiento, mientras que los pacientes que recibieron RTX con un esquema fijo, lo tomaron cada 6 meses siempre y cuando no estuvieran en remisión (DAS28<2,6)11-13,19,36.
Un estudio prospectivo abierto llevado a cabo en dos centros de dos países distintos (Reino Unido y Países Bajos) con un total de 48 pacientes durante 1 año de tratamiento, no se demostró una eficacia superior de un régimen terapéutico sobre otro. Tampoco hubo diferencias en lo que respecta a la seguridad40. Posteriormente, los mismos autores presentaron los resultados a los 2 años del tratamiento, y se confirmaron los resultados del estudio anterior41. Es interesante destacar que, al ser dos poblaciones de dos hospitales distintos, las características basales eran ligeramente diferentes. La población tratada a demanda tenía un DAS28 basal significativamente más alto (6,1 frente a 5,1; p=0,03) y la media de anti-TNF que habían recibido previamente era numéricamente superior (2,05 frente a 1,54; p=0,33), lo cual indicaba indirectamente que estos pacientes tenían una enfermedad más grave41.
Recientemente se han presentado los resultados de un subanálisis de los pacientes tratados a demanda y con esquema fijo (cada 6 meses) procedentes de los ensayos de fases II y III del fármaco. Con el esquema fijo se trataba a los pacientes cada 6 meses siempre y cuando no tuvieran un DAS28<2,6. Este régimen fijo mantuvo a los pacientes con un DAS28 y HAQ persistentemente más bajos. Como era lógico, la incidencia de brotes fue menor con el esquema fijo (el 19 frente al 42%). La mediana de retratamiento fue claramente superior con el régimen fijo (25 frente a 62 semanas), aunque la administración de más ciclos de RTX no incrementó los efectos secundarios42.
Pregunta 8. ¿Qué datos de eficacia hay con el retratamiento de los pacientes sin respuesta previa a rituximab comparados con los pacientes que tuvieron una respuesta moderada o buena (criterios EULAR)?
Votos a favor entre dos proposiciones (en segunda votación): 68%; votos a favor siendo sólo una opción: 89%.
Comentario a la recomendación
Esta recomendación tiene un grado de evidencia discreto y fue una de las recomendaciones con menor grado de acuerdo (70%); además, la fuerza de la recomendación sólo es de grado D. La información sobre la eficacia de un segundo ciclo de RTX en pacientes que no han respondido a un primer ciclo es contradictoria. En los ensayos clínicos fundamentales, habitualmente se excluyó de ciclos adicionales a los pacientes que no habían respondido a un primer ciclo de RTX11,19. En un pequeño estudio abierto, 7 pacientes que no habían respondido a un primer ciclo de RTX recibieron uno o dos ciclos adicionales, y no se observó respuesta clínicamente significativa43. Sin embargo, en otro estudio también abierto, 25 pacientes con falta de respuesta a un primer ciclo de RTX recibieron un segundo ciclo de tratamiento, y se observó una respuesta EULAR en el 71% de los casos44. En este segundo estudio, la mayor eficacia del retratamiento en estos pacientes parecía estar relacionada con una depleción más profunda de linfocitos B en sangre periférica, evaluada por técnicas de citometría de flujo de alta sensibilidad45.
Pregunta 9. ¿Es útil monitorizar los linfocitos B en los pacientes que reciben rituximab?
En la práctica clínica, la eficacia del tratamiento con RTX o la necesidad de nuevos ciclos tienen que determinarse según índices de actividad clínica y no según la cantidad de linfocitos B en sangre periférica.
a) Categoría de la evidencia, 4; b) fuerza de la recomendación, D; grado de acuerdo: 8,5/9 (94%).
Votos a favor entre dos proposiciones: no realizada porque sólo había una proposición; votos a favor siendo sólo una opción: 100%.
Comentario a la recomendación
Esta recomendación tuvo un grado de evidencia 4, aunque el grado de acuerdo fue de los más elevados (94%).
La depleción de linfocitos B causada por RTX es más intensa en sangre periférica que en médula ósea u otros órganos linfoides46,47. No se ha encontrado una relación clara entre la depleción de los linfocitos B circulantes medida por citometría de flujo convencional48 y la respuesta o la recaída de los síntomas, y sí que parece haber relación entre la persistencia de linfocitos B en sangre periférica a las 2 semanas de la administración y la ausencia de respuesta clínica cuando se utiliza citometría de flujo de alta sensibilidad49. El problema radica en que la citometría de flujo de alta sensibilidad no está disponible en la mayoría de los centros hospitalarios para su uso en la práctica clínica diaria.
Mientras en sangre periférica la depleción es prácticamente total, en la sinovial reumatoide la depleción es ligera o moderada, pero siempre es mayor en los respondedores, de manera que cuantos más linfocitos B persisten en la sinovial, la respuesta es menor o dura menos tiempo50.
El significado clínico de la depleción parcial de los linfocitos B en los lugares de inflamación (sinovial) o en los de maduración celular (médula ósea) es desconocido e incluso se desconoce si el RTX elimina preferentemente algún subtipo celular más que otro, pero la respuesta se ha relacionado con mayor número de células precursoras plasmáticas en la sinovial y/o sangre periférica que son CD20–47.
Probablemente, más importante que la población B total sea los subtipos celulares, como los linfocitos B activados (expresan HLA DR) o de memoria (IgD-CD27+). Se ha descrito que tanto los linfocitos B activados como los de memoria son los que más se deplecionan en los pacientes que responden al tratamiento con RTX, pero estos datos provienen de estudios observacionales llevados a cabo en un número relativamente pequeño de pacientes51.
Pregunta 10. ¿Cuál es el tiempo óptimo para evaluar la respuesta de un paciente que ha sido tratado con rituximab (12 frente a 16 semanas)?
Votos a favor entre dos proposiciones: no realizada porque no había una segunda propuesta; votos a favor siendo sólo una opción: 100%.
Comentario a la recomendación
Esta recomendación cuenta con un grado de evidencia aceptable (1c) y un grado de acuerdo del 100%.
En todo paciente que ha recibido RTX, se debe evaluar la respuesta en un plazo determinado tras la administración del fármaco. Esto es fundamental, si se considera que la mayoría de los pacientes retratados son los que tuvieron una respuesta clínica al fármaco. No existen estudios dirigidos específicamente a tratar de determinar el momento óptimo de la respuesta con RTX; sin embargo, de los datos publicados en los estudios DANCER y REFLEX11,19, se pueden extraer varias conclusiones. En el primero de ellos, la respuesta ACR20 estaba claramente definida a partir de la semana 12 (el 30% en ACR20 con placebo frente al 55% en ACR20 con RTX). También esto se cumplió con ACR50 y 70, aunque la respuesta ACR70 en el grupo tratado con 1.000mg×2 se incrementó más lentamente y alcanzó su nivel más alto en la semana 2411. Con respecto al estudio REFLEX19, la primera diferencia significativa con respecto al placebo en el ACR20 apareció en la semana 8. Después se evaluó a los pacientes en las semanas 12, 16, 20 y 24, y mostraron un perfil de respuesta similar, sin diferencias en los distintos momentos de evaluación, aunque el ACR70 sólo fue significativo a partir de la semana 16.
La recomendación de evaluar clínicamente al paciente en la semana 16 tendría la ventaja de recoger a la inmensa mayoría de los pacientes que han obtenido respuesta. Hacerlo más tarde, especialmente en la semana 24 en los pacientes que tienen un esquema terapéutico fijo, podría suponer evaluar al paciente en la fase de brote, sin saber a ciencia cierta el grado de respuesta.
Pregunta 11. En los pacientes que reciben rituximab, ¿cuál es la frecuencia de descenso de inmunoglobulinas y qué relación hay entre este descenso y la aparición de infecciones graves?
Los pacientes que reciben tratamiento con rituximab pueden presentar descensos de IgG e IgM en algún momento del tratamientoa. Se ha observado una posible tendencia a mayor número de infecciones graves tras descensos de IgGb. Se recomienda cuantificar periódicamente las inmunoglobulinas.
aa) Categoría de la evidencia, 1a; b) fuerza de la recomendación, A; grado de acuerdo: 7,6/9 (84%).
ba) Categoría de la evidencia, –1c; b) fuerza de la recomendación, B; grado de acuerdo: 7,6/9 (84%).
Votos a favor entre dos proposiciones: 82%; votos a favor siendo sólo una opción: 96%.
Comentario a la recomendación
Esta recomendación se analizó para la evidencia en dos partes: una, la relación del tratamiento con RTX y los descensos de inmunoglobulinas, y otra, la posible relación de estos descensos con infecciones. Ambas tienen nivel de evidencia y grado de acuerdo elevados.
En los pacientes tratados con RTX se observa una disminución global en la concentración de IgM y en menor grado de IgG, aunque la media de ambas permanece por encima de los límites inferiores de la normalidad11,19. En un análisis general de seguridad en 2.578 pacientes incluidos en ensayos clínicos (5.013 pacientes-año de seguimiento), se observa que un 5 y un 23% de los pacientes presentan valores plasmáticos de IgG e IgM, respectivamente, por debajo de la normalidad38,52. Mientras que la proporción de pacientes con descensos de IgG permanece estable con ciclos de tratamiento repetidos, la de pacientes que experimentan descensos de IgM en algún momento se incrementa con el número de ciclos recibidos. Estos datos se refieren a descensos que ocurren en cualquier momento del tratamiento. Alrededor de un 1% de los pacientes presentan un descenso persistente de IgG52. No ha habido casos de pacientes con inmunoglobulinas indetectables39.
En cuanto a la repercusión clínica de estos descensos de inmunoglobulinas, se observa que la frecuencia de infecciones graves es similar en pacientes con y sin ellos. Sin embargo, cuando se analiza la frecuencia de infecciones graves en pacientes antes y después de los descensos de IgG, se observa una tendencia a mayor número de infecciones graves tras el descenso, sin que este aumento alcance significación estadística52. Los descensos de IgM no parecen asociarse a mayor riesgo de efectos adversos38,52. Datos recientes procedentes de Roche y no publicados mencionan que el tratamiento repetido con RTX puede originar cifras bajas de IgM sin aumento de infecciones, mientras que los valores persistentemente bajos de IgG (4 meses o más) se pueden asociar con un incremento de infecciones graves.
Una publicación posterior a la revisión sistemática señala que los valores bajos de IgG (< 6g/l) antes de la administración de RTX son un factor independiente de riesgo de infecciones graves53. Ello reforzaría la necesidad monitorizar y determinar los valores basales de inmunoglobulinas antes de iniciar tratamiento con RTX.
Pregunta 12. ¿Cuál es la eficacia de la vacunación en pacientes que reciben rituximab?
Los pacientes que van a ser tratados con RTX deben recibir las mismas vacunas que los pacientes inmunodeficientes. La respuesta a la vacunación está disminuida en ellos. Se recomienda vacunar preferiblemente antes de iniciar el tratamiento con RTX o lo más lejos posible del ciclo anterior.
a) Categoría de la evidencia, –1c; b) fuerza de la recomendación, B; grado de acuerdo: 7,8/9 (87%).
Votos a favor entre dos proposiciones: 82%; votos a favor siendo sólo una opción: 96%.
Comentario a la recomendación
Se trata de una recomendación con un alto grado de evidencia (–1c) y de acuerdo (86%).
Un estudio abierto comparó la formación de anticuerpos contra virus de la gripe estacional y H1N1 en 20 pacientes tratados con MTX, 23 con RTX y 29 controles sanos. Los pacientes tratados con RTX recibieron la vacuna precozmente, a las 4-8 semanas de administrar RTX, o de forma tardía, 6-10 meses después del ciclo de RTX. La formación de anticuerpos fue menor en los pacientes tratados con RTX respecto a los controles o los que recibieron MTX. En el grupo precoz no se observó respuesta, en tanto que en los vacunados de forma tardía se observó un moderado aumento de anticuerpos, incluso en ausencia de linfocitos CD1954. La respuesta fue superior en los pacientes que se habían vacunado en años anteriores. La seguridad de la vacunación fue similar en los distintos grupos de RTX. Datos similares se habían encontrado en un estudio previo más limitado55.
La formación de anticuerpos tras la vacunación se ha comparado en pacientes tratados con MTX o RTX en un estudio abierto, aleatorizado y controlado con placebo (RTX 1.000×2+MTX frente a placebo+MTX). Se midió la respuesta a toxoide tetánico (incremento del cuádruple en los títulos de anticuerpos) y la respuesta a otros neoantígenos realizada entre las semanas 24 y 36 después de la administración de RTX. La respuesta a la vacunación con toxoide tetánico fue similar en los dos grupos. La hipersensibilidad retardada a estimulación cutánea con cándida se preservó de modo similar en los dos grupos. La respuesta a vacuna de polisacárido de neumococo y al neoantígeno (KLH) medida como incremento en los títulos de anticuerpos específicos fue menor en el grupo tratado con RTX56. Los autores señalan la necesidad de completar un programa de vacunación antes de tratar con RTX.
Pregunta 13. En los pacientes que reciben rituximab, frente a placebo, ¿existe un incremento de las infecciones graves?
El riesgo de infecciones graves en pacientes con AR tratados con 1.000mg×2 de RTX está aumentado en comparación con pacientes similares que han recibido placebo. Los ciclos repetidos no aumentan este riesgo.
a) Categoría de la evidencia, 2b; b) fuerza de la recomendación, B; grado de acuerdo: 7,6/9 (84%).
Votos a favor entre dos proposiciones: no se realizó porque no había dos propuestas; votos a favor siendo sólo una opción: 89%.
Comentario a la recomendación
Esta recomendación presenta un nivel de evidencia moderado con un grado de acuerdo muy alto (89%).
Los datos sobre el riesgo de infecciones en pacientes tratados con RTX proceden de ensayos clínicos controlados y de los ensayos de extensión. La conclusión que se puede obtener de los estudios es que el riesgo de infecciones graves está aumentado en los pacientes tratados con 1.000mg×2 en comparación con dosis más bajas o con el placebo. En el estudio REFLEX19, la tasa de infecciones graves en los pacientes tratados con 1.000mg×2 fue 5,2/100 pacientes-año, mientras que en los tratados con placebo la tasa era de 3,7/100 pacientes-año. En el estudio IMAGE14, las tasas de infecciones graves fueron 6,09, 4,61 y 3,73/100 pacientes-año con dosis de 1.000mg×2, 500mg×2 y placebo, respectivamente. En un estudio que incluyó a todos los pacientes tratados con RTX en los ensayos previos al registro, las tasas de infección grave en pacientes que habían recibido RTX era de 4,25 (3,8-4,7), similar a la obtenida con placebo, 4,33 (3,21-6), sin observarse cambio en la tasa con los retratamientos52. Datos similares se obtienen de la revisión sistemática (tabla 1). Los resultados de este estudio son difíciles de interpretar teniendo en cuenta los siguientes aspectos: a) los pacientes recibieron dosis diferentes de RTX; b) la frecuencia de infecciones graves fue baja, hecho que precisa un elevado tamaño de muestra para aceptar o rechazar la hipótesis, y c) se encontró una tasa elevada de infecciones en el grupo placebo. En otro estudio57 con una muestra pequeña y seguimiento limitado, el tratamiento con biológicos después de RTX no aumentó el riesgo de infecciones graves. Las tasas de infección grave fueron 6,99/100 pacientes-año durante la terapia con RTX y 5,49/100 pacientes-año con la instauración de otro biológico después de RTX. En el estudio de seguridad TAME58, que se realizó en pacientes con AR con dosis estables de etanercept o adalimumab, la tasa de infecciones graves a las 24 semanas en 33 pacientes que habían recibido uno o dos cursos de 500mg×2 de RTX fue 6,43 (0,91-45,6)/100 pacientes-año y 0 en 13 pacientes en el grupo placebo. El escaso número de pacientes y la tasa de infección en el grupo que recibió RTX son argumentos que contraindican el uso combinado de RTX y anti-TNF hasta que no se disponga de más datos de seguridad. A pesar de este aumento de infecciones graves, el número de pacientes con infecciones oportunistas y tuberculosis fue escaso o nulo. Cuando se analizan las tasas de infecciones graves en las diferentes cohortes de pacientes tratados con rituximab, se encuentran cifras similares a las de pacientes tratados con anti-TNF u otros biológicos59. Estos datos tienen que ser complementados con datos de la vida real obtenidos de los registros.
Pregunta 14. En los pacientes con neoplasia sólida previa y que posteriormente reciben rituximab, ¿cuál es el riesgo de que se desarrolle un nuevo tumor sólido?
Votos a favor entre dos proposiciones: no disponible; votos a favor siendo sólo una opción: 100%.
Comentario a la recomendación
Actualmente no hay datos en la revisión de la literatura que permitan contestar a la pregunta (nivel de evidencia –4). La tasa de tumores sólidos en enfermos con AR que reciben RTX tanto en los ensayos clínicos controlados como en cohortes observacionales es similar a la de la población con AR52.
La posibilidad de que se desarrolle un tumor se ha estudiado con otros biológicos con los que se dispone de más experiencia en la AR. El resultado de un metaanálisis de ensayos clínicos aleatorizados con anti-TNF (sólo se incluían infliximab y adalimumab) demostró un aumento del riesgo de neoplasias en pacientes tratados con ellos60. Sin embargo, los resultados de otros estudios indican que el tratamiento con agentes biológicos, fundamentalmente anti-TNF, no aumenta el riesgo de neoplasias sólidas, con la excepción de las neoplasias cutáneas61-64. Tampoco se ha demostrado una mayor tasa de mortalidad en pacientes tratados con anti-TNF que en los que se desarrolla un tumor65,66. En dos series con un número de casos pequeño, en el que los pacientes fueron tratados con RTX en lugar de un anti-TNF, entre otros motivos por haber tenido ya un tumor, los autores no describen un aumento de tumores. No obstante, el seguimiento fue corto y en ningún caso era ese el motivo del estudio18,67. Es probable que la historia previa de neoplasia pueda afectar a la decisión del médico respecto a la prescripción de un agente biológico (confusión por indicación), y en este sentido, la posibilidad de ser tratado con un agente biológico sea menor en pacientes con antecedentes de cáncer. No obstante, en un estudio llevado a cabo en Estados Unidos, se vio que, en los pacientes con cáncer previo, la probabilidad de ser tratado con un biológico estaba reducida sólo en un 29%68. Además, no se ha visto que la incidencia de cáncer fuera superior en pacientes que ya hubieran tenido un tumor63. Pese a lo dicho, antes de prescribir un biológico siempre habrá que tener en cuenta la ficha técnica y las recomendaciones de uso de estos fármacos6.
Pregunta 15. En los pacientes tratados con rituximab, ¿cuál es el riesgo de enfermedad pulmonar intersticial?
No hay datos que indiquen que se desarrolle enfermedad pulmonar intersticial difusa con RTX en AR. No existen datos suficientes de seguridad que avalen o contraindiquen la administración de RTX en pacientes con AR y enfermedad pulmonar intersticial difusa.
a) Categoría de la evidencia, 5; b) fuerza de la recomendación, C; grado de acuerdo: 7,2/9 (80%).
Votos a favor entre dos proposiciones: 83%; votos a favor siendo sólo una opción: 93%.
Comentario a la recomendación
Esta recomendación carece de evidencia, por lo que se puede considerar en su totalidad como recomendación de experto. Se han descrito casos aislados de desarrollo de neumonitis intersticial más fallo respiratorio tras la administración de RTX, pero en general se trata de pacientes con neoplasias hematológicas69,70. Por otro lado, también se ha usado con éxito RTX para el tratamiento de neumonitis intersticial resistente a terapia convencional en pacientes con lupus eritematoso sistémico y esclerosis sistémica71-73. Igualmente se han descrito casos aislados de neumonitis intersticial, algunos de ellos con desenlace fatal, en pacientes tratados con anti-TNF (infliximab, etanercept y adalimumab)74,75.
Pregunta 16. En los pacientes tratados con rituximab, ¿cuál es el riesgo de insuficiencia cardiaca congestiva?
No existen datos de que la administración de RTXfavorezca el desarrollo de insuficiencia cardiaca congestiva. El RTX se puede administrar a pacientes con insuficiencia cardiaca bien controlada. En los pacientes con insuficiencia cardiaca congestiva grave (clase IV) o enfermedad cardiaca grave no controlada, el uso de RTX está contraindicado.
a) Categoría de la evidencia, 5; b) fuerza de la recomendación, D; grado de acuerdo: 7,5/9 (83%).
Votos a favor entre dos proposiciones: 76%; votos a favor siendo sólo una opción: 96%.
Comentario a la recomendación
Igual que la anterior recomendación y debido a la ausencia total de evidencia, se debe considerar en su totalidad como una recomendación de experto. A diferencia de lo que sucede con los anti-TNF, no hay información sobre deterioro de la función cardíaca en pacientes con AR y sin cardiopatía previa al ser tratados con RTX. En los ensayos clínicos controlados con placebo, se notificaron acontecimientos cardíacos graves en una proporción similar que en el grupo placebo39.
Dado que existe algún informe de casos aislados de insuficiencia cardíaca relacionados con la infusión, si el paciente refiere antecedentes de cardiopatía, se aconseja sopesar el riesgo de complicaciones cardiovasculares derivadas de las reacciones periinfusionales antes de administrar RTX y llevar a cabo una monitorización rigurosa durante el tratamiento39. En caso de que los pacientes con AR sufran insuficiencia cardíaca grave (grado IV NYHA) o enfermedad cardíaca grave no controlada, el tratamiento con RTX está contraindicado39.
Pregunta 17. ¿Cuál es el riesgo de fallo hepático fulminante en pacientes que tienen infección por virus de la hepatitis B y reciben rituximab?
Hay riesgo de reactivación de una hepatitis por virus B, incluida una hepatitis fulminante, en pacientes con infección crónica por este virus que reciben RTX. Se recomienda no tratar con RTX a pacientes con infección crónica por virus B, salvo circunstancias muy excepcionales, en las que deberá realizarse un seguimiento estricto del paciente y el tratamiento antiviral adecuado.
a) Categoría de la evidencia, –4; b) fuerza de la recomendación, D; grado de acuerdo: 8,5/9 (94%).
Votos a favor entre dos proposiciones: no realizada porque no hubo dos o más propuestas; votos a favor siendo sólo una opción: 100%.
Comentario a la recomendación
No existe ningún estudio controlado que avale esta recomendación, por lo que su redacción está fundamentada en los datos de estudios no controlados, en pacientes con enfermedades hematológicas y la experiencia de los expertos.
La reactivación de una hepatitis B es un hecho bien conocido en pacientes oncohematológicos tratados con citotóxicos. La mayor experiencia se ha obtenido de pacientes con linfoma no hodgkiniano o con trasplante de médula ósea76. Dicha reactivación puede ocasionar hepatitis asintomática, hepatitis clínica e incluso hepatitis fulminante con resultado de muerte. Los pacientes con linfoma tratados con RTX podrían tener un riesgo adicional de sufrir esta complicación77. En un estudio retrospectivo de 115 casos de linfoma no hodgkiniano tratados con RTX (más quimioterapia), de los que 15 eran portadores de HBsAg, se observó que 8 de los 10 que no recibieron profilaxis con lamivudina tuvieron una reactivación de una hepatitis B, incluida una hepatitis fulminante que ocasionó la muerte78. Ninguno de los 5 casos que recibieron lamivudina presentó esta complicación. No obstante, se detectó hepatitis B de novo en 4 pacientes HBsAg negativos, de los que 2 fallecieron por una hepatitis fulminante78. En una revisión sistemática de la bibliografía publicada en 2007, se identificaron 64 casos de infecciones virales asociadas a RTX en pacientes con linfoma; se observó que el 40% fue por hepatitis B. La mitad de estas infecciones por virus B acabaron en un desenlace fatal por hepatitis fulminante79.
Se desconoce cuál es el riego de reactivación de hepatitis B en pacientes con AR y si este riego es menor que en el caso de enfermedades hematológicas, para las que el RTX se usa en combinación con quimioterapia. En los ensayos clínicos con RTX en AR, se excluyó a los pacientes con serología positiva a virus B. En un análisis de seguridad comunicado recientemente, de 3.095 pacientes (7.198 pacientes/año) con AR tratados con RTX, no se evidenció ningún caso de reactivación de hepatitis B52. No obstante, se han comunicado casos aislados de reactivación de hepatitis B80 o hepatitis B de novo39 en pacientes con AR tratados con RTX.
DiscusiónLas recomendaciones presentadas están basadas en una revisión sistemática de la literatura y la opinión de experto cuando la evidencia científica fue escasa o nula. Se ha seguido una metodología científica establecida a priori, basada en una modificación de la técnica Delphi, que incluyó la revisión sistemática de la evidencia siempre que fue posible, o no sistemática en otros casos y la participación de un numeroso grupo de reumatólogos españoles.
Ciertos aspectos de las recomendaciones desarrolladas pueden generar mayor controversia o ser más problemáticas, y se discuten a continuación.
La recomendación número 1, una de las que presenta mayor grado de evidencia (1a), versa sobre la eficacia de RTX como primer agente biológico. La eficacia de RTX como primer agente biológico está demostrada. El nivel de evidencia de esta recomendación es elevado. Las conclusiones sobre progresión radiográfica se basan fundamentalmente en el estudio IMAGE14. En este estudio el beneficio radiográfico se observó de modo claro sólo con la dosis de 1.000mg×2. La aparición de algunos casos de leucoencefalopatía multifocal progresiva (LMP) en distintas situaciones clínicas ha supuesto que Hoffman La Roche haya decidido no proseguir la indicación de RTX en este tipo de pacientes: AR sin tratamiento previo con FAME.
La recomendación número 3, que hace referencia a la eficacia del tratamiento con RTX en pacientes con FR y/o ACPA negativos, es producto de la discusión de subanálisis de los estudios de RTX en AR. No existe ningún estudio cuyo objetivo sea valorar si RTX es eficaz en pacientes con FR y/o ACPA negativos. La revisión sistemática en este contexto es imposible y los datos de la revisión no sistemática tampoco son claros, pues sólo conducen a confusión. Dado que existe evidencia del beneficio de RTX en este subgrupo de pacientes y ante la ausencia de variables capaces de predecir respuesta, la recomendación se basa en el trabajo de Isaacs et al26, reforzada por la opinión de los expertos. El empleo de RTX en pacientes FR y ACPA negativos debe reservarse a casos en que el médico tratante lo considere oportuno, tras análisis individual de cada caso.
En la recomendación número 5, se discute si la dosis de 500mg×2 es tan eficaz como la dosis de 1.000mg×2. En el subgrupo de pacientes en que han fallado uno o más anti-TNF, la dosis estudiada y eficaz del fármaco es la de 1.000mg×2. Los beneficios del fármaco en progresión radiográfica incluyen a pacientes del REFLEX19 tratados con 1.000mg×2, mientras que en los pacientes con artritis de menos de 4 años de evolución sin exposición previa a MTX del estudio IMAGE14, la dosis eficaz en este desenlace es de 1.000mg×2 y superior a la de 500mg×2. Los ensayos clínicos controlados dirigidos a evaluar eficacia en variables diferentes a desenlace radiográfico (DAS, respuesta EULAR, función física, calidad de vida, etc.) no muestran diferencias entre las dos dosis, con una tendencia a tener mejores desenlaces en enfermos con las dosis de 1.000mg×2, sin diferencias en eventos adversos entre los dos grupos (cita de la revisión sistemática). Debido a estos hallazgos, los panelistas decidieron, con un nivel de evidencia y de acuerdo elevados, que la dosis de RTX es la de ficha técnica y que actualmente no se puede recomendar la dosis de 500mg×2 como equivalente en el contexto del tratamiento del enfermo con AR y fallo de los anti-TNF. Del mismo modo, en los casos en que la indicación de administrar RTX sea progresión acelerada del daño estructural, la dosis recomendada es de 1000mg×2.
La recomendación número 7 trata sobre la administración de RTX siguiendo un esquema fijo o a demanda. El nivel de evidencia es bajo, ya que no existen estudios controlados a este respecto. Del conjunto de datos obtenidos de estudios prospectivos y subanálisis, se concluye que RTX es eficaz tanto en los pacientes tratados siguiendo un esquema posológico fijo como en quienes lo reciben a demanda. Sin embargo, los pacientes tratados con un esquema fijo presentaron mejor respuesta clínica y menor número de brotes, sin diferencias en eventos diversos. Estos pacientes recibieron un mayor número de ciclos. La administración siguiendo un esquema fijo podría contribuir a mantener a los pacientes con un nivel de actividad menor. No obstante, esta estrategia supone administrar más ciclos de RTX, lo cual debe tenerse en cuenta en el balance riesgo/beneficio.
Las recomendaciones 8 y 9, sobre aspectos de retratamiento y monitorización, tienen un nivel de evidencia muy bajo y acuerdo entre los panelistas aceptable. Esto se debe a la escasa literatura al respecto y la contradicción de los resultados de estudios de baja calidad metodológica, problemas inherentes a la elaboración de guías de práctica clínica. Hasta el fin de la revisión, la recomendación 8 sostiene que la eficacia de la administración de un nuevo ciclo de RTX en pacientes que no han respondido previamente es cuestionable. La recomendación 9 concluye que en práctica clínica, la eficacia del tratamiento con RTX o la necesidad de nuevos ciclos tienen que determinarse con base en índices de actividad clínica y no según la concentración de linfocitos B en sangre periférica. Estas recomendaciones podrían modificarse en un futuro próximo con la introducción de técnicas de laboratorio avanzadas en la identificación de depleción de células B.
La recomendación 11 incluye un aspecto clínico muy importante, dado que la monitorización de las inmunoglobulinas es una prueba relativamente fácil y sencilla. Los pacientes con AR de los ensayos clínicos que son candidatos a recibir RTX tienen una frecuencia basal de descenso de IgG por debajo de cifras consideradas clínicamente significativas (< 6g/l), del 1,7%. Este porcentaje se incrementó al 4,7% tras cuatro ciclos de RTX. En la Cohorte Francesa de terapias biológicas, se informa que el 4,6% de los pacientes tenía valores de IgG por debajo de dicha cifra en la evaluación basal, es decir, antes del tratamiento53. En otras enfermedades, como inmunodeficiencias primarias, leucemias o pacientes con trasplante de órganos, el descenso de cifras de IgG se asocia con infecciones clínicamente relevantes. Una publicación muy reciente, posterior a la revisión sistemática realizada para este artículo, señala que los bajos valores de IgG antes de la administración de RTX son un factor independiente de riesgo de infecciones graves53. Tras discusión del grupo de panelistas, se decidió emitir la recomendación de mayor seguridad para el paciente, que reforzaría la necesidad no sólo de monitorizar, sino también de determinar los valores basales de inmunoglobulinas antes de iniciar el tratamiento con RTX.
La recomendación 13 (“El riesgo de infecciones graves en pacientes con AR tratados con 1.000mg×2 de RTX está aumentado en comparación con pacientes similares que han recibido placebo. Los ciclos repetidos no aumentan este riesgo”) fue una de las más difíciles de abordar. Seguimos sin poder concluir si la falta de asociación entre el empleo de RTX e infecciones graves identificada en la revisión sistemática es real o no se ha podido demostrar por problemas metodológicos (error tipo II). La impresión del clínico es que el número y el tipo de infecciones graves en el paciente tratado con RTX es similar a lo observado con otros anti-TNF y más aún en otras dianas como las de abatacept59. La discusión al respecto puede ampliarse en la revisión sistemática81. Los autores asumimos la responsabilidad de recomendar que “la tasa de infecciones graves en el paciente tratado con RTX es similar a la de otros biológicos”.
La recomendación número 14 presenta un bajo nivel de evidencia, ya que no hay datos en la literatura que permitan responder a la pregunta de cuál es el riesgo de que se desarrolle un nuevo tumor sólido en pacientes con antecedente de neoplasia. La evidencia indirecta disponible con otros tratamientos biológicos, fundamentalmente anti-TNF, ha tenido alguna polémica. Los resultados de un metaanálisis de ensayos clínicos aleatorizados demuestra que los anti-TNF incrementan el riesgo de neoplasia, especialmente cuando se administran a dosis elevadas60. Sin embargo, la mayoría de los registros clínicos no ha podido demostrar un aumento del riesgo de neoplasia, excepto para las neoplasias cutáneas distintas del melanoma61-64. En dos series pequeñas de pacientes tratados con RTX, entre otras cosas porque algunos de ellos ya habían tenido una neoplasia, no se describe un aumento del número de neoplasias18,67. No obstante, el tamaño de muestra de los trabajos no permite hacer mayores conclusiones.
Las recomendaciones 15 y 16, basadas en el riesgo de que RTX aumente la probabilidad de sufrir enfermedad pulmonar intersticial o insuficiencia cardiaca congestiva, se establecen con base en la opinión de los expertos, ya que la única evidencia disponible es un número muy reducido de informes de casos aislados, en los que es imposible establecer causalidad. Por ello se debe considerarlas en su totalidad como recomendaciones de experto, con acuerdo elevado entre expertos.
Finalmente, la recomendación 17, centrada en el riesgo de que RTX pudiera favorecer una insuficiencia hepática en pacientes previamente infectados por virus B, también es producto de estudios no controlados llevados a cabo principalmente en pacientes oncohematológicos. Dado que en las recomendaciones se prima la seguridad del paciente, decidimos mantener una recomendación en la que el grado de acuerdo entre expertos es de los más elevados.
La creación de un documento de consenso cuyo fin sea mejorar la práctica clínica, particularmente cuando se trata de resolver dudas de manejo de un subgrupo de enfermos con AR en tratamiento con RTX, requirió de un esfuerzo considerable. Los autores de este consenso son reumatólogos con experiencia en el manejo de biológicos, con consulta en diferentes zonas. Sus fortalezas son que se basan en una revisión sistemática siempre que fuera posible y en la opinión de los expertos emitida de modo sistemático. Sus debilidades más importantes son las relacionadas con la revisión sistemática: la incapacidad para dar respuesta a muchas de las dudas por carecer de evidencia científica para hacerlo, como ocurrió con la mayoría de las recomendaciones sobre seguridad. En algunas áreas la evidencia es tan escasa que a menudo crea confusión más que resolver dudas (dosis de 1.000mg×2 frente a 500mg×2 o la eficacia en el enfermo con FR y/o ACPA negativos). Un tercer problema es que, para dar respuesta sobre el desarrollo de eventos poco frecuentes, no se tiene un tamaño de muestra suficiente ni será posible obtenerlo por la naturaleza de la enfermedad, como podría ser el caso de las infecciones graves y su posible asociación con RTX. La suma de sesgos posibles debidos a una revisión sistemática que incluye la mejor evidencia disponible, sólo aquella de ensayos clínicos controlados, pero que no considera estudios observacionales, limita la validez externa de las aseveraciones. Esto se une a los posibles sesgos no detectados en la metodología. Finalmente, las revisiones tenían como límite una fecha, y mientras se elaboraba el consenso, se disponía de nueva evidencia con fecha posterior al punto de corte, que en algún caso no fue posible incluir.
Así, algunas de estas recomendaciones continúan generando cuestionamientos de difícil solución en la práctica clínica habitual. En este sentido, serían necesarios más estudios que intenten responder a estas cuestiones sin resolver, sobre todo en las recomendaciones que se basan únicamente en la opinión de experto. No obstante, los objetivos del Documento de Consenso se han cumplido, y se han establecido 17 recomendaciones con base en la mejor evidencia disponible, que facilitan el empleo de RTX en enfermos con AR en práctica clínica habitual.
Conflicto de interesesEste documento se ha financiado a través de una donación sin restricciones realizada al Servicio de Reumatología del Hospital Universitario La Paz (AREPAZ) por Roche Farma España. La elección de los expertos fue responsabilidad exclusiva del coordinador del proyecto (EMM). Ningún empleado de Roche Farma participó en las reuniones científicas ni conoció su desarrollo hasta que el proyecto estuvo finalizado. La organización de las reuniones y el pago de honorarios a los expertos fue responsabilidad exclusiva del Servicio de Reumatología del Hospital Universitario La Paz (AREPAZ).
Grupo de Expertos en Rituximab: José Luis Andreu (Servicio de Reumatología, Hospital Universitario Puerta de Hierro, Majadahonda, Madrid), Javier Ballina (Hospital Universitario Central de Asturias, Oviedo, Asturias), M. Gema Bonilla Hernán (Hospital Universitario La Paz, Madrid), R. Ibáñez Bosch (Complejo Hospitalario de Navarra, Pamplona, Navarra), Sagrario Bustabad (Hospital Universitario de Canarias, La Laguna, Tenerife), Eugenio Chamizo Carmona (Servicio de Reumatología, Hospital de Mérida, Mérida), Antonio Fernández-Nebro (Hospital Regional Universitario Carlos Haya, Málaga), José Francisco García-Llorente (Hospital de Mendaro), Antonio Gómez (Hospital de Sabadell, Institut Universitari Parc Taulí-UAB, Sabadell, Barcelona), Francisco Javier Manero Ruiz (Hospital Universitario Miguel Servet, Zaragoza), Carlos Marras (HUVA Arrixaca, Murcia), S. Marsal (Grup de Recerca de Reumatologia, Institut de Recerca Hospital Vall d’Hebron, Barcelona), Santiago Muñoz Fernández (Hospital Infanta Sofía, San Sebastián de los Reyes, Madrid), Javier Narváez (Hospital Universitario de Bellvitge, L’Hospitalet de Llobregat, Barcelona), Lucía Pantoja Zarza (Hospital El Bierzo, Ponferrada, León), Trinidad Pérez Sandoval (Sección de Reumatología, Complejo Asistencial de León, León), José J. Pérez Venegas (Hospital General del Sas, Jerez de La Frontera, Cádiz), Jesús Tornero Molina (Sección de Reumatología, Hospital Universitario de Guadalajara, Departamento de Medicina, Universidad de Alcalá, Madrid) y Paloma Vela (Hospital General Universitario de Alicante, Alicante).
En el Anexo 1 se incluye el listado de los investigadores del el grupo de Expertos en Rituximab.