La enfermedad celiaca (EC) es una afección entérica ocasionada por la ingesta de granos que contienen gluten. Una manifestación clínica poco reconocida es la artritis periférica, que puede simular artritis reumatoide.
ObjetivoDeterminar la frecuencia de anti-Gliadina (aGL), anti Transglutaminasa Tisular (aTGT) y anti-Gliadina Ultra-purificada (aGLU) en pacientes con diagnostico de AR.
MétodosEs un estudio transversal de pacientes con AR (criterios ACR). Se registraron variables demográficas y clínicas y se les realizaron determinaciones séricas de anticuerpos aGL, aGLU y aTGT por ELISA.
ResultadosSe incluyeron 85 pacientes con AR. El 87% de los pacientes fueron mujeres. El promedio de edad fue de 44 años±12, con una media de 12±9 años de evolución. Los anticuerpos aGL IgG estuvieron positivos en 16 pacientes, los aGL IgA en 29 pacientes, la aGLU en 14 pacientes y solo un paciente fue positivo para aTGT.
ConclusionesEs posible que pacientes con poliartritis y que cumplan con los criterios de clasificación de AR puedan tener de hecho EC. De otra forma, la EC debe considerarse dentro del diagnóstico diferencial de poliartritis.
Celiac disease (CD) is an enteric disease caused by dietary gluten in individuals with genetic predisposition. One of the clinical manifestations of CD is the peripheral arthritis that may simulate RA.
ObjectiveTo determine the frequency of anti-gliadin (aGL), anti-tissue transglutaminase (aTGT) and ultra purified anti-gliadin (AGLU) antibodies in patients with RA.
MethodsCross-sectional study. We included consecutive patients diagnosed as RA (ACR). Demographic and clinical data was registered by direct interview and serum levels of aGL, aTGT y aGLU were detrmined using ELISA.
ResultsEighty-five RA patients were included; 87% were women. Mean age was 44±12 years, mean disease duration 12 ±9 years. aGL IgG antibodies were positive in 16 patients, IgA aGL antibodies in 29 patients, aGLU in 14 patients and only one patient had aTGT.
ConclusionsIt is possible that CD may be the correct diagnosis in a patient with polyarthritis, even if the patient meets the ACR criteria for RA. In other words, CD should be considered among the differential diagnoses in a patient with poly-arthritis.
El diagnóstico de artritis reumatoide (AR) no representa mayor problema cuando el daño estructural está establecido; sin embargo, en etapas tempranas representa un reto ya que existen múltiples enfermedades que pueden cursar con artritis1.
Una causa de poliartritis poco reconocida en México es la enfermedad celiaca (EC) que se caracteriza por alteraciones intestinales ocasionadas por la ingesta de granos que contienen gluten en individuos con predisposición genética2. Los estudios poblacionales recientes han mostrado que la EC ocurre no solo en países anglosajones, sino también en otros en donde se creía que no existía; de hecho, en países de Norteamérica, Asia y África la prevalencia de EC alcanza el 1% de la población general3–7.
La determinación de anticuerpos séricos como anti-transglutaminasa tisular (aTGT), anti-endomisio (aEM), anti-gliadina (aGL) y anti-gliadina ultrapurificada (aGLU) son útiles para el diagnóstico de EC8. Los anticuerpos aTGT son los que tiene mayor sensibilidad (98%) y especificidad (96%) para el diagnostico de EC; en tanto, aGL y aGLU tienen una sensibilidad del 80% y una especificidad de 80–90%9.
Existe controversia en la literatura sobre la interrelación entre EC y AR. La información puede agruparse en tres vertientes: 1) que existe un aumento de permeabilidad intestinal en pacientes con AR secundario al uso de AINES, con activación de autoinmunidad y de EC en sujetos con predisposición genética10; 2) que las 2 enfermedades puedan ocurrir por azar en el mismo sujeto, sin compartir mecanismos patogénicos11, y 3) que algunos pacientes que estén con diagnóstico de AR, en realidad tengan EC con manifestaciones articulares12. El objetivo del presente estudio fue evaluar la frecuencia de aGL, aTGT y aGLU en una muestra consecutiva de pacientes con diagnóstico de AR atendidos en consulta de reumatología.
Pacientes y métodosEste es un estudio transversal en donde se evaluaron pacientes consecutivos con diagnóstico de AR según los criterios de clasificación del ACR13 y que estuvieran en tratamiento por médico reumatólogo en un hospital se segundo nivel de atención del IMSS (HGR 45) en un lapso de 2 meses.
Se anotaron variables demográficas y clínicas de cada paciente por entrevista directa siguiendo un cuestionario diseñado ex profeso y por revisión de expediente clínico. Cada paciente dio su consentimiento para obtener una muestra adicional de 5ml sangre venosa periférica para la determinación de anticuerpos aGL IgG e IgA, aTGT y aGLU.
Las concentraciones de los anticuerpos se evaluaron por la técnica de ELISA mediante kits comerciales. Los límites superiores normales recomendados por el fabricante (EUROIMMUN®. Medizinische Labordiagnostika AG) fue de 20UR/ml para aTGT y de 25UR/ml para aGL.
Las diferencias entre promedios se determinaron con la prueba de t-student para muestras independientes, y de 2 colas. Las diferencias entre proporciones se determinaron con la prueba de chi-cuadrada con corrección de Fisher cuando se considero apropiado. Se considerará significancia estadística cuando p<0.05. El estudio fue aprobado por el comité de ética del HGR 45, IMSS.
Todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en el mismo.
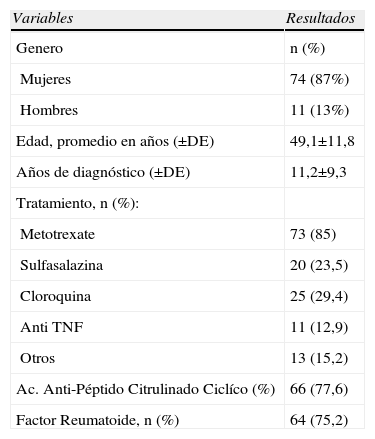
ResultadosSe incluyeron 85 pacientes con diagnostico de AR de los cuales 74 eran mujeres (87%); la tabla 1 presenta los principales datos demográficos y clínicos de estos pacientes. El rango de edad fue de los 16 hasta 76 años. El 25,8% de los pacientes tenían la enfermedad menos de 5 años, 25,8% entre 5–10 años y el 48,4% más de 10 años de evolución. La mayoría de los pacientes se encontraban en tratamiento con metotrexate y el 13% de los pacientes utilizaban algún anti-TNF alfa.
Características Demográficas y Clínicas de los 85 Pacientes Estudiados
| Variables | Resultados |
| Genero | n (%) |
| Mujeres | 74 (87%) |
| Hombres | 11 (13%) |
| Edad, promedio en años (±DE) | 49,1±11,8 |
| Años de diagnóstico (±DE) | 11,2±9,3 |
| Tratamiento, n (%): | |
| Metotrexate | 73 (85) |
| Sulfasalazina | 20 (23,5) |
| Cloroquina | 25 (29,4) |
| Anti TNF | 11 (12,9) |
| Otros | 13 (15,2) |
| Ac. Anti-Péptido Citrulinado Ciclíco (%) | 66 (77,6) |
| Factor Reumatoide, n (%) | 64 (75,2) |
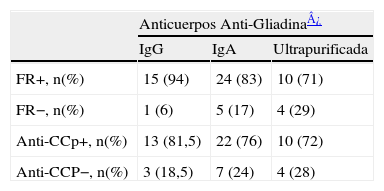
Los anticuerpos aGL IgG fueron positivos en 16 pacientes con límite superior de 157 e inferior de 29,9mgs/dl. Los anticuerpos aGL IgA fueron positivos en 29 pacientes con límite superior de 163 e inferior de 31mgs/dl. La aGLU fue positiva en 14 pacientes con valores superior de 129 e inferior de 28mgs/ dl. La tabla 2 muestra la distribución de frecuencias de los anticuerpos séricos estudiados por grupos de factor reumatoide y anticuerpos antipéptido citrulinado ciclíco; las diferencias observadas no tuvieron significancia estadística. La frecuencia de anticuerpos aGL IgG fue del 18%, aGL IgA fue del 34% y para aGLU fue del 16%. Solo un paciente resulto positivo tanto para aGL IgA e IgG como para aTGT este último con valor de 92,5mgs/dl. No se determinaron diferencias significativas entre características clínicas de los pacientes con y sin estos anticuerpos.
Distribución de Frecuencias de Anticuerpos en 85 pacientes con Artritis Reumatoide
| Anticuerpos Anti-Gliadina¿ | |||
| IgG | IgA | Ultrapurificada | |
| FR+, n(%) | 15 (94) | 24 (83) | 10 (71) |
| FR−, n(%) | 1 (6) | 5 (17) | 4 (29) |
| Anti-CCp+, n(%) | 13 (81,5) | 22 (76) | 10 (72) |
| Anti-CCP−, n(%) | 3 (18,5) | 7 (24) | 4 (28) |
En este estudio se encontró que entre el 16–34% de pacientes consecutivos con diagnóstico de AR atendidos por un reumatólogo tenían anticuerpos séricos relacionados con antigenicidad a gluten. Un solo paciente, correspondiendo al 1% de la población estudiada, tuvo 3 anticuerpos positivos, incluyendo aTGT. Esta paciente tenía el diagnóstico de AR, seropositiva a factor reumatoide y a antiCCP y sin erosiones evidentes en las radiografías simples de manos y pies. Se consideró como falla de respuesta a metotrexate, por lo que recibió rituximab con lo que se obtuvo una respuesta favorable; sin embargo, 13 meses después presentó nuevamente poliartritis y aceleración de la eritrosedimentación globular. La paciente accedió a una dieta libre de gluten lográndose en 2 meses remisión total de la poliartritis sin recibir rituximab ni metotrexate. Veinte meses después la paciente continúa con dieta libre en gluten y en remisión.
Estos datos apoyan 2 conceptos. El primero en relación a que pacientes con AR pueden tener alteraciones gastrointestinales que condicionen antigenicidad al gluten. No se conoce la relevancia clínica de esto, pero se ha sugerido que puede tener implicaciones terapéuticas. Por ejemplo, Hafström et al11, aleatorizaron 66 pacientes con AR activa a recibir dieta libre de gluten (38 pacientes) o dieta habitual pero bien balanceada (28 pacientes) durante un año. En los pacientes que recibieron dieta sin gluten el 40,5% cumplieron criterios de respuesta ACR20 en comparación con el 4% del grupo sin dieta; los IgG aGL también disminuyeron.
El segundo concepto está en relación a que las manifestaciones articulares de la EC, al menos en algunos pacientes, pueden semejar AR. En nuestra serie, el 1% de los pacientes el diagnóstico final fue de enfermedad celiaca y no de artritis reumatoide. El diagnostico de EC puede pasar desapercibido en muchos casos ya que pueden predominar las manifestaciones sistémicas como poliartritis y las gastrointestinales ser leves o inclusive ausentes; se ha dicho que es la «gran impostora de la era moderna». La EC puede ser «silente» ya que la diarrea puede no ser prominente y diagnosticarse como síndrome de intestino irritable, o presentarse con poliartritis, osteoporosis, anemia, neuropatías periféricas, ataxia, epilepisa, pancreatitis recurrente, estomatitis aftosa, hiperamilasemia o alteraciones en las pruebas de función hepática y también puede asociarse con otras enfermedades como hepatitis autoinmune, enfermedades tiroideas, diabetes mellitus tipo I y psoriasis, entre otras14. Se ha encontrado, por ejemplo, que entre el 2–7% de los pacientes con osteoporosis tienen EC15.
En conclusión, la presencia de anticuerpos aGL, aGLU y aTGT es frecuente en pacientes con AR y es posible que algunos casos diagnosticados como AR tengan en realidad EC. Se sugiere incluir a la EC dentro del diagnóstico diferencial de poliartritis, máxime cuando no muestren mejoría con FARMES.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.