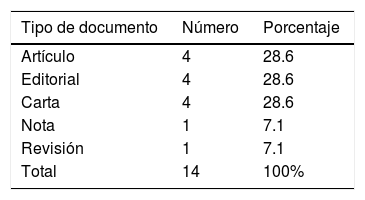
Una búsqueda realizada en Scopus --la mayor base de datos de resúmenes y citaciones de revistas científicas arbitradas a escala global-- muestra que entre 1990 y junio de 2018 el número de artículos que abordó el tema del consentimiento para publicación de casos clínicos (CPCC) registró 14 documentos1-14. De este total, apenas cuatro fueron artículos arbitrados por pares publicados en revistas indexadas, tal y como se muestra en la Tabla 1.
Al interior de esta muestra analizada, un número tan pequeño de resultados ilustra con celeridad la pertinencia del artículo: “Hoja de información al paciente y consentimiento informado de casos clínicos y series de casos: propuesta de un modelo estandarizado para comunicaciones en congresos y otras publicaciones científicas”, publicado por Juana Cruz del Río, Isabel Sastre Gervás y, Susana Romero Yuste, * en el presente número de Reumatología Clínica.
Las autoras proponen un formato digital como soporte bioético para: 1) la divulgación de casos clínicos y series de casos en congresos; 2) la publicación en revistas que no cuentan con un modelo propio y, 3) la realización de actividades docentes en el ámbito de la salud. Con su propuesta, las autoras buscan hacer cumplir el derecho a la intimidad y a la protección de datos de los pacientes sujetos de investigación en España.
El artículo referido no solo es pertinente; también es oportuno, ya que la publicación de casos clínicos ha sido paulatinamente abandonada por diversas revistas médicas, argumentando que este tipo de estudios afecta los factores de impacto al carecer de estándares de calidad, ser fuente de muy pocas citaciones, e incumplir con los componentes éticos de los proyectos de investigación clínica. El trabajo que aquí se presenta intenta subsanar, en alguna medida, estas deficiencias.
Algunos retos para LatinoaméricaDurante la segunda mitad de siglo XX la revisión de los componentes éticos de los proyectos con experimentación en seres humanos se hizo obligatoria en diversos países occidentales15.
Hasta 1966 la investigación clínica se realizaba rutinariamente sin recabar ningún tipo de consentimiento entre los pacientes sujetos de investigación16. Como parte de esta evolución, es hasta 1996 que se publica el primer artículo y guías del Comité Internacional de Editores de Revistas Médicas sobre CPCC14.
Pese a los avances efectuados desde entonces, todavía existen múltiples desafíos en la materia, particularmente en los países en desarrollo, donde los comités de ética en investigación son inexistentes o precarios.
Dado que el consentimiento posee una naturaleza contextual, nos encaminamos hacia una problemática que debe ponderar factores socioculturales como la edad de los participantes, su nivel educativo, diferencias idiomáticas, coerción e influencia de las sociedades patriarcales o tradicionales17.
El CPCC desarrollado para los países latinoamericanos debería de tomar en cuenta asimismo que, en ocasiones, los investigadores requieren lidiar con poblaciones altamente vulnerables, que incluyen a niños, mujeres, ancianos, personas con trastornos del desarrollo intelectual18, migrantes ilegales, e indígenas.
En todos estos entornos, garantizar los derechos de sujetos de investigación analfabetos, discapacitados o de los hablantes de lenguas autóctonas, por ejemplo, suele requerir la presencia adicional de un testigo independiente, de un tutor o de un traductor para confirmar que el consentimiento fue otorgado de manera consciente y libre.
Todas estas consideraciones deben ser tomadas en cuenta al momento de recabar un CPCC, con el propósito de minimizar las asimetrías entre los investigadores y los sujetos de investigación19.
El deber del reumatólogo: proteger los derechos y la dignidad de las personasEn síntesis: el CPCC, que busca proteger al sujeto de investigación del posible daño y la explotación durante la publicación de una investigación, debe contextualizarse dentro de la realidad sociocultural de cada nación, especialmente cuando la investigación del caso clínico o serie de casos a publicar se realiza dentro de comunidades rurales, marginadas o muy pobres.
En todo caso, nunca se debe olvidar que, en los proyectos de investigación clínica efectuados por reumatólogos, el respeto de la privacidad, los derechos y de la dignidad intrínseca de las personas se concreta a través de componentes como el CPCC.
Lo anterior requiere de un diálogo e intercambio constante, respetuoso y fluido entre investigadores, pacientes y sus asociaciones, instancias reguladoras, instituciones de salud y revistas científicas, que debe ser reforzado mediante una adecuada y sólida formación bioética en los programas de pregrado y posgrado20,21.
Conflicto de interésLos autores declaran no haber recibido ningún tipo de financiación ni tener conflicto de interés.