La infección por clamidia del tracto urogenital es la más prevalente de las infecciones de transmisión sexual; sin embargo, el número de diagnósticos de artritis relacionada con clamidia se encuentra habitualmente muy por debajo de la incidencia estimada para la enfermedad. Esta situación podría estar relacionada con el alto porcentaje de infecciones previas asintomáticas y la ausencia de unos criterios diagnósticos adecuados. Los nuevos sistemas de detección de clamidia por medio de la reacción en cadena de la polimerasa (PCR) constituyen una de las técnicas más útiles para establecer el diagnóstico de esta patología.
La terapia biológica plantea dudas teóricas en cuanto a su indicación y existe escasa información en cuanto a su eficacia en la artritis reactiva por clamidia. Aunque la utilidad del tratamiento antibiótico prolongado no está bien establecida, el tratamiento antibiótico combinado abre una nueva puerta al abordaje terapéutico de esta patología.
Urogenital chlamydia infections are the most prevalent of all sexually transmitted diseases although the number of chlamydia-induced reactive arthritis cases are generally below the estimated incidence of the disease. This may be related with the high rate of asymptomatic chlamydial infections and the lack of adequate diagnostic criteria. Polymerase chain reaction (PCR), a new system for detection of Chlamydia, is one of the most useful techniques for the diagnosis of this disease.
Biologic therapy produces theoretical doubts regarding its indication and there is little information related with chlamydia induced reactive arthritis treatment efficacy. Although the usefulness of long antibiotic treatment is not clear, the use of combination antibiotics opens new therapeutic strategies for chlamydia induced reactive arthritis.
En 1969 Ahvonen introdujo por primera vez el término de artritis reactiva (ARe) en relación a pacientes que presentaban una «artritis que se desarrolla durante una infección en cualquier localización del cuerpo pero en la que el microorganismo no se puede recuperar de la articulación»1.
La artritis relacionada con clamidia nos plantea varios interrogantes, tanto desde el punto de vista conceptual y epidemiológico, como en su diagnostico o tratamiento:
- 1.
¿Es similar al resto de las artritis reactivas?
- 2.
¿Su incidencia es muy baja o está infradiagnosticada?
- 3.
¿Cómo la llamamos?
- 4.
¿Cómo la diagnosticamos?
- 5.
¿Qué pruebas diagnósticas son más adecuadas?
- 6.
¿Tiene alguna utilidad el tratamiento antibiótico prolongado?
- 7.
¿Se pueden utilizar terapias biológicas?
Según los criterios del Colegio Americano de Reumatología (ACR) (1981), la ARe es una «artritis periférica que ocurre en relación con uretritis o cervicitis o diarrea»2.
En 1999 se introdujo una definición internacional de consenso de ARe3, en la cual se establecen como patógenos causales: Chlamydia trachomatis (C. trachomatis), Yersinia, Salmonella, Shigella y Campilobacter, y como patógenos posibles: Clostridium difficile y Chlamydia pneumoniae (C. pneumoniae). La duración del intervalo entre la infección y el desarrollo de la artritis se considera que debe ser entre unos días y varias semanas, y el patrón característico de artritis como una oligo-monoartritis asimétrica, de predominio en MMII. La diferencia de duración entre aguda y crónica se establece en 6 meses.
Sin embargo, estas definiciones nos plantean varias dudas en cuanto al concepto de ARe:
- 1.
¿Realmente es una artritis estéril?
- 2.
¿Qué ocurre con los casos sin infección clínica previa del tracto genitourinario (TGU)?
- 3.
¿Y con los casos que no cumplen el intervalo establecido entre la infección del TGU y la artritis?
- 4.
¿Pueden existir formas axiales?, ¿o solo artritis periférica?
- 5.
¿Cómo demostramos la infección previa por clamidia?
Clínicamente, las artritis reactivas postentérica y posvenérea son muy similares, aunque presentan importantes diferencias, tanto en su patogenia como en su epidemiología que, como luego veremos, pueden condicionar de forma importante el tratamiento de ambos procesos (tabla 1).
Diferencias entre ARe postentérica y posvenérea
| Postentérica | Posvenérea | |
| Vía de entrada | Gastrointestinal | Genitourinaria |
| Infección | Sintomática | Asintomática (60%) |
| Relación H/M | 1/1 | 9/1 |
| Tasa de ataque | 1,5-30% (↑ en formas GI más sintomáticas) | 5% |
| Detección de microorganismos viables a nivel sinovial | (−) | (+) |
El patrón articular típico de la ARe por clamidia es el de una mono/oligoartritis o dactilitis de los MMII, con o sin afectación axial.
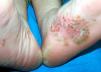
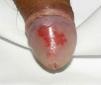
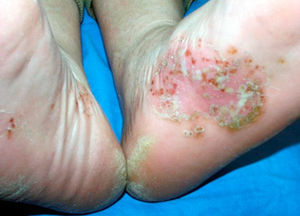
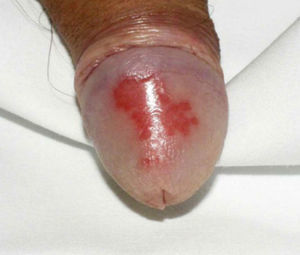
La afectación extraarticular incluye la presencia de entesitis, conjuntivitis, uretritis o cervicitis, y lesiones cutáneas características como la queratodermia blenorrágica (fig. 1) o la balanitis circinada (fig. 2).
EpidemiologíaLa C. trachomatis es el patógeno bacteriano de transmisión sexual más prevalente en EE. UU. En 2009 se declararon en el CDC (Centers of Disease Control and Prevention)4 1.245.000 casos y se estima una incidencia de aproximadamente 3 millones de casos nuevos/año y de 5 millones de casos activos. La prevalencia de infección por clamidia en EE. UU. en mujeres sexualmente activas, entre los 14 y los 19 años de edad, es del 7%.
Según las recomendaciones del servicio de medicina preventiva americano de 2011 para el cribado de clamidia (U.S. Preventive Services Task Force), está indicado un cribado anual (fuerza de recomendación de grado A) en: todas las mujeres<25 años sexualmente activas y en mujeres ≥25 años que no mantengan una pareja estable. No existen, sin embargo, evidencias suficientes para recomendar el cribado en varones.
En España, actualmente, no existe una recomendación establecida de cribado poblacional para clamidia y se realiza habitualmente solo ante la sospecha de enfermedad de transmisión sexual.
La incidencia anual de ARe aguda por clamidia en EE. UU. se estima en un 5% de la población infectada, lo que significaría 150.000 casos/año y de ARe crónica en 60.000 casos/año.
Como luego veremos, esta incidencia no guarda relación con los casos diagnosticados de ARe y está muy por debajo con la incidencia de diagnósticos en otras patologías consideradas más frecuentes como la artritis reumatoide que, sin embargo, presenta una incidencia anual de nuevos casos inferior (120.000 casos/año) a la ARe.
Uno de los motivos que justifican el reducido número de diagnósticos es el alto porcentaje de infecciones urogenitales asintomáticas, que se estima en el 75% de las mujeres y el 50% de los varones infectados.
Los datos de que disponemos en España indican que el número de diagnósticos de ARe es extremadamente bajo. Según los datos del Registro español de espondiloartritis (REGISPONSER), el diagnóstico de ARe, incluyendo forma postentéricas y posvenéreas, fue de 16 casos de 1.385 casos registrados de espondiloartritis (1,2%) (tabla 2), un número claramente inferior al esperado.
Casuística por subgrupos de espondiloartritis. Datos REGISPONSER
| N=1.385 | APS | EA | ARe | Otras espondiloartritis |
| N.° casos (%) | 290 (21%) | 842 (61%) | 16 (1,2%) | 231 (17%) |
| Sexo, % (H/M) | 57/43 | 76/24 | 72/28 | 49/51 |
| Edad de inicio (años) | 40 | 26 | 24 | 30 |
| Retraso diagnóstico (años) | 3,7 | 8 | 2 | 4,5 |
| HLA-B27 (%) | 36 (22%) | 658 (84%) | 8 (50%) | 131 (70%) |
APS: artritis psoriásica; ARe: artritis reactiva; EA: espondilitis anquilosante.
Según los datos del programa de Espondiloartritis precoz de la SER (ESPERANZA), de 603 casos de espondiloartritis registrados en 2011 se incluyeron tan solo 23 casos (3,8%) de ARe según el criterio del médico que lo valoró (tabla 3).
Variables clínicas. Programa de Espondiloartritis precoz de la SER (ESPERANZA)
| Formas de espondiloartritis (N=603) | N.° (%) |
| EA | 117 (19,4) |
| EA asociada a psoriasis | 24 (4) |
| EA asociada a EII | 20 (3,3) |
| Artritis psoriásica | 75 (12,4) |
| Artritis periférica asociada a EII | 14 (2,3) |
| Artritis reactiva | 23 (3,8) |
| Espondiloartritis indiferenciada | 294 (48,8) |
| Otras (Sapho, Whipple…) | 36 (6) |
EA: espondilitis anquilosante.
En nuestra área sanitaria, con una población de 270.000 habitantes, realizamos un estudio retrospectivo de los casos detectados de infección urogenital por clamidia atendidos en atención primaria y atención especializada en un periodo de 8 años (2004-2011). El diagnóstico de la infección se estableció por estudio de PCR (reacción en cadena de la polimerasa) en exudado uretral, cervical o en orina. En este periodo se solicitaron 3.812 determinaciones, con un porcentaje de positividad del 10,4% y se detectaron 7 casos de ARe, 2 agudas (1,6%) y 5 crónicas (4,1%) (tabla 4).
PatogeniaLa clamidia es una bacteria gramnegativa con capacidad de invasión intracelular.
Se ha comprobado la presencia de ADN y ARN bacteriano de clamidia a nivel intraarticular, lo que indica que existen bacterias vivas y metabólicamente activas en el interior de la articulación, aunque en una forma no cultivable.
Se ha demostrado la presencia tanto de C. trachomatis como de C. pneumoniae, aunque esta última de forma significativamente menos frecuente5.
El ADN bacteriano actúa como un potente inductor de la inflamación articular por un proceso dependiente de TNF-α
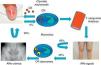
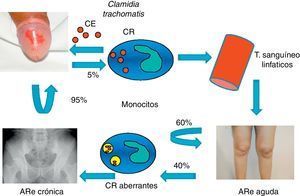
Recientemente, se ha comprobado que las cepas de clamidia implicadas en la inflamación articular no son genitales sino oculares, aunque adquiridas a través de una infección urogenital. Esta situación se produce en un porcentaje escaso de las infecciones, lo que podría estar en relación con el bajo número de casos (5%) que desarrollan artritis, aunque hasta el momento no existen evidencias al respecto6,7 (fig. 3).
Las bacterias gramnegativas comparten una serie de antígenos que se han implicado en los mecanismos patogénicos de la inflamación articular en las ARe, como los lipopolisacáridos (LPS) o las heat shock protein (HSP60). Los LPS forman parte de la membrana externa de estas bacterias y se han detectado en la articulación inflamada de enfermos con ARe. Este antígeno, una vez procesado a nivel intracelular, actúa estimulando los linfocitos y la producción de citocinas proinflamatorias8. Las HSP60 se han detectado en células del líquido sinovial y además se han podido detectar en células mononucleares de sangre periférica, incluso varios años después del desarrollo de la ARe9.
En las ARe asociadas a clamidia, la puerta de entrada de la infección se produce a nivel urogenital. Las bacterias implicadas, por su capacidad de sobrevivir en el interior de las células, son capaces de evitar los mecanismos de defensa del huésped y diseminarse en el organismo hasta alcanzar la articulación, adaptándose al medio articular. La existencia de una respuesta inmunitaria ineficaz parece contribuir de forma importante en las manifestaciones y el curso de la enfermedad.
Se han implicado diferentes mecanismos para justificar la persistencia de la clamidia en la articulación en la ARe. Se ha visto que existe una disminución en la síntesis de antígenos de membrana de la bacteria (MOMP), que explicaría la morfología altamente aberrante encontrada en la articulación y la atenuación de su poder inmunogénico. Por otro lado, la clamidia es capaz de disminuir la apoptosis de los monocitos infectados —interfiriendo con la liberación de citocromo C de la mitocondria de la célula— atenúa la expresión de las moléculas presentadoras de antígeno de clase I y II (CMH-I y II) e induce la apoptosis de linfocitos T por TNF-α, facilitando la evasión de una respuesta inmunitaria eficaz10.
Es posible que en la ARe exista una interacción anormal entre la bacteria artritogénica y el huésped HLA-B27+. En estudios in vitro se ha comprobado que el HLA-B27 confiere un defecto a la eliminación intracelular de la bacteria desencadenante de la ARe, aunque el mecanismo molecular implicado no ha sido aclarado. La respuesta mantenida por la persistencia de los péptidos de origen bacteriano a nivel sinovial determinarían la persistencia de la inflamación articular.
Clásicamente, se estimaba la prevalencia de HLA-B27 en las ARe en el 70-80%; actualmente, se ha comprobado que es claramente inferior, oscilando entre un 30 y un 50%. Los pacientes HLA-B27+ desarrollan mayor severidad y afectación extraarticular con un mayor número de casos con uretritis, conjuntivitis y artritis; esto podría justificar una mayor expresividad clínica y un mayor número de diagnósticos en estos casos.
Tanto los linfocitos T CD4 como CD8 desempeñan un papel fundamental en la patogenia de la ARe; sin embargo, la importancia relativa de cada uno de los subtipos permanece por aclarar. La asociación de la enfermedad con HLA-B27 implicaría la presentación de antígenos bacterianos por esta molécula a los linfocitos T CD8, que serían los desencadenantes de la ARe, mientras que los linfocitos CD4 actuarían regulando esta respuesta, reconociendo otros péptidos bacterianos presentados por moléculas del CMH de clase II.
En estudios realizados con monocitos y linfocitos T de sangre periférica en enfermos con ARe, se ha demostrado que existe una disminución en la producción de TNF-α y se han correlacionado los niveles bajos de TNF-α con el curso crónico de la enfermedad y con la positividad de HLA-B2711. También se han detectado niveles elevados de IL-10 en la articulación de enfermos con ARe por clamidia comparados con oligoartritis indiferenciadas12. En la ARe existe pues una producción relativamente baja de citocinas Th1 que podría explicar, en parte, la persistencia bacteriana.
Por el momento, no es posible predecir si el tratamiento ideal sería el dirigido a estimular la respuesta Th1, como sería la utilización de IFN-γ o IL-12 para favorecer la eliminación bacteriana, o por el contrario, la utilización de terapia anti-TNF-α, del que se desconoce si podría inducir una exacerbación de la infección o una supresión de la inflamación sin estimular el crecimiento bacteriano13.
Todas las especies de clamidia tienen un ciclo de desarrollo bifásico. En la primera fase el cuerpo elemental (forma infecciosa extracelular del microorganismo) se une a la célula (generalmente células epiteliales) a los receptores de proteínas de baja densidad. Se convierte en una inclusión citoplasmática, dentro del cual el cuerpo reticular se transforma en la forma metabólicamente activa, sufre una serie de divisiones celulares y se reorganiza a la forma de cuerpo elemental que se libera por lisis para propagar de nuevo la infección14.
Existe, sin embargo, una serie de mecanismos implicados en la «persistencia» de la clamidia en la articulación. Se inducen un bloqueo del ciclo de desarrollo de la clamidia, la interrupción de la producción y liberación de cuerpos elementales, y una disminución en la actividad metabólica que le hacen refractarias al tratamiento antibiótico. Se produce una replicación de clamidia en ausencia de división celular, una disminución de la expresión de las proteínas de membrana (omp1) que conducen a una morfología aberrante intracelular de la clamidia y una disminución del poder inmunogénico. Existe una inhibición de la expresión de las moléculas presentadoras de antígeno (clase I y II) por acción de las proteasas de la clamidia y se ha comprobado in vitro que la presencia de antibióticos en el medio favorecen este estado de «persistencia»14.
DiagnósticoSerologíaSe ha detectado una alta prevalencia de positividades por reactividad cruzada con C. pneumoniae, un germen sumamente frecuente en la población. Tiene además una sensibilidad limitada, ya que existe un predominio de respuesta celular sobre la humoral porque la clamidia es un patógeno predominantemente intracelular
Los anticuerpos IgG permanecen elevados durante meses y se deben combinar con anticuerpos IgM y/o IgA, lo que indicaría una infección persistente. Se consideran títulos positivos cuando son>2 desviaciones estándar de la población control
Su especificidad y sensibilidad son del 78 y el 73%, respectivamente.
Reacción en cadena de polimerasaSe considera el «patrón de oro» para el diagnostico de la ARe por clamidia. Es una técnica validada, sensible y específica para la detección de ADN de clamidia en muestras de orina, exudado uretral o cervical. La determinación en el líquido sinovial, los monocitos de sangre periférica y en la membrana sinovial solo se realiza en centros especializados y está todavía sometida a variaciones técnicas pendientes de validación15–17.
Para intentar aplicar estas técnicas a la práctica clínica habitual se ha propuesto un algoritmo diagnóstico18.
- 1.
En el caso de una ARe típica en la que se han excluido otros diagnósticos (artritis microcristalinas, artritis reumatoide, artritis psoriásica…), en presencia de infección previa del tracto genitourinario, la serología positiva para clamidia establecería una probabilidad postest del 70%, mientras que si la determinación por PCR en orina es positiva la probabilidad postest se elevaría al 93%.
- 2.
En la misma situación, pero en ausencia de infección previa del tracto genitourinario. La serología positiva para clamidia establecería una probabilidad postest del 31%, que se elevaría al 60% en los casos HLA-B27+. Si la determinación por PCR en orina es positiva la probabilidad postest sería del 63 y el 80% en los casos HLA-B27+.
La aplicación de este algoritmo, sin embargo, deja fuera aspectos fundamentales que contribuyen al diagnóstico de la ARe por clamidia: ¿qué ocurre con los enfermos que presentan dactilitis, balanitis, queratodermia, conjuntivitis o uveítis, lumbalgia inflamatoria o sacroilitis en la radiografía o por estudio de RM?
Respecto del diagnóstico podríamos concluir que ninguno de los tests es útil si no existe un cuadro clínico sugestivo de ARe y se han excluido por un clínico con amplia experiencia otros diagnósticos alternativos. Ni los test ni los síntomas clínicos son suficientes de forma independiente para establecer un diagnóstico definitivo. Para establecer el diagnóstico debemos utilizar una combinación de síntomas clínicos y test, fundamentalmente PCR en orina, exudado uretral o cervical y HLA-B27.
TratamientoLos AINE son eficaces pero no han demostrado que acorten o modifiquen el curso de la enfermedad. Los corticoides pueden ser útiles en fases agudas o en infiltración local y aunque teóricamente podrían plantear problemas en la persistencia bacteriana, no existen datos en este sentido.
El único fármaco modificador de enfermedad (FAME) estudiado es la sulfasalazina, que ha demostrado ser eficaz.
Con respecto al tratamiento antibiótico de la infección previa del tracto genito-urinario, se ha comprobado que el tratamiento previo de la infección por clamidia reduce la incidencia de recaídas de ARe del 37% en los no tratados al 10% en los tratados con eritromicina o tetraciclina19.
Las pautas de tratamiento recomendadas en la infección del tracto genito-urinario incluyen: doxiciclina 100mg/12h vo durante 10-14 días o azitromicina 1g vo en dosis única, debiéndose realizar el tratamiento conjunto de la pareja20.
El primer estudio que demostró la eficacia del tratamiento con limeciclina (3m) en la ARe por clamidia, pero no en la postentérica, se publicó en 199121. Posteriormente, se realizaron varios trabajos en los que administró a largo plazo: doxiciclina (2001)22, ciprofloxacino (1999, 2000) y azitromicina (2004), que no demostraron ser eficaces. Sin embargo, en estos trabajos se incluyeron espondiloartritis indiferenciadas o ARe en los que no se diferenciaron formas postentéricas y posvenéreas23.
El tratamiento combinado con doxiciclina+rifampicina durante 9meses sí demostró ser clínicamente eficaz en la espondiloartritis indiferenciada crónica cuando se procedió a una selección clínica previa de los casos que se sospechaban asociados a clamidia, aunque el estudio carecía de grupo control con placebo24.
En estudios in vitro se ha comprobado que el tratamiento con ciprofloxacino, tetraciclinas, azitromicina o rifampicina suprime el crecimiento de las clamidias, pero induce un estado de «infección persistente» que se reactiva al suprimir el antibiótico. En cambio, la combinación de azitromicina+rifampicina es capaz de erradicar la bacteria en el estado de «infección persistente»17,23.
Recientemente25 se ha publicado un estudio de 6meses de tratamiento antibiótico con rifampicina, combinado con doxiciclina o azitromicina comparado con placebo y 9meses de seguimiento. En la selección de enfermos se propone un nuevo concepto el de «espondiloartritis inducida por clamidia» que incluiría a enfermos diagnosticados de espondiloartritis según los criterios ESSG, excluyendo psoriasis, EII, EA y diarrea previa, que además tuvieran PCR+para C. trachomatis o C. pneumoniae en monocitos de sangre periférica y/o en membrana sinovial. Esta propuesta ha motivado que se haya replanteado la idoneidad del actual sistema de clasificación de espondiloartritis axial y periférica propuesta por ASAS26,27.
Curiosamente, de las 26 biopsias sinoviales realizadas la PCR fue positiva en el 62% y en el 64% en monocitos de sangre periférica. A los 6meses se obtuvo una mejoría clínica>20% en el 63% de los casos en los 2 grupos de tratamiento antibiótico combinado y en un 22% la resolución completa. En 12 de los 17 casos tratados con antibióticos la PCR se negativizó en monocitos de SP y en 4 de 6 en membrana sinovial tras el tratamiento.
En cuanto a la utilización de terapia biológica, su uso plantea varias dudas teóricas:
- 1.
Los niveles detectados de TNF-α son inferiores a los encontrados en otros tipos de artritis
- 2.
La persistencia de C. trachomatis y C. pneumoniae se ha asociado inversamente a la concentración de TNF-α.
- 3.
Por el contrario, las concentraciones séricas de TNF-α son más elevadas que en los controles sanos.
Existe solo un estudio abierto con etanercept que demostró ser eficaz en ARe por clamidia (6 casos) en 6meses de seguimiento. La evolución de las determinaciones de PCR en biopsia sinovial aportó datos confusos. Dos casos se negativizaron tras el tratamiento, 1 permaneció positivo y se positivizaron 2 casos nuevos28.
ConclusionesA diferencia de la ARe postentérica, en la ARe asociada a clamidia queda establecida la presencia de bacterias viables en un estadio metabólico aberrante a nivel articular.
La determinación del ADN bacteriano por PCR es actualmente la prueba más útil para objetivar la asociación a la infección por clamidia. La PCR en orina o exudado uretral o cervical constituye la prueba más asequible, estandarizada y utilizada en la práctica clínica.
La ARe asociada a clamidia está infradiagnosticada en España, el alto porcentaje de infecciones urogenitales asintomáticas por clamidia dificulta su sospecha diagnóstica.
Un elevado porcentaje de las espondiloartritis indiferenciadas crónicas podría estar relacionado con infección previa por clamidia.
Se plantea un nuevo grupo de clasificación dentro de las espondiloartritis: «espondiloartritis reactiva» y «espondiloartritis inducida por clamidia», que incluye manifestaciones tanto axiales como periféricas.
Son necesarios unos nuevos criterios de clasificación que permitan una selección más sencilla y adecuada de los enfermos con «artritis relacionada con clamidia».
Las infecciones urogenitales detectadas o no tratadas se deben tratar con un tratamiento antibiótico adecuado. El tratamiento con terapia anti-TNF puede ser eficaz pero plantea «dudas teóricas» en cuanto a la interferencia negativa en el curso de la enfermedad.
El tratamiento antibiótico combinado, prolongado, abre una nueva vía al abordaje terapéutico de la ARe asociada a clamidia, aunque todavía quedan interrogantes por aclarar: a) combinación y duración de la pauta antibiótica más adecuada; b) valor de la PCR en orina como criterio de selección; c) utilidad de esta pauta en las formas precoces de ARe, y d) confirmación de estos resultados en estudios más amplios. Estos nuevos hallazgos abren una nueva puerta al estudio de la etiología infecciosa de las espondiloartritis y a la búsqueda de un tratamiento potencialmente curativo de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.