El síndrome de fatiga crónica (SFC) es una entidad que afecta predominantemente a las mujeres, con escasos estudios epidemiológicos en los hombres. El objetivo fue evaluar si existen diferencias de género en el SFC y definir el perfil clínico en el hombre.
Pacientes y métodoEstudio de cohorte transversal prospectivo de inclusión de pacientes con SFC en el momento del diagnóstico. Se evaluaron datos sociodemográficos, clínicos, fenómenos comórbidos y evaluación de la fatiga, dolor, ansiedad/depresión y calidad de vida a través de cuestionarios. Se realizó un estudio comparativo de las variables entre género.
ResultadosSe estudió a un total de 1.309 pacientes con SFC, de los cuales 119 (9,1%) fueron hombres. La edad media y de inicio de los síntomas de los hombres fueron menores que en las mujeres. El 30% eran hombres solteros, vs. el 15% de mujeres, y el 32% tenían un trabajo especializado vs. el 20% en mujeres. El desencadenante más frecuente fue el infeccioso. El dolor generalizado, las contracturas musculares, los mareos, la disfunción sexual, el fenómeno de Raynaud, la rigidez matutina, las artralgias migratorias, las alergias a fármacos y metales, así como el edema facial, fueron menos frecuentes en los hombres. Se presentó fibromialgia en 29% de los hombres vs. 58% de las mujeres. Los fenómenos comórbidos fueron menos frecuentes en los hombres. Las puntuaciones en la función física, el rol físico y la salud física global del SF-36 fueron más altas en los hombres. Las dimensiones sensorial y afectiva del dolor fueron inferiores en los hombres.
ConclusionesEl perfil clínico del hombre fue el de un paciente más joven, soltero, con trabajo especializado y con un desencadenante infeccioso. Los hombres presentaron menor dolor, menor sintomatología muscular e inmune, menor número de fenómenos comórbidos y mejor calidad de vida.
Chronic fatigue syndrome (CFS) is a chronic condition that predominantly affects women. To date, there are few epidemiologic studies on CFS in men. The objective of the study was to assess whether there are gender-related differences in CFS, and to define a clinical phenotype in men.
Patients and methodsA prospective, cross-sectional cohort study was conducted including CFS patients at the time of diagnosis. Sociodemographic data, clinical variables, comorbid phenomena, fatigue, pain, anxiety/depression, and health quality of life, were assessed in the CFS population. A comparative study was also conducted between genders.
ResultsThe study included 1309 CFS patients, of which 119 (9.1%) were men. The mean age and symptoms onset were lower in men than women. The subjects included 30% single men vs. 15% single women, and 32% of men had specialist work vs. 20% of women. The most common triggering factor was an infection. Widespread pain, muscle spasms, dizziness, sexual dysfunction, Raynaud's phenomenon, morning stiffness, migratory arthralgias, drug and metals allergy, and facial oedema were less frequent in men. Fibromyalgia was present in 29% of men vs. 58% in women. The scores on physical function, physical role, and overall physical health of the SF-36 were higher in men. The sensory and affective dimensions of pain were lower in men.
ConclusionsThe clinical phenotype of the men with CFS was young, single, skilled worker, and infection as the main triggering agent. Men had less pain and less muscle and immune symptoms, fewer comorbid phenomena, and a better quality of life.
El síndrome de fatiga crónica (SFC) es una entidad multisistémica de causa desconocida, que afecta mayoritariamente a adultos jóvenes, con edades comprendidas entre los 20 y 40 años y con una relación hombre: mujer de 1:4 en algunas series1,2. Se estima su prevalencia entre el 0,2 y el 2,6% de la población general3,4. El SFC debe sospecharse ante un paciente con un cuadro de fatiga inexplicable de al menos 6 meses de duración que no mejora con el reposo. La fatiga debe acompañarse de 4 o más de los siguientes síntomas: deterioro de la memoria y concentración a corto plazo, odinofagia, ganglios cervicales o axilares dolorosos, dolor muscular, oligoartralgias sin signos inflamatorios, cefalea de nueva aparición o de nuevas características o severidad, sueño no reparador y fatiga postejercicio durante más de 24 h. Todos estos síntomas deben determinar una alteración funcional grave, tal como se propone en los criterios diagnósticos internacionales establecidos por el CDC en 19945. En 2003, se propuso una nueva definición del SFC creada con la intención de excluir los casos psiquiátricos, a través del documento canadiense de consenso de casos sobre SFC6, que son útiles y complementarios a los criterios del CDC y nos permiten estudiar los bloques sintomáticos (neurológico, muscular, cognitivo, neurovegetativo e inmunológico). En el 2011, dichos criterios se actualizaron, proponiendo como criterio obligatorio la fatiga posesfuerzo7. El SFC se asocia a diferentes fenómenos comórbidos (síndrome seco, síndrome miofascial regional, trastornos de ansiedad/depresión, fascitis plantar, enfermedad vertebral degenerativa o mecánica, tendinopatía del hombro y fibromialgia [FM])8,9, con una prevalencia superior a la que se observa en el paciente no afecto del SFC10. Debido al menor número de hombres afectos de SFC, en nuestra experiencia la relación hombre: mujer es de 1:99, los estudios epidemiológicos y clínicos en el SFC se han desarrollado básicamente en mujeres y existen pocos estudios sobre el perfil del hombre afecto de SFC. Las diferencias de salud entre hombres y mujeres están determinadas, por una parte, por diferencias biológicas que, además de las funciones reproductivas, implican factores genéticos, hormonales y neurometabólicos. En el momento actual, la hipótesis patogénica más aceptada en el SFC es considerarla como un proceso de base genética, con diferentes desencadenantes y con disfunción neuroinmunoinflamatoria posterior que daría lugar a diferentes síntomas del paciente11. En el SFC se constatan fenómenos clínicos que también se observan en enfermedades inmunoinflamatorias más prevalentes en la mujer (lupus eritematoso sistémico, esclerosis múltiple, artritis reumatoide, síndrome de Sjögren, síndrome de intestino irritable)12, con una mejoría de los síntomas durante el embarazo y el empeoramiento durante la menstruación y el parto. Por todo lo anteriormente expuesto, es lógico hipotetizar que el SFC afectará más a mujeres que a hombres, sin disponer en el momento actual del fenotipo clínico diferenciador con la mujer. El objetivo del estudio es evaluar las características clínicas de los hombres con SFC y realizar un estudio comparativo frente a las mujeres para valorar si existen diferencias de género en los pacientes con SFC para así disponer de un perfil clínico diferenciador con implicaciones pronósticas y de manejo terapéutico.
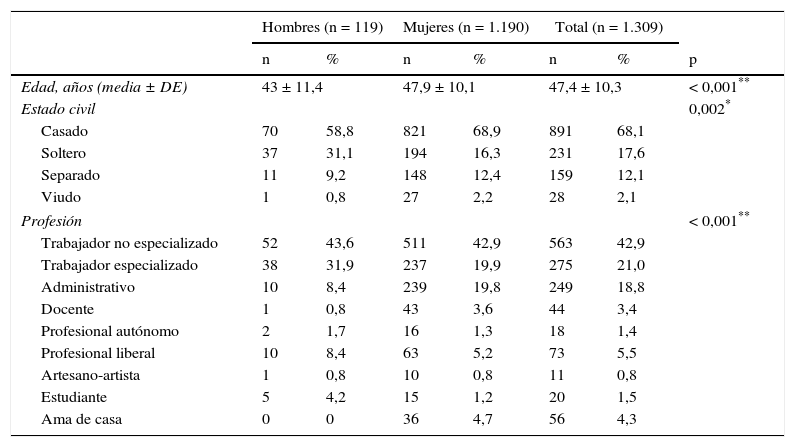
Pacientes y métodosSe estudió a 1.309 pacientes que fueron diagnosticados de SFC en la Unidad de Fatiga Crónica del Hospital Universitario Vall d’Hebron según los criterios diagnósticos5 y que tras el diagnóstico aceptaban ser incluidos en una base de datos. En la tabla 1 se especifican los criterios de inclusión y exclusión del estudio. El diseño fue un estudio de cohorte de inclusión transversal prospectivo en el momento del diagnóstico. Se valoró la influencia del género en la presentación clínica de la enfermedad, presencia de fenómenos comórbidos asociados, escalas de síntomas y cuestionarios administrados. Dichos pacientes procedían en su mayoría de derivaciones para estudio de clínica compatible desde el primer nivel asistencial o especializado de todas las comunidades autónomas. El período de inclusión de los pacientes fue desde enero de 2008 hasta mayo de 2011, de forma consecutiva. Las entrevistas fueron realizadas por 2 internistas especializados en el diagnóstico de la enfermedad. A todos los pacientes se les pidió el consentimiento informado por escrito y el estudio fue aprobado por el Comité de Ética del Hospital Universitario Vall d’Hebron. Se recogieron variables sociodemográficas de cada paciente (edad, sexo, estado civil, profesión, situación laboral y nivel educativo). En la tabla 2 se muestran los datos sociodemográficos de los pacientes estudiados. Se les interrogó sobre las características de la fatiga (forma y momento de inicio, curso y tiempo de evolución) y características del dolor (edad de inicio, tiempo de evolución de dolor continuo). La entrevista clínica se realizó definiendo los bloques de sintomatología (muscular, cognitiva, neurológica, autonómica/neurovegetativa e inmunológica) definidos por los criterios canadienses del SFC7. Se valoró la presencia de cefalea recurrente y trastornos del sueño (sueño no reparador, insomnio, pesadillas y sueño superficial) y fenómenos comórbidos asociados (síndrome de piernas inquietas, parálisis del sueño y síndrome de apnea/hipoapnea leve). Se interrogó sobre la existencia de FM definida según los criterios de la ACR13, síndrome seco definido por la presencia de sequedad bucal más sequedad ocular demostrada por la prueba de Schirmer, síndrome miofascial regional definido como dolor, rigidez y claudicación de la articulación temporomandibular según los criterios de Travell y Simons, trastornos de ansiedad (ansiedad generalizada y trastornos de angustia) según la definición del DSM-IV, fascitis plantar, enfermedad vertebral degenerativa o mecánica y tendinopatía del hombro. Asimismo, la presencia de osteoporosis, dislipidemia, endometriosis e hipersensibilidad química múltiple. A todos los pacientes se les cuantificaron los síntomas, fatiga, dolor, ansiedad/depresión y la calidad de vida a través de cuestionarios autoadministrables. Para la valoración de la fatiga, se seleccionó la escala de impacto de fatiga (FIS 40)14. La versión FIS 40 incluye 3 subescalas de percepción de impacto de la fatiga, la cognitiva de 10 ítems, la física de 10 ítems y la función psicosocial de 20 ítems, con puntuación para cada ítem de 1 a 4. Para valorar el dolor, el cuestionario de McGill15 evalúa aspectos cuantitativos (intensidad) y cualitativos del dolor (dimensiones sensorial y afectiva). Cada uno de los términos descriptivos tiene asignado un número o rango que permite obtener una puntuación de acuerdo con las palabras escogidas, con lo que se obtiene el denominado «pain rating index» (PRI) o «índice de valoración del dolor». Esta puntuación refleja el modo en que el paciente califica su propia experiencia dolorosa, permitiendo al investigador valorar la influencia que sobre esta experiencia ejercen los factores emocionales y sensoriales. Además, contiene un apartado en el que el paciente refleja la intensidad del dolor que padece. En la cuantificación de la ansiedad/depresión, la escala de ansiedad y depresión hospitalaria (HADS)16, consta de 14 afirmaciones referentes a síntomas de ansiedad y depresión, en las que la frecuencia o intensidad se mide con escala de 4 puntos (que se pueden valorar de 0 a 3). La puntuación total de cada subescala se obtiene sumando los ítems, con un rango que va desde 0 a 21. Y, finalmente, para valorar la calidad de vida se utilizó el cuestionario SF-3617. Es una escala genérica que proporciona un perfil del estado de salud y consta de 36 preguntas que exploran 8 dimensiones del estado de salud (función física, rol físico, dolor corporal, salud general, vitalidad, función social, rol emocional y salud mental).
Criterios de inclusión y exclusión de los pacientes con síndrome de fatiga crónica
| Criterios de inclusión | 1- Pacientes de ambos sexos mayores de 18 años 2- Pacientes con SFC según los criterios diagnóstico establecidos (Fukuda et al., 1994) de la Unidad de Fatiga Crónica, Hospital Universitari Vall d’Hebrón, Barcelona 3- Pacientes que otorguen libremente el consentimiento por escrito para participar en el estudio |
| Criterios de exclusión | 1- Pacientes que estén participando en otro estudio de igual o distinta naturaleza en los últimos 30 días previos a la inclusión 2- Cualquier sujeto que, a juicio del investigador, no sea capaz de seguir las instrucciones del estudio o cumplimentar los cuestionarios autoadministrables 3- Sujetos que no otorguen el consentimiento informado por escrito para participar en el estudio |
Datos sociodemográficos de los pacientes estudiados
| Hombres (n = 119) | Mujeres (n = 1.190) | Total (n = 1.309) | |||||
|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | p | |
| Edad, años (media ± DE) | 43 ± 11,4 | 47,9 ± 10,1 | 47,4 ± 10,3 | < 0,001** | |||
| Estado civil | 0,002* | ||||||
| Casado | 70 | 58,8 | 821 | 68,9 | 891 | 68,1 | |
| Soltero | 37 | 31,1 | 194 | 16,3 | 231 | 17,6 | |
| Separado | 11 | 9,2 | 148 | 12,4 | 159 | 12,1 | |
| Viudo | 1 | 0,8 | 27 | 2,2 | 28 | 2,1 | |
| Profesión | < 0,001** | ||||||
| Trabajador no especializado | 52 | 43,6 | 511 | 42,9 | 563 | 42,9 | |
| Trabajador especializado | 38 | 31,9 | 237 | 19,9 | 275 | 21,0 | |
| Administrativo | 10 | 8,4 | 239 | 19,8 | 249 | 18,8 | |
| Docente | 1 | 0,8 | 43 | 3,6 | 44 | 3,4 | |
| Profesional autónomo | 2 | 1,7 | 16 | 1,3 | 18 | 1,4 | |
| Profesional liberal | 10 | 8,4 | 63 | 5,2 | 73 | 5,5 | |
| Artesano-artista | 1 | 0,8 | 10 | 0,8 | 11 | 0,8 | |
| Estudiante | 5 | 4,2 | 15 | 1,2 | 20 | 1,5 | |
| Ama de casa | 0 | 0 | 36 | 4,7 | 56 | 4,3 | |
p: prueba de chi-cuadrado (comparaciones por sexo), prueba no-paramétrica de Kruskal-Wallis (comparación de medias).
*p < 0,05.
**p < 0,001.
Se realizó un análisis descriptivo de la muestra mediante frecuencias absolutas y relativas en el caso de las variables categóricas, y mediante medidas de tendencia central y dispersión en las variables continuas. Se calculó el índice de consistencia interna de los ítems basado en el alfa de Cronbach para estimar la fiabilidad relacionada con la sintomatología muscular, cognitiva, neurológica e inmunológica y la disfunción neurovegetativa, con la finalidad de valorar la capacidad de obtener resultados consistentes en mediciones sucesivas del mismo fenómeno. Si el valor de alfa era superior a 0,7, se consideró que los datos eran aceptables y se podría trabajar en una sola dimensión que sería la suma de los ítems de cada sintomatología. Para comparar los valores de las variables categóricas entre hombres y mujeres afectos de SFC, se utilizó la prueba de independencia de chi-cuadrado y la prueba t-test de muestras independientes para las comparaciones entre variables continuas. El error tipo I (α) se fijó en el 5%. El análisis estadístico se llevó a cabo mediante el software R (The R Foundation for Statistical Computing).
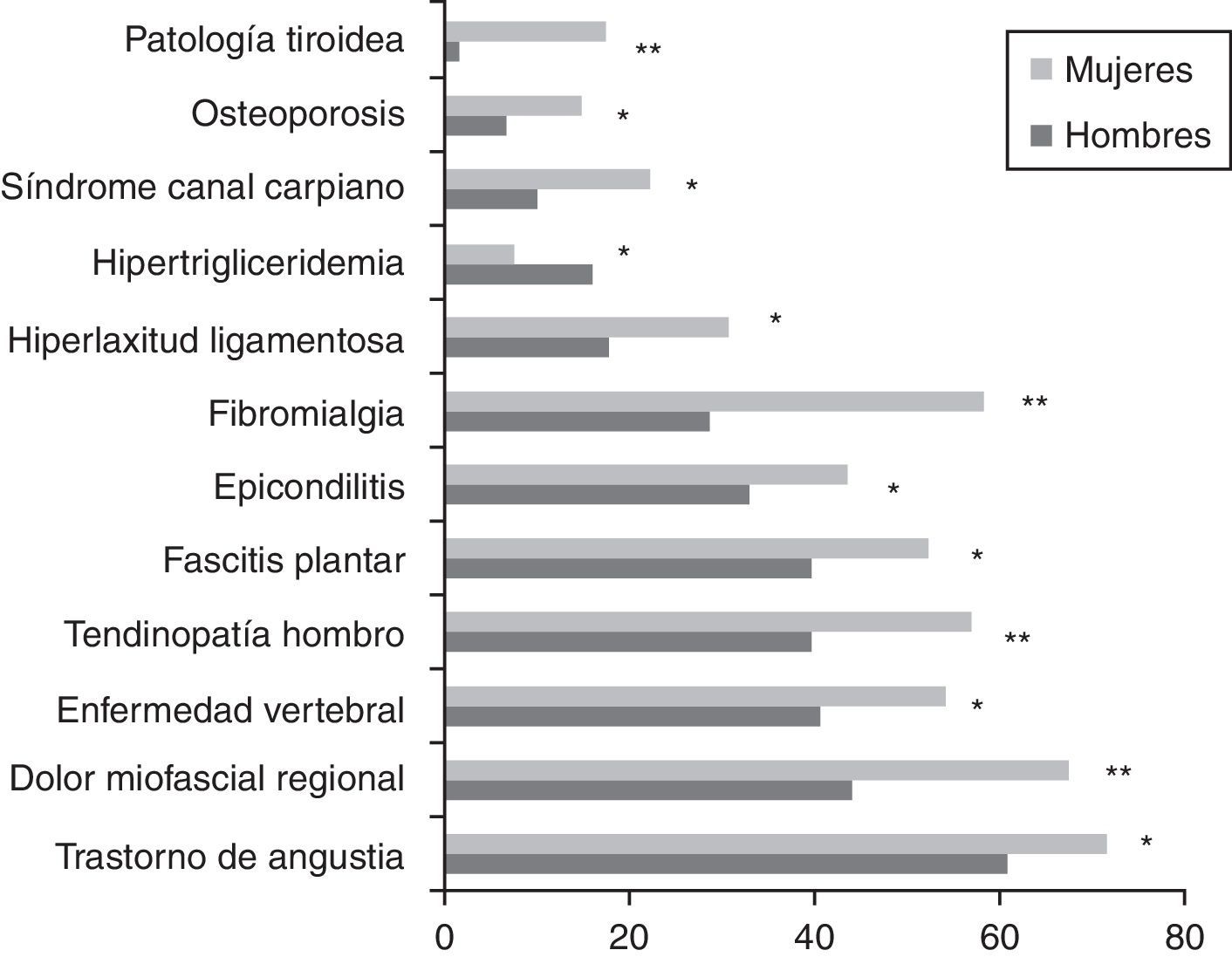
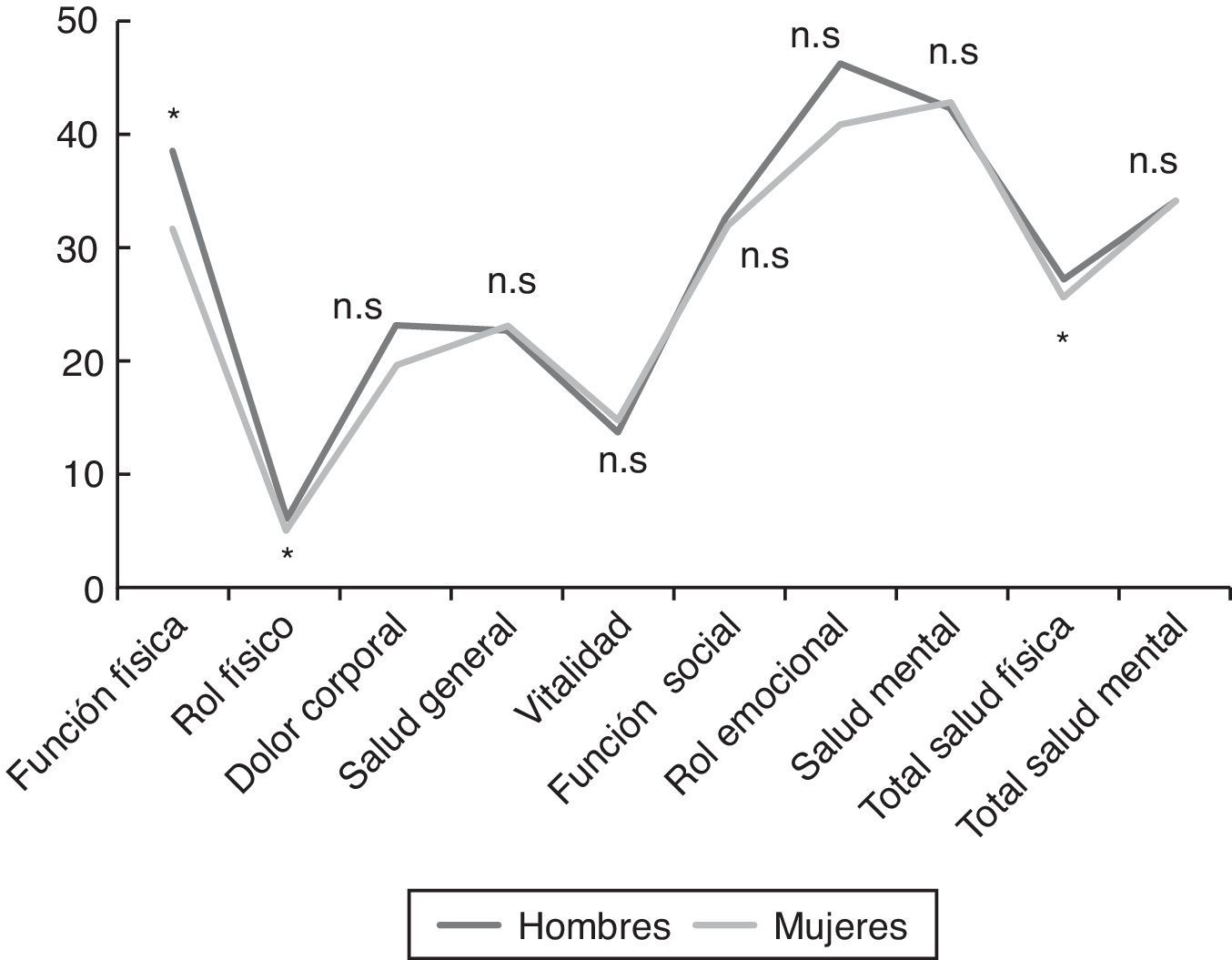
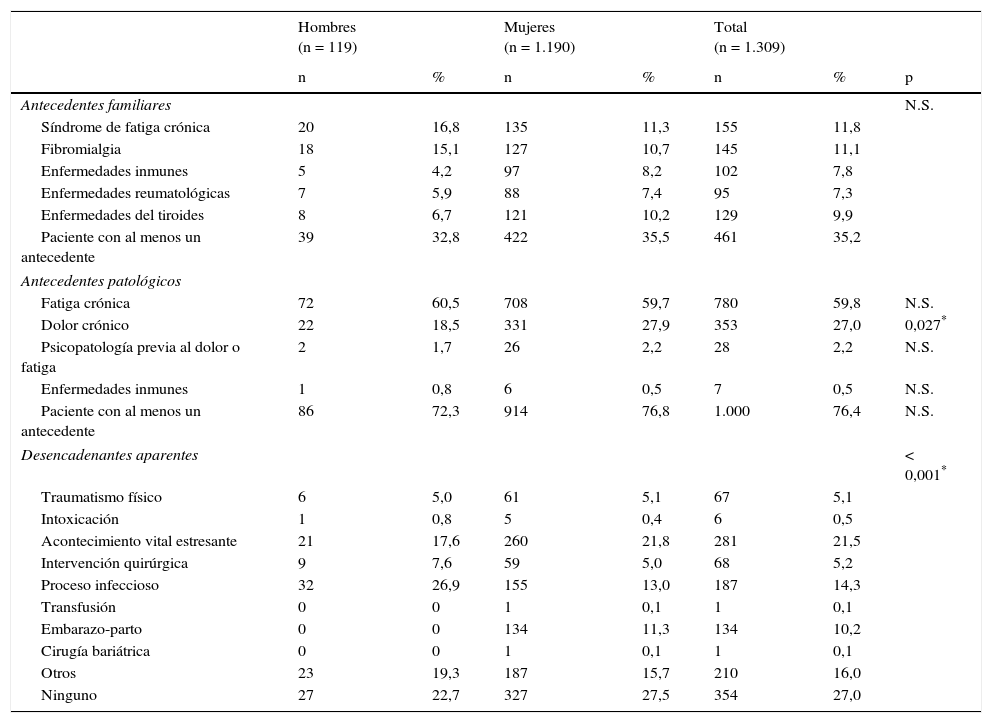
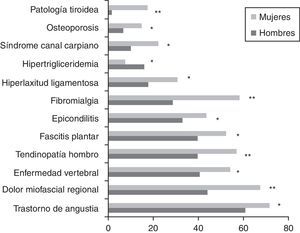
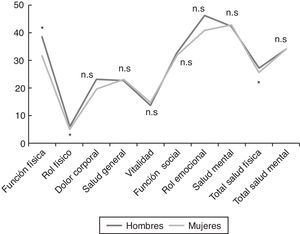
ResultadosSe incluyó a un total de 1.309 pacientes (91% mujeres vs. 9% hombres) con una edad media global de 47,4±10,3 años. Los hombres fueron diagnosticados a una edad más temprana que las mujeres (43,0±11,4 vs. 47,9±10,1 años; p < 0,001). En cuanto al estado civil, el porcentaje de hombres solteros fue superior al de las mujeres (31,1 vs. 16,3%; p = 0,002). Los hombres tenían un trabajo más especializado que las mujeres (31,9 vs. 19,7%; p < 0,001). Respecto al nivel educativo y situación laboral, no se encontraron diferencias estadísticamente significativas. Las variables demográficas comparativas entre ambos sexos se detallan en la tabla 3. Los antecedentes familiares de SFC, FM, enfermedades inmunes, reumatológicas y del tiroides estaban presentes en 461 pacientes (35,2%), con un porcentaje de SFC del 11,8%, sin diferencias significativas entre sexos. El 76,4% de los pacientes tenía algún antecedente personal de fatiga, dolor crónico, psicopatología previa al dolor o fatiga o enfermedades inmunes. Los hombres solamente referían menos dolor crónico respecto a las mujeres (18,5 vs. 27,9%; p = 0,027), pero en el resto de antecedentes patológicos, las diferencias no fueron estadísticamente significativas. Había diferencias entre sexos al valorar la presencia de un desencadenante previo al inicio de la sintomatología. Los hombres referían con mayor frecuencia un proceso infeccioso frente a las mujeres (26,9 vs. 13%; p < 0,001) y los hombres presentaban menos un acontecimiento vital estresante comparados con las mujeres (17,6 vs. 21,8%; p < 0,001). La forma de inicio de la fatiga fue gradual en el 66% y tuvo un curso continuo en el 83,9% de los pacientes, de los cuales el 88,1% referían empeoramiento desde el inicio. La edad de inicio de la fatiga (34,5±12; p = 0,016) y el tiempo de evolución del dolor (90,2±70,1; p = 0,036) fueron menores en los hombres. La presencia de cefalea recurrente fue casi similar en los hombres y en las mujeres (86,4 vs. 85,4%). El 98,7% de los pacientes referían un sueño no reparador, porcentaje similar en ambos sexos. Las pesadillas y el insomnio fueron menos frecuentes en los hombres respecto a las mujeres (33,6 vs. 58,8%; p = 0,012). No se encontraron diferencias estadísticamente significativas en la valoración de fenómenos asociados (síndrome de piernas inquietas, parálisis del sueño y síndrome de apneas) entre sexos. De todos los grupos de sintomatología estudiados (muscular, cognitivo, neurológico, neurovegetativo e inmunológico), solamente los grupos de síntomas cognitivo, neurológico y neurovegetativo mostraron valores de consistencia interna alfa de Cronbach superiores a 0,70, por lo que se trabajó con dichos resultados en una sola dimensión estratificando en leve, moderada y grave según el número de síntomas. No había diferencias estadísticas entre sexos en ningún síntoma cognitivo ni neurológico. La hipersensibilidad a los olores era más frecuente en mujeres (68,2%; p = 0,002). En el grupo de sintomatología neurovegetativa, los mareos (69,7%; p < 0,001) y la disfunción sexual (69,7%; p = 0,023) eran menos prevalentes en hombres. Respecto a la sintomatología inmunológica y muscular fueron las que presentaron mayores diferencias entre sexos. En la sintomatología inmunológica estudiada, había diferencias entre sexos en el fenómeno de Raynaud (19,3 vs. 27,9%; p = 0,045), el entumecimiento matutino generalizado (76,5 vs. 83,7%; p = 0,045), las artralgias migratorias (79 vs. 86,4%; p = 0,028), la alergia a fármacos (16 vs. 24,8%; p = 0,032) o alergia a metales (6,7 vs. 17,1%; p = 0,003) y edema facial (2,5 vs. 7,7%; p = 0,037). Por otra parte, en cuanto a la sintomatología muscular, el dolor generalizado (78,2 vs. 90,9%; p < 0,001), la dificultad para los movimientos finos por dolor (77,3 vs. 86,1%; p = 0,010) y las contracturas musculares (83,2 vs. 89,6%; p = 0,034) fueron menos frecuentes en los hombres. En la figura 1, se detallan las frecuencias de fenómenos comórbidos en los pacientes estudiados por sexo. La FM, enfermedades osteomusculares (dolor miofascial regional) y alteraciones tiroideas fueron más frecuentes en las mujeres, mientras que la hipertrigliceridemia fue más frecuente en los hombres. No se observaron diferencias estadísticas entre sexos en las escalas FIS 40 y HADS. En el cuestionario SF-36, los hombres mostraron mejores puntuaciones en las subescalas de función física (38,4±23,5; p = 0,002), rol físico (6,2±15,7; p = 0,034) y total de salud física (27±6,8; p = 0,035) (fig. 2). Se observaron diferencias estadísticamente significativas en el cuestionario de dolor de McGill. En las dimensiones sensorial y afectiva, las puntuaciones en hombres fueron más bajas con respecto a mujeres (16±8,3 vs. 18,6±8.0; p = 0,005 y 6,4±3,8 vs. 7,2±3,9; p = 0,024, respectivamente). No se observaron diferencias significativas en la intensidad del dolor entre géneros.
Antecedentes familiares, patológicos y desencadenantes aparentes de los pacientes estudiados
| Hombres (n = 119) | Mujeres (n = 1.190) | Total (n = 1.309) | |||||
|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | p | |
| Antecedentes familiares | N.S. | ||||||
| Síndrome de fatiga crónica | 20 | 16,8 | 135 | 11,3 | 155 | 11,8 | |
| Fibromialgia | 18 | 15,1 | 127 | 10,7 | 145 | 11,1 | |
| Enfermedades inmunes | 5 | 4,2 | 97 | 8,2 | 102 | 7,8 | |
| Enfermedades reumatológicas | 7 | 5,9 | 88 | 7,4 | 95 | 7,3 | |
| Enfermedades del tiroides | 8 | 6,7 | 121 | 10,2 | 129 | 9,9 | |
| Paciente con al menos un antecedente | 39 | 32,8 | 422 | 35,5 | 461 | 35,2 | |
| Antecedentes patológicos | |||||||
| Fatiga crónica | 72 | 60,5 | 708 | 59,7 | 780 | 59,8 | N.S. |
| Dolor crónico | 22 | 18,5 | 331 | 27,9 | 353 | 27,0 | 0,027* |
| Psicopatología previa al dolor o fatiga | 2 | 1,7 | 26 | 2,2 | 28 | 2,2 | N.S. |
| Enfermedades inmunes | 1 | 0,8 | 6 | 0,5 | 7 | 0,5 | N.S. |
| Paciente con al menos un antecedente | 86 | 72,3 | 914 | 76,8 | 1.000 | 76,4 | N.S. |
| Desencadenantes aparentes | < 0,001* | ||||||
| Traumatismo físico | 6 | 5,0 | 61 | 5,1 | 67 | 5,1 | |
| Intoxicación | 1 | 0,8 | 5 | 0,4 | 6 | 0,5 | |
| Acontecimiento vital estresante | 21 | 17,6 | 260 | 21,8 | 281 | 21,5 | |
| Intervención quirúrgica | 9 | 7,6 | 59 | 5,0 | 68 | 5,2 | |
| Proceso infeccioso | 32 | 26,9 | 155 | 13,0 | 187 | 14,3 | |
| Transfusión | 0 | 0 | 1 | 0,1 | 1 | 0,1 | |
| Embarazo-parto | 0 | 0 | 134 | 11,3 | 134 | 10,2 | |
| Cirugía bariátrica | 0 | 0 | 1 | 0,1 | 1 | 0,1 | |
| Otros | 23 | 19,3 | 187 | 15,7 | 210 | 16,0 | |
| Ninguno | 27 | 22,7 | 327 | 27,5 | 354 | 27,0 | |
N.S.: no significativo; p: prueba de chi cuadrado (comparaciones por sexo).
*p < 0,05.
El SFC es un proceso médico definido actualmente por criterios diagnósticos establecidos, que afecta mayormente a mujeres, en una proporción que puede llegar a ser de 9:1, tal y como se constata en nuestra serie y en otros procesos de base inmunoinflamatoria (lupus eritematoso y esclerosis múltiple)12,18. Quizá motivado por la escasa prevalencia en hombres, en la literatura hay pocos estudios que valoren la influencia del género en este síndrome. El estudio de Buchwald et al.19, realizado con 348 pacientes con SFC (288 mujeres y 60 hombres), demostró que, en los hombres, es menos frecuente la presencia de adenopatías, dolor faríngeo, rigidez matutina, disfunción intestinal y FM, con una mejor función física en el SF-36, que coincide con nuestros resultados en los que se comprueban menos incidencia de sintomatología inmunoinflamatoria y neurovegetativa, menor prevalencia de fenómenos comórbidos (FM) y mejor calidad de vida física. En esta misma línea de influencia del género en la fatiga crónica, sí existen más referencias en relación con fenómenos comórbidos asociados de la FM. Así, Ruiz Perez et al.20, en una cohorte de 214 pacientes con FM (197 mujeres y 17 hombres), demostró que el tiempo transcurrido desde el inicio de los síntomas hasta el diagnóstico de la enfermedad era mayor en los hombres, que tenían mayor nivel educativo, mayor porcentaje de enfermedad mental y que repercutía más en el entorno familiar, respecto a las mujeres. Ellos atribuyen la mayor prevalencia de FM en mujeres a diferencias hormonales, culturales y socioeconómicas, así como a la percepción de la enfermedad y al comportamiento y actitudes del sexo femenino hacia los servicios sanitarios. Miró et al.21, con un grupo reducido de 42 pacientes con FM (21 mujeres y 21 hombres), encontró en los hombres que el dolor se relacionaba con la calidad del sueño y en las mujeres, que además tenían un umbral de sensibilidad al dolor más bajo y un mayor consumo de analgésicos, con miedo al dolor y catastrofización. En otro trabajo del grupo de Yunus et al.22 constataron que los hombres con FM tenían menos puntos gatillo, dolor, fatiga, sueño no reparador, número de síntomas y presencia de disfunción neurovegetativa en forma de intestino irritable. Las diferencias de género en varios aspectos de la enfermedad o de las enfermedades han sido documentadas en las últimas décadas. Estas diferencias se han descrito en enfermedades reumáticas, síndromes de dolor crónico, incluidos aquellos relacionados con la FM, sin que hayan sido del todo comprendidos los mecanismos implicados en la mayor sensibilidad del dolor en las mujeres22. En este estudio, a pesar de que los antecedentes de trastorno de angustia fueron más frecuentes en el sexo femenino, valorados por la escala HADS, no se encontraron diferencias entre sexos. Tampoco hay diferencias en la dimensión salud mental y salud mental global del cuestionario SF-36, lo cual nos podría indicar que la sintomatología afectiva no determina características diferenciales entre sexos o que la enfermedad afecta a nivel emocional de la misma forma a ambos sexos. Este punto lo consideramos de importancia, dado que al SFC, tanto en el ámbito del personal sanitario como en la población general, se le atribuye un componente psicológico o funcional en la génesis de la enfermedad, cuando hoy día la hipótesis más aceptada lo considera como un proceso neuroinmune-inflamatorio, en un paciente con susceptibilidad genética. Dicha disfunción inmune estaría desencadenada por un importante número de procesos (infecciones, trauma físico/psíquico, vacunas, tóxicos, anestesia/parto, metales/químicos) que ocasionan el complejo sintomático del SFC, en su vertiente periférica con intolerancia al ejercicio físico y en su vertiente central con severa disfunción cognitiva que incluye alteraciones de la concentración y de la memoria inmediata. Una de las limitaciones principales del estudio es que, al ser una cohorte de inclusión transversal prospectiva en el momento del diagnóstico, no se puede valorar la evolución en el tiempo. Los pacientes proceden en su mayoría de la atención primaria de salud o de la especializada ambulatoria y las listas de espera y el desconocimiento de la enfermedad conducen a un retraso en el diagnóstico, por lo que el tiempo transcurrido entre el inicio de los síntomas o la sospecha diagnóstica es superior al recomendado. La población estudiada se diagnostica en una unidad especializada en SFC, hecho que conlleva mayor gravedad sintomática y más comorbilidades que si el reclutamiento se hubiese realizado en atención primaria. En la actualidad, este estudio es el más amplio de todos los publicados sobre diferencias de género en el SFC19. Se demuestra que el SFC es muy poco frecuente en hombres con respecto a mujeres en la cohorte estudiada. El fenotipo clínico del paciente varón afecto de SFC es más joven en el inicio de la enfermedad, soltero y tiene trabajo especializado con mayor frecuencia, y el desencadenante infeccioso es el principal agente que precede a la condición. Los hombres presentan menor sintomatología muscular, inmunológica y neurovegetativa. En los hombres se constata menor número de fenómenos comórbidos asociados (FM, trastornos osteomusculares, osteoporosis, crisis de ansiedad/depresión, enfermedad tiroidea) y presentan una mejor calidad de vida, preferentemente en el componente relacionado con la función física y el dolor. Existen estudios que plantean que el SFC está infradiagnosticado en general, y aún más en hombres. La investigación futura tendrá que determinar por qué los hombres tienen diferente perfil clínico en los síntomas, donde algunas de las diferencias fisiológicas podrían estar involucradas (sistema neuroendocrino, sistema cardiovascular, sistema musculoesquelético, sistema inmune, psicopatología y respuesta a fármacos).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
AutoríaLos autores del manuscrito han participado en la concepción y diseño, en la recogida de datos, en el análisis e interpretación de los datos, así como en la redacción, revisión y aprobación del manuscrito remitido.
Conflicto de interesesLos autores declaran la inexistencia de conflictos de intereses.