Evaluar la asociación entre la pérdida de peso y cambios en la actividad en pacientes con artritis psoriásica (APs).
MétodosSe llevó a cabo una revisión sistemática en Medline, Embase y Cochrane Central desde el inicio hasta abril del 2015. Criterios de inclusión: 1) ensayos clínicos aleatorizados controlados (ECA); 2) pacientes con APs; 3) cualquier intervención encaminada al control de peso, y 4) evaluación de la actividad de la APs. Se evaluaron los riesgos de sesgos según la escala Cochrane.
ResultadosDe 215 artículos identificados, solo 2 ECA cumplieron los criterios de inclusión, uno de ellos en formato abstract. Ambos tenían riesgos de sesgos moderados. Los pacientes que lograban perder peso, por cualquier método, mostraban menores niveles de actividad e inflamación. El porcentaje de pérdida de peso correlaciona moderadamente con cambios en medidas de inflamación.
ConclusiónLa pérdida de peso en APs podría asociarse a menor inflamación, si bien la evidencia que lo apoya es limitada.
To evaluate the association between weight loss and changes in disease activity in patients with psoriatic arthritis (PsA).
MethodsWe performed a systematic review of the literature, with searches in Medline, Embase and Cochrane Central Library from inception until April 2015. Inclusion criteria: 1) randomized controlled trials (RCT); 2) PsA patients; 3) interventions were any intervention aimed at weight control; and 4) a PsA activity-related outcome measure was evaluated. Risks of bias were assessed by the Cochrane Collaboration scale.
ResultsOf the 215 articles identified, only 2 RCT met the inclusion criteria, 1 in abstract format. Both showed moderate risk of bias. Patients who managed to lose weight—by any method—had better results in terms of activity and inflammation. The percentage of weight loss correlated moderately with changes in inflammatory outcomes.
ConclusionWeight loss in PsA could be associated with less inflammation; however, the evidence to support this is limited.
La prevalencia de sobrepeso y obesidad en personas con psoriasis y artritis psoriásica (APs) es mayor que en la población general1,2. A su vez, se ha visto que la obesidad puede ser un factor de riesgo para el desarrollo de enfermedad psoriásica3-6, así como de mayor actividad y gravedad. Esto podría explicarse a través del estado proinflamatorio que la acumulación de tejido adiposo provoca, con alteración de la expresión de citocinas, tales como el factor de necrosis tumoral (TNF) α, la interleucina (IL)-6 y adipocinas (leptina, adiponectina)7-10. Los pacientes con psoriasis que además son obesos tienen una enfermedad cutánea más grave y responden peor a los tratamientos11,12. En pacientes con APs, la obesidad también predice mala respuesta articular al tratamiento, sea este biológico o no13,14. Se ha visto que la restricción calórica reduce los niveles de citocinas inflamatorias en sujetos obesos15,16 y que puede mejorar sensiblemente la psoriasis17; sin embargo, no queda claro el efecto sobre la artritis. Con el fin de apoyar una serie de recomendaciones para el manejo de la APs, se decidió realizar una revisión sistemática, cuyo objetivo fue evaluar el efecto de la pérdida de peso en la actividad de la enfermedad y en la respuesta al tratamiento en pacientes con APs.
MétodosSe llevó a cabo una revisión sistemática de la literatura. Para ello se diseñó una estrategia de búsqueda en las bases de datos bibliográficas Medline (desde 1960), Embase (desde 1980) y la biblioteca Cochrane Central desde el inicio hasta abril del 2015. La búsqueda incluyó términos MeSH y texto libre (tabla 1). La búsqueda se limitó a estudios en seres humanos y a estudios publicados en inglés y español. Además, se realizó una búsqueda manual en la bibliografía de los artículos incluidos y en los congresos americano y europeo de Reumatología de los 2 últimos años.
Estrategia de búsqueda
| #1 ‘psoriatic arthritis’ |
| #2 ‘psoriatic arthritis’/exp |
| #3 #1 OR #2 |
| #4 ‘diet’ |
| #5 ‘weight control’ |
| #6 ‘weight reduction’ |
| #7 ‘weight reduction’/exp |
| #8 ‘antiobesity agents’ |
| #9 ‘antiobesity agents’ |
| #10 ‘anti obesity agents’ |
| #11 ‘metformin’ |
| #12 ‘sibutramine’ |
| #13 ‘orlistat’ |
| #14 ‘xenical’ |
| #15 ‘meridia’ |
| #16 ‘glucophage’ |
| #17 ‘low calorie diet’ |
| #18 ‘low fat diet’ |
| #19 nutrition$ AND (intervention$ OR education$) |
| #20 diet$ AND (intervention$ OR education$) |
| #21 ‘weight loss’ AND (intervention$ OR education$) |
| #22 weight AND reduction |
| #23 ‘weight reduction’/exp |
| #24 (#4 - #23) OR |
| #25 #3 AND #24 |
Dos revisoras (RA, LC) examinaron de forma independiente los títulos y los resúmenes de los artículos recuperados para los criterios de selección. A continuación, se recogieron los datos de los estudios seleccionados.
Se incluyeron únicamente: 1) ensayos clínicos aleatorizados (ECA), en los que 2) la población a tratar fuesen pacientes con APs, 3) la intervención fuera cualquier medida encaminada al control de peso (dieta, ejercicio, fármacos, cirugías, etc.), 4) se comparara frente a no realización de intervención alguna o control, y 5) se realizara alguna medida de evaluación de la actividad, periférica (recuento articular 66/68, DAS28, DAS, VAS, índices de entesitis) o axial (ASDAS, BASDAI, BASFI, BASMI), reactantes de fase aguda (VSG y proteína C reactiva [PCR]) o de imagen, u otros índices de eficacia documentado en el artículo.
Todos los artículos obtenidos se revisaron en detalle con apoyo de hojas de recogida de datos confeccionadas ad hoc. Se recogieron todos los datos de la descripción de la muestra y de los resultados específicos del control de peso sobre la actividad inflamatoria. Se evaluaron así mismo los riesgos de sesgos mediante los dominios propuestos por la Colaboración Cochrane18.
Se realizó un análisis cualitativo de la información recogida por tipo de estudio y población estudiada, por calidad y por resultados específicos, así como una evaluación cualitativa de la heterogeneidad.
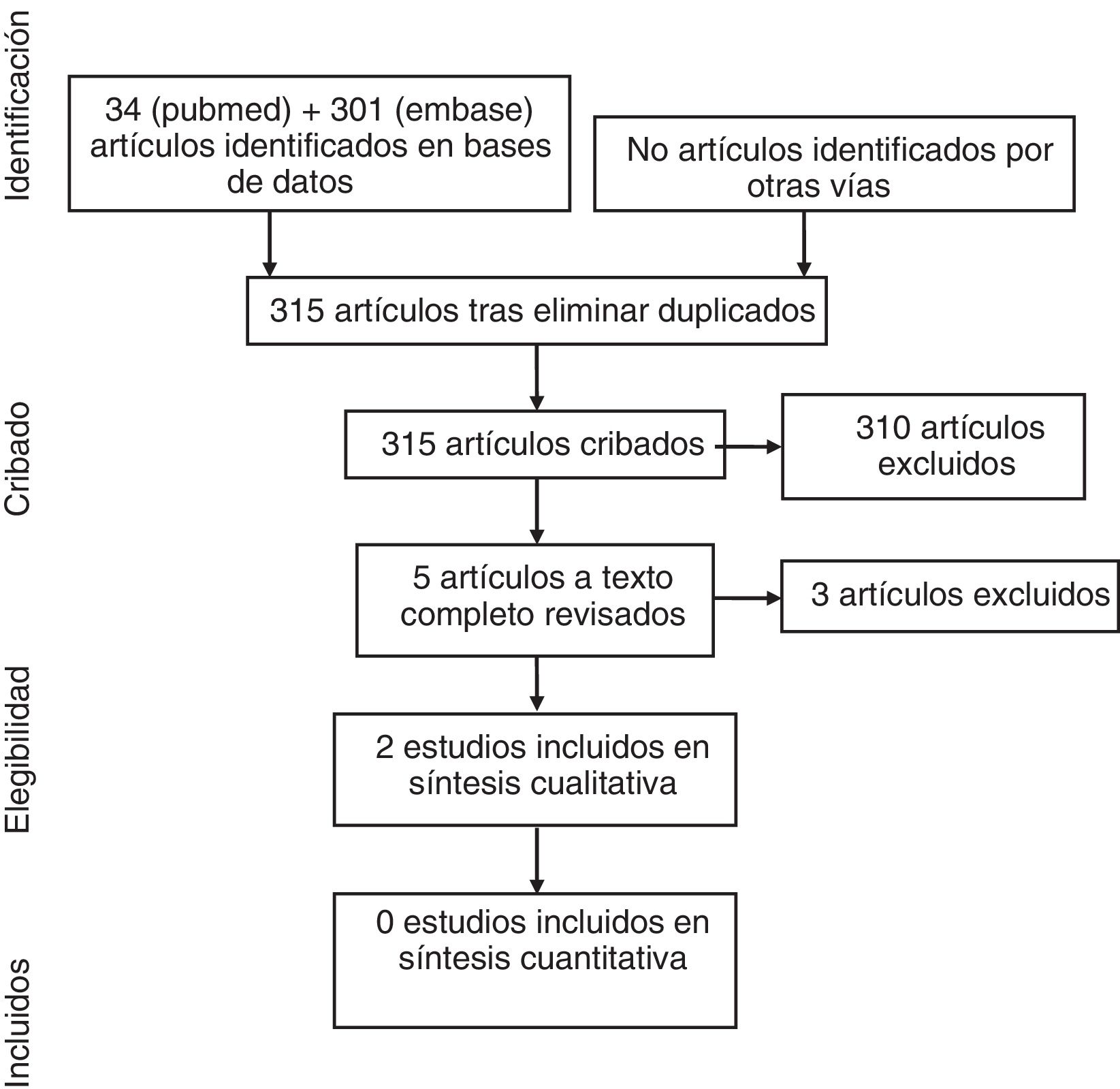
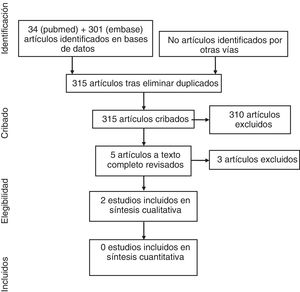
ResultadosEn el diagrama de la figura 1 se detallan los resultados de la búsqueda. En la estrategia de búsqueda se identificó un total de 215 artículos, de los cuales 5 fueron seleccionados para una revisión en detalle tras la exclusión de 210 referencias por título y resumen. Finalmente, 3 artículos fueron excluidos (en la tabla 2 se detallan los estudios excluidos y los motivos de su exclusión).
Estudios excluidos y razones
| Autor, año | Razón para exclusión |
|---|---|
| Schett et al., 2014 | No analiza el efecto del control del peso. Es un ensayo clínico aleatorizado a 24 semanas que evalúa el impacto del peso e índice de masa corporal basales sobre la respuesta clínica (ACR 20 y HAQ) a apremilast en APs, no el cambio en el peso |
| Di Minnet et al., 2012 | Abstract a congreso. Evalúa el efecto de la reducción de peso mediante dieta, para alcanzar la actividad mínima en pacientes con sobrepeso/obesos con APs, que inician tratamiento anti-TNF. Se excluye porque posteriormente se ha publicado en 2014 y es el incluido en la revisión sistemática |
| Sullivan et al., 2013 | Ensayo abierto a 24 semanas que analiza el efecto del análogo GLP-I (liraglutida) en la actividad en 15 pacientes con artritis inflamatoria (11 artritis reumatoide; 4 APs) y diabetes mellitus tipo 2. No aporta datos por separado y el tamaño muestral es demasiado pequeño |
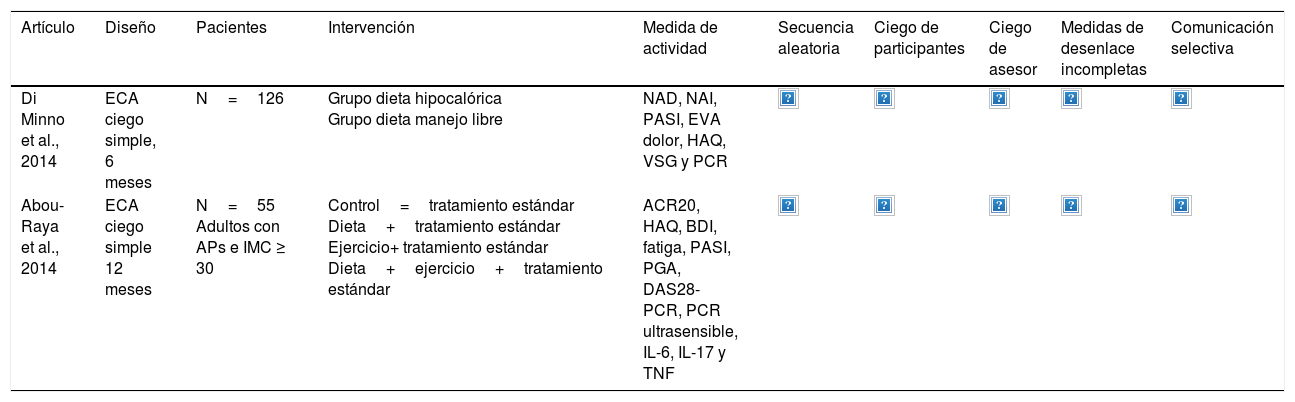
En la tabla 3 se presentan los datos de los 2 artículos incluidos finalmente en el análisis13,19. Se trata de 2 ECA, uno de ellos en formato abstract. Los riesgos de sesgos son moderados en el estudio de di Minno et al. y altos en el de Abou-Raya et al., en este último por falta de información.
Características de los estudios incluidos
| Artículo | Diseño | Pacientes | Intervención | Medida de actividad | Secuencia aleatoria | Ciego de participantes | Ciego de asesor | Medidas de desenlace incompletas | Comunicación selectiva |
|---|---|---|---|---|---|---|---|---|---|
| Di Minno et al., 2014 | ECA ciego simple, 6 meses | N=126 | Grupo dieta hipocalórica Grupo dieta manejo libre | NAD, NAI, PASI, EVA dolor, HAQ, VSG y PCR | |||||
| Abou-Raya et al., 2014 | ECA ciego simple 12 meses | N=55 Adultos con APs e IMC ≥ 30 | Control=tratamiento estándar Dieta+tratamiento estándar Ejercicio+ tratamiento estándar Dieta+ejercicio+tratamiento estándar | ACR20, HAQ, BDI, fatiga, PASI, PGA, DAS28-PCR, PCR ultrasensible, IL-6, IL-17 y TNF |
Los colores indican la adecuación a los determinados dominios de la escala de sesgos.
ACR20: American College of Rheumatology; APs: artritis psoriásica; BDI: inventario de depresión Beck's; DAS28-CRP: Disease activity score-PCR; EVA: escala visual analógica; HAQ: Health Assessment Questionnaire; IMC: índice de masa corporal; NAD: número de articulaciones dolorosas; NAI: número de articulaciones inflamadas; PASI: Psoriasis Area Severity Index; PCR: proteína C reactiva; PGA: Physician's Global Assessment; VSG: velocidad de sedimentación globular.
En el estudio de di Minno et al.13 se aleatorizó a pacientes con APs y obesidad a recibir una dieta hipocalórica basada en una ingesta de grasa del 30-35% de la ingesta total diaria, aumento de la fibra y pescado al menos un día a la semana, o una dieta libre, recibiendo unos consejos nutricionales. Al mismo tiempo, y por falta de control sintomático, los pacientes iniciaban tratamiento con fármacos anti-TNF, no pudiendo haber recibido tratamiento biológico previamente para poder entrar en el estudio. El 58,7% logró una pérdida de peso ≥ 5%, ocurriendo esta más frecuentemente en el grupo de dieta hipocalórica (49 de 63) que en el de dieta libre (25 de 63; p < 0,001). Con ambas dietas se logró una mejoría significativa en los recuentos articulares, de entesis, PASI, HAQ, EVA, PCR y VSG a los 6 meses. Los pacientes con una pérdida peso superior al 5% mostraron con mayor frecuencia actividad mínima de la enfermedad según Coates y Helliwell20 (50%) que los que no lograron tanta pérdida de peso (23%; odds ratio=4,20; intervalo de confianza del 95%, 1,82 a 9,66; p<0,001).
El estudio de Abou-Raya et al.19 pretendía evaluar si la pérdida de peso a través del ejercicio o la dieta, o ambos, es más eficaz que solo el tratamiento estándar (antiinflamatorios no esteroideos, fármacos modificadores de enfermedad, anti-TNF-α) en la mejoría de los síntomas (dolor, función física, fatiga, depresión) e inflamación sistémica en pacientes adultos obesos con APs. La reducción media de peso corporal fue del 15% en todos los grupos de intervención frente al 2% en grupo control p<0,001. En el grupo de ejercicio se observó una mejoría significativa en ACR20, HAQ, BDI, fatiga, PASI y PGA, y en el grupo de la dieta una mejora significativa en ACR20 y respuesta PASI75 y unas reducciones significativas en los marcadores inflamatorios sistémicos. En el grupo dieta y ejercicio se observó una mejoría significativa en ACR20, HAQ, depresión, fatiga, DAS28-CRP, PASI, valoración global del médico, junto con reducciones significativas en los niveles séricos de PCR ultrasensible, IL-6, IL-17 y TNF en comparación con los controles. Se encontró una correlación moderada entre el porcentaje de pérdida de peso y la reducción en el PASI (r = 0,587).
DiscusiónNumerosos estudios han descrito la elevada prevalencia de factores de riesgo cardiovascular, como hipertensión arterial, obesidad, diabetes mellitus y dislipidemia, en pacientes con APs21-27. Es más, la evidencia indica que la obesidad, la resistencia a la insulina, la psoriasis y la APs pueden compartir una predisposición común en términos de inflamación de bajo grado24. También se ha visto que el índice de masa corporal se asocia en APs a peor respuesta al tratamiento28. Lo que no estaba tan claro es si la reducción del peso podría tener un efecto sobre la actividad. En nuestra revisión sistemática hemos encontrado 2 estudios que apoyan esta hipótesis, uno con un nivel de evidencia alto y otro con un nivel algo menor por encontrarse aún en formato de resumen solo.
Existen estrechos vínculos entre el sistema metabólico y el sistema inmunológico29. Por ejemplo, la IL-6 es una citocina proinflamatoria clave que puede estimular el hipotálamo, que se asocia con la obesidad central, la hipertensión y la resistencia a la insulina e induce la producción de la PCR30. Existen además datos de que la restricción calórica disminuye los niveles de PCR y TNF-α15, por lo que los pacientes sometidos a una dieta de 1.500 calorías/día pueden tener descensos en los niveles de PCR por este motivo y no solo por una disminución en su actividad inflamatoria. Esto podría justificar el efecto observado sobre la actividad en los estudios.
Otros factores podrían ser los que tengan un efecto sobre el peso y sobre la actividad. Por ejemplo, en el estudio de di Minno et al., un 20% de los pacientes estaban recibiendo tratamiento crónico con hipoglucemiantes orales y es conocida la acción que sobre el peso corporal pueden tener los agonistas del glucagón péptido-1, la metformina y la sulfonilurea; además, también se iniciaba el tratamiento con anti-TNF. Si bien los pacientes estaban con dosis estables de hipoglucemiantes y todos iniciaban anti-TNF, no se puede descartar del todo que el efecto del peso sobre la actividad se debiera en parte a estos otros tratamientos. Incluso se podría considerar que los pacientes más adherentes a la dieta o al ejercicio sean también los más adherentes a los tratamientos31.
Nuestra revisión se ha visto limitada por el bajo número de estudios publicados y por la calidad intermedia de los mismos. La hipótesis de que la pérdida de peso en APs podría llevar aparejada una reducción de la actividad, aunque indicativa, se sustenta únicamente en 2 estudios aleatorizados, uno de ellos solo comunicado en forma de abstract, por lo que concluimos que aún merece ser investigada en más profundidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónMSD.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.