1) Revisar sistemática y críticamente la evidencia sobre eficacia y seguridad de la terapia combinada con fármacos modificadores de la enfermedad (FAME) sintéticos en la artritis reumatoide (AR); 2) Emitir recomendaciones prácticas sobre su uso.
MétodosSe realizó una revisión sistemática de la literatura con una estrategia de búsqueda bibliográfica sensible en Medline, Embase y Cochrane Library. Se seleccionaron ensayos clínicos aleatorizados que analizasen la eficacia y/o seguridad de 1) la terapia combinada con FAME sintéticos comparada con la terapia secuencial con FAME sintético en la AR de inicio; y 2) la combinación metotrexato+leflunomida o la triple terapia de FAME sintéticos en la AR establecida refractaria a FAME sintéticos. Dos revisores realizaron la primera selección por título y abstract y 11 la selección tras lectura en detalle y la recogida de datos. La calidad se evaluó con la escala de Jadad. En una reunión de grupo nominal en base sus resultados se consensuaron una serie de recomendaciones.
ResultadosFinalmente no se incluyó ningún artículo en la RSL. Del análisis de los artículos revisados se encontró la eficacia en las AR de inicio del tratamiento precoz con FAME sintéticos siguiendo una estrategia «treat to target» y en AR establecidas refractarias a FAME sintéticos la de la terapia combinada con FAME sintéticos. Con ello se generaron 5 recomendaciones sobre la terapia combinada con FAME sintéticos.
ConclusionesEstas recomendaciones pretenden facilitar la toma de decisiones con el uso de la terapia combinada con FAME sintéticos en la AR.
1) To systematically and critically review the evidence of combined therapy with synthetic disease-modifying antirheumatic drugs (DMARD) in rheumatoid arthritis (RA); 2) To design practical recommendations on their use.
MethodsA systematic literature review (SLR) was performed with a sensitive bibliographic search strategy in Medline, EMBASE and Cochrane Library. We selected randomized clinical trials that analyzed the efficacy and/or safety of 1) combined therapy of synthetic compared with sequential therapy of synthetic DMARD in early RA; and 2) combination of methotrexate+leflunomide or triple therapy with synthetic DMARD in established RA refractory to synthetic DMARD. Two reviewers made the first selection by title and abstract and 11 performed the selection after detailed review of the articles and data collection. The quality of the studies was evaluated with the Jadad scale. Based on the results, related recommendations were agreed upon in a nominal group meeting.
ResultsUltimately, no articles were included in the SLR. The analysis of the reviewed articles demonstrated the effectiveness of the treatment with synthetic DMARD following a “treat to target” strategy in early RA patients, and of combination therapy of synthetic DMARD in established RA refractory to synthetic DMARD. This resulted in 6 recommendations concerning combination therapy with synthetic DMARD.
ConclusionsThese recommendations aim to facilitate decision-making with the use of combined therapy with DMARD in RA.
En los últimos años el manejo de la artritis reumatoide (AR) ha cambiado enormemente. Nuevos fármacos y estrategias de tratamiento han cambiado completamente el pronóstico de estos pacientes1–4. Los fármacos modificadores de la enfermedad (FAME) sintéticos como el metrotexato (MTX) o la leflunomida (LEF) han sido y son terapias fundamentales en el manejo de estos pacientes5–7. Pero, con los nuevos hallazgos en la patogenia de la enfermedad y con la aparición de las terapias biológicas las recomendaciones sobre su uso se han ido modificando8–10.
Por ejemplo, en la última actualización del documento de consenso EULAR sobre el manejo de la AR (año 2016)1, aunque con mucha controversia, finalmente se excluyó una recomendación de la edición de 201311, que sugería en las AR naïve a FAME, independientemente del uso de corticoides concomitantes, se debía usar FAME sintéticos convencionales en monoterapia o en combinación. Son diferentes los motivos para excluir la terapia combinada definitivamente en el tratamiento de inicio, desde el mayor efecto cuando se asocian con biológicos en comparación con la combinación entre ellos al mayor número de acontecimientos adversos comparados con la monoterapia. En el mismo documento, y, en relación con los pacientes refractarios o con toxicidad al tratamiento inicial, si no presentan factores de mal pronóstico la terapia combinada con MTX, LEF o salazopirina (SSZ) es una opción recomendada, y señalan que la combinación de los 3 es la más frecuente.
Sin embargo, incluso teniendo esto presente, pueden persistir cuestiones no resueltas. Por ejemplo, en relación con el uso de la terapia combinada con FAME sintéticos, aunque se aducen argumentos en contra, ¿realmente son suficientes para excluir esta modalidad de tratamiento en la AR de inicio? También, en el caso de las AR establecidas refractarias al tratamiento inicial y sin factores de mal pronóstico, ¿qué terapia combinada es la más adecuada?
Por otro lado, el proyecto NEXUS es una actividad que se realiza anualmente en la que, en base a la mejor evidencia y experiencia posible, se trata de dar respuesta a cuestiones en la AR que están poco claras. Por ello, y teniendo en cuenta todo lo comentado anteriormente, y en el contexto de este proyecto, el objetivo de esta revisión sistemática de la literatura (RSL) fue el de evaluar algunos aspectos sobre la eficacia y seguridad de la terapia combinada con FAME sintéticos en la AR, y con ello emitir una serie de recomendaciones prácticas que sirvan de guía a los clínicos en la práctica diaria.
MétodosProyecto NEXUSEsta publicación forma parte del proyecto NEXUS. Este está liderado por 2 coordinadores nacionales (expertos reumatólogos), y está compuesto por 8 grupos de trabajo cada uno con un coordinador regional y 2 o 3 revisores (dependiendo del grupo), para un total de 22 revisores. Cada año se analizan distintos temas de interés en el ámbito de la AR. En la edición de 2017-2018 han sido el uso de corticoides y de la terapia combinada con FAME sintéticos en la AR. En esta publicación describimos la RSL referente a la pregunta sobre terapia combinada en la AR. La Sociedad Española de Reumatología garantiza que la metodología usada es adecuada, pero no avala las conclusiones puesto que la Sociedad Española de Reumatología tiene posiciones oficiales al respecto.
Protocolo de la revisiónEn un primer momento, uno de los coordinadores nacionales generó las siguientes preguntas clínicas para que fueran contestadas mediante una RSL: «En pacientes con AR de inicio, ¿es mejor la terapia combinada con FAME sintéticos que la terapia secuencial con FAME sintético? En pacientes con AR establecida refractaria a tratamiento estándar de primera línea (FAME sintético), ¿es eficaz y segura la combinación MTX+LEF o la triple terapia de FAME sintéticos?». Con las mismas se definió un protocolo de la RSL.
PICO y criterios de selección de estudiosLas 2 preguntas clínicas se transformaron en preguntas PICO con el que a su vez se definieron los criterios de inclusión y exclusión. Para la primera pregunta se seleccionaron estudios que incluyesen pacientes con AR (criterios internacionales o a juicio del clínico), de inicio (≤ 2 años de evolución), adultos (≥18 años), naïve a FAME; en tratamiento con terapia combinada (doble o triple) con FAME sintético con o sin corticoides u otros fármacos adyuvantes. Como comparador, los estudios debían tener FAME sintéticos en terapia secuencial (de monoterapias o FAME que se van añadiendo).
Para la segunda pregunta se seleccionaron estudios que incluyesen pacientes con AR (criterios internacionales o a juicio del clínico), adultos (≥18 años), establecidas (> 2 años de evolución), refractarias a tratamiento estándar de primera línea (FAME sintético); en tratamiento con terapia combinada de MTX y LEF) o la triple terapia con FAME sintéticos, con o sin corticoides u otros fármacos adyuvantes.
En ambas preguntas se buscaron artículos que en sus resultados analizasen las variables de eficacia y seguridad habitualmente utilizadas en el estudio de la AR. Finalmente, solo se incluyeron estudios con los siguientes diseños: metaanálisis, revisiones sistemáticas, y ensayos clínicos aleatorizados (ECA). Se excluyeron estudios en animales y de ciencia básica.
Estrategia de búsquedaCon la ayuda de una experta documentalista se generaron las estrategias de búsquedas para las distintas bases de datos. Se utilizaron términos Mesh y términos en texto libre. Como límites se buscaron solo artículos en humanos, en inglés o español.
Se han cribado las siguientes bases de datos bibliográficas (desde su inicio hasta julio de 2017): Medline, Embase y Cochrane Library. Dado el volumen de citas que se recuperó se decidió no revisar la literatura gris de los principales congresos de reumatología, nacionales e internacionales. Posteriormente, se realizó una búsqueda manual secundaria de la bibliografía de los artículos que finalmente se incluyeron. En el material suplementario se muestran las estrategias de búsqueda así como el número de citas que se recuperaron.
Todas citas resultantes de las búsquedas se introdujeron en el programa EndNote para facilitar su gestión.
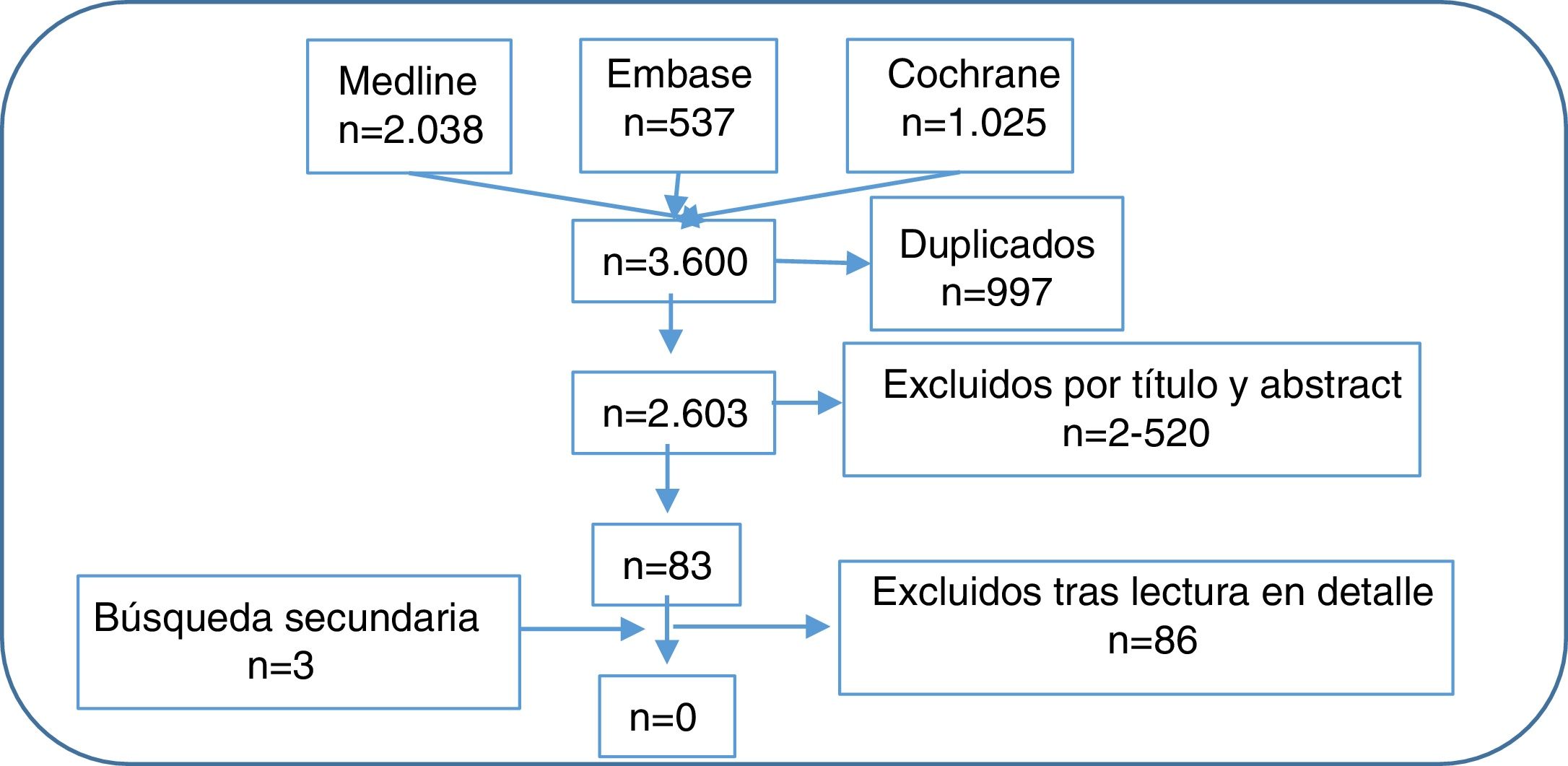
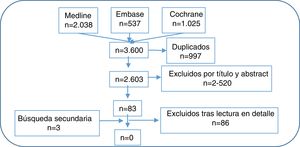
Selección de artículosA continuación, 2 revisores realizaron la primera selección de artículos con su lectura por título y abstract, siguiendo los criterios de inclusión y exclusión, de forma independiente. En caso de discrepancia, una tercera revisora se encargó de decidir. Posteriormente, 11 revisores realizaron la segunda selección de artículos con su lectura en detalle, también de forma independiente y aplicando los mismos criterios de inclusión y exclusión. Para ello el número de citas recuperadas se distribuyó equitativamente entre los 10 revisores. En caso de discrepancia, el otro revisor de la fase anterior resolvió el problema. En la figura 1 mostramos el diagrama de flujo del proceso de selección de los artículos y en el material suplementario las características de los estudios incluidos y excluidos.
Recogida de datos y evaluación de la calidad de los estudiosLos 11 revisores así como uno de los revisores de la primera fase de selección recogieron los datos de los estudios incluidos utilizando plantillas específicas prediseñadas para esta revisión. Para evaluar la calidad metodológica de los estudios incluidos, se utilizó la escala de Jadad12. De nuevo, en casos de discrepancia el otro revisor de la fase anterior resolvió el problema.
Análisis y presentación de los datosSe crearon tablas de evidencia y de resultados en las que se describen las principales características y resultados de los estudios incluidos. Algunos de estos se expresan como número y porcentaje (%), media y desviación estándar, mediana y rango interquartílico (p25-p75), otros como odds ratio, riesgo relativo o hazard ratio y sus intervalos de confianza (IC) al 95%. Solo se valoró la posibilidad de realizar un metaanálisis en caso de homogeneidad.
Reunión de grupo nominal y generación de las recomendacionesEn una reunión de grupo nominal de 2 días a la que asistieron todos los integrantes del proyecto NEXUS, se presentaron y discutieron los resultados de la RSL. Con ello se consensuaron una serie de recomendaciones. Para cada una de las recomendaciones, y con asistencia de la metodóloga se les asignó un nivel de evidencia (NE) y un grado de recomendación (GR) según las recomendaciones para medicina basada en la evidencia del Center for Evidence Based Medicine de Oxford13.
ResultadosDe 2.603 citas recuperadas tras el primer proceso de selección se evaluaron en detalle 83 y otras 3 más por búsqueda secundaria. Finalmente, tras su lectura en detalle, no se encontraron ECA que directamente contestaran las 2 preguntas (ver estudios excluidos en el material suplementario). A continuación, comentamos algunos de los estudios excluidos en esta RSL que, aunque no cumplieron criterios para ser incluidos, pueden aportar datos e ideas relevantes en relación con las 2 preguntas de investigación. En la tabla 1 enumeramos las principales conclusiones y recomendaciones.
Conclusiones principales y recomendaciones de la revisión
| Conclusiones | |
|---|---|
| En AR de reciente comienzo… | |
| 1 | Un tratamiento precoz siguiendo una estrategia «treat to target» mejora los parámetros de actividad, daño, función y calidad de vida a corto, medio y se mantiene a largo plazo (NE 1b; GR B) |
| En pacientes con AR establecida refractaria a FAME sintéticos… | |
| 1 | La adición de LEF es mejor que MTX en monoterapia para mejorar la actividad, función y calidad de vida a corto-medio plazo, sin diferencias claras en relación con los AA (número y AA graves) (NE 1b; GR B) |
| 2 | La combinación MTX+ETN parece ser superior a la combinación de FAME sintéticos en la mejoría de actividad y función a corto plazo, especialmente cuando se analizan las mejores respuestas (remisión, ACR70) (NE 1b; GR B) |
| 3 | No se puede demostrar la superioridad de MTX+LEF frente a MTX+HCQ o MTX+SSZ en pacientes con AR establecida refractaria a MTX, a corto plazo (NE 1b; GR B) |
| 4 | La combinación de FAME sintéticos es similar a MTX+RTX (a dosis de 500mg iv 2 dosis) para mejorar la actividad y función a corto-medio plazo, sin diferencias claras en relación con los AA (número y AA graves) (NE 1b; GR B) |
| 5 | La triple terapia con MTX+SSZ+HCQ mejora parámetros de actividad y daño radiográfico (NE 1b; GR B) |
| 6 | La eficacia de la triple terapia con FAME sintéticos es comparable a la combinación ETN+MTX (NE 1b; GR B) |
| 7 | Los AA de la triple terapia con MTX+SSZ+HCQ son los esperables por el uso de este tipo de fármacos (NE 1b; GR B) |
| Recomendaciones | |
| 1 | En pacientes con AR de inicio se recomienda seguir una estrategia «treat to target» con el objetivo de alcanzar la remisión lo antes posible (NE 1b; GA A) |
| 2 | En pacientes con AR establecida refractaria a tratamiento de primera línea con FAME sintético se recomienda tener en cuenta la opción de utilizar la combinación MTX y LEF, dependiendo del contexto clínico y criterio médico (NE 1b; GR B) |
| 3 | Se recomienda seguir con la gestión del riesgo habitual si se pauta la combinación MTX+LEF (NE 5; GR D) |
| 4 | En pacientes con AR establecida refractaria a tratamiento de primera línea con FAME sintético se recomienda tener en cuenta la opción de utilizar la triple terapia con MTX+HCQ+SSZ, dependiendo del contexto clínico y criterio médico (NE 1b; GR B) |
| 5 | Se recomienda una estrecha gestión del riesgo en los pacientes con AR a los que se les paute la triple terapia con MTX+HCQ+SSZ (NE 5; GR D) |
AA:acontecimiento adverso; ACR:American College of Rheumatology; AR:artritis reumatoide; ETN:etanercept; FAME:fármacos modificadores de la enfermedad; GR:grado de recomendación; HCQ:hidroxicloroquina; iv:intravenoso; LEF:leflunomida; mg:miligramo; MTX:metrotexato; NE:nivel de evidencia; SSZ:salazopirina.
El estudio BeSt fue un estudio diseñado para analizar, en la AR de inicio, el efecto de distintas estrategias de tratamiento. Los pacientes eran asignados a un uno de los 4 grupos, y, si no había respuesta, rápidamente se tomaba una decisión terapéutica14–26. Así, los pacientes cambiaban de terapia (dentro de su grupo) e incluso pasar de un brazo de tratamiento a otro. Estos grupos fueron los siguientes: grupo 1 monoterapia secuencial, grupo 2 terapia combinada secuencial (en escalada, es decir, se inicia con monoterapia y si no hay respuesta suficiente se añade otro fármaco), grupo 3 terapia combinada de inicio con MTX+SSZ+prednisona (dosis altas con disminución de dosis rápida), y el grupo 4 terapia combinada MTX+infliximab (IFX). Se disponen datos de hasta 10 años de seguimiento, en los que se evaluaron la actividad de la AR, la función, el daño estructural, la calidad de vida y la seguridad.
En el estudio BeSt, al año17, los grupos tratados con MTX+SSZ+prednisona y MTX+IFX, mostraron un mejor control de la actividad, función, progresión del daño radiográfico que los otros grupos aunque también presentaron más acontecimientos adversos (AA), sin observarse diferencias en la densidad mineral ósea. Progresivamente, en los años del 2-516,19,20,26, estas diferencias entre los grupos prácticamente desaparecieron, y en concreto a los 5 años20, el 48% de los pacientes estaban en remisión clínica (DAS28<1,6) y el 14% en remisión libre de fármaco, independientemente del grupo de tratamiento inicial. A partir de los 5 años se publicó que el daño radiográfico fue menor en aquellos que iniciaron el tratamiento en alguno de los grupos de combinación20. Y, a 10 años, se realizó un subanálisis de los pacientes ACPA-negativo, objetivándose que el uso de inicio de MTX+SSZ+prednisona y MTX+IFX fue más eficaz, en comparación con el MTX en monoterapia.
Pregunta 2. En pacientes con AR establecida refractaria a tratamiento estándar de primera línea (FAME sintético), ¿es eficaz y segura la combinación MTX+LEF o la triple terapia de FAME sintéticos?Se han encontrado 3 ECA27–29, de buena calidad (uno realmente son datos agregados de 2 estudios). Incluyen casi 1.000 pacientes con AR, la mayoría establecida (duración media de 5 a 18 años) y refractarios a FAME sintéticos convencionales, sobre todo MTX (tabla 2). El MTX se pautó a dosis de 10-20 miligramos (mg)/semana y la LEF entre 10-20mg/día. Se comparó con MTX en monoterapia, MTX+etanercept (ETN), MTX+hidroxicloroquina (HCQ) y rituximab (RTX). Todos los pacientes incluidos podían tomar prednisona (hasta 10mg/d). Estos ECA analizaron la eficacia (actividad, función, calidad de vida) y seguridad de esta combinación hasta las 24 semanas.
Principales características y resultados de los estudios incluidos con terapia combinada de MTX y LEF
| Estudio | Población | Intervención | Eficacia | Seguridad | |
|---|---|---|---|---|---|
| 1 | Fleischmann_2014 (datos agregados APPEAL+Latin RA), durac. 16 sem., Jadad 4 | -Grupo ETN+MTX (n=478): 89% mujeres, edad media 48 a, DAS 28 medio 6,4, durac. AR 7 a-Grupo HCQ+MTX (n=81): 86% mujeres, edad media 49 a, DAS 28 medio 6,6, durac. AR 8 a-Grupo SSZ+MTX (n=95): 91% mujeres, edad media 47 a, DAS28 medio 6,6, durac. AR 7 a-Grupo LEF+MTX (n=69): 89% mujeres, edad media 49 a, DAS 28 medio 6,2, durac. AR 8 a | -Grupo ETN+MTX-Grupo HCQ+MTX-Grupo SSZ+MTX-Grupo LEF+MTX | -% pacientes con ACR20Grupo ETN+MTX=82%Grupo HCQ+MTX=59% (p<0,001 vs. ETN+MTX)Grupo SSZ+MTX=54% (p<0,01 vs. ETN+MTX)Grupo LEF+MTX=62% (p<0,001 vs. ETN+MTX)-% pacientes con ACR50Grupo ETN+MTX=56%Grupo HCQ+MTX=31% (p<0,001 vs. ETN+MTX)Grupo SSZ+MTX=20% (p<0,001 vs. ETN+MTX)Grupo LEF+MTX=38% (p<0,05 vs. ETN+MTX)-% pacientes con ACR70Grupo ETN+MTX=24%Grupo HCQ+MTX=12% (p<0,01 vs. ETN+MTX)Grupo SSZ+MTX=6% (p<0,001 vs. ETN+MTX)Grupo LEF+MTX=7% (p<0,05 vs. ETN+MTX)-% pacientes con baja actividad DAS28Grupo ETN+MTX=39%Grupo HCQ+MTX=20% (p<0,01 vs. ETN+MTX)Grupo SSZ+MTX=14% (p<0,01 vs. ETN+MTX)Grupo LEF+MTX=20% (p<0,01 vs. ETN+MTX)-% pacientes con remisión DAS28Grupo ETN+MTX=18%Grupo HCQ+MTX=7% (p<0,01 vs. ETN+MTX)Grupo SSZ+MTX=4% (p<0,001 vs. ETN+MTX)Grupo LEF+MTX=9% (no se muestra la p)-% pacientes con baja actividad CDAIGrupo ETN+MTX=54%Grupo HCQ+MTX=30% (p<0,01 vs. ETN+MTX) (p<0,05 vs. SSZ+MTX)Grupo SSZ+MTX=18% (p<0,001 vs. ETN+MTX)Grupo LEF+MTX=42% (p<0,001 vs. SSZ+MTX)-% pacientes con remisión CDAIGrupo ETN+MTX=7%Grupo HCQ+MTX=2%Grupo SSZ+MTX=3%Grupo LEF+MTX=3% (no se muestra la p)-Δ DAS28:Grupo ETN+MTX=-2,7Grupo HCQ+MTX=-2,0 (p<0,001 vs. ETN+MTX)Grupo SSZ+MTX=-1,5 (p<0,001 vs. ETN+MTX)Grupo LEF+MTX=-1,8 (p<0,001 vs. ETN+MTX)-Δ CDAI:Grupo ETN+MTX=-26,7Grupo HCQ+MTX=-21,1 (p<0,001 vs. ETN+MTX)Grupo SSZ+MTX=-17,4 (p<0,001 vs.ETN+MTX)Grupo LEF+MTX=-17,7 (p<0,001 vs. ETN+MTX)-Δ HAQ:Grupo ETN+MTX=-0,77Grupo HCQ+MTX=-0,47 (p<0,001 vs. ETN+MTX)Grupo SSZ+MTX=-0,48 (p<0,001 vs. ETN+MTX)Grupo LEF+MTX=-0,58 (no se muestra la p) | -No se analizan |
| 2 | Kremer_2002, ECA doble ciego, activo control, durac. 24 sem., multicen, internacional, Jadad 5 | -Grupo LFN+MTX (n=130): 76% mujeres, edad media 55 a, durac. AR 10 a-Grupo MTX+PBO (n=133): 76% mujeres, edad media 55 a, durac. AR 10 a | -MTX (15-20 mg/sem. o 10-15 mg/sem., si es la dosis máx. tolerada)+PCB-MTX+LFN 100 mg/día, 2 días → LFN 10 mg/día (si actividad, ↑ dosis a 20 mg/día)-Prednisona 10 mg/día | -% pacientes con ACR20MTX+LFN 46,2% vs. MTX+PCB 19,5%, p<0,001-% pacientes con ACR50MTX+LFN 26,2% vs. MTX+PCB 6%, p<0,001-% pacientes con ACR70MTX+LFN 10% vs. MTX+PBO 2,3%, p=0,015-Δ HAQMTX+LFN -0,42 vs. MTX+PCB -0,09, diferencia=-0,33 (IC 95% -0,44, -0,21); p<0,001-Δ SF-36 componente físicoMTX+LFN 6,8 vs. MTX+PCB 0,3, diferencia=6,5 (IC 95% 3,9, 8,7); p<0,001-Δ SF-36 componente mentalMTX+LFN=3,0 vs. MTX+PCB 1,2 (ns) | -DiarreaMTX+LFN=25,4%MTX+PCB=13,5%-Infección tracto respirat supMTX+LFN=22,3%MTX+PCB=24,1%-NáuseaMTX+LFN=16,2%MTX+PCB=11,3%-CefaleaMTX+LFN=10,0%MTX+PCB=8,3%-RashMTX+LFN=7,7%MTX+PCB=8,3%-MareoMTX+LFN=7,7%MTX+PCB=5,3%-InfeccionesMTX+LFN=40,8%MTX+PCB=51,9%-ALT >3 LSNLFN+MTX 3,8%MTX+PCB 0,8%-AST >3 LSNLFN+MTX 1,5%MTX+PCB 0,8% |
| 3 | Wijesinghe_2017, ECA, doble ciego, activo control, durac. 24 sem., multicen, nacional, Jadad 5 | -RTX+MTX (n=20): 80% mujeres, edad media 44 a, DAS28 medio 6,88, durac. AR 5 a-LFN+MTX (n=19): 95% mujeres, edad media 48 a, DAS28 medio 6,43, durac. AR 18 a | -RTX+MTX:RTX 500mg iv días 0 y 14 mes+MTX-LEF+MTX: LFN 10 mg/día vo (hasta 20 mg/día)+MTX-Todos corticoides-AINE y analgésicos permitidos | -RTX+MTX vs. LFN+MTXACR20: 85% vs. 84% (ns)ACR50: 60% vs. 64% (ns)ACR70: 35% vs. 32% (ns)No respuesta ACR: 15% vs. 16% (ns)DAS28: 3,26 vs. 3,25 (ns)DAS remisión (<2,6): 20% vs. 26% (ns)DAS baja actividad (<3,2): 40% vs. 42% (ns)DAS moderada actividad (3,2-51): 60% vs. 58% (ns)DAS alta actividad (> 5,1): 0% vs. 0%Respuesta EULAR moderada: 60% vs. 58% (ns)Respuesta EULAR buena: 40% vs. 42% (ns)NAD: 1,8 vs. 1,16 (ns)PCR: 6 vs. 3 (ns)VSG: 28,05 vs. 30,42 (ns)FR: 84 vs. 60 (ns)HAQ: 2,872 vs. 2,132 (ns) | -RTX+MTXAA graves n=5Infecciones n=4Angina inestable n=1Muertes n=0-LFN+MTXAA graves n=3Infecciones n=1Eventos cardiacos n=2Muerte n=1 |
a:años; AA:acontecimiento adverso; ACR:American College of Rheumatology; AR:artritis reumatoide; CDAI:Clinical Disease Activity Index; DAS:Disease Activity Score; durac.:duración; ECA:ensayo clínico aleatorizado; ETN:etanercept; FR:factor reumatoide; HAQ:Health Assessment Questionnaire; HCQ:hidroxicloroquina; IAM:infarto agudo de miocardio; iv:intravenoso; LEF:leflunomida; LSN:límite superior de la normalidad; máx.:máxima; mg:miligramo; MTX:metotrexato; NAD:número de articulaciones dolorosas; ns:no significativo; PBO:placebo; PCR:proteína C reactiva; RTX:rituximab; sem.:semana; SF:Short Form; SSZ:salazopirina; sup:superior; vo:vía oral; VSG:velocidad de sedimentación globular.
La combinación MTX+LEF fue estadísticamente superior a MTX en monoterapia en el ACR 20, 50 y 70, HAQ y SF-36 tras 24 semanas de tratamiento en uno de los ECA28. Sin embargo, otro estudio a 16 semanas encontró que, aunque todas las combinaciones analizadas mejoraban la actividad y función de los pacientes, la combinación MTX+ETN fue superior a MTX+LEF en muchas de las variables que evaluaron la actividad de la AR (ACR 20,5 0, 70, DAS28, CDAI) y la función. Por otro lado, en este estudio no se pudo demostrar la superioridad de MTX+LEF frente a MTX+HCQ o MTX+SSZ en estos pacientes27. En el tercer estudio incluido29, la combinación MTX+LEF fue similar a MTX+RTX (a dosis de 500mg intravenoso en 2 dosis) para mejorar la actividad (evaluada entre otras con el DAS28 y la respuesta EULAR), en los cambios en los reactantes de fase aguda y en la función de los pacientes a las 24 semanas.
En cuanto a la seguridad, se reportaron AA esperados por el uso de estos FAME, como náuseas, diarrea o elevaciones de las transaminasas27–29.
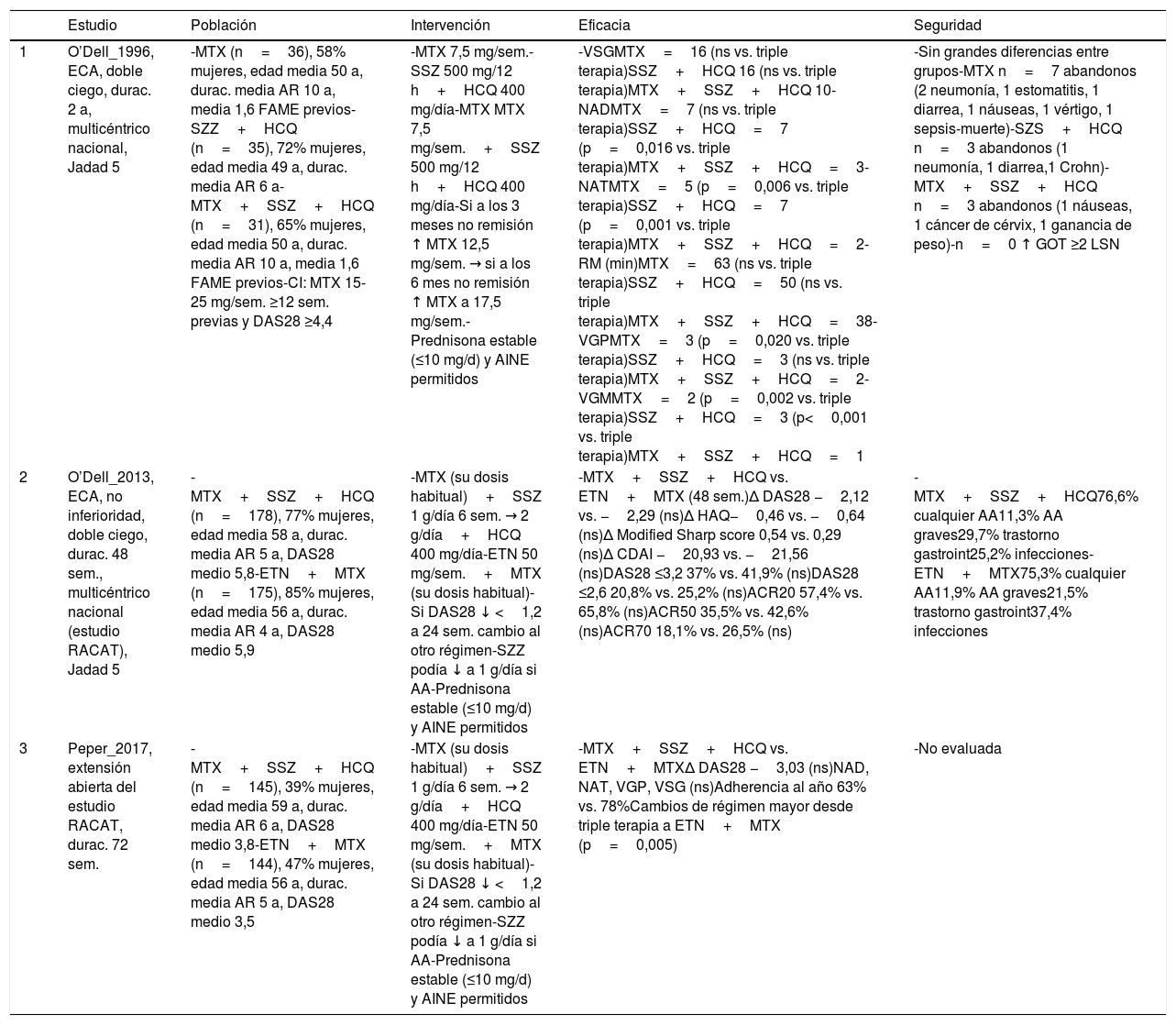
En relación a la eficacia y seguridad de la triple terapia en AR establecida y refractaria, la RSL incluyó 3 ECA de buena calidad30–33, que analizaron la triple terapia con FAME sintéticos en pacientes con AR, la mayoría establecida (tabla 3). Los ECA tuvieron una duración de 1-2 años e incluyeron más de 400 pacientes con AR de 6 a 10 años de evolución, activas (DAS28 medio de 6), refractarias a FAME sintéticos. En todos los casos la triple terapia consistió en MTX a dosis de 20mg/sem, SSZ 1-2 gramos/día e HCQ 400mg/día. Los comparadores en estos ECA fueron MTX en monoterapia, MTX+HCQ y ETN+MTX. Todos los pacientes incluidos podían tomar dosis estables de corticoides (≤ 10mg/d) y como medidas de desenlace se evaluaron la actividad de la AR (clínica y analítica), valoración global del paciente (VGP), el daño estructural y la seguridad.
Principales características y resultados de los estudios incluidos con la triple terapia
| Estudio | Población | Intervención | Eficacia | Seguridad | |
|---|---|---|---|---|---|
| 1 | O’Dell_1996, ECA, doble ciego, durac. 2 a, multicéntrico nacional, Jadad 5 | -MTX (n=36), 58% mujeres, edad media 50 a, durac. media AR 10 a, media 1,6 FAME previos-SZZ+HCQ (n=35), 72% mujeres, edad media 49 a, durac. media AR 6 a-MTX+SSZ+HCQ (n=31), 65% mujeres, edad media 50 a, durac. media AR 10 a, media 1,6 FAME previos-CI: MTX 15-25 mg/sem. ≥12 sem. previas y DAS28 ≥4,4 | -MTX 7,5 mg/sem.-SSZ 500 mg/12 h+HCQ 400 mg/día-MTX MTX 7,5 mg/sem.+SSZ 500 mg/12 h+HCQ 400 mg/día-Si a los 3 meses no remisión ↑ MTX 12,5 mg/sem. → si a los 6 mes no remisión ↑ MTX a 17,5 mg/sem.-Prednisona estable (≤10 mg/d) y AINE permitidos | -VSGMTX=16 (ns vs. triple terapia)SSZ+HCQ 16 (ns vs. triple terapia)MTX+SSZ+HCQ 10-NADMTX=7 (ns vs. triple terapia)SSZ+HCQ=7 (p=0,016 vs. triple terapia)MTX+SSZ+HCQ=3-NATMTX=5 (p=0,006 vs. triple terapia)SSZ+HCQ=7 (p=0,001 vs. triple terapia)MTX+SSZ+HCQ=2-RM (min)MTX=63 (ns vs. triple terapia)SSZ+HCQ=50 (ns vs. triple terapia)MTX+SSZ+HCQ=38-VGPMTX=3 (p=0,020 vs. triple terapia)SSZ+HCQ=3 (ns vs. triple terapia)MTX+SSZ+HCQ=2-VGMMTX=2 (p=0,002 vs. triple terapia)SSZ+HCQ=3 (p<0,001 vs. triple terapia)MTX+SSZ+HCQ=1 | -Sin grandes diferencias entre grupos-MTX n=7 abandonos (2 neumonía, 1 estomatitis, 1 diarrea, 1 náuseas, 1 vértigo, 1 sepsis-muerte)-SZS+HCQ n=3 abandonos (1 neumonía, 1 diarrea,1 Crohn)-MTX+SSZ+HCQ n=3 abandonos (1 náuseas, 1 cáncer de cérvix, 1 ganancia de peso)-n=0 ↑ GOT ≥2 LSN |
| 2 | O’Dell_2013, ECA, no inferioridad, doble ciego, durac. 48 sem., multicéntrico nacional (estudio RACAT), Jadad 5 | -MTX+SSZ+HCQ (n=178), 77% mujeres, edad media 58 a, durac. media AR 5 a, DAS28 medio 5,8-ETN+MTX (n=175), 85% mujeres, edad media 56 a, durac. media AR 4 a, DAS28 medio 5,9 | -MTX (su dosis habitual)+SSZ 1 g/día 6 sem. → 2 g/día+HCQ 400 mg/día-ETN 50 mg/sem.+MTX (su dosis habitual)-Si DAS28 ↓ <1,2 a 24 sem. cambio al otro régimen-SZZ podía ↓ a 1 g/día si AA-Prednisona estable (≤10 mg/d) y AINE permitidos | -MTX+SSZ+HCQ vs. ETN+MTX (48 sem.)Δ DAS28 −2,12 vs. −2,29 (ns)Δ HAQ−0,46 vs. −0,64 (ns)Δ Modified Sharp score 0,54 vs. 0,29 (ns)Δ CDAI −20,93 vs. −21,56 (ns)DAS28 ≤3,2 37% vs. 41,9% (ns)DAS28 ≤2,6 20,8% vs. 25,2% (ns)ACR20 57,4% vs. 65,8% (ns)ACR50 35,5% vs. 42,6% (ns)ACR70 18,1% vs. 26,5% (ns) | -MTX+SSZ+HCQ76,6% cualquier AA11,3% AA graves29,7% trastorno gastroint25,2% infecciones-ETN+MTX75,3% cualquier AA11,9% AA graves21,5% trastorno gastroint37,4% infecciones |
| 3 | Peper_2017, extensión abierta del estudio RACAT, durac. 72 sem. | -MTX+SSZ+HCQ (n=145), 39% mujeres, edad media 59 a, durac. media AR 6 a, DAS28 medio 3,8-ETN+MTX (n=144), 47% mujeres, edad media 56 a, durac. media AR 5 a, DAS28 medio 3,5 | -MTX (su dosis habitual)+SSZ 1 g/día 6 sem. → 2 g/día+HCQ 400 mg/día-ETN 50 mg/sem.+MTX (su dosis habitual)-Si DAS28 ↓ <1,2 a 24 sem. cambio al otro régimen-SZZ podía ↓ a 1 g/día si AA-Prednisona estable (≤10 mg/d) y AINE permitidos | -MTX+SSZ+HCQ vs. ETN+MTXΔ DAS28 −3,03 (ns)NAD, NAT, VGP, VSG (ns)Adherencia al año 63% vs. 78%Cambios de régimen mayor desde triple terapia a ETN+MTX (p=0,005) | -No evaluada |
a:años; AA:acontecimiento adverso; ACR:American College of Rheumatology; AINE:antiinflamatorios no esteroideos; AR:artritis reumatoide; CI:criterio de inclusión; CDAI:Clinical Disease Activity Index; durac.:duración; DAS:Disease Activity Score; ECA:ensayo clínico aleatorizado; ETN:etanercept; g:gramo; gastroint:gastrointestinales; HAQ:Health Assessment Questionnaire; HCQ:hidroxicloroquina; LSN:límite superior de la normalidad; mg:miligramo; min:minutos; MTX:metotrexato; NAD:número de articulaciones dolorosas; NAT:número de articulaciones tumefactas; ns:no significativo; sem.:semana; RM:rigidez matutina; SSZ:salazopirina; VSG:velocidad de sedimentación globular.
En el primero de los ECA32, publicado en 1996, la triple terapia fue significativamente superior a MTX en monoterapia a la hora mejorar el número de las articulaciones tumefactas, la VGP y la valoración global del médico (VGM). De igual manera, la combinación de SSZ+HCQ mejoró el número de articulaciones tumefactas, dolorosas y la VGM, a medio-largo plazo (2 años). Sin embargo, no hubo diferencias en la VSG y la duración de la rigidez matutina. Tampoco en términos de seguridad.
El estudio RACAT fue un ECA de no inferioridad, en el que la triple terapia (MTX+SSZ+HCQ) se comparó con la combinación MTX+ETN. A las 24 semanas de tratamiento, MTX+ETN fue estadísticamente superior a la triple terapia superior en el porcentaje de pacientes que alcanzaron la baja actividad-DAS28 (24,8% vs. 34,8% p=0,050), la remisión-DAS28 (12,7% vs. 21,7% p=0,030) y el ACR70 (5% vs. 16% p=0,001), sin diferencias en el resto de variables, incluida la media de reducción del DAS28 que fue la medida de desenlace principal. Sin embargo, a las 48 semanas (donde los pacientes podían asignarse a la otra rama en caso de respuesta insuficiente), no hubo diferencias estadísticamente significativas entre grupos en relación con la actividad de AR (DAS28, CDAI, respuesta ACR 20, 50, 70), el HAQ y la progresión radiográfica (tabla 3). En su extensión abierta a 72 semanas30, la adherencia al tratamiento al año fue mayor en el grupo ETN+MTX que en la triple terapia 78% vs. 63%, y los cambios de régimen fueron más numerosos desde la triple terapia a ETN+MTX que a la inversa (p=0,005). El DAS28 siguió mejorando sin diferencias estadísticamente significativas entre grupos.
En cuanto a la seguridad, se reportaron AA esperados por el uso de estos FAME, como infecciones o trastornos gastrointestinales30–32.
DiscusiónEn esta RSL hemos tratado de analizar algunos aspectos relacionados con la terapia combinada con FAME sintéticos en pacientes con AR. Una de las preguntas está relacionada con su uso en las AR de inicio (actualmente esta posibilidad no está contemplada en las últimas recomendaciones EULAR1). La otra pregunta se formuló para analizar la combinación MTX+LEF y la triple terapia de MTX+SSZ+HCQ, en pacientes con AR establecida refractarios al tratamiento estándar con FAME sintéticos.
Sin embargo, tras los procesos de selección de la RSL, no se incluyó ningún artículo que cumpliera todos los criterios de inclusión por lo que no se pudieron contestar directamente las preguntas formuladas. A pesar de ello, con el análisis de los ECA excluidos en la misma, pudimos extraer una serie de conclusiones y recomendaciones relacionadas con las preguntas.
En primer lugar, en relación con el uso de la terapia combinada con FAME sintético en la AR de inicio, hemos mostrado los resultados del estudio BeSt. Tras los diez años del mismo14–22,24–26, se puede concluir que lo realmente importante es iniciar un tratamiento precoz y tomar decisiones si no se alcanza la respuesta esperada. En este sentido, muchos estudios en la AR han demostrado que un diagnóstico y tratamiento precoz siguiendo una estrategia «treat to target» mejora claramente el pronóstico de estos pacientes3,4,34. Aunque es difícil de analizar, también se sugiere que, aunque al final el efecto de los 4 grupos es muy similar, los pacientes que comenzaron en alguno de los grupos de terapia combinada, uno incluía dos FAME sintéticos: MTX+SSZ pero también en combinación con glucocorticoides a dosis altas) tienen una respuesta más rápida (aunque el hecho de incluir corticoides a dosis altas en un grupo y terapia biológica en el otro puede influir en los resultados en gran manera), y una menor progresión radiográfica (quizá condicionada por lo anterior). A continuación, en relación con la pregunta para los pacientes con AR establecida refractaria a FAME sintéticos, la combinación MTX+LEF, y de MTX+SSZ+HCQ, al igual que plantea EULAR1, pueden ser opciones terapéuticas a valorar en este perfil de pacientes, a pesar de la escasa o nula evidencia científica acumulada. En este sentido se precisa de estudios de calidad específicos.
Por otro lado, esta RSL tiene varias limitaciones. La primera y más importante ha sido la dificultad para encontrar estudios que se ajustasen al PICO de la preguntas de investigación así como a los criterios de inclusión de la revisión, hasta tal punto que no ha sido posible encontrar ningún estudio que pudiera contestarla directamente. También, incluso teniendo presente los ECA que hemos comentado, algunos de ellos tienen tamaños muestrales muy pequeños que limitan la generabilidad de sus resultados, en otros necesitaríamos datos más a largo plazo para poder concluir con mayor seguridad. Y por ejemplo, en el estudio BeSt, los participantes podían cambiar de tratamiento dentro de su grupo y cambiar de grupo (y había 4), en este estudio también, al igual que en otros, las dosis de los FAME se podían ir modificando. Todo ello dificulta la estadística y su interpretación.
En conclusión, y aunque no hayamos podido contestar directamente a las preguntas formuladas en esta RSL, estamos convencidos que tanto los resultados, conclusiones y recomendaciones de este documento pueden contribuir muy positivamente a un mejor conocimiento del uso de FAME sintéticos en la AR.
FinanciaciónEl proyecto NEXUS estuvo financiado por Roche que no participó en la elección de los temas, ni en el desarrollo de la revisión, conclusiones o recomendaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Roche por su implicación en el proyecto NEXUS. A los integrantes del grupo NEXUS por su participación en la revisión: Mercedes Alperi, Fred Antonio Anton Pages, Nagore Fernández-Llanio Comella. Y a las Dras. Liliana Ercole y Estíbaliz Loza por su coordinación metodológica y logística.