Una de las características principales de las vasculitis asociadas a ANCA (VAA) es la ausencia de depósito de complejos inmunes en las biopsias de los tejidos afectados y de consumo de complemento. Sin embargo, en etapas tempranas de enfermedades similares producidas en modelos animales, se ha observado que el sistema del complemento puede participar en la génesis de estas patologías. Varios modelos se han desarrollado en el intento de disecar los mecanismos patogénicos de enfermedades como granulomatosis con poliangitis (Wegener) (GPA) o poliangitis microscópica siendo más exitosos en esta última, sin que hasta el momento se disponga de un modelo satisfactorio para explicar los cambios que llevan a enfermedad granulomatosa vasculítica, máxime si se asocia a anticuerpos contra proteinasa-3 (PR-3), como es el caso en la GPA. Este manuscrito revisa en forma sucinta las evidencias recientes de la presencia de complemento en biopsias de pacientes con VAA, así como modelos animales que ponen de manifiesto la participación del sistema de complemento en su patogenia.
One of the main characteristics of the vasculitis associated with antineutrophil cytoplasm autoantibodies (AASV) is the absence of immune complex deposition in biopsies of affected tissues as well as a lack of complement depletion. However, in early stages of disease induced in animal models, it has been observed that the complement system may be involved in the generation of these diseases. There are various animal models which have been developed with the aim of knowing which are the pathogenic mechanisms in granulomatosis with polyangiitis (Wegener) (GPA) and microscopic polyangiitis (MPA), the latter being explained using these approaches in a more satisfactory manner, as there is lack of a model which reproduces the changes leading to a granulomatous vasculitis associated with antibodies against proteinase-3, as in GPA. This short review presents recent evidence of the presence of complement in biopsies of patients with AASV and the most recent animal models, which show the participation of complement in their etiology.
En varias enfermedades autoinmunes, el sistema del complemento es responsable, mediante su activación, de efectos que amplifican las respuestas a agentes que hipotéticamente incitan el desarrollo del daño y la muerte celular en tejidos como los riñones, la piel y las mucosas, los pulmones y todos aquellos órganos que se ven afectados en el lupus eritematoso generalizado (LEG), enfermedad prototípica donde estos mecanismos disparadores y amplificadores conllevan a las manifestaciones clínicas, y en otras como las vasculitis sistémicas asociadas a ANCA (VSAA), que son la poliangitis con granulomatosis (Wegener) (GPA), la poliangitis microscópica (PAM) y el síndrome de Churg-Strauss (SCS). La activación de este conjunto de proteínas circulantes ocurre al través de tres vías: la clásica, la alterna y la de la lectina (proteína circulante que se une a manosas en las superficies de microorganismos)1. Tal activación desata subsecuentes pasos que se dirigen a dividir varias moléculas que constituyen este sistema, de las cuales unas funcionan como enzimas sobre otras proteínas, para escindirlas, y otras atraen a células responsables de generar inflamación en tejidos a los sitios de activación del sistema puesto en marcha. Si bien, cualquiera de las tres vías convergen finalmente en la formación de convertasa de C5, paso esencial para la generación de un conjunto de proteínas que unidas a la membrana de células, ya sea externas (bacterias) o propias, llevan a su lisis, conocido como complejo de ataque a la membrana (CAM), las diferencias en los pasos previos a esta formación determinan la forma en la que puede bloquearse dicha activación y permiten conocer la participación de cada vía en la generación de enfermedades distintas.
En enfermedades como el LEG, la identificación en biopsias de tejidos afectados de complejos inmunes (CI) constituidos por productos de degradación de este sistema con inmunoglobulinas dirigidas contra diversos antígenos blanco constituye una característica distintiva. En el caso de las VSAA, la presencia de estos depósitos de CI y productos de degradación del sistema de complemento es escasa o inexistente, al menos mediante técnicas histopatológicas convencionales, lo que llevó a suponer por años la escasa participación del sistema de complemento en la generación de estas patologías. Sin embargo, en años recientes, algunos estudios han puesto de manifiesto que en al menos algunos enfermos es posible hallar depósito de estos CI en conjunto con productos de degradación del sistema del complemento, y al través de varios modelos animales se ha evidenciado que este sistema es importante para el desarrollo de las lesiones histológicas que pueden verse en las VSAA. Esta revisión tiene como objetivo principal describir los principales hallazgos de tales estudios, los que involucran al complemento en estas enfermedades, describiéndose los más recientes desarrollos en modelos animales, particularmente desde la descripción del propuesto por Xiao et al.2 en 2002.
Evidencia de la presencia de componentes del complemento en biopsias de pacientes con vasculitis sistémica asociada a anticuerpos anticitoplasma de neutrófiloUna de las manifestaciones clínicas distintivas de las VSAA es la afección renal. La lesión histopatológica característica en este grupo de enfermedades es la glomerulonefritis proliferativa focal y segmentaria pauciinmune con necrosis intra y extracapilar3. La importancia del reconocimiento de una lesión renal de estas características está en que entre el 80 y 90% de estos casos responde a la presencia de una VSAA. En estas lesiones, el depósito de CI es raro, de allí el término de pauciinmune, si bien, en algunos casos y dependiendo de la técnica empleada, es factible hallar depósito de ellos. Desde 1983, Ronco et al. describieron esta situación, particularmente en el mesangio4. Esta situación fue mejor demostrada con el estudio de Haas y Eustace en 20045, en el que en 68 de 126 biopsias renales se demostró depósito de CI mediante microscopia electrónica (ME) y de estas en 59 también se halló en forma moderada mediante inmunofluorescencia indirecta (IFI) y en escala semicuantitativa (de 0 a 4 cruces, siendo la mayoría 2+), el depósito de inmunoglobulinas o componentes del complemento. De forma interesante, no todos los casos con depósito de CI demostrados mediante ME, fueron positivos en su demostración por IFI y viceversa. En específico, la presencia de C3 por IFI se apreció en 71 biopsias, la mayoría con intensidad 1+, de las cuales 51 se observaron también en ME, y en cuanto a depósito de C1q, hubo 10 biopsias positivas por IFI, siendo todas con intensidad de 1+, de las que 2 no fueron demostradas por ME. De alguna forma, esto permite decir en definitiva que los hallazgos en cuanto al depósito de CI y especialmente aquellos con demostración de elementos del complemento en estas, no son uniformes. Uno de los aspectos más interesantes de este abanico de posibilidades en cuanto a hallazgos en las biopsias renales lo es si ello marca diferencias clínicas. En tal análisis, los pacientes que tuvieron estos depósitos presentaron mayor proteinuria y tendencia a mayores niveles de creatinina sérica, lo primero siendo observado también por otro grupo, el que también observó una mayor tendencia a mal pronóstico de la función renal en los pacientes en los que se observó el depósito de CI.
Más recientemente, en China, Chen et al.6 efectuaron un estudio de biopsias de 112 pacientes con la misma metodología, semicuantificando con la misma escala los depósitos de C3c y C1q. Como ocurre en tal región del mundo, la mayoría de los pacientes fueron positivos para ANCA-MPO (n=94), de los que 64 fueron clasificados como MPA. Con la IFI se halló depósito de C3c en 37 de las 112 biopsias, siendo el 86% de ellas en escala semicuantitativa de 1+ y 2+. Este depósito fue mayor en las paredes de los capilares glomerulares, seguido de depósitos en el mesangio. En cuanto al depósito de C1q este se vio solamente en 7 de los casos. Otros cambios histológicos asociados frecuentemente con este depósito fueron la mayor presencia de formación de medias lunas, así como mayor infiltrado intersticial y atrofia tubular. La correlación de estos hallazgos con la clínica fue tal que, en comparación con aquellos sin depósito de C3c, los pacientes con depósito de C3c tuvieron de nuevo más proteinuria y mayores niveles de creatinina sérica, lo que también se reflejó en menor depuración de creatinina al momento de la presentación. Esto también impactó en el aspecto de los requerimientos dialíticos. Aquellos pacientes con depósito de C3c ameritaron diálisis en casi la mitad de los casos, mientras que solamente el 28% de aquellos sin este depósito en las biopsias renales requirió diálisis. Esto puede explicarse por los cambios intersticiales antes referidos, ya que aunque también existieron más medias lunas, no hubo diferencia entre el tipo de estas (fibrosas o celulares) entre aquellos con o sin depósito de C3c.
En resumen, estos estudios muestran que el depósito de CI, y particularmente la demostración de complemento en las biopsias renales, puede definir un subgrupo de pacientes con mayor daño renal, el cual incluso puede predisponer a falla renal irreversible debido a la necesidad de sustitución de la función renal. Sería deseable, aun en forma retrospectiva, identificar en diferentes poblaciones si estos cambios son constantes, indistintamente del grupo étnico del que se trate, además de expandir estos datos tanto a población con VSAA con ANCA-PR3, ya que al momento esto ha sido más observado en pacientes positivos para ANCA-MPO.
Estos hallazgos no han sido solamente en riñones. Ya desde los años setenta se habían descrito elementos del complemento en biopsias de piel7, pero más recientemente, hace una década, Brons et al.8 demostraron en 6 de 11 biopsias de piel de pacientes con GPA de nuevo inicio, el depósito de C3c; este mismo hallazgo fue visto en 11 de 21 pacientes en recaída de la enfermedad. Aunque algunos pacientes tenían también afección renal, datos similares a los de los estudios sobre histopatología renal arriba descritos no fueron proveídos con mayor detalle. Sin embargo, la presencia de componentes de complemento en otras localizaciones, más directamente asequibles, podría brindar datos de correlación clínica también. Además, enfatizaría la práctica constante, como lo es en el caso de las biopsias renales, de efectuar IFI en toda biopsia de especímenes en casos de sospecha de estas enfermedades, independientemente del tejido del que se trate.
El sistema del complemento en modelos animales de vasculitis asociadas a anticuerpos anticitoplasma de neutrófiloHasta ahora, y después de casi una década, el modelo animal más exitoso para explicar la patogenia de estas enfermedades es el descrito por Xiao et al.9. En tal modelo, fue posible, tanto en ratones nativos de cepa C57BL/J6, como en ratones deficientes del gen 2 activador de recombinasa (Rag2 –/–), el desarrollo de glomerulonefritis pauciinmune focal y segmentaria con formación de medias lunas, lesiones análogas a las vistas en las VSAA de pacientes con GPA y MPA, cuando recibieron inmunización con anticuerpos contra MPO, mediante la adyuvancia de esplenocitos de los ratones inmunizados con MPO y, sobre todo, empleando ambos métodos de inmunización, tanto pasiva mediante la inyección de anti-MPO, como activa, con la transferencia de esplenocitos productores de ANCA-MPO generados en ratones deficientes de MPO. En este modelo, las lesiones glomerulares fueron mayores si la concentración de esplenocitos productores de ANCA-MPO fue creciente, desarrollándose las lesiones más graves en quienes más concentración de estas células recibieron; hubo también glomerulonefritis con la sola inyección pasiva de anticuerpos contra MPO. También hubo cambios morfológicos en ratones inmunizados contra anticuerpos control, dirigidos contra albúmina sérica bovina (anti-ASB), pero los cambios fueron más marcados en aquellos que recibieron anti-MPO. Para lo que a esta revisión concierne es interesante el hallazgo de que en la IFI, todos los ratones Rag2 –/– que recibieron ANCA-MPO, esplenocitos de ratones controles (es decir, aquellos no inmunizados con MPO) y también los que recibieron anti-ASB, presentaron mayor intensidad de C3 que de inmunoglobulinas y MPO en los glomérulos. Estos depósitos tuvieron morfología granular y las lesiones renales observadas carecieron de formación de medias lunas. Sin embargo, la progresión a lesiones características como necrosis focal y segmentaria con formación de medias lunas ocurrió en mayor medida en los inmunizados con ANCA-MPO o en quienes recibieron esplenocitos productores de estos anticuerpos2. Ello pudiera sugerir que algún estímulo inespecífico, como consecuencia de infecciones o procesos inflamatorios transitorios, como la que podría haberse generado con la inyección de anticuerpos contra ASB, dan origen a una lesión que se ve posteriormente potenciada por los anticuerpos dirigidos contra proteasas de serina de los neutrófilos y monocitos, y que las lesiones iniciales podrían ser mediadas por CI, los que en condiciones usuales pueden ser removidos sin causar daño permanente, pero que en individuos con ANCA-MPO circulantes, tales lesiones se magnifican y progresan a daño renal morfológico con las consecuentes alteraciones de la función renal que suceden a ese daño.
Tal posible concierto de factores, donde hasta hace poco se pensaba que el complemento tenía participación escasa, se ha visto modificado para este actor con el subsecuente desarrollo del modelo arriba descrito. En 2007, el mismo grupo mostró que los cambios arriba descritos podían inhibirse al bloquear el sistema del complemento9. En tales experimentos, se usaron ratones depletados de factor B (B –/–), C4 y C5 (C4 –/– y C5 –/–), y factor de veneno de cobra (CVF) para depletar complemento. En los ratones inyectados con ANCA-MPO de isotipo IgG, la depleción previa de complemento mediante la inyección de CVF evitó el desarrollo de glomerulonefritis necrosante o con formación de medias lunas. Esto mismo se observó cuando se depletó de complemento a los ratones que recibieron esplenocitos ANCA-MPO positivos, que en el modelo previo fueron los que desarrollaron lesiones más graves. En los ratones depletados de C5, ninguno de ellos desarrolló lesiones renales ni tampoco afección clínica después de haber recibido ANCA-MPO. Al emplear ratones B –/–, efectos similares a los obtenidos con la depleción de C5, pudieron verse, sin el desarrollo de lesiones ni de alteraciones en orina en estos ratones, a diferencia de lo visto cuando se inyectaron ratones C4 –/– con ANCA-MPO, los que si tuvieron cambios. Esto indica que la carencia de C4 no es relevante en este modelo para el desarrollo de lesiones glomerulares características de las VSAA, mientras que por el contrario, tanto la depleción de C5, etapa común para las vías clásica, alterna y de la lectina, como la de factor B, el cual se activa mediante la vía alterna, dando origen a la convertasa C3Bb, son necesarios para el desarrollo de lesiones, lo que no es así cuando se inhabilita o no está presente la activación de la vía clásica del complemento. Los ratones C4 –/– desarrollaron enfermedad, mientras que los B –/– y los C5 –/– no, con lo cual se demuestra que la vía preferente para la presencia de lesiones glomerulares es la alterna, lo que puede estar inducido por ANCA-MPO, esplenocitos productores de tal anticuerpo, o ambos. En este mismo artículo, se describe que la activación de neutrófilos por ANCA-PR3 y ANCA-MPO de pacientes, libera factores, los cuales no fueron caracterizados en detalle —pero se hipotetiza cuáles—, entre ellos properdina, que son capaces de generar C3a y, por lo tanto, de activar el complemento. De esta forma, cabe la posibilidad de que la perturbación de neutrófilos lleve a la liberación de ciertos factores que activen preferentemente la vía alterna del complemento, con la subsecuente generación de convertasas de C3 y C5, lo que eventualmente conlleva a las lesiones glomerulares distintivas de estas patologías. Una confirmación de que la vía alterna tiene un papel relevante en la génesis de estas lesiones, probablemente también en pacientes, es que la investigación en biopsias de 7 enfermos ANCA-MPO positivos, en China, mostró la ausencia de C4d y de lectina unida a manosa, pero si de C3d y factor B, los que además se colocalizaron con el CAM en vasos del intersticio y capilares glomerulares, dando sustento a la idea de que esta vía de activación de complemento parece ser la más relevante en la generación de los cambios histológicos10.
Posterior al modelo animal que demostró la participación de la vía alterna del complemento en la generación de lesiones renales vistas en VSAA, Schreiber et al.11 estudiaron el papel del receptor de C5a (C5aR). Receptores para C3 y C5 están presentes en la superficie de los neutrófilos. Para estudiar la relevancia de C5aR, se llevaron a cabo, tanto experimentos in vitro como en un modelo animal. En este último, ratones depletados de MPO fueron inmunizados con anti-MPO y después de ser irradiados, recibieron médula ósea de ratones sanos o bien de ratones sin presencia del gene para C5a (C5aR –/–). En aquellos ratones que recibieron trasplante de médula de sus congéneres sanos, existió hematuria y proteinuria consistente con el desarrollo de lesiones glomerulares necrosantes con formación de medias lunas, mientras que los ratones que recibieron médula ósea carente del gene de C5aR en su mayoría (sólo 1 de 8 tuvo formación mínima de medias lunas) carecieron tanto de lesiones histológicas, entre ellas también infiltrado por neutrófilos, como de su traducción clínica. Por lo tanto, la falta de acción de C5a, bloqueando su receptor en neutrófilos, puede inhibir a este potentísimo factor quimiotáctico y activador de la expresión de moléculas de adhesión por neutrófilos y de la función fagocítica de estas células, todos ellos elementos importantes en la generación de diversas enfermedades glomerulares. Por lo tanto, el bloqueo de la acción de este factor, ya sea evitando su generación a partir de la vía alterna, sin la formación de convertasas necesarias, o más adelante en el camino, inhibiendo su interacción con su receptor, podría evitar el camino patogénico observado en las VSAA.
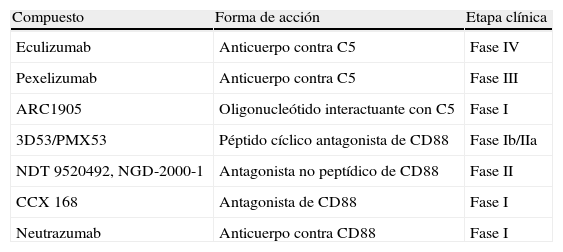
Potenciales terapias basadas en bloqueo de complemento vasculitis sistémicas asociadas a anticuerpos anticitoplasma de neutrófiloEstas evidencias, en conjunto con los avances bioteconológicos, han permitido vislumbrar, no solo para estas enfermedades, varias intervenciones dirigidas a componentes del sistema del complemento. De las más avanzadas al momento, está la inhibición del eje C5-C5a, con lo que los pasos previos a la formación del CAM podrían verse inhibidos. Para lograr este objetivo se puede inhibir la formación de las convertasas de C5, el de la vía clásica C4b2a3b, y el de la vía alterna, probablemente más relevante para las VSAA, según lo descrito antes, C3bBb. Otra posibilidad es inhibir C5 mediante la unión a esta molécula, evitando la acción de las convertasas sobre ella. Al momento este abordaje es el más adelantado y la única molécula aprobada para uso responde a este mecanismo de acción. El eculizumab, anticuerpo monoclonal dirigido contra C5, se une con alta afinidad a este componente del complemento, y se utiliza en hemoglobinuria paroxística nocturna, desarrollándose al momento estudios fase IV con esta aplicación terapéutica. Desde luego, la inhibición de la producción de C5a y C5b sucede tras la administración de eculizumab, y con el fin de evitar ello y más selectivamente inhibir sólo la actividad de C5a, se están probando otras opciones. Una posibilidad, de hecho una de las que más desarrollo tiene debido a la relevancia de C5aR, consiste en su bloqueo. Para tal fin, existen varios abordajes: bloquear mediante antagonistas peptídicos y no peptídicos a C5aR, y emplear anticuerpos contra C5aR, específicamente, contra su receptor de alta afinidad (CD88). Particularmente, un muy potente antagonista de CD88 iniciará en breve, y seguramente para cuando este artículo vea la luz ya lo habrá hecho, su prueba en las VSAA. Esta molécula, denominada CCX168, es un antagonista no peptídico de CD88 y se administra por vía oral, siendo en este grupo de enfermedades una novedad en lo que se refiere a moléculas nuevas en la terapia de las VSAA. Debe citarse que, desde luego, estos abordajes son plausibles en muchas patologías autoinmunes y deben verse, por supuesto, en el futuro y de manera cercana durante el seguimiento, los efectos de la inhibición crónica de tan importante eje, sistema que es de los más importantes onto y filogenéticamente en lo que significa la defensa de los organismos ante elementos extraños. Este cuidado que se debe tener se ejemplifica con los bien sabidos efectos que el déficit hereditario de componentes del complemento tiene en una mayor predisposición a las infecciones, como las neumocócicas. En la tabla 1 se sintetiza información relevante sobre ciertas moléculas inhibidoras del eje C5-C5aR que se encuentran ya en fases clínicas de prueba. Se refiere a los lectores interesados a una excelente revisión12.
Moléculas inhibidoras del eje C5-C5a en fases clínicas de prueba
| Compuesto | Forma de acción | Etapa clínica |
| Eculizumab | Anticuerpo contra C5 | Fase IV |
| Pexelizumab | Anticuerpo contra C5 | Fase III |
| ARC1905 | Oligonucleótido interactuante con C5 | Fase I |
| 3D53/PMX53 | Péptido cíclico antagonista de CD88 | Fase Ib/IIa |
| NDT 9520492, NGD-2000-1 | Antagonista no peptídico de CD88 | Fase II |
| CCX 168 | Antagonista de CD88 | Fase I |
| Neutrazumab | Anticuerpo contra CD88 | Fase I |
Adaptado de Woodruff et al12.
Uno de los caminos más importantes para entender la patogenia de las VSAA se ha dedicado en los últimos 10 años a examinar el papel del sistema del complemento en estas patologías. En contra de lo pensado hace varias décadas, actualmente es de sumo interés, para grupos pioneros y para la industria biofarmacéutica, continuar con estudios relacionados con este campo, puesto que ello abrirá más opciones de identificación de los caminos que generan estos problemas y su posible inhibición temprana, lo que cobra relevancia ante la relativa carencia de terapias en estas patologías a pesar de los sustanciales avances recientes con la introducción de terapias dirigidas a la supresión de las células B (véase más adelante en este número) y potencialmente también contra las células T y a la remoción de ANCA de la circulación. En todo caso, el mejor conocimiento de todas estas vías que intervienen en la patogenia de las VSAA permite vislumbrar a futuro un panorama de opciones terapéuticas que individualmente, o incluso en conjunto, frenen a tiempo las complicaciones graves de estas entidades. Queda por esperar la prueba del tiempo, y desde luego, el deseo de que tales terapias futuras, basadas en estos conocimientos, estén disponibles para casi todo paciente afectado por una VSAA.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.