Agrupar a los pacientes con enfermedad pulmonar intersticial (EPI) asociada a enfermedad indiferenciada del tejido conectivo (EITC) según la presencia o no de ciertas manifestaciones clínicas o inmunológicas, esperando encontrar diferentes expresiones tomográficas o funcionales.
MétodosEstudio de cohortes retrospectivas. Se incluyeron pacientes que cumplían criterios de Kinder para EITC. Se consideraron variables predictoras: manifestaciones «altamente específicas de enfermedad del tejido conectivo (ETC)» (Raynaud, xeroftalmia o artritis), títulos altos de anticuerpos antinucleares (ANA) (mayores a 1:320) y patrones específicos de ANA (centromérico, citoplásmico y nucleolar). El cambio en la capacidad vital forzada% (CVF%) en el tiempo y el patrón en TCAR fueron las variables de resultado estudiadas.
ResultadosSe incluyeron 66 pacientes. Veintinueve presentaron al menos una manifestación «altamente específica de ETC» (43,94%), 16 ANA específico (28,57%) y 29 ANA alto título (43,94%). Aquellos con manifestaciones «altamente específicas de ETC» presentaron menor frecuencia de sexo masculino (10,34% vs 48,65%, p<0,001), menor edad en años (media 52 [DE14,58] vs 62,08 [9,46], p<0,001) y menor mediana de declinación de CVF% (1[RIC −1 a 10] vs −6 [RIC −16 a −4], p<0,006). En el análisis de regresión lineal múltiple la presencia de manifestaciones «altamente específicas de ETC» se asoció con mejoría en CVF% (coeficiente B de 13,25 [IC95% 2,41 a 24,09]). No encontramos asociaciones en cuanto al patrón en TACAR.
ConclusionesLa presencia de manifestaciones «altamente específicas de ETC» se asoció con sexo femenino, menor edad al inicio y una evolución más favorable en cuanto a la CVF%, lo cual evidencia el impacto de las manifestaciones clínicas en la evolución de estos pacientes.
To identify clinical or immunological features in patients with undifferentiated connective tissue disease (UCTD) associated interstitial lung disease (ILD), in order to group them and recognize different functional and high resolution computed tomography (HRCT) behavior.
MethodsRetrospective cohort study. Patients meeting Kinder criteria for UCTD were included. We defined the following predictive variables: ‘highly specific’ connective tissue disease (CTD) manifestations (Raynaud's phenomenon, dry eyes or arthritis), high antinuclear antibody (ANA) titer (above 1: 320), and ‘specific’ ANA staining patterns (centromere, cytoplasmic and nucleolar patterns). We evaluated the following outcomes: change in the percentage of the predicted forced vital capacity (FVC%) during the follow-up period, and HRCT pattern.
ResultsSixty-six patients were included. Twenty-nine (43.94%) showed at least one ‘highly specific’ CTD manifestation, 16 (28.57%) had a ‘specific’ ANA staining pattern and 29 (43.94%) high ANA titer. Patients with ‘highly specific’ CTD manifestations were younger (mean [SD] 52 years [14.58] vs 62.08 years [9.46], P<.001), were more likely men (10.34% vs 48.65%, P<.001) and showed a smaller decline of the FVC% (median [interquartile range] 1% [−1 to 10] vs -6% [−16 to −4], P<.006). In the multivariate analysis, the presence of highly specific manifestations was associated with improvement in the FVC% (B coefficient of 13.25 [95% confidence interval, 2.41 to 24.09]). No association was observed in relation to the HRCT pattern.
ConclusionThe presence of ‘highly specific’ CTD manifestations was associated with female sex, younger age and better functional behavior. These findings highlight the impact of the clinical features in the outcome of patients with UCTD ILD.
El diagnóstico de neumonía intersticial idiopática requiere la exclusión de otras causas conocidas de enfermedad pulmonar intersticial (EPI), entre ellas las enfermedades del tejido conectivo (ETC). Las recomendaciones más conservadoras sugieren realizar la determinación de factor reumatoide (FR) y anticuerpos antinucleares (ANA) junto a un interrogatorio dirigido con el fin de descartar una ETC, aunque se considera que rastrear la presencia de otros anticuerpos (anti-Ro/SS-A, anti-La/SS-B, anti-Jo-1, etc.) podría ser de utilidad en casos seleccionados1,2. Como consecuencia de estas recomendaciones es común el hallazgo de datos positivos al examen físico, interrogatorio y/o laboratorio inmunológico en pacientes que no cumplen criterios clasificatorios para una ETC en particular, configurando un síndrome que ha recibido múltiples denominaciones, entre las cuales destacamos la de enfermedad indiferenciada del tejido conectivo (EITC)3. Se trata de una entidad con una importante heterogeneidad en cuanto a sus características demográficas, clínicas, morfológicas (histológicas y tomográficas) y evolutivas4-8. La existencia de criterios clasificatorios con alta sensibilidad propuestos por diversos autores ha contribuido a su heterogeneidad4,5,9,10. Recientemente se ha publicado un consenso intersociedades que intenta aportar claridad a la definición de esta entidad denominándola «enfermedad intersticial pulmonar con hallazgos autoinmunes», aunque los criterios que propone no han sido aún validados11. Subyace la hipótesis de que esta entidad abarca al menos 2 grupos de pacientes diferentes. En primer lugar habría un grupo de pacientes con una EPI de naturaleza inflamatoria, asociada a una ETC incompleta que podrá o no definirse en su evolución. En segundo lugar habría otro grupo de pacientes con una EPI de naturaleza fibrótica, con un perfil clínico similar a la fibrosis pulmonar idiopática (FPI), con resultados falsamente positivos en el laboratorio inmunológico, acompañados de manifestaciones clínicas extrapulmonares inespecíficas y prevalentes en la población general12. En este contexto, el objetivo principal de nuestro estudio fue agrupar los pacientes según la presencia o no de ciertas manifestaciones clínicas o rasgos inmunológicos, esperando encontrar que estos grupos tengan expresiones tomográficas y/o funcionales diferentes.
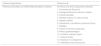
Materiales y métodosSe trata de un estudio observacional, de cohortes retrospectivas. Se revisaron las historias clínicas de todos pacientes internados en la clínica de EPI del Instituto Nacional de Enfermedades Respiratorias Ismael Cosio Villegas (INER) (México) durante el período de enero de 2012 a diciembre de 2014, y de todos los pacientes de consulta externa que concurrieron al consultorio de EPI Hospital María Ferrer (HMF) (Argentina) en el período de enero de 2012 a junio de 2015. Los pacientes dieron su consentimiento por escrito. Se incluyeron aquellos pacientes con EPI que cumplían con los criterios de Kinder para EITC (tabla 1)3. Se excluyeron los pacientes que cumplían criterios para una ETC definida de acuerdo a los criterios del American College of Rheumatology (ACR) u con otra causa de enfermedad intersticial conocida.
Criterios de Kinder para pacientes con EPI asociada a EITC
| Criterios diagnósticos | Presencia de |
|---|---|
| Síntomas asociados con enfermedad del tejido conectivo | Al menos uno de los siguientes síntomas: |
| 1. Fenómeno de Raynaud | |
| 2. Artralgia/Inflamación articular múltiple | |
| 3. Fotosensibilidad | |
| 4. Pérdida de peso no intencionada | |
| 5. Rigidez matinal | |
| 6. Xerostomía o xeroftalmia (síntomas Sicca) | |
| 7. Disfagia | |
| 8. Fiebre recurrente inexplicada | |
| 9. Reflujo gastroesofágico | |
| 10. Cambios cutáneos (rash) | |
| 11. Úlceras orales | |
| 12. Alopecia no androgénica | |
| 13. Debilidad muscular proximal |
| Evidencia de inflamación sistémica en ausencia de infección | Hallazgos positivos en al menos uno delos siguientes: |
|---|---|
| 1. Anticuerpos antinucleares (ANA) | |
| 2. Factor reumatoide (FR) | |
| 3. Anti- Scl70 | |
| 4. Anti Ro/SS-A o La/SS-B | |
| 5. Anti-Jo-1 | |
| 6. Eritrosedimentación (mayor al doble del valor normal) o proteína C reactiva |
Se consignaron datos demográficos (edad, sexo, tabaquismo), clínicos (signos/síntomas respiratorios y asociados ETC), de laboratorio inmunológico (ANA, FR, anti-Ro/SS-A, anti-Jo-1, anti-Scl-70, anticentrómero y anti U1RNP), de la función respiratoria (capacidad vital forzada porcentual del teórico [CVF%] y difusión de monóxido de carbono porcentual del teórico [DLCO%] al inicio, variación de la CVF% en el seguimiento), de tomografía computarizada de alta resolución (TCAR) y biopsia pulmonar quirúrgica. El seguimiento se realizó con examen funcional respiratorio cada 4 a 6meses. Con respecto a las manifestaciones clínicas, y por tratarse de un estudio retrospectivo, se analizaron aquellas manifestaciones que se interrogan habitualmente en la consulta del médico neumólogo dedicado a EPI de los centros participantes (las incluidas en los criterios de Kinder). Otras manifestaciones más específicas pero que requieren de la presencia de otro especialista para ser objetivadas (por ejemplo, manos de mecánico o signo de Gottron) no fueron analizadas. También se consignaron los datos relacionados al tratamiento. En todos los casos el mismo fue indicado por el médico tratante según su criterio.
Definición de las variablesLaboratorio inmunológico: la determinación de FR de los pacientes del HMF se realizó mediante nefelometría con un valor de corte de 35U/ml, y en el INER mediante inmunoquimioluminiscencia con un valor de corte de 20U/ml. El ANA se realizó mediante inmunofluorescencia indirecta (IFI), utilizando como corte un título de 1:80. La determinación de anti Ro/SS-A, anti-Jo-1, anti U1RNP y anti Scl-70 se realizó mediante ELISA, con un valor de corte de 20U/ml. El anticuerpo anticentrómero se midió mediante IFI con título de corte de 1:80. Examen funcional respiratorio: se realizó espirometría, pletismografía y DLCO al inicio y cada 4-6meses de acuerdo a los criterios de aceptabilidad y reproducibilidad de referencia13-16.
TCAR: fueron realizadas con cortes de 1mm de grosor e intervalos de 10mm. Las mismas fueron evaluadas por un radiólogo experto en enfermedad intersticial, que las clasificó según criterios de referencia en típica de neumonía intersticial usual (NIU), NIU posible, e inconsistente con NIU1. Biopsias pulmonares: fueron evaluadas por un patólogo con experiencia en EPI, y fueron clasificadas en NIU, neumonía intersticial no específica (NINE), neumonía en organización (NO), NINE con NO, neumonía intersticial linfoidea (NIL) y EPI no clasificable2. Se consignó además la presencia de folículos linfoides, bronquiolitis folicular, compromiso pleural y compromiso vascular.
Un grupo multidisciplinario definió a priori las comparaciones a realizar. Se definió un grupo de manifestaciones clínicas (fenómeno de Raynaud, xeroftalmia o artritis), incluidas en los criterios propuestos por Kinder, como altamente específicas de ETC. Los pacientes que presentaron al menos una de ellas se consideró que presentaban manifestaciones altamente específicas de ETC. Se consideraron títulos altos de ANA los mayores a 1:320, y patrones específicos de ANA el centromérico, el citoplásmico y el nucleolar. La elección de estos patrones de ANA como «específicos» está vinculada a su fuerte asociación con ETC en las que la EPI constituye una manifestación frecuente, lo cual aleja la posibilidad de estar ante un falso positivo del test17,18. Estas 3 variables (manifestaciones altamente específicas de ETC, ANA específico y ANA alto título) se consideraron como principales variables predictoras. Se consideraron como principales variables de resultado la variación de la FVC% en el tiempo y el patrón en TACAR. Se evaluaron además el sexo y la edad. Se escogieron estas variables por tratarse de características que se expresan de manera diferente en una enfermedad «tipo FPI» y una EPI inflamatoria asociada a una ETC5. Se incluyeron potenciales confundidores en un análisis multivariado para intentar corregir el efecto de eventuales sesgos de selección.
Análisis estadísticoLas variables categóricas se describieron según su frecuencia, y las continuas con media y desvío estándar (DE) o mediana y rango intercuartil (RIC) dependiendo de la presencia o no de distribución normal, respectivamente. El análisis univariado se realizó mediante el test del Chi-cuadrado (χ2), test exacto de Fisher, test de Student o Wilcoxon's rank-sum test según el tipo de variable. Se realizó análisis de regresión logística múltiple para conocer qué variables se asociaron con la presencia de un patrón en TCAR inconsistente con NIU. Se incluyeron como covariables en el modelo el sexo, la edad menor a 60años, la presencia de manifestaciones altamente específicas de ETC, el ANA específico y el ANA alto título. Se informaron los OR ajustados y sus intervalos de confianza (IC) del 95%. Se utilizó regresión lineal múltiple para conocer qué variables se asociaron con el cambio de la CVF % en el tiempo. Se incluyeron como variables independientes edad mayor a 60años, sexo, la presencia de manifestaciones «altamente específicas de ETC», el ANA específico, el ANA alto título, la presencia de un patrón inconsistente con NIU en la TACAR y el hecho de haber recibido o no un tratamiento específico. Se informaron los coeficientes beta y sus IC95%. Se consideró estadísticamente significativo un valor de p<0,05. Se utilizó para el análisis estadístico STATA 13.0.
ResultadosCaracterísticas de las cohortesSe revisaron 648 historias clínicas en el INER y 292 historias clínicas en el HMF. Se incluyeron en total 66 pacientes, 21 hombres (31,82%), con una media (DE) de edad de 57,65años (12,91). La mediana (RIC) de tiempo de seguimiento fue de 35 semanas (27-50).
Las cohortes analizadas (INER y HMF) mostraron ser diferentes en cuanto a la proporción de pacientes tabaquistas (33,3% vs 66,6%, p<0,011), positividad del anticuerpo anti Ro/SS-A (4,55% vs. 47,62%, p<0,001), presencia de fenómeno de Raynaud (6,67% vs. 33,33%, p<0,005), xeroftalmia (15,56% vs. 42,86%, p<0,016), manifestaciones altamente específicas de ETC (31,11% vs 71,43%, p<0,002) y TCAR inconsistente con NIU (64,44% vs 85% 14,29, p<0,001), respectivamente (tabla 2).
Cohorte de pacientes con EPI asociada a EITC, HMF e INER. Descripción de las características demográficas, clínicas, de laboratorio inmunológico y de imágenes. Comparación entre ambas cohortes
| INER (n = 45) | HMF (n = 21) | Total (n=66) | |
|---|---|---|---|
| Características demográficas | |||
| Sexo masculino | 17 (37,78) | 4 (19,05) | 21 (31,82) |
| Edad al diagnóstico | 57,37 (12,20) | 58,23 (14,61) | 57,65 (12,91) |
| Tabaquismoa | 15 (33,33) | 14 (66,67) | 29 (43,94) |
| Laboratorio inmunológico | |||
| ANA positivo | 37 (84,09) | 20 (95,24) | 57 (87,69) |
| FR positivo | 20 (48,78) | 9 (42,86) | 29 (46,77) |
| ANA alto título | 17 (37,78) | 12 (57,14) | 29 (43,94) |
| ANA específico | 9 (25) | 7 (35) | 16 (28,57) |
| Características clínicas | |||
| Raynauda | 3 (6,67) | 7 (33,33) | 10 (15,15) |
| Xeroftalmiaa | 7 (15,56) | 9 (42,86) | 16 (24,24) |
| Xerostomía | 15 (33,33) | 12 (57,14) | 27 (40,91) |
| Artritis | 6 (13,23) | 6 (28,57) | 12 (18,18) |
| Artralgias | 12 (26,67) | 6 (28,57) | 18 (27,27) |
| Rigidez matutina | 4 (8, 89) | 0 | 4 (6,06) |
| Síntomas RGE | 13 (28,89) | 7 (33,33) | 20 (30,3) |
| Pérdida de peso | 19 (42,22) | 6 (28,57) | 25 (37,88) |
| Fotosensibilidad | 1 (2,22) | 1 (4,76) | 2 (3,03) |
| Disfagia | 2 (4,44) | 0 | 2 (3,03) |
| Fiebre recurrente inexplicada | 5 (11,11) | 1 (4,76) | 6 (9,09) |
| Debilidad muscular proximal | 0 | 2 (9,52) | 2 (3,03) |
| Alopecia | 0 | 0 | 0 |
| Manifestaciones altamente específicas de ETCa | 14 (31,11) | 15 (71,94) | 29 (43,94) |
| Examen funcional respiratorio al inicio | |||
| CVF (% predicho) | 60,61 (19,5) | 64,4 (19) | 61,86 (19,3) |
| DLCO (% predicho) | 44,36 (23,6) | 45,85 (18,7) | 44,94 (21,6) |
| Patrón en TCAR | |||
| Patrón NIU típico | 6 (13,33) | 3 (14,29) | 9 (13,64) |
| Patrón inconsistente con NIUa | 29 (64,44) | 3 (14,29) | 32 (48,48) |
ANA: anticuerpos antinucleares; CVF: capacidad vital forzada; DLCO: difusión de monóxido de carbono; EITC: enfermedad indiferenciada del tejido conectivo; EPI: enfermedad pulmonar intersticial; HMF: Hospital María Ferrer; INER: Instituto Nacional de Enfermedades Respiratorias Ismael Cosio Villegas; FR: factor reumatoide; NIU: neumonía intersticial usual; RGE: reflujo gastroesofágico; TCAR: tomografía computarizada de alta resolución.
Datos expresados como n (%) o media (DE).
Las manifestaciones clínicas más frecuentes fueron: xerostomía (40,9%), pérdida de peso (38%) y síntomas de reflujo gastroesofágico (30,3%).
El hallazgo serológico más frecuente fue la positividad del ANA (87,69%), presentando el 44% de los casos un título mayor a 1:320. El moteado fino fue el patrón de IFI más frecuentemente observado (48,12%). El anticuerpo anti Ro/SS-A se testeó en 43 casos, siendo positivo en 11 (25,2%), mientras que el anti-Jo-1 fue positivo en 7 (23,3%) de los 30 solicitados. Todos los individuos testeados para anti-Scl70 y anti-U1RNP fueron negativos. Se realizó biopsia quirúrgica en 15 pacientes (22,7%). En 7 el diagnóstico definitivo fue NIU, pero cabe destacar que en 3 de ellos se observó la presencia de folículos linfoides difusos. En 7 casos el diagnóstico fue NINE (en 3 combinada con hallazgos de NIU y en 2 con NO). Tres biopsias fueron definidas como «no clasificables». Los hallazgos histológicos fueron: compromiso de arteriolas en 5, bronquiolitis folicular en 2 y folículos linfoides difusos en 9 biopsias. En ningún caso se observó compromiso pleural.
En lo que respecta al tratamiento, solo 47 pacientes recibieron algún fármaco específico (inmunosupresor o antifibrótico). Los tratamientos utilizados por frecuencia fueron azatioprina en 23 (48,94%), micofenolato mofetil en 14 (29,79%), metotrexato en 3 (6,38%), esteroides solos en 3 (6,38%), ciclofosfamida en 2 (4,26%) y pirfenidona en 2 (4,26%).
Definiendo patrones. Análisis univariado y multivariadoEn el análisis univariado los pacientes con manifestaciones «altamente específicas de ETC» resultaron ser más jóvenes (media 52 años (DE 14,58) vs. 62 años (9,46); p<0,01] y con menor frecuencia de sexo masculino (10,34% vs. 48,65%; p<0,01). Aunque no se observó diferencias en la CVF % y DLCO % inicial, los pacientes con manifestaciones «altamente específicas de ETC» presentaron mejor evolución en el examen funcional respiratorio. La variación de la mediana (RIC) de CVF % en el tiempo fue de 1 (−1 a 10) en los pacientes con manifestaciones «altamente específicas de ETC» vs −6 puntos (−16 a −4) en aquellos sin estas manifestaciones (p<0,01) (tabla 3). Es importante aclarar que ambos grupos (con y sin manifestaciones «altamente específicas de ETC») tuvieron medianas (RIC) de tiempo de seguimiento similares (34 semanas [27-56] vs 36 semanas [27-50]; p=0,758].
Cohorte de pacientes con EPI asociada a EITC, HMF e INER. Comparación entre pacientes con y sin presencia de manifestaciones «altamente específicas de ETC»
| EITC con manifestaciones altamente específicas de ETC n=29 | EITC sin manifestaciones altamente específicas de ETC n=37 | p | |
|---|---|---|---|
| Sexo masculino | 3 (10,34) | 18 (48,65) | < 0,01 |
| Edad | 52 (14,58) | 62,08 (9,46) | < 0,01 |
| TCAR NIU típica | 3 (10,34) | 6 (16,22) | 0,72 |
| TCAR inconsistente con NIU | 14 (48,28) | 18 (48,65) | 0,97 |
| CVF (% predicho) inicio | 58 (19,78) | 64,97 (18,66) | 0,15 |
| DLCO (% predicho) inicio | 43 (19,02) | 46,38 (23,60) | 0,57 |
| Diferencia entre CVF (% predicho) final e inicial | 1 (− 1 a 10) | − 6 (− 16 a − 4) | < 0,01 |
| Tiempo de seguimiento en semanas | 34 (27 a 56) | 36 (27 a 50) | 0,76 |
CVF: capacidad vital forzada; DLCO: difusión de monóxido de carbono; EITC: enfermedad indiferenciada del tejido conectivo; EPI: enfermedad pulmonar intersticial; HMF: Hospital María Ferrer; INER: Instituto Nacional de Enfermedades Respiratorias Ismael Cosio Villegas; NIU: neumonía intersticial usual; TCAR: tomografía computarizada de alta resolución.
Datos expresados como n (%) media (DS) o mediana (RIC).
La presencia o no de ANA en altos títulos o con patrón específico no se asoció con diferencias en cuanto a sexo, edad, frecuencia de manifestaciones «altamente específicas de ETC», datos funcionales o de TACAR. En el análisis de regresión logística múltiple con patrón en TCAR inconsistente con NIU como variable dependiente, la edad menor a 60años fue la única variable que mostró una asociación estadísticamente significativa, con un OR (IC95%) de 11,53 (2,7-47,69) (tabla 4). En el análisis multivariado por regresión lineal múltiple la presencia de manifestaciones «altamente específicas de ETC» se asoció con una mejoría en los valores de CVF%, con un coeficiente beta de 13,25 puntos (IC95% 2,41-24,09), siendo esta la única variable independiente que mostró asociación estadísticamente significativa (tabla 5)
Cohorte de pacientes con EPI asociada a EITC, HMF e INER. Análisis de regresión logística múltiple con la TCAR inconsistente con NIU como variable dependiente
| OR (IC 95%) | p | |
|---|---|---|
| Manifestaciones «altamente específicas de ETC» | 0,35 (0,08-1,46) | 0,15 |
| ANA alto título | 0,93 (0,24-3,59) | 0,93 |
| ANA específico | 0,82 (0,18-3,64) | 0,80 |
| Sexo masculino | 0,90 (0,18-4,43) | 0,90 |
| Edad menor a 60 años | 11,53 (2,79-47,69) | < 0,01 |
ANA: anticuerpos antinucleares; EITC: enfermedad indiferenciada del tejido conectivo; EPI: enfermedad pulmonar intersticial; HMF: Hospital Ferrer; IC: intervalo de confianza; INER: Instituto Nacional de Enfermedades Respiratorias Ismael Cosio Villegas; NIU: neumonía intersticial usual; OR: odds ratio; TCAR: tomografía computarizada de alta resolución.
Cohorte de pacientes con EPI asociada a EITC, HMF e INER. Análisis de regresión lineal múltiple con cambio en la CVF% como variable dependiente
| Coeficiente B | IC 95% | p | |
|---|---|---|---|
| Manifestaciones «altamente específicas de ETC» | 13,25 | 2,41 a 24,09 | 0,01 |
| ANA alto título | 2,94 | −8,49 a 14,37 | 0,59 |
| ANA específico | −2,06 | −17,06 a 12,86 | 0,77 |
| Sexo masculino | 1,48 | −10,34 a 17,27 | 0,79 |
| Edad mayor a 60 años | 3,57 | −10,12 a 17,27 | 0,59 |
| TACAR inconsistente con NIU | 1,56 | −9,10 a 12,23 | 0,82 |
| Recibió tratamiento | 3,65 | −7,47 a 14,79 | 0,49 |
ANA: anticuerpos antinucleares; CVF: capacidad vital forzada; EITC: enfermedad indiferenciada del tejido conectivo; EPI: enfermedad pulmonar intersticial; HMF: Hospital Ferrer; IC: intervalo de confianza; INER: Instituto Nacional de Enfermedades Respiratorias Ismael Cosio Villegas; NIU: neumonía intersticial usual; TCAR: tomografía computarizada de alta resolución.
En nuestro trabajo encontramos que la presencia de al menos una manifestación «altamente específica de ETC» (fenómeno de Raynaud, xeroftalmia o artritis) se asoció con mayor prevalencia de sexo femenino, menor edad al inicio y una evolución más favorable en cuanto a la variación de la CVF% en el tiempo que se confirmó luego de ajustar por potenciales confundidores. Este perfil se diferencia de lo observado clásicamente en pacientes con FPI, enfermedad con predominio de sexo masculino, edad avanzada y deterioro funcional rápido12. Un dato a destacar en cuanto a nuestros resultados es que las cohortes presentaron diferencias clínicas y radiológicas significativas. Si bien no contamos con una explicación definitiva para este hallazgo, es posible que las diferencias estén relacionadas con el momento en el cual son evaluados los pacientes (durante la internación en el INER y durante la consulta externa en el HMF).
Durante la evaluación inicial de un paciente con EPI, la presencia de manifestaciones clínicas relacionadas a una ETC o la positividad de autoanticuerpos representa un dilema para el médico, que debe escoger entre considerar al paciente como portador de una EPI idiopática (FPI) y utilizar fármacos antifibróticos, o considerarlo una EPI asociada a ETC y utilizar fármacos inmunosupresores19,20. El hallazgo de manifestaciones clínicas que puedan contribuir a diferenciar estos fenotipos nos parece un aporte de relevancia.
Nuestros resultados apoyan lo propuesto por otros autores en cuanto al impacto de las manifestaciones clínicas en la evolución de este grupo de pacientes5. En el consenso intersociedades publicado recientemente se proponen nuevos criterios clasificatorios (aún no validados) en los que las manifestaciones clínicas ocupan un dominio específico (junto a uno serológico y otro morfológico)11. En este consenso se eliminan ciertas manifestaciones clínicas incluidas en criterios anteriores (por ejemplo, síntomas de reflujo gastroesofágico, pérdida de peso) y se incluyen otras de mayor especificidad, entre las que se encuentran el fenómeno de Raynaud y la artritis. Los pacientes que cumplen con los criterios propuestos y no cumplen con los criterios para una ETC definida presentan una «enfermedad intersticial pulmonar con hallazgos autoinmunes». Consideramos que el objetivo y los resultados de nuestro estudio van en el mismo sentido que lo propuesto en este consenso, al intentar excluir manifestaciones demasiado sensibles que pueden llevar a incluir erróneamente a pacientes con FPI en el grupo de pacientes con una EPI asociada a ETC.
En cuanto a los datos serológicos, ni la presencia de ANA a títulos altos ni los patrones específicos en la IFI resultaron de utilidad para diferenciar entre los grupos planteados en la hipótesis de este estudio. Esto contrasta con lo reportado por otros grupos, que destacan el papel de la detección de autoanticuerpos en el estudio de estos pacientes4,21. Consideramos que la información que brinda el laboratorio inmunológico puede ser de utilidad, aunque sabemos que no está exenta de falsos positivos y negativos (más aún al tratarse de técnicas dependientes del observador, como la IFI) y debe ser interpretada acorde al contexto clínico en que se obtiene.
En un estudio reciente que evaluó pacientes con diagnóstico de «enfermedad intersticial pulmonar con hallazgos autoinmunes» según el consenso antes mencionado11 se observó que aquellos con un patrón diferente de NIU presentaban mejor sobrevida, destacando la importancia del patrón tomográfico e histológico22. En nuestro estudio el patrón en TCAR no fue diferente en los subgrupos estudiados. Tampoco encontramos asociación con mejor evolución funcional cuando se incluyó como covariable «patrón inconsistente con NIU» en el análisis multivariado de cambio de CVF en el tiempo. Es de destacar la baja prevalencia en nuestra cohorte de patrón típico de NIU en las TACAR en comparación con otros trabajos4,22,23. Es posible que esto haya disminuido el poder del estudio para encontrar diferencias en el patrón de TCAR en función de las manifestaciones clínicas, el laboratorio inmunológico y la evolución funcional. Nuestra cohorte proviene de 2 centros especializados en enfermedades respiratorias que cuentan con médicos experimentados en la evaluación de pacientes con EPI y con una cantidad de pacientes similar a la de otras cohortes publicadas con anterioridad, por lo que consideramos que nuestros resultados son representativos y comparables con los de otros trabajos.
Nuestro estudio presenta algunas limitaciones. Los pacientes fueron incluidos a partir de la historia clínica de internación en un centro (INER) y a partir de la consulta externa en otro (HMF). Esto puede representar una diferencia importante en cuanto a la severidad de los casos entre ambos centros, lo cual implica un posible sesgo de selección. Por otro lado, al tratarse de un estudio retrospectivo con datos tomados directamente de la historia clínica, el interrogatorio de los síntomas vinculables a ETC no fue estandarizado, dando lugar a un posible sesgo de información. El estudio también presenta limitaciones en cuanto a la evaluación de los rasgos de enfermedad autoinmune. Solo fueron contempladas las variables clínicas y serológicas propuestas en los criterios Kinder, los cuales excluyen manifestaciones y hallazgos serológicos específicos de ETC, como la presencia de manos de mecánico, telangiectasias palmares, signo de Gottron, anticuerpos antisintetatasas diferentes de Jo-1 o anticuerpos contra péptidos citrulinados. Muchas de estas variables se incorporan en el último consenso intersociedades y resultan de utilidad al momento de identificar pacientes con EITC11. Tampoco fueron analizados el rol de la capilaroscopia o de la biopsia de glándula salival menor en la evaluación de pacientes con EPI asociada a EITC, ya que no se encuentran incluidos dentro de los criterios diagnósticos utilizados24,25. Finalmente, para evaluar la evolución funcional optamos por estudiar el cambio de la CVF% en el tiempo, sabiendo que no es el mejor abordaje en pacientes que tienen tiempos de seguimiento distintos. El análisis de tiempo al evento hubiera sido un abordaje más exacto, aunque no contamos con los datos necesarios para realizarlo. Si bien consideramos que nuestro estudio aporta información de utilidad, y que está en consonancia con el último consenso intersociedades, creemos que hacen falta estudios prospectivos que evalúen sobrevida y con mayor cantidad de pacientes para responder de manera contundente la pregunta planteada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna.
Conflicto de InteresesLos autores declaran que no presentan conflicto de intereses.
Andrea, Werbach.