Dada la heterogeneidad clínica de la artritis psoriásica (APs), se han elaborado recomendaciones por grupos internacionales para orientar las decisiones terapéuticas del reumatólogo. Esta revisión sistemática (RS) tiene el objetivo de evaluar la evidencia sobre la eficacia de los FAME en APs.
MétodosBúsqueda bibliográfica en Medline, Embase, Cochrane Library, desde 2008 hasta 2014. Se incluyeron RS, EC y estudios observacionales, en pacientes con APs con evaluación de eficacia de FAME sintéticos (metotrexato, sulfasalazina y leflunomida), los siguientes desenlaces: síntomas periféricos; daño estructural radiológico periférico; síntomas axiales; entesopatía por ecografía o resonancia magnética (número de entesis antes y después del estudio); dactilitis, y uveítis.
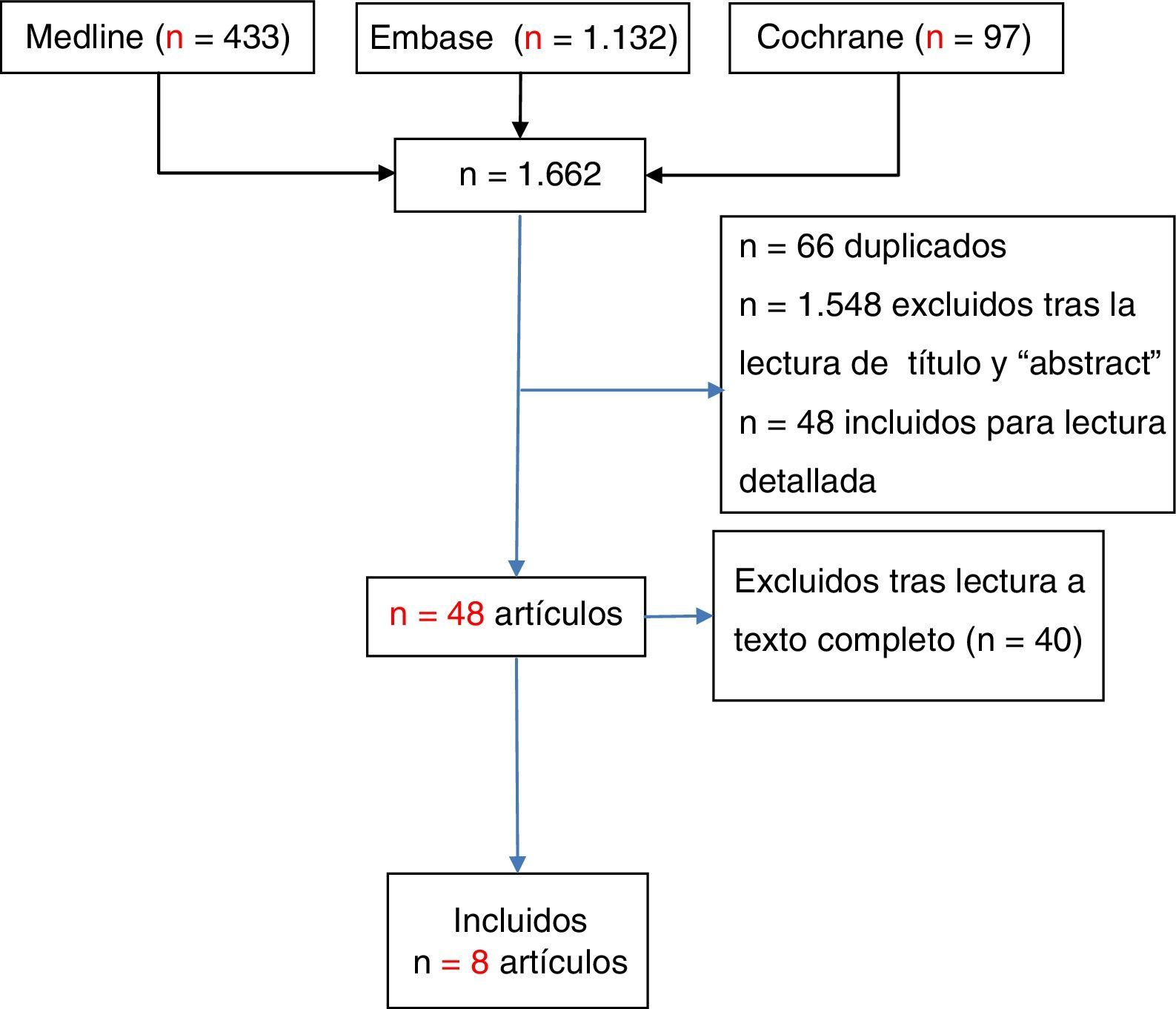
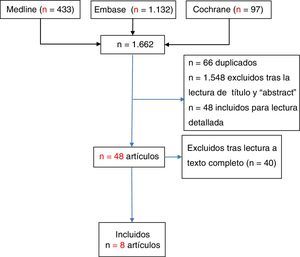
ResultadosSe recuperaron 1.662 documentos para revisar por título y «abstract» (Medline, n=433; Embase n=1.132; Cochrane, n=97), se seleccionaron 48 estudios para su lectura detallada, y se incluyeron 8 estudios.
ConclusionesYa que los estudios incluidos no son consistentes, y hay argumentos para apoyar la eficacia del metotrexato, la evidencia observada con el tratamiento de FAME en APs no es concluyente.
Due to the clinical heterogeneity of psoriatic arthritis (PsA), recommendations have been developed by international groups to guide therapeutic decisions of the rheumatologist. The objective of the current systematic review (RS) was to evaluate the evidence of efficacy of disease-modifying antirheumatic drugs (DMARDs) in PsA.
MethodsLiterature search in Medline, EMBASE, Cochrane Library, from 2008 to 2014. We included RS, randomized clinical trials and observational studies, in patients with PsA and an evaluation of efficiency of conventional DMARDs (methotrexate, sulfasalazine, leflunomide), according to the following outcomes: peripheral and axial symptoms; peripheral radiological damage; enthesitis according to power Doppler ultrasound or magnetic resonance imaging (enthesitis count before and after therapy); dactylitis; uveitis.
ResultsTitle and abstract were used to retrieve 1,662 documents for this review (Medline, n=433; EMBASE n=1,132; Cochrane, n=97), and 48 studies were selected for detailed reading; finally, 8 studies were included.
ConclusionsSince the studies included are not robust, and there are arguments to support the effectiveness of methotrexate, the evidence observed with the treatment of DMARDs in PsA is not conclusive
La artritis psoriásica (APs) es una enfermedad inflamatoria sistémica que afecta del 20 al 30% de pacientes con psoriasis. Se caracteriza por la inflamación del sistema musculoesquelético y la piel, incluyendo sus manifestaciones clínicas, la columna axial, las articulaciones periféricas, la entesitis, la dactilitis y las lesiones ungueales y cutáneas1. La evolución de algunos pacientes puede tener un curso leve, mientras que otros pueden desarrollar daño articular radiológico, destrucción articular periférica y discapacidad funcional. Se han realizado revisiones sistemáticas (RS), alguna con metaanálisis2-4, sobre la eficacia del tratamiento en la APs2-5, en las que se muestran un escaso nivel de evidencia sobre la eficacia de los FAME sintéticos. Sin embargo, y para ayudar a orientar la actitud del especialista ante la heterogeneidad de la presentación clínica y los diferentes grados de gravedad en la afectación articular1, 2 grupos internacionales, basándose en dichas RS, han realizado recomendaciones sobre el tratamiento, como la European League Against Rheumatism (EULAR)6, con un algoritmo enfocado principalmente en síntomas musculoesqueléticos, y la del Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA)7 con 5 dominios de afectación (artritis periférica, afectación cutánea y ungueal, entesitis, dactilitis y artritis axial)8. Así, para la artritis periférica activa, ambos recomiendan tratamiento con FAME, como metotrexato (MTX), sulfasalazina (SSZ) y leflunomida (LEF).
El MTX se ha utilizado frecuentemente como primer FAME en APs a causa de la eficacia mostrada en el tratamiento de las alteraciones articulares y cutáneas9. A pesar del escaso nivel de evidencia, el MTX permanece como uno de los tratamientos más frecuentemente utilizados en la APs1. En la consulta de reumatología de los pacientes derivados desde dermatología, un 30% de los casos supone la adición de un nuevo FAME, siendo el MTX el más utilizado10. La escasez de ensayos clínicos de alta calidad que apoyen su eficacia en APs obliga a preguntarse por qué el uso generalizado de MTX en APs1, qué eficacia tiene y para qué fenotipo clínico de APs. Además, aunque los ensayos clínicos no han mostrado suficiente significación de la eficacia del MTX frente a placebo, se ha considerado que el diseño de tales estudios tiene limitaciones metodológicas que no permiten extraer conclusiones definitivas11. Según lo anterior, el objetivo de este trabajo fue reevaluar de forma sistemática la evidencia disponible sobre la eficacia de los FAME en el tratamiento de APs y forma parte del proceso de actualización de la Guía de Práctica Clínica para el tratamiento de la Espondiloartritis Axial y la Artritis psoriásica de la Sociedad Española de Reumatología (ESPOGUIA)12, cuya versión previa era del 2009.
Material y métodosSe realizó una RS en 3 bases de datos: Medline, Embase y Cochrane Library, que incluyó estudios publicados en inglés, español y francés, con las fechas de búsqueda de enero del 2008 hasta noviembre del 2014, para recuperar los estudios sobre la eficacia de FAME en APs. La estrategia de búsqueda con descriptores de alta sensibilidad (MG) se muestra en el anexo suplementario con los términos (anexo).
Criterios de inclusión: siguiendo el formato PICO, se seleccionaron aquellos ECA que cumplían los siguientes requisitos: 1) pacientes adultos con APs con un número igual o mayor de 50; 2) intervención de FAME tradicionales (MTX, SSZ, LEF) frente a placebo; 3) medidas de desenlace de eficacia en términos de cambios en: a) síntomas periféricos (ACR 20/50/70, respuesta EULAR basada en el DAS28, Psoriatic Arthritis Response Criteria [PsARC]); daño estructural radiológico periférico (método Sharp/van der Heijde —manos, muñecas y pies— modificado para APs, que incluye articulaciones interfalángicas distales); b) afectación axial (BASDAI, BASFI, ASAS 20/40 5/6); c) entesopatía por ecografía o por resonancia magnética con número de entesis (MASES, LEI) a la inclusión y al final del estudio (porcentaje de mejoría); d) dactilitis, con número de dactilitis en la línea basal y al final del estudio (porcentaje de mejoría), y e) uveítis, con número de episodios antes y después del tratamiento. Se incluyeron RS de ECA (con preferencia en fase iii o iv). También se seleccionaron estudios que ayudaron a responder parcialmente a la pregunta planteada (eficacia y seguridad de FAME tradicional frente a un FAME tradicional, o frente a combinación de varios FAME tradicionales). En las preguntas dónde no se encontró evidencia proveniente de diseños de RS de ECA, se incluyeron estudios observacionales contenidos en las RS. Se excluyeron estudios que no se ajustaron a los componentes de la pregunta PICO y también abstracts, pósteres, revisiones narrativas, cartas, editoriales y cualquier tipo de estudio sin publicar. La selección de estudios fue realizada por un revisor (JM) en sucesivas fases: selección de títulos y resúmenes de los títulos seleccionados, revisión del texto completo de los estudios seleccionados y evaluación de los mismos, para eliminar artículos que no cumplían los criterios de inclusión. También se realizó una búsqueda manual en la bibliografía de los estudios incluidos. Las dudas durante el proceso de selección fueron contrastadas con 2 metodólogos de la SER (PD, DS) y se llegó a un consenso en su caso. Para gestionar las referencias bibliográficas se utilizó EndNote X7. En la lectura crítica de los estudios y evaluación de la calidad se utilizaron las plantillas del Scottish Intercollegiate Guidelines Network (SIGN)13. Para asignar el nivel de evidencia se utilizó la escala de Oxford14.
ResultadosSe recuperaron 1.662 documentos para su revisión por título y «abstract» (Medline, n=433; Embase n=1.132; Cochrane, n=97). Se seleccionaron 48 estudios para la lectura detallada, de los que se excluyeron 40 (a disposición de los solicitantes). Finalmente, 8 estudios cumplían los criterios de inclusión (fig. 1) (tabla 1 de síntesis de la evidencia). Se incluyeron, pues, 2 RS2,5, 2 EC incluidos en alguna de estas RS15,16, un EC abierto no incluido en las RS17, 3 estudios observacionales (2 estudios prospectivos18,19 y uno retrospectivo20), 2 de estos18,19 incluidos en la RS de Acosta Felquer et al.5, con un nivel de evidencia que se resume en la tabla 3. Según el fármaco considerado en la intervención, con MTX se incluyeron 2 EC15,16 y un estudio observacional20, mientras que con LEF fueron 3 estudios17-19, un EC abierto17 y 2 estudios observacionales18,19.
RS y estudios incluidos (criterios de inclusión, características de población, intervención, seguimiento)
| RS/estudio | Criterios inclusión y características de población | Intervención/dosis/seguimiento | Comparador | Resultados |
|---|---|---|---|---|
| Ash et al.2 | RS y metaanálisis, EC doble ciego aleatorizado; APs; estudios de tratamiento con AINE, FAME sintéticos (MTX, CyA, SSZ y LEF), glucocorticoides o biológicos; ≥ 5 pacientes; inglés, francés, alemán, Italiano o español. En AINE y FAME: por el escaso número recuperado de EC incluyeron estudios observacionales y registros | FAME (con criterios de inclusión para la actual RS): MTX, SSZ, LEF | Placebo AINE (Scarpa et al.16) | AINE y FAME n=1.099 cribados, n=125 analizados. Scarpa et al.16 |
| Acosta Felquer et al.5 | No detalla criterios de inclusión, aparte de la búsqueda bibliográfica expuesta anteriormente en resultados | FAME (con criterios de inclusión para la actual RS): MTX, SSZ, LEF | Placebo (Kingsley et al.15) AINE (Scarpa et al.16) | FAME: con MTX se incluyeron en la actual RS, desde 2008, 2 EC y 2 estudios observacionales (la tabla 2 muestra los respectivos resultados): – Scarpa et al.16 – Kingsley et al.15 – Behrens et al.19 – Chandran et al.20 |
| Scarpa et al.16 | APs precoz de subgrupo oligoentesoartritis<12 semanas, según criterios Moll y Wright o «sine psoriasis» de estudio previo | Grupo A (n=19) AINE 3 meses y después MTX (10mg/semana i-ms) 3 meses | Grupo B (n=16) AINE+MTX los 6 meses | Véase la tabla 2 |
| Características: ♂/♀=18/17, edad (media±DE)=25,6 (5,6) años | ||||
| Kingsley et al.15, estudio MIPA (Metotrexate In Psoriatic Arthritis) | Psoriasis clínica (cutánea o ungueal) y sinovitis inflamatoria activa ≥ una articulación periférica; AINE ≥ 1 mes; FAME discontinuado ≥ 1 mes y consentimiento informado. Exclusión: otras artropatías inflamatorias o «artritis mutilans»; esteroides sistémicos actual o en últimos 3 meses; tratamiento previo o actual con MTX; otras enfermedades graves (hepáticas, renal o cardiaca); riesgo potencial de embarazo sin medidas adecuadas anticonceptivas, hemograma anormal y pruebas de función hepática u otras contraindicaciones a MTX | MTX (n=109) (dosis objetivo 15mg/semana, inicial 7,5mg/semana, ↑ en 4 semanas a 10mg/semana y en 8 semanas objetivo 15mg/semana). n=21 pérdidas en el seguimiento, 14 discontinúan tratamiento, 7 excluidos para análisis. No eventos adversos inesperados | (n=112) placebo. n=23 pérdidas en el seguimiento, 12 discontinúan, 16 excluidos para análisis | Véase la tabla 2 |
| Características: n=221: 109/112. ♀/♂=MTX/Pbo (n, %)=53 (49)/56 (51) vs. 44 (39)/68 (61). Edad (media±DE)=46 (13)/51 (11) | ||||
| Chandran et al.20 | Pacientes con MTX (oral o subcutáneo) durante al menos 2 años, entre 1994 y 2004, se permitió FAME concomitante. Se excluyó a los tratados antes de 1994 y con MTX antes de la entrada | MTX (n=59 pacientes entre 1994-2004) | MTX (n=19 vistos en estudio previo) 1978-1993 | Véase la tabla 2 |
| Características cohorte reciente (36 ♂, edad (media)= 46 años) vs. anterior: duración APs: 8±7,9 años vs. 11,5±11,6 | ||||
| Asaduzzaman et al.17 | APs activa (≥ 3 articulaciones inflamadas y 3 dolorosas); edad ≥ 18 años; (♀ si medidas adecuadas anticonceptivas); ALT, creatinina sérica, hemograma y plaquetas dentro de rango definido. Exclusión: afectación articular axial; función inmunitaria comprometida incluyendo displasia médula ósea; infección grave no controlada; vacuna viva concurrente, y retinoides, PUVA, CyA en las 2 últimas semanas. | LEF (n=17), 100mg oral los 3 primeros días, continuando por 20mg/día. Se permitió en ambos grupos ibuprofeno, con un máximo de 1.400mg/día. n=16 completaron las 24 semanas | MTX (n=15), 10mg oral/sem., durante 6 meses; n=14 completaron 24 semanas | Véase la tabla 2 |
| Características: Bangladesh (2002-2003), razón ♂/♀: 14/2 LEF vs 13/1 MTX. Edad (media±DE) =: 41,8±13,4 vs. 37,9±9,3. Duración de APs (años): 3,2±2,4 vs. 2,8±2,2 | ||||
| Asiri et al.18 | APs que recibió solo LEF o en combinación con MTX identificados en la base de datos | LEF (n=43; 50,6%). Discontinúan 16 (35%) (eventos adversos consistentes con estudios), continúan 55 (64,7%) | LEF+ MTX (n=42; 49,4%). Discontinúan 14 pacientes | Véase la tabla 2 |
| Características: n=85, 38 ♀, 47 ♂, edad (media±DE)=51,6 (12,6), duración APs=12,3 (9,1), articulaciones inflamadas activas (n.° medio±DE) = 16 (12,9), edad diag. psoriasis y APs: 30,6 (14,1) y 39,2 (13,8). La mayoría (98%) cumplió criterios CASPAR para APs | ||||
| Behrens et al.19 | ≥ 18 años con APs activa y sin tratamiento previo con LEF, diag. por criterios Moll y Wright en APs. Exclusión: enfermedad articular no activa, nódulos reumatoides, FR+ | LEF (dosis de carga 100mg/día durante 3 días, seguido de 20mg/día oral). n=511 evaluados a las 24 semanas. Discontinúan 63 (12,3%) | Véase la tabla 2 | |
| Características: internacional, n=440 de 511; ♀ 52,2%. Edad (media±DE)=50,7±11,4. Duración APs: 6,1±6,8 años. Duración psoriasis (media±DE): 13,9±10,8 años. Dactilitis: 61,7% | ||||
AINE: antiinflamatorio no esteroideo; ALT: alanina aminotransferasa; APs: artritis psoriásica; CyA: ciclosporina; EC: ensayo clínico; EGM: valoración actividad médico; EGP: dolor (valoración actividad por paciente); FAME: fármacos antirreumáticos modificadores de la enfermedad; FR: factor reumatoide; LEF: leflunomida; MTX: metotrexato; media±DE: media±desviación estándar; NAD: recuento de articulaciones dolorosas; Pbo: placebo; PUVA: psoraleno con luz ultravioleta A; RS: revisión sistemática; SSZ: sulfasalazina.
Resultados de los estudios incluidos
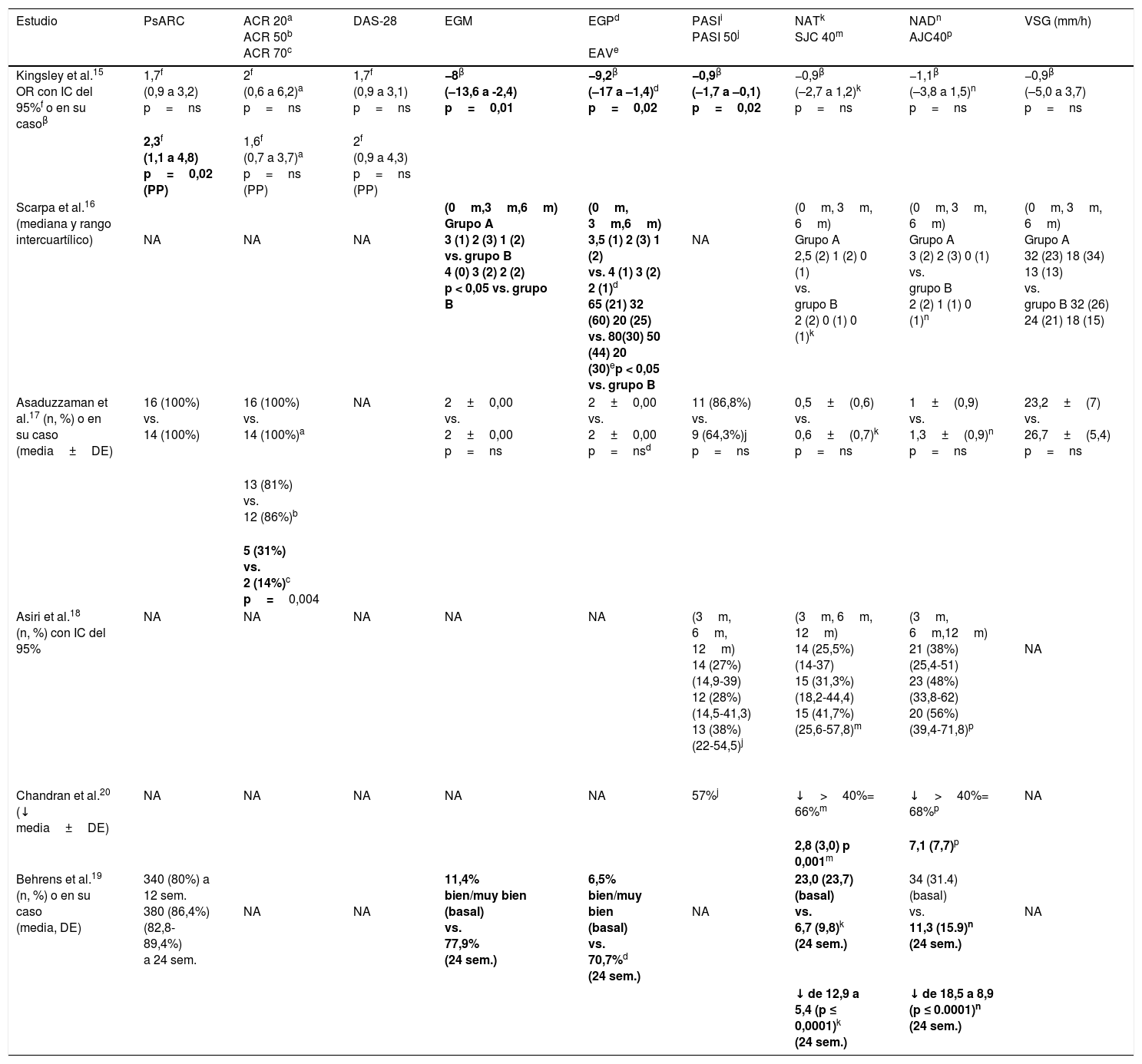
| Estudio | PsARC | ACR 20a ACR 50b ACR 70c | DAS-28 | EGM | EGPd EAVe | PASIi PASI 50j | NATk SJC 40m | NADn AJC40p | VSG (mm/h) |
|---|---|---|---|---|---|---|---|---|---|
| Kingsley et al.15 OR con IC del 95%f o en su casoβ | 1,7f (0,9 a 3,2) p=ns | 2f (0,6 a 6,2)a p=ns | 1,7f (0,9 a 3,1) p=ns | −8β (–13,6 a -2,4) p=0,01 | −9,2β (–17 a –1,4)d p=0,02 | −0,9β (–1,7 a –0,1) p=0,02 | −0,9β (–2,7 a 1,2)k p=ns | −1,1β (–3,8 a 1,5)n p=ns | −0,9β (–5,0 a 3,7) p=ns |
| 2,3f (1,1 a 4,8) p=0,02 (PP) | 1,6f (0,7 a 3,7)a p=ns (PP) | 2f (0,9 a 4,3) p=ns (PP) | |||||||
| Scarpa et al.16 (mediana y rango intercuartílico) | NA | NA | NA | (0m,3m,6m) Grupo A 3 (1) 2 (3) 1 (2) vs. grupo B 4 (0) 3 (2) 2 (2) p < 0,05 vs. grupo B | (0m, 3m,6m) 3,5 (1) 2 (3) 1 (2) vs. 4 (1) 3 (2) 2 (1)d 65 (21) 32 (60) 20 (25) vs. 80(30) 50 (44) 20 (30)ep < 0,05 vs. grupo B | NA | (0m, 3m, 6m) Grupo A 2,5 (2) 1 (2) 0 (1) vs. grupo B 2 (2) 0 (1) 0 (1)k | (0m, 3m, 6m) Grupo A 3 (2) 2 (3) 0 (1) vs. grupo B 2 (2) 1 (1) 0 (1)n | (0m, 3m, 6m) Grupo A 32 (23) 18 (34) 13 (13) vs. grupo B 32 (26) 24 (21) 18 (15) |
| Asaduzzaman et al.17 (n, %) o en su caso (media±DE) | 16 (100%) vs. 14 (100%) | 16 (100%) vs. 14 (100%)a | NA | 2±0,00 vs. 2±0,00 p=ns | 2±0,00 vs. 2±0,00 p=nsd | 11 (86,8%) vs. 9 (64,3%)j p=ns | 0,5±(0,6) vs. 0,6±(0,7)k p=ns | 1±(0,9) vs. 1,3±(0,9)n p=ns | 23,2±(7) vs. 26,7±(5,4) p=ns |
| 13 (81%) vs. 12 (86%)b | |||||||||
| 5 (31%) vs. 2 (14%)c p=0,004 | |||||||||
| Asiri et al.18 (n, %) con IC del 95% | NA | NA | NA | NA | NA | (3m, 6m, 12m) 14 (27%) (14,9-39) 12 (28%) (14,5-41,3) 13 (38%) (22-54,5)j | (3m, 6m, 12m) 14 (25,5%) (14-37) 15 (31,3%) (18,2-44,4) 15 (41,7%) (25,6-57,8)m | (3m, 6m,12m) 21 (38%) (25,4-51) 23 (48%) (33,8-62) 20 (56%) (39,4-71,8)p | NA |
| Chandran et al.20 (↓ media±DE) | NA | NA | NA | NA | NA | 57%j | ↓>40%= 66%m | ↓>40%= 68%p | NA |
| 2,8 (3,0) p 0,001m | 7,1 (7,7)p | ||||||||
| Behrens et al.19 (n, %) o en su caso (media, DE) | 340 (80%) a 12 sem. 380 (86,4%) (82,8-89,4%) a 24 sem. | NA | NA | 11,4% bien/muy bien (basal) vs. 77,9% (24 sem.) | 6,5% bien/muy bien (basal) vs. 70,7%d (24 sem.) | NA | 23,0 (23,7) (basal) vs. 6,7 (9,8)k (24 sem.) | 34 (31.4) (basal) vs. 11,3 (15.9)n (24 sem.) | NA |
| ↓ de 12,9 a 5,4 (p ≤ 0,0001)k (24 sem.) | ↓ de 18,5 a 8,9 (p ≤ 0.0001)n (24 sem.) |
En negritas, las celdas en las que el valor de p es significativo.
ACR: Colegio Americano de Reumatología; ACR 50: criterio del Colegio Americano de Reumatología de mejoría al menos del 50%; ACR 20 es ≥ 20% de mejoría; ACR70 es ≥ 70% de mejoría; DAS: índice de actividad de la enfermedad; AJC40: disminución de más de 40% articulaciones de articulaciones inflamadas activas; DE: desviación estándar; EGM: valoración actividad por el médico; EGP: valoración actividad por el paciente; IC: intervalo de confianza; m: meses; NA: no aplicable; NAD: recuento de articulaciones dolorosas; NAT: recuento de articulaciones inflamadas; ns: valor de p no significativo; OR: odds ratio; PASI: índice de la severidad del área de psoriasis; PsARC: criterios de respuesta en APs; PP: análisis por protocolo; SJC40: disminución de más del 40% de las articulaciones inflamadas; VSG: velocidad de sedimentación globular.
Resumen de evidencia: nivel y calidad de la evidencia
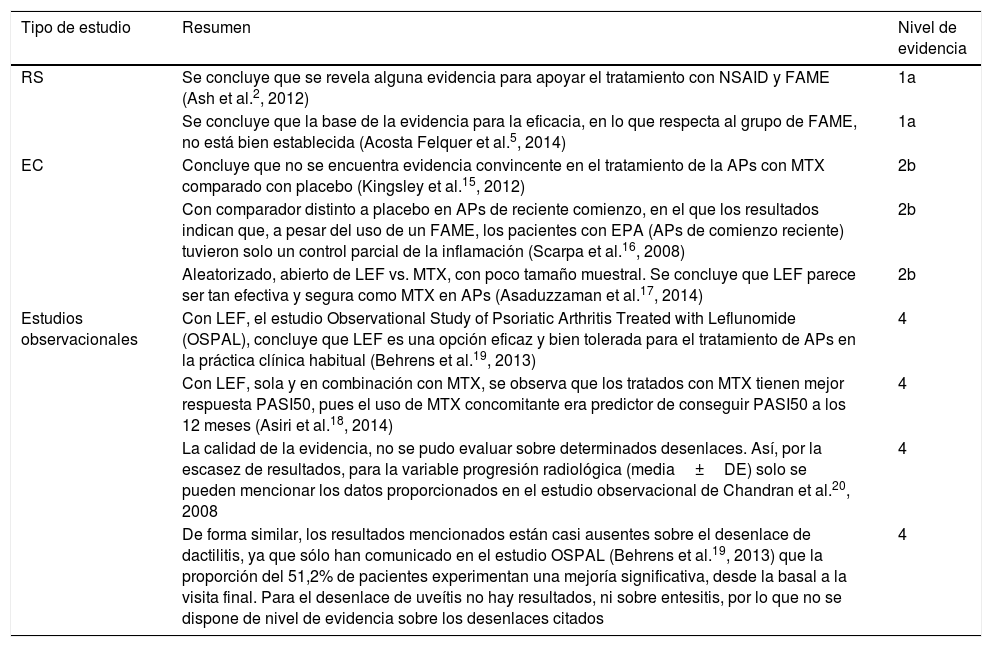
| Tipo de estudio | Resumen | Nivel de evidencia |
|---|---|---|
| RS | Se concluye que se revela alguna evidencia para apoyar el tratamiento con NSAID y FAME (Ash et al.2, 2012) | 1a |
| Se concluye que la base de la evidencia para la eficacia, en lo que respecta al grupo de FAME, no está bien establecida (Acosta Felquer et al.5, 2014) | 1a | |
| EC | Concluye que no se encuentra evidencia convincente en el tratamiento de la APs con MTX comparado con placebo (Kingsley et al.15, 2012) | 2b |
| Con comparador distinto a placebo en APs de reciente comienzo, en el que los resultados indican que, a pesar del uso de un FAME, los pacientes con EPA (APs de comienzo reciente) tuvieron solo un control parcial de la inflamación (Scarpa et al.16, 2008) | 2b | |
| Aleatorizado, abierto de LEF vs. MTX, con poco tamaño muestral. Se concluye que LEF parece ser tan efectiva y segura como MTX en APs (Asaduzzaman et al.17, 2014) | 2b | |
| Estudios observacionales | Con LEF, el estudio Observational Study of Psoriatic Arthritis Treated with Leflunomide (OSPAL), concluye que LEF es una opción eficaz y bien tolerada para el tratamiento de APs en la práctica clínica habitual (Behrens et al.19, 2013) | 4 |
| Con LEF, sola y en combinación con MTX, se observa que los tratados con MTX tienen mejor respuesta PASI50, pues el uso de MTX concomitante era predictor de conseguir PASI50 a los 12 meses (Asiri et al.18, 2014) | 4 | |
| La calidad de la evidencia, no se pudo evaluar sobre determinados desenlaces. Así, por la escasez de resultados, para la variable progresión radiológica (media±DE) solo se pueden mencionar los datos proporcionados en el estudio observacional de Chandran et al.20, 2008 | 4 | |
| De forma similar, los resultados mencionados están casi ausentes sobre el desenlace de dactilitis, ya que sólo han comunicado en el estudio OSPAL (Behrens et al.19, 2013) que la proporción del 51,2% de pacientes experimentan una mejoría significativa, desde la basal a la visita final. Para el desenlace de uveítis no hay resultados, ni sobre entesitis, por lo que no se dispone de nivel de evidencia sobre los desenlaces citados | 4 |
La RS de Ash et al.2 se realizó en 2012, con estudios entre 1962 y enero del 2010, y el objetivo era revisar la evidencia disponible en la eficacia y seguridad de todos los tratamientos farmacológicos no tópicos para APs, desde AINE a FAME y fármacos biológicos, para proveer datos al desarrollo de recomendaciones por la EULAR del tratamiento en APs (NE 1a). Asimismo, en la RS de Acosta Felquer et al.5, en 2014, el objetivo era evaluar la eficacia de diferentes tratamientos y estrategias terapéuticas para informar al desarrollo de nuevas recomendaciones GRAPPA sobre el tratamiento en APs periférica, y resumen la evidencia del tratamiento disponible. Se buscó documentación en Medline, Embase y Cochrane, desde 2006 hasta el presente. También se revisaron abstracts de EULAR y ACR, desde el 2010 hasta el 2013. En la RS de Ash et al., se concluyó que hay alguna evidencia para apoyar el tratamiento con NSAID y FAME, con buena evidencia para la eficacia de antifactor de necrosis tumoral en APs2, mientras que en lo que respecta al grupo de FAME las conclusiones de la RS de Acosta Felquer et al. eran que la base de la evidencia para su efectividad no está bien establecida5.
Al analizar los estudios aportados por la RS de Ash et al.2, en el grupo de MTX se vieron 3 EC (n=93 pacientes) que compararon MTX en monoterapia frente a placebo y 7 estudios abiertos o retrospectivos de MTX en APs. Estos estudios no reunieron los criterios de inclusión para la RS actual. Del mismo modo, con LEF como intervención, también se detallaron varios estudios que no cumplieron los criterios de inclusión para la actual RS, entre ellos un EC y 2 ensayos abiertos. En el grupo de SSZ, los estudios que incluyeron para evaluar la eficacia de este fármaco (7 ECA con comparaciones de SSZ en monoterapia vs. placebo o tratamiento sintomático) corresponden a evidencia anterior a 2008 y ya incluida en la ESPOGUIA del 2009.
MetotrexatoEl EC abierto de Scarpa et al.16, incluido en ambas RS2,5, evalúa la eficacia de MTX con un comparador distinto a placebo (AINE), a los 3 y 6 meses, en un grupo de pacientes con APs en estadio clínico precoz (n=35 APs), que se dividieron en 2 grupos según el tipo de afectación articular (tabla 1). El grupo que tuvo desde el inicio MTX alcanzó una mejoría más rápida de NAD y NAI, estadísticamente significativo a los 3 meses (p < 0,05). A los 6 meses todas las variables en ambos grupos confirmaron la mejoría previamente registrada, pero al comparar entre grupos, aparte de la mejoría significativa de evaluación global por el paciente (EGP) y evaluación global por el médico (EGM) en el grupo que añadió MTX a los 3 meses, no mostró resultado significativo (p<0,05) (tabla 2). Según estos resultados, concluyen que el MTX en APs precoz es efectivo sobre los síntomas clínicos, mientras la mayoría de los marcadores de actividad de la enfermedad permanecen sin afectarse sustancialmente. En este EC abierto se observó un escaso tamaño muestral, así como que se delimita a estudiar un estadio inicial de APs, sin enumerar las retiradas (tabla 3) (NE 2b).
El EC de Kingsley et al., estudio MIPA15, se realizó con el objetivo de comprobar la eficacia de MTX (15mg/semana), aleatorizado, comparado con placebo, doble ciego, de grupos paralelos en APs activa. El desenlace principal era el PsARC a los 6 meses y otras medidas de desenlace incluyeron ACR 20, DAS 28 y sus componentes. Se aleatorizó a 221 pacientes, n=109 con MTX y n=112 con placebo, y se analizaron 67 (61%) cumplidores válidos y 61 (54%) en los grupos activo y placebo, respectivamente (tabla 1). Los únicos beneficios de MTX fueron la disminución de la puntuación global del paciente y el médico, y la puntuación media en afectación cutánea a los 6 meses (PASI) (tabla 2). Concluyeron que no se encuentra evidencia para mejorar la sinovitis con MTX y, en consecuencia, se cuestionan su clasificación como un FAME en APs. Sin embargo, hay factores en el diseño del estudio que pudieron contribuir a los resultados observados, incluyendo un elevado número de pérdidas en el seguimiento que disminuye la validez y la conclusión del estudio, lo cual podría reflejar un sesgo de atrición, y podría sesgar el resultado. El reclutamiento de los pacientes duró 5 años, lo cual podría reflejar un elemento de sesgo de selección. Alrededor del 35% de los pacientes incluidos tuvieron afectación oligoarticular y una dosis relativamente baja de MTX, que solo se consiguió por el 78% de los pacientes (tabla 3) (NE 2b).
En el estudio observacional retrospectivo de Chandran et al.20, el objetivo primario era revaluar respecto a su estudio previo, si el tratamiento más precoz con MTX en el curso de APs y a mayor dosis obtiene mejores desenlaces en la progresión del daño radiológico articular periférico (método modificado de Steinbrocker) (tabla 1). Al igual que en el estudio previo, se usó como medida de desenlace de inflamación articular una reducción ≥ 40% en articulaciones inflamadas activas (AJC40) y el PASI para psoriasis. Con una duración de la APs menor en la última cohorte (media±DE) de 8±7,9 vs. 11,5±11,6 años y con dosis mayor de MTX (16,2 vs. 10,8mg/semana), el resultado (media±DE) fue una significativa menor progresión radiológica en la cohorte más reciente (1,5±1,8) respecto a la antigua (2,3±1,2) (tabla 2). Concluyen los autores que el tratamiento con MTX ha cambiado desde la pasada década para incluir a pacientes con enfermedad de más corta duración y menos daño radiológico, con dosis más elevadas y con mejores desenlaces clínicos y radiológicos. Sin embargo, analizaron a pacientes que continuaron MTX durante 24 meses y excluyeron a aquellos que suspendieron el tratamiento antes de 24 meses a causa de efectos secundarios o carencia de eficacia, por lo que los resultados, según comentan los autores, podrían estar sesgados hacia una mejor respuesta a MTX (tabla 3) (NE 4).
LeflunomidaEl ECA abierto, de Asaduzzaman et al.17, en 2014, compara la eficacia y la seguridad de LEF vs. MTX en APs, con 32 pacientes, en Bangladesh (tabla 1). El objetivo primario de eficacia en APs era la proporción de pacientes que cumplieran los criterios de respuesta a los 6 meses y para evaluarlo se utilizaron los criterios de mejoría de ACR (ACR 20, ACR 50 y ACR 70), el área corporal de psoriasis y el índice de gravedad cutánea (PASI). Todos los pacientes de ambos grupos obtuvieron el objetivo primario, pero para el secundario había diferencia significativa en ACR 70 a favor de LEF (tabla 2). Se concluyó que LEF parece ser tan efectiva y segura como MTX en APs. Sin embargo, en este EC abierto se observó un escaso tamaño muestral (tabla 3) (NE 2b).
El estudio observacional prospectivo de Asiri et al.18, en 2014, evalúa la efectividad y seguridad de LEF sola y en combinación con MTX en 85 APs (tabla 1). La efectividad se definió por la continuación del fármaco, la reducción ≥ 40% en articulaciones dolorosas (TJC 40), reducción ≥ 40% en recuento articulaciones inflamadas (SJC 40) y respuesta PASI 50 y PASI 75. Los resultados fueron similares entre ambos grupos (tabla 2). Se concluyó que LEF consiguió la mejoría en al menos el 50% de los pacientes al año y el tratamiento concomitante con MTX fue predictor de conseguir PASI 50 a los 12 meses (odds ratio 6,19; IC del 95%, 0,20 a 31,97). Hubo 30 (35%) pacientes que interrumpieron LEF. Los resultados se basaron sobre los pacientes que estuvieron tomando el fármaco en cada momento del estudio. Sin embargo, si se hubiera calculado la respuesta basándose en un análisis por intención de tratar, la proporción de respuesta podría haber sido mucho menor (tabla 3) (NE 4).
En el estudio observacional prospectivo, multinacional, de Behrens et al.19, en 2013, que reclutó a 514 pacientes, el objetivo era determinar la efectividad clínica y la seguridad de LEF en pacientes adultos con APs activa, con evaluación a las 12 y 24 semanas. La medida de desenlace primario era la evaluación de la respuesta según el criterio PsARC. Otras evaluaciones incluyeron la valoración global, la fatiga, el dolor, la afectación cutánea, la dactilitis y la lesión ungueal (tabla 1). Se observó una mejoría significativa en las puntuaciones y los recuentos de TJC, SJC, EGM, EGP, fatiga, dolor, enfermedad cutánea, dactilitis (desde un 46,7% en la visita basal a 51,2% [n=467] en la final) y lesiones ungueales (n=466 (32%) (tabla 2). Se concluyó que LEF es una opción eficaz y bien tolerada para el tratamiento de APs en la práctica clínica habitual, con efecto beneficioso en artritis periférica y sobre otros síntomas citados. La proporción de pacientes (n=63) que interrumpieron el tratamiento era del 12,3% (98 reacciones adversas en 62 pacientes [12,1%]; 3 graves [2 aumentos de enzimas hepáticas, una crisis hipertensiva]). No obstante, en comparación con un EC, se trata de un estudio sobre la práctica clínica habitual, con una población diversa de pacientes, amplia variedad de comorbilidades y medicación concomitante que podría ser un potencial factor confusor (tabla 3) (NE 4).
La RS no prosiguió después de la fase de síntesis cualitativa y como resultado no se obtuvo un metaanálisis, al no recuperar un número suficiente de estudios, así como por la heterogeneidad del diseño de los estudios incluidos.
DiscusiónLos resultados de la RS actual, que forma parte de la Guía de Práctica Clínica para el Tratamiento de la Espondiloartritis Axial y la Artritis Psoriásica12, concuerdan con los previos de las 2 RS incluidas2,5, pues la primera concluye que hay escasa evidencia de eficacia con el tratamiento con FAME en APs, o bien la segunda al concluir que los FAME tradicionales se utilizan para el tratamiento de la APs sin que la base de la evidencia de su eficacia esté bien establecida5. También estos resultados se sustentan en el hecho que de una manera afín a la anterior Espoguia21 del 2009, se podría decir que en la RS actual se muestra una evidencia diversa y asimétrica de los estudios: en concreto, por lo que respecta a los desenlaces evaluados, hay que mencionar que solo un estudio utiliza el daño radiológico20 y ninguno menciona la capacidad funcional ni la calidad de vida.
Los estudios con LEF obtuvieron resultados similares entre sí, pues en el EC abierto de Asaduzzaman et al.17 LEF tiene cierta eficacia y seguridad en APs, al igual que MTX, ya que el objetivo primario se obtiene en ambos grupos, y en el secundario hay diferencia significativa en ACR 70 a favor de LEF. Asimismo, en el estudio observacional de Asiri et al.18, LEF consigue la mejoría en al menos 50% de los pacientes, mientras el tratamiento concomitante con MTX se muestra como un predictor de conseguir el desenlace de PASI 50. Igualmente, el estudio observacional de Behrens et al.19 muestra que el tratamiento con LEF es una alternativa eficaz en el tratamiento de APs periférica con efecto beneficioso sobre dolor, fatiga, y dactilitis. Por otra parte, aunque el MTX sea el FAME más frecuente utilizado en APs (39%)22, podría ser por el beneficio clínico de MTX sobre la psoriasis cutánea1, pues, por ejemplo, en el estudio de Asiri et al.18, un porcentaje mayor de pacientes del grupo combinado de MTX con LEF obtuvo una respuesta PASI 50, en comparación al grupo con LEF en monoterapia.
Sin embargo, se objetiva falta de evidencia del tratamiento con MTX respecto a otros FAME en el tratamiento de APs, al igual que en revisiones previas23. Esta apreciación se ha intentado explicar según distintos autores con varias hipótesis. Así, según algunos autores podría deberse a que la evidencia del tratamiento se apoya, al igual que los desenlaces24, en su previa utilización en AR. Además, se puede considerar que el número de ensayos clínicos bien diseñados con desenlaces apropiados, así como el de estudios observacionales, es insuficiente para evaluar la eficacia y seguridad de FAME en APs1,18,25,26.
En este mismo argumento inciden Pincus et al., y otros autores, mediante un análisis reciente sobre el tratamiento con MTX27,28, en donde se evalúa el diseño del estudio, entre otras causas, para intentar explicar la influencia de los múltiples factores en el resultado y en la calidad de la evidencia; así, se exploran varias hipótesis sobre los resultados del estudio MIPA, con diferentes teorías según se exponga la alta proporción de retiradas, una relativa baja dosis de MTX, o unos criterios de inclusión de APs con enfermedad menos grave y con menos articulaciones activas15,29.
Como un resultado del escenario expuesto, aunque pueda haber algún estudio incluido que obtenga menor calidad, en tanto que la ausencia de evidencia no implica evidencia de ausencia30, en acuerdo con una RS que evalúa la calidad de 6 recientes guías clínicas que versan sobre el tratamiento de la APs (con exclusión de biológicos), la consecuencia implicaría que las guías de práctica clínica poseen suficiente calidad, ya que de forma intrínseca tienen rigor en su proceso de desarrollo y asesoran en la práctica clínica, si bien considera que alguna se puede mejorar en algún dominio o ítem26. Una limitación importante en la actual RS es que no se realizó ningún metaanálisis, al no recuperar un número suficiente de estudios, así como por la diversidad en su diseño, inconveniente ya señalado entre otros por Ceponis y Kavanaugh1. De acuerdo con las conclusiones de los estudios y las RS evaluadas2,20, si bien, según sugiere Sevrain et al., es poco probable la realización de nuevos EC por el escaso interés en estudiar antiguos medicamentos26, se puede concluir que se objetiva la necesidad de efectuar EC o estudios observacionales de calidad, con desenlaces apropiados a los «core set» propuestos por OMERACT31, que evalúen de forma adecuada la eficacia de los FAME según el perfil de heterogeneidad clínica de la APs y sustenten esta indicación, para mejorar la consistencia del nivel de evidencia y así disminuir la incertidumbre que pueda haber para guiar la decisión terapéutica de un precoz tratamiento.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesSe declara ausencia de conflictos de intereses.
Cochrane Central: 97 resultados
| #1 | “Arthritis, Psoriatic” or “psoriatic arthritis” or “psoriatic arthropathy” or “psoriasis arthritis” or “Arthritis Psoriatic” or “Arthritic Psoriasis” or “Psoriatic rheumatism” | |
| #2 | Arthrit* near/4 psoria* | |
| #3 | (Oligoart* near/4 Psoria*) | |
| #4 | “Enthesitis” or “Dactylitis” or “Uveitis” | |
| #5 | (“axial” or “peripheral” or “mixed disease”) and Psoria* | |
| #6 | MeSH descriptor: [Arthritis, Psoriatic] explode all trees | |
| #7 | MeSH descriptor: [Uveitis] explode all trees | |
| #8 | #1 or #2 or #3 or #4 or #5 or #6 or #7 | |
| #9 | methotrexate or “MTX” or sulfasalazine or “Sulfasalazine” or “sulphasalazine” or “SSZ” or “salazopyrine” or “leflunomide” or leflunomide or “LEF” or “FAME” or csDMARD or sDMARD (Word variations have been searched) | |
| #10 | “non biologic*” and “DMARDs” | |
| #11 | (Synthetic* or chemical*) and “DMARDs” | |
| #12 | #9 or #10 or #11 | 6151 |
| #13 | #8 and #12 Publication Year from 2008 to 2014 |
Medline (Pubmed): 433 resultados
(“Arthritis, Psoriatic”[Mesh] OR “psoriatic arthritis”[Title/Abstract] OR “psoriasis arthritis”[Title/Abstract] OR “Arthritis Psoriatic”[Title/Abstract] OR “Arthritic Psoriasis”[Title/Abstract] OR (Arthritis[Title/Abstract] AND psoriatic[Title/Abstract]) OR (Oligoart* AND “Psoria*”) OR “Enthesitis”[Title/Abstract] OR “Dactylitis”[Title/Abstract] OR “Uveitis”[Mesh] OR ((“axial”[Title/Abstract] OR “peripheral”[Title/Abstract] OR “mixed disease”[Title/Abstract]) AND Psoria*)) AND (methotrexate[All Fields] OR “MTX”[Title/Abstract] OR sulfasalazine[All Fields] OR “Sulfasalazine”[Mesh] OR “sulphasalazine”[All Fields] OR “SSZ”[Title/Abstract] OR “salazopyrine”[All Fields] OR “leflunomide”[Substance Name] OR leflunomide[All Fields] OR “LEF”[Title/Abstract] OR “FAME”[Title/Abstract] OR (“non biologic*”[Title/Abstract] AND “DMARDs”[Title/Abstract]) OR ((Synthetic*[Title/Abstract] OR chemical*[Title/Abstract]) AND “DMARDs”[All Fields]))
NOT (“Animals”[Mesh] NOT (“Animals”[Mesh] AND “Humans”[Mesh]))
Filters: Publication date from 2008/01/01 to 2014/12/31; English; French; Spanish
Embase: 1.132 resultados
’arthritis, psoriatic’:ab,ti OR ‘psoriatic arthritis’:ab,ti OR ‘psoriatic arthropathy’:ab,ti OR ‘psoriasis arthritis’:ab,ti OR ‘arthritis psoriatic’:ab,ti OR ‘arthritic psoriasis’:ab,ti OR (arthr*:ab,ti AND psoria*:ab,ti) OR ‘psoriatic rheumatism’:ab,ti OR (oligoart*:ab,ti AND psoria*:ab,ti) OR ‘enthesitis’:ab,ti OR ‘dactylitis’:ab,ti OR ‘uveitis’:ab,ti OR (’axial’:ab,ti OR ‘peripheral’:ab,ti OR ‘mixed disease’:ab,ti AND psoria*:ab,ti) AND (’methotrexate’/exp OR methotrexate:ab,ti OR ‘mtx’/exp OR ‘sulfasalazine’/exp OR ‘sulfasalazine’:ab,ti OR ‘sulphasalazine’/exp OR ‘sulphasalazine’:ab,ti OR ‘ssz’:ab,ti OR ‘salazopyrine’/exp OR ‘salazopyrine’:ab,ti OR ‘leflunomide’:ab,ti OR ‘leflunomide’/exp OR leflunomide:ab,ti OR ‘fame’:ab,ti OR csdmard:ab,ti OR sdmard:ab,ti OR (’non biologic’:ab,ti AND dmards:ab,ti) OR (synthetic*:ab,ti OR chemical*:ab,ti AND dmards:ab,ti)) NOT (’animals’/exp NOT (’animals’/exp AND ‘humans’/exp)) AND [embase]/lim NOT [medline]/lim AND ([english]/lim OR [french]/lim OR [spanish]/lim) AND [2008–2014]/py