Existen pacientes con artritis reumatoide (AR) que no responden de la forma deseada a la terapia biológica. Nuestro objetivo fue reconocer los atributos del FAME biológico (FAMEb) que podrían identificar al más adecuado en las primeras líneas de tratamiento de la AR.
MétodosPara reconocer los atributos que podrían definir el FAMEb, se realizó una búsqueda sistemática de la literatura acerca de aspectos generales, farmacología, eficacia, seguridad, administración y coste. A continuación, se realizó un proceso Delphi a 2 rondas entre un grupo de reumatólogos expertos en el manejo de la AR para determinar el grado de acuerdo con los atributos identificados, indicando el grado de importancia que se le daba a cada atributo. Se aplicaron 2 criterios para determinar la consistencia de los resultados: 1) sobre la base de la mediana y el rango intercuartílico, y 2) el cumplimiento simultáneo de media, mediana, desviación estándar, rango intercuartílico y coeficiente de variación. Se determinaron también la concordancia y la ratificación final del panel de expertos.
ResultadosOchenta y tres reumatólogos españoles completaron las 2 circulaciones del proceso Delphi. Ninguno de los 77 atributos identificados se consideró de baja importancia, 75 de los 77 (97,4%) se consideraron de alta importancia y 76 de los 77 (98,7%) fueron ratificados. Quince tuvieron el apoyo del 100% del grupo de trabajo.
ConclusionesQuince atributos tuvieron el apoyo del 100% del grupo de trabajo y podrían considerarse los que definirían el FAMEb ideal en las primeras líneas de tratamiento de la AR.
To date, between 17% and 35% of patients with rheumatoid arthritis (RA) do not respond as expected to the initial biological therapy. The objective of this project is to recognize and weigh the attributes of biologic DMARD (bDMARD) to identify the most appropriate for each case, in the first lines of treatment of RA (after inadequate response to at least one synthetic DMARD or previous bDMARD).
MethodsTo recognize the possible attributes that could define the bDMARD, we performed a systematic search of the literature that recognized the possible attributes involving general aspects, pharmacology, efficacy, safety, management, and cost. Then a Delphi process was conducted with two rounds among a group of selected expert rheumatologists in the management of RA indicating the degree of agreement with the attributes identified in the literature. The project was completed between February and September 2015, indicating the degree of importance that was ascribed to each attribute. Two criteria were applied to determine the consistency of results: 1) based on the median and interquartile range; and 2) on the simultaneous compliance with mean, median, standard deviation, interquartile range and coefficient of variation. The agreement and final ratification of the expert panel were also determined.
ResultsEighty-three Spanish rheumatologists participated and completed both rounds of the Delphi process. In no case was the importance of the 77 attributes identified considered to be low; 75 of 77 (97.4%) were considered highly important and 76 of 77 (98.7%) were ratified. Fifteen attributes had the support of 100% of the working group.
ConclusionsThere was a high degree of agreement concerning the selected attributes. Fifteen of them had the support of 100% of the working group and could be considered the definition of the ideal bDMARD in the first lines of RA treatment.
El objetivo principal del tratamiento de la artritis reumatoide (AR) es controlar la actividad inflamatoria y evitar las lesiones estructurales. Se recomienda instaurarlo con un fármaco modificador de la enfermedad (FAME) lo antes posible1. Se deben considerar candidatos a terapia biológica a los pacientes en los que el tratamiento con FAME sintético (FAMEs) no haya conseguido el objetivo terapéutico1,2. No obstante, se observa que entre el 17 y el 35% de los pacientes con AR no responden de la forma deseada a la terapia biológica inicial3.
La elección del FAME biológico (FAMEb) se basa, en general, en necesidades clínicas o preferencias del paciente, la experiencia del médico prescriptor y el precio o la disponibilidad del fármaco. No se suele realizar una terapia individualizada, como sería deseable, con el objeto de seleccionar el mejor fármaco para cada paciente. En otras patologías se ha avanzado notablemente en la terapia individualizada mediante el estudio de marcadores biológicos que predicen la respuesta a ciertos fármacos. Esto aún no es posible en la AR.
Por estas razones, el objetivo del presente proyecto ACORDAR es identificar y valorar los atributos que ayudarán a seleccionar la terapia con FAMEb más adecuada para cada caso.
Material y métodoEl proyecto se llevó a cabo entre los meses de febrero y septiembre del 2015.
Para responder a la pregunta de investigación «¿cuáles son los atributos relevantes del FAMEb que le hacen idóneo en las primeras líneas de tratamiento en AR?», se parte de una estrategia de búsqueda bibliográfica sistemática, siguiendo el método PICO, donde como población se toma a los pacientes adultos con AR, intervención el tratamiento con FAMEb; y resultado (outcome), los atributos generales del FAMEb, de su farmacología, eficacia, seguridad, administración y coste.
Revisando como fuentes primarias la revista Reumatología Clínica, así como la web de la Sociedad Española de Reumatología y de otras entidades de prestigio (EMA, editoriales, etc.); Pubmed, Embase y la biblioteca Cochrane Plus, se emplearon combinaciones de términos MeSH: población, «rheumatoid arthritis»; intervención, «biologic» o «biologic + DMARD», en primeras líneas; resultado, «characteristic», «efficacy», «safety», «side effects», «pharmacology», «adherence», «route-administration» y «cost».
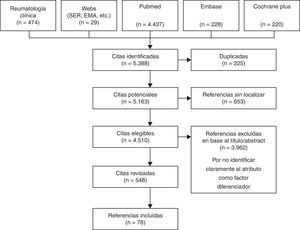
Los términos eran buscados en castellano e inglés, desde 1990 coincidiendo con el desarrollo de los FAMEb. Se revisaron los abstracts y/o artículos de un total de 548 publicaciones de las 4.510 localizadas en las distintas bases de datos investigadas, por una única persona experta en la materia, identificando atributos del producto considerados para valorar o comparar el biológico aplicado en AR, al margen del valor que estos presentaran, proponiéndose 109 atributos al comité, de los que finalmente se seleccionaron, agruparon y redactaron 77: 7sobre aspectos generales, 5 relacionados con atributos de farmacología, 18 relativos a la eficacia, 31 a la seguridad, 6 a la administración y 10 al coste (fig. 1)1,4-27.
Entre los meses de mayo, junio y julio se organizaron 12 reuniones en diferentes localidades de España, invitándose a participar a 7 reumatólogos expertos en la materia en cada una de ellas, explicando el proyecto a 83 reumatólogos de todo el país. Tras cada una de las reuniones se enviaba la primera circulación Delphi, en el que se asignaba a cada atributo el grado de importancia que se le otorgaba sobre una escala numérica Likert del 1 al 9, correspondiendo cada segmento a: del 1 al 3, menor importancia; del 4 al 6, importancia intermedia, y del 7 al 9, la máxima importancia (cuestionario incluido en el material suplementario). El proceso Delphi se completó con una segunda circulación enviada una vez recibida la respuesta de todos los participantes, en el mes de julio.
Para determinar la consistencia del grado de acuerdo, se valoraron simultáneamente 2 criterios (siendo desviación estándar [DE], rango intercuartílico [RIC] y coeficiente de variación [CV]):
- –
Criterio en base a la mediana y la dispersión, asignándosele la importancia correspondiente a la mediana, si RIC ≤ 1,00.
- –
Criterio en base al cumplimiento simultaneo: media y mediana en mismo segmento, además DE y RIC ≤ 1, y CV ≤ 0,25.
Se consideraba un resultado concordante, si menos de una tercera parte de las respuestas quedaban fuera del segmento de importancia atribuido por la mediana.
Por último, se circuló la lista de atributos con la importancia resultante junto a los criterios de consistencia y concordancia, para su ratificación por los participantes, obteniéndose así el porcentaje de los que respaldan cada atributo finalmente.
El análisis de los aspectos de segmentación y los 77 atributos seleccionados se realizaron mediante las herramientas estadísticas de Microsoft Excel 2012: media y DE; mediana, cuartiles y RIC; moda, valor mínimo y máximo, así como el CV. Se aplicó la correlación de Spearman para comprobar la concordancia entre las 2 rondas y el alfa de Cronbach para cuantificar el nivel de fiabilidad interna del cuestionario.
ResultadosLos 83 reumatólogos participantes que completaron ambas circulaciones Delphi y la ratificación tenían una experiencia media en el manejo de la AR de 19,07 años (DE ± 7,5) y una media en el uso de FAMEb de 13,19 años (DE ± 4,38), siendo jefes de servicio el 8,43%, de sección el 10,84% y adjuntos el resto (80,72%).
En la tabla 1 se muestra el resumen del grado de importancia y de acuerdo de cada uno de los atributos del estudio entre los reumatólogos. Tan solo 2 atributos relacionados con la administración del fármaco («no necesidad de dosis de carga» y «no contener látex en el dispositivo») se consideraron de importancia intermedia. En todos los demás, el grado de importancia se consideró alto. El grado de acuerdo de todos los atributos fue superior al 73% excepto los anteriormente señalados que presentaron el grado de acuerdo más bajo (el 48,19 y el 59,04%, respectivamente).
Análisis de los atributos del FAME biológico y resultados encontrados en las 2 rondas Delphi
| Atributos (por bloques temáticos) | Media | DE | Mediana | RIC | Grado de importancia | Criterios de consistencia | Ratificación (% de apoyo) | ||
|---|---|---|---|---|---|---|---|---|---|
| 1.° | 2.° | 3.° | |||||||
| General | |||||||||
| Producto con indicación aprobada en AR como primera línea de biológico | 8,14 | 0,91 | 8 | 1 | Alto | Sí | Sí | Sí | 100,00 |
| Producto con indicación aprobada en AR tras fallo a FAME biológico | 7,78 | 1,41 | 8 | 0 | Alto | Sí | Sí | 96,39 | |
| Producto recomendado en guías (SER, EULAR, ACR, etc.) como primera línea de biológico | 8,06 | 0,82 | 8 | 1 | Alto | Sí | Sí | Sí | 100,00 |
| Producto recomendado en guías (SER, EULAR, ACR) tras fracaso a un biológico previo | 7,48 | 1,58 | 8 | 1 | Alto | Sí | Sí | 96,39 | |
| Producto directamente avalado por ensayos clínicos comparativos frente a terapias activas, aleatorizados y aleatorizados frente a otras terapias biológicas | 8,54 | 0,85 | 9 | 1 | Alto | Sí | Sí | Sí | 98,80 |
| Producto adecuado para su utilización en población anciana | 6,78 | 1,56 | 7 | 2 | Alto | Sí | 80,72 | ||
| Presentar altas tasas de supervivencia del fármaco | 7,73 | 1,15 | 8 | 1 | Alto | Sí | Sí | 95,18 | |
| Farmacología | |||||||||
| Producto que aporta una estructura, mecanismo de acción y diana terapéutica diferencial | 7,52 | 1,46 | 8 | 1 | Alto | Sí | Sí | 95,18 | |
| Origen del producto (murino-humano) | 6,66 | 1,82 | 7 | 2 | Alto | Sí | 78,31 | ||
| Vida media (en unos casos será preferible mayor y en otras menor) | 6,52 | 1,73 | 7 | 2 | Alto | Sí | 75,90 | ||
| Producto que se acompaña de una baja incidencia de anticuerpos neutralizantes | 7,63 | 1,30 | 8 | 1 | Alto | Sí | Sí | 98,80 | |
| Producto que no precisa aumento de dosis a largo plazo por pérdida de eficacia (tolerancia) | 7,61 | 1,46 | 8 | 1 | Alto | Sí | Sí | 95,18 | |
| Eficacia | |||||||||
| Producto que muestra eficacia en pacientes sin tratamiento previo con FAME sintético | 7,00 | 1,35 | 7 | 1 | Alto | Sí | Sí | 84,34 | |
| Producto que muestra eficacia tras respuesta inadecuada o fracaso a FAME sintético | 7,96 | 0,96 | 8 | 0 | Alto | Sí | Sí | Sí | 98,80 |
| Producto que muestra eficacia tras fallo de otro biológico | 8,18 | 0,59 | 8 | 1 | Alto | Sí | Sí | Sí | 100,00 |
| Producto eficaz en monoterapia | 7,70 | 0,96 | 8 | 1 | Alto | Sí | Sí | Sí | 97,59 |
| Producto eficaz en AR precoz | 7,81 | 1,21 | 8 | 0 | Alto | Sí | Sí | 91,57 | |
| Producto eficaz en AR establecida | 8,51 | 0,55 | 9 | 1 | Alto | Sí | Sí | Sí | 97,59 |
| Producto con demostrada eficacia en combinación al MTX (u otro FAME) | 7,88 | 0,92 | 8 | 0 | Alto | Sí | Sí | Sí | 96,39 |
| Tratamiento que se acompaña de mejoría en la actividad inflamatoria, según los índices establecidos | 8,75 | 0,56 | 9 | 0 | Alto | Sí | Sí | Sí | 97,59 |
| Tratamiento que se acompaña de reducción en la progresión del daño articular | 8,81 | 0,43 | 9 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Tratamiento que se acompaña de mejoría de la función física | 8,66 | 0,57 | 9 | 1 | Alto | Sí | Sí | Sí | 98,80 |
| Tratamiento que se acompaña de mejoría en la calidad de vida | 8,52 | 0,72 | 9 | 1 | Alto | Sí | Sí | Sí | 97,59 |
| Tratamiento que reduce las comorbilidades asociadas a la AR | 8,11 | 0,91 | 8 | 1 | Alto | Sí | Sí | Sí | 100,00 |
| Tratamiento eficaz en manifestaciones extraarticulares | 7,99 | 0,88 | 8 | 0 | Alto | Sí | Sí | Sí | 98,80 |
| Tratamiento caracterizado por su rapidez de acción (respuesta clínica precoz) | 7,81 | 1,08 | 8 | 1 | Alto | Sí | Sí | 92,77 | |
| Tratamiento caracterizado por una alta tasa de remisión | 8,86 | 0,35 | 9 | 0 | Alto | Sí | Sí | Sí | 98,80 |
| Tratamiento caracterizado por una respuesta mantenida a largo plazo | 8,77 | 0,48 | 9 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Fármaco con evidencia de eficacia en diferentes subgrupos inmunológicos de AR | 7,76 | 1,12 | 8 | 1 | Alto | Sí | Sí | 89,16 | |
| Producto que facilite la adherencia al tratamiento | 7,96 | 0,77 | 8 | 2 | Alto | Sí | 85,54 | ||
| Seguridad | |||||||||
| Producto seguro (de forma global) | 8,86 | 0,39 | 9 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Producto seguro (de forma global) comparado con otros FAME biológicos | 8,58 | 1,00 | 9 | 1 | Alto | Sí | Sí | Sí | 98,80 |
| Seguridad demostrada a largo plazo | 8,80 | 0,44 | 9 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Producto que no presenta antecedentes de alteraciones del desarrollo prenatal ni posnatal (aunque no sea recomendado en mujeres embarazadas o lactantes e incluso se recomienda la anticoncepción) | 7,22 | 1,47 | 7 | 1 | Alto | Sí | Sí | 90,36 | |
| Producto con bajo número de contraindicaciones | 7,92 | 0,84 | 8 | 0 | Alto | Sí | Sí | Sí | 98,80 |
| Tratamiento con infrecuentes reacciones alérgicas | 8,01 | 0,59 | 8 | 0 | Alto | Sí | Sí | Sí | 98,80 |
| Tratamiento con baja incidencia de infecciones graves | 8,86 | 0,39 | 9 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Tratamiento que no aumenta la incidencia de tuberculosis | 8,49 | 0,89 | 9 | 1 | Alto | Sí | Sí | Sí | 97,59 |
| Producto que no reactiva la hepatitis B | 8,14 | 1,08 | 8 | 1 | Alto | Sí | Sí | 98,80 | |
| Producto que no reactiva la hepatitis C | 8,07 | 1,06 | 8 | 1 | Alto | Sí | Sí | 98,80 | |
| Producto que no reactiva la infección por HIV | 7,49 | 1,48 | 8 | 1 | Alto | Sí | Sí | 92,77 | |
| Producto que no aumenta la incidencia de leucoencefalopatía multifocal progresiva | 7,32 | 1,60 | 8 | 1 | Alto | Sí | Sí | 90,36 | |
| Producto que no aumenta la incidencia de neoplasias malignas sólidas | 8,73 | 0,52 | 9 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Producto que no aumenta la incidencia de neoplasias hematológicas | 8,76 | 0,46 | 9 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Producto que no aumenta la incidencia de psoriasis cutánea | 7,14 | 1,26 | 7 | 1 | Alto | Sí | Sí | 93,98 | |
| Producto que no aumenta la inducción de cuadros lúpicos | 7,23 | 1,06 | 7 | 1 | Alto | Sí | Sí | 91,57 | |
| Producto seguro en pacientes con patología cardiovascular | 8,05 | 0,56 | 8 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Producto seguro en pacientes con enfermedad pulmonar intersticial | 8,05 | 0,64 | 8 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Producto seguro en pacientes con enfermedad desmielinizante | 7,66 | 1,13 | 8 | 1 | Alto | Sí | Sí | 90,36 | |
| Tratamiento que no altere la respuesta inmunológica de la vacuna | 7,67 | 1,21 | 8 | 1 | Alto | Sí | Sí | 87,95 | |
| Producto compatible y sin interacción con los tratamientos habituales de la AR: metotrexato, sulfasalazina, hidroxicloroquina, o leflunomida, AINE, corticoides, etc. | 8,16 | 0,80 | 8 | 1 | Alto | Sí | Sí | Sí | 97,59 |
| Producto seguro con un amplio intervalo de dosis | 7,04 | 1,58 | 7 | 1 | Alto | Sí | Sí | 85,54 | |
| Mostrar reducción en la mortalidad | 8,07 | 0,93 | 8 | 1 | Alto | Sí | Sí | Sí | 100,00 |
| Tratamiento sin alteraciones del perfil lipídico aterogénico | 7,01 | 1,43 | 7 | 1 | Alto | Sí | Sí | 90,36 | |
| Tratamiento sin alteración en las enzimas hepáticas | 7,58 | 0,95 | 8 | 1 | Alto | Sí | Sí | Sí | 98,80 |
| Tratamiento sin alteración en los recuentos hematológicos | 7,81 | 0,63 | 8 | 1 | Alto | Sí | Sí | Sí | 98,80 |
| Producto cuyos excipientes evitan potenciales intolerancias | 6,93 | 1,45 | 7 | 1 | Alto | Sí | Sí | 89,16 | |
| En autoadministración, el tratamiento no se acompaña de dolor ni reacción en el punto de la inyección (caso de ser SC) | 7,57 | 1,14 | 8 | 1 | Alto | Sí | Sí | 87,95 | |
| Tratamiento con baja tasa de reacciones infusionales (caso de ser IV) | 7,94 | 0,79 | 8 | 0 | Alto | Sí | Sí | Sí | 98,80 |
| Presentar una escasa incidencia/tasa de AA | 8,57 | 0,91 | 9 | 1 | Alto | Sí | Sí | Sí | 98,80 |
| Presentar una escasa incidencia de AA graves | 8,93 | 0,26 | 9 | 0 | Alto | Sí | Sí | Sí | 100,00 |
| Administración del producto | |||||||||
| Presentar diferentes alternativas de vía de administración (IV y SC). | 6,48 | 1,77 | 7 | 2 | Alto | Sí | 73,49 | ||
| No necesidad de dosis de carga | 5,70 | 1,99 | 6 | 3 | Intermedio | 48,19 | |||
| No precisar un largo tiempo de perfusión | 6,61 | 1,68 | 7 | 2 | Alto | 80,72 | |||
| Cómodas condiciones y periodo de estabilidad del fármaco reconstituido | 6,37 | 1,88 | 7 | 1 | Alto | Sí | 84,34 | ||
| Presentarse en un dispositivo simple y ergonómico | 6,90 | 1,43 | 7 | 2 | Alto | Sí | 79,52 | ||
| No contener látex en el dispositivo | 5,84 | 1,68 | 6 | 2 | Intermedio | 59,04 | |||
| Costes | |||||||||
| Tener bajos costes directos de tratamiento | 7,88 | 0,92 | 8 | 0 | Alto | Sí | Sí | Sí | 96,39 |
| Tener un bajo coste debido a la preparación en farmacia (optimización de viales) | 7,11 | 1,53 | 7 | 1 | Alto | Sí | Sí | 85,54 | |
| Tener un bajo coste de la administración del medicamento | 7,59 | 1,10 | 8 | 1 | Alto | Sí | Sí | 91,57 | |
| Tener un bajo coste de monitorización | 7,23 | 1,22 | 7 | 1 | Alto | Sí | Sí | 91,57 | |
| Demostrar un coste efectividad incremental favorable | 7,86 | 0,95 | 8 | 1 | Alto | Sí | Sí | Sí | 98,80 |
| Tener soporte de estudios de farmacoeconomía versus otras alternativas biológicas | 7,14 | 1,52 | 7 | 1 | Alto | Sí | Sí | 86,75 | |
| Acompañarse de una reducción de la discapacidad laboral | 7,98 | 1,04 | 8 | 1 | Alto | Sí | Sí | 96,39 | |
| Mostrar una reducción de los costes indirectos | 7,41 | 1,15 | 7 | 1 | Alto | Sí | Sí | 95,18 | |
| Haber demostrado tener una pauta flexible que permita reducir dosis o prolongar. El intervalo en pacientes en remisión (optimización de dosis) | 7,93 | 1,25 | 8 | 1 | Alto | Sí | Sí | 97,59 | |
| Disponer de una presentación que coincide con la pauta terapéutica | 7,53 | 1,50 | 8 | 1 | Alto | Sí | Sí | 89,16 | |
Los coeficientes de correlación de Spearman entre las 2 rondas por bloques temáticos y los coeficientes alfa de Cronbach se expresan en la tabla 2.
Quince atributos presentaron un 100% de acuerdo y se consideraron los más relevantes (tabla 3).
Atributos con una concordancia del 100% en las 2 rondas Delphi del estudio
| Bloques temáticos | Atributos |
|---|---|
| General | Producto con indicación aprobada en AR como primera línea de biológico |
| Producto recomendado en guías (SER, EULAR, ACR, etc.) como primera línea de biológico | |
| Eficacia | Producto que muestra eficacia tras fallo de otro biológico |
| Tratamiento que se acompaña de reducción en la progresión del daño articular | |
| Tratamiento que reduce las comorbilidades asociadas a la AR | |
| Tratamiento caracterizado por una respuesta mantenida a largo plazo | |
| Seguridad | Producto seguro (de forma global) |
| Seguridad demostrada a largo plazo | |
| Tratamiento con baja incidencia de infecciones graves | |
| Producto que no aumenta la incidencia de neoplasias malignas sólidas | |
| Producto que no aumenta la incidencia de neoplasias hematológicas | |
| Producto seguro en pacientes con patología cardiovascular | |
| Producto seguro en pacientes con enfermedad pulmonar intersticial | |
| Mostrar reducción en la mortalidad | |
| Presentar una escasa incidencia de acontecimientos adversos graves | |
En este trabajo se intenta hacer un esfuerzo en favor de la medicina personalizada para poder definir el fármaco ideal para los pacientes con AR que necesitan un FAMEb tras el fracaso a uno previo o a un FAMEs. En ausencia de marcadores biológicos que puedan definir el fármaco ideal para un paciente, este tipo de estudios pueden ser útiles para una mayor eficiencia en el uso de fármacos de alto impacto.
En él participaron reumatólogos de diferentes comunidades autónomas españolas que suponían el 91,45% de la población total y el número de expertos participantes alcanzó aproximadamente al 10% de los reumatólogos activos en hospitales españoles, lo que con una heterogeneidad del 50% y un nivel de confianza del 95% tendría un margen de error de muestreo de±10,19%.
Se eligió el proceso Delphi, por ser un método científico ampliamente aceptado, que facilita alcanzar acuerdos28, facilitando además la participación de un gran número de expertos de forma telemática.
La correlación de Spearman es aceptable y su valor p muy pequeño, por lo que se puede considerar que hubo concordancia entre las respuestas de las 2 circulaciones Delphi. Por otro lado, los coeficientes alfa de Cronbach han sido siempre superiores a 0,7, demostrando la fiabilidad interna del cuestionario.
En nuestro conocimiento, este es el primer trabajo que trata de averiguar los atributos ideales para seleccionar un FAMEb. De los resultados obtenidos, podemos observar que parece que para el grupo de especialistas era muy importante disponer de la indicación aprobada en AR en primera línea, que exista una variada gama de mecanismos de acción y dianas terapéuticas, y que el fármaco no genere anticuerpos neutralizantes ni necesite un aumento de dosis para lograr su eficacia. El disponer de datos acerca de la eficacia en subgrupos inmunológicos determinados de pacientes como, por ejemplo, presencia o no de ACPA es también ampliamente respaldado en el estudio. Los aspectos sobre seguridad son también muy valorados por el grupo de especialistas.
En los aspectos relacionados con la administración del fármaco es en donde se encuentra mayor dispersión de las respuestas. La necesidad de una dosis de carga del fármaco fue, en concreto, el aspecto menos valorado del estudio.
La fortaleza de este estudio radica, en nuestra opinión, en la originalidad de intentar definir, mediante un estudio Delphi, las características ideales para elegir un FAMEb que serían las de la tabla 3. Lo deseable sería que cada uno de estos atributos fuera estudiado específicamente para demostrar que su presencia se asocia a una mayor eficacia de cada fármaco. Pero realizar estudios clínicos de este tipo sería muy caro y difícil y no parece factible que puedan llegar a realizarse. Por lo tanto, este tipo de estudios Delphi puede contribuir a ayudar a los clínicos en la elección del mejor fármaco para cada paciente.
En conclusión, podemos destacar que:
- –
Hubo un alto grado de acuerdo con los atributos seleccionados de la bibliografía.
- –
La mayoría se consideraron de importancia alta, 75 de los 77 (97,40%), mientras que ninguno lo fue de baja importancia.
- –
Hay quince atributos ratificados por el 100% de especialistas podrían definir el FAMEb ideal tras el fracaso a un FAMEs u otro FAMAb previo. Todos ellos se refieren a aspectos generales, de eficacia y de seguridad.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste proyecto ha sido financiado por Bristol-Myers Squibb, con el soporte de Scientia Salus como secretaría técnica.
Conflicto de interesesLos autores consideran que no existen conflictos de interés.
Participantes y autores, en orden alfabético de primer apellido:
Abad Hernandez, MA, H. Virgen del Puerto (Extremadura)
Alcalde Villar, M., H. U, Severo Ochoa (Madrid)
Álvarez Pio, A., H. G. de La Palma (Canarias)
Aragón Diez, A., H. U. de Getafe (Madrid)
Atanes Sandoval, A. D., C. H. U. A Coruña (Galicia)
Bernad Pineda, M., C. U. La Paz (Madrid)
Blanco Rodríguez, J. S., C. H. U. de Santiago (Galicia)
Bustabad Reyes, S., C. H. U. de Canarias (Canarias)
Caliz Caliz, R., C. H. R. Virgen de las Nieves (Andalucía)
Calvo Alén, J., H. de Sierrallana (Cantabria)
Campos Fernández, C., H. G. U. de Valencia (Comunidad Valenciana)
Caro Fernandez, N., H. G. Ntra. Sra. del Prado (Castilla-La Mancha)
Carrasco Cubero, M. C., C. H. U. de Badajoz (Extremadura)
Castaño Sánchez, M., H. C. U. Virgen de la Arrixaca (Murcia)
Castro Oreiro, S., H. U. Joan XXIII de Tarragona (Cataluña)
Chalmeta Vermejo, I., H U. i Politècnic La Fe (Comunidad Valenciana)
Chamizo Carmona, E., C. H. del Área de Salud de Mérida (Extremadura)
Cobo Ibañez, M. T., H. U. Infanta Sofía (Madrid)
Conesa Mateos, M. A., H. C. U. de Valencia (Comunidad Valenciana)
Corominas Macias, H., H. de Sant Joan Despí Moisés Broggi (Cataluña)
Díaz Torne, C., H. de la Santa Creu i Sant Pau (Cataluña)
Fernández Domínguez, L., C. H. U. de Ourense (Galicia)
Fernández Nebro, A., C. H. R. de Málaga (Andalucía)
Fernández Ortiz, A. M., H. G. de Almansa (Castilla-La Mancha)
Fernández Prada, M., H. U. de Guadalajara (Castilla-La Mancha)
Fernández-Llanio Comella, N., H. Arnau de Vilanova (Comunidad Valenciana)
Ferraz Amaro, I. A., C. H. U. de Canarias (Canarias)
Ferrer Gonzalez, M. A., C. H. R. Virgen de las Nieves (Andalucía)
Francisco Hernández, F. M., C. H. U. de Gran Canaria Dr. Negrín (Canarias)
García Gonzalez, J., H. U. 12 de Octubre (Madrid)
García Llorente, J. F., H. de Basurto (País Vasco)
García Aparicio, A. M., C. H. de Toledo (Castilla-La Mancha)
García Feito, J., C. H. de E. Torrecárdenas (Andalucía)
García Porrua, C., H. U. Lucus Augusti (Galicia)
García Vadillo, J.A., H. U. de La Princesa (Madrid)
García Vivar, M. L., H. de Basurto (País Vasco)
García-Villalba Sánchez, F., H. G. U. Reina Sofía (Murcia)
Garmendia Sánchez, M. E., H. U. de Cruces (País Vasco)
Gomez Centeno, A. D., H. de Sabadell (Cataluña)
González Álvarez, B. C., H. U. Ntra. Sra. de Candelaria (Canarias)
González Gómez, M. L., H. El Escorial (Madrid)
Gonzalez Hernandez, M. T., C. H. Gregorio Marañón (Madrid)
Gutierrez Polo, R., C. H. de Navarra (Navarra)
Hernandez Beriain, J. A., C. H. U. Insular-Materno Infantil (Canarias)
Hidalgo Calleja, M. C., C. A. U. de Salamanca (Castilla-León)
Maceiras Pan, F. J., C. H. U. de Vigo (Galicia)
Magallares López, B., H. de la Santa Creu i Sant Pau (Cataluña)
Martinea Taboada, V., H. U. Marqués de Valdecilla (Cantabria)
Martínez Gonzales, O., C. A. U. de Salamanca (Castilla-León)
Martinez López, J. A., H. U. Fundación Jiménez Díaz (Madrid)
Mateo Soria, M. L., H. U. Germans Trias y Pujol (Cataluña)
Miguelez Sanchez, J. R., H. U. de Móstoles (Madrid)
Minguez Blasco, S., Althaia Xarxa de Manresa (Cataluña)
Minguez Vega, M., H. U. San Juan de Alicante (Comunidad Valenciana)
Morcillo Valle, M., H. El Escorial (Madrid)
Morell Hita, J. L., H. Ramón y Cajal (Madrid)
Moreno Martinez, M. J., H. Rafael Mendez (Murcia)
Moreno Gil, M. P., C. H. de Cáceres (Extremadura)
Moreno Morales, J., H. G. U. Santa Lucía (Murcia)
Moya Alvarado, P., H. de Sant Pau i Santa Tecla (Cataluña)
Muñoz Fernandez, S., H. U. Infanta Sofía (Madrid)
Muñoz Jiménez, A., C. H. regional Virgen del Rocío (Andalucía)
Narvaez García, F. J., H. U. de Bellvitge (Cataluña)
Noguera Pons, J. R., H. G. U. de Elche (Comunidad Valenciana)
Oliva Ruiz, M. R., H. Comarcal del Noroeste (Murcia)
Paredes Gonzalez-Alto, S. R., H. U. de Sant Joan de Reus (Cataluña)
Peiteado López, D., C. U. La Paz (Madrid)
Pérez Sandobal, T., C. Universitario de León (Castilla-León)
Pérez Venegas, J. J., H. de Jerez de la Frontera (Andalucía)
Ponce Fernández, A., H. G. de Granollers (Cataluña)
Raya Álvarez, E. G. C., H. R. Virgen de las Nieves (Andalucía)
Reyner Echevarria, P., H. Santa Caterina (Cataluña)
Rivera Redondo, J., C. H. Gregorio Marañón (Madrid)
Rodriguez Heredia, J. M., H. U. de Getafe (Madrid)
Rodríguez Montero, S. A., C. H. Virgen de Valme (Andalucía)
Romero Yuste, S. M., C. H. U. de Pontevedra (Galicia)
Rubio Moreno, E., C. H. Regional Virgen del Rocío (Andalucía)
Rueda Cid, A., H. G. U. de Valencia (Comunidad Valenciana)
Ruiz Esquide, V., H. Clínic i Provincial de Barcelona (Cataluña)
Ruíz Jimeno, M. T., H. Sierrallana (Cantabria)
Salvador Alarcon, G., H. U. Mútua de Terrassa (Cataluña)
Urena Garnica, I. C., C. H. Regional de Málaga (Andalucía)
Valls Pascual, E., H. U. Doctor Peset (Comunidad Valenciana)