Los alfavirus tropicales tienen especial tropismo por el tejido osteoarticular. Los pacientes desarrollan cuadros crónicos reumatológicos similares a la artritis reumatoide y la espondilitis anquilosante. El prototipo es el virus Chikungunya, aunque otros virus menos conocidos en nuestro medio como Sindbis, Ross River, Mayaro, O’nyong nyong y Barmah Forest tienen un potencial para propagarse a través de vectores y causar cuadros reumatológicos crónicos.
Los movimientos poblacionales internacionales han aumentado el número de pacientes diagnosticados por estos virus tropicales en zonas no endémicas. Dado que pueden dejar secuelas y afectar la calidad de vida, es importante conocerlos. Los cambios en los ecosistemas han favorecido la expansión de mosquitos competentes, haciendo realidad el temor de transmisión local en el sur de Europa.
El objetivo de esta revisión es dar una aproximación clínica de los distintos alfavirus tropicales artritogénicos, especialmente de aquellos en los que la patología reumática crónica es más frecuente.
Tropical alphaviruses have special tropism for bone and joint tissue. Patients can develop chronic rheumatic disorders similar to rheumatoid arthritis and ankylosing spondylitis. The prototype is Chikungunya virus, although other lesser known viruses in our environment such as Sindbis, Ross River, Mayaro, O’nyong nyong and Barmah Forest viruses have the potential to be sped through vectors and cause chronic rheumatic disease.
International population movements have increased the numbers of patients diagnosed with these tropical viruses in areas in which they are not endemic. Since they can leave persistent symptoms and affect the quality of life of the patients, it is important that we be aware of them. Changes in ecosystems have favored the expansion of competent mosquitoes, making fears of local transmission in southern Europe a reality.
The objective of this review is to provide a clinical approach to the different arthritogenic tropical alphaviruses, especially those in which chronic rheumatic disease is more frequent.
Aunque los datos sobre la prevalencia de las enfermedades reumatológicas en regiones tropicales son escasos, parece que el número de casos de artritis reumatoide (AR), de espondiloartritis y de enfermedades del tejido conectivo está en aumento a nivel mundial1.
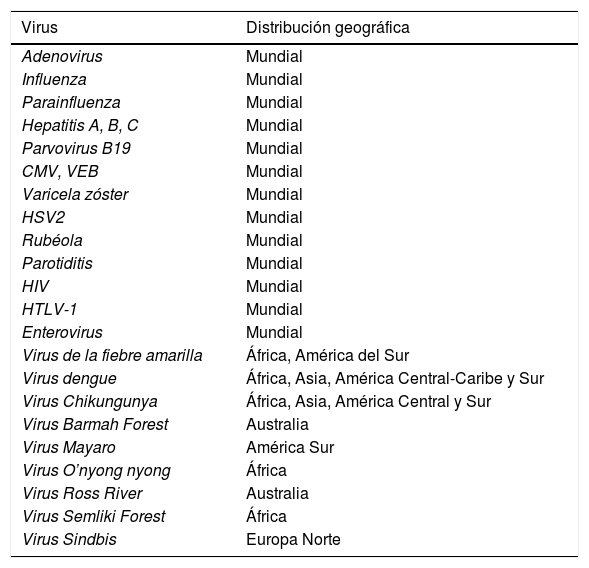
Las enfermedades infecciosas son una causa importante de sintomatología osteoarticular. En la tabla 1 se muestran los virus causantes de manifestaciones osteoarticulares y su distribución geográfica.
Virus causantes de manifestaciones osteomioarticulares y su distribución geográfica
| Virus | Distribución geográfica |
|---|---|
| Adenovirus | Mundial |
| Influenza | Mundial |
| Parainfluenza | Mundial |
| Hepatitis A, B, C | Mundial |
| Parvovirus B19 | Mundial |
| CMV, VEB | Mundial |
| Varicela zóster | Mundial |
| HSV2 | Mundial |
| Rubéola | Mundial |
| Parotiditis | Mundial |
| HIV | Mundial |
| HTLV-1 | Mundial |
| Enterovirus | Mundial |
| Virus de la fiebre amarilla | África, América del Sur |
| Virus dengue | África, Asia, América Central-Caribe y Sur |
| Virus Chikungunya | África, Asia, América Central y Sur |
| Virus Barmah Forest | Australia |
| Virus Mayaro | América Sur |
| Virus O’nyong nyong | África |
| Virus Ross River | Australia |
| Virus Semliki Forest | África |
| Virus Sindbis | Europa Norte |
El parvovirus B19, el virus de la rubéola, el virus de la hepatitis A y ciertos arbovirus son causa frecuente de afectación articular, mientras que los virus respiratorios, los enterovirus, los virus de la familia herpes virus y el virus de la parotiditis son una causa rara de artritis. Cuadros de artralgias son frecuentes en otras infecciones por flavivirus tropicales como el virus del dengue o el virus Zika. Durante la fase febril aguda por virus Zika hasta un 65% de los pacientes presentan artralgias o artritis y ocasionalmente tumefacción de manos y tobillos. Estas se manifiestan solo durante un corto periodo de tiempo y generalmente de baja intensidad. Son varias las bacterias y hongos capaces de producir cuadros de artritis reactivas o incluso de cuadros graves y prolongados2.
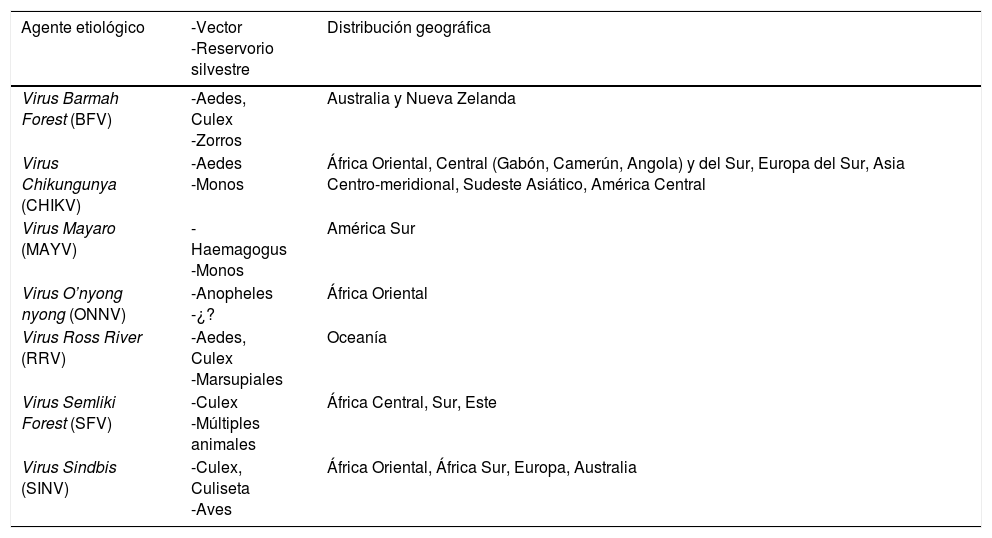
Los alfavirus tropicales tienen especial tropismo por el tejido osteomuscular. Son arbovirus que pertenecen a la familia Togaviridae, y se clasifican en los asociados a meningoencefalitis del Nuevo Mundo y en los asociados a poliartritis (tabla 2). Los reservorios de estos virus son por lo general animales silvestres y aunque el ser humano puede convertirse en reservorio, la transmisión es por mosquitos y la no vectorial de persona a persona es excepcional3.
Vector, reservorio y su distribución geográfica de los alphavirus
| Agente etiológico | -Vector -Reservorio silvestre | Distribución geográfica |
|---|---|---|
| Virus Barmah Forest (BFV) | -Aedes, Culex -Zorros | Australia y Nueva Zelanda |
| Virus Chikungunya (CHIKV) | -Aedes -Monos | África Oriental, Central (Gabón, Camerún, Angola) y del Sur, Europa del Sur, Asia Centro-meridional, Sudeste Asiático, América Central |
| Virus Mayaro (MAYV) | -Haemagogus -Monos | América Sur |
| Virus O’nyong nyong (ONNV) | -Anopheles -¿? | África Oriental |
| Virus Ross River (RRV) | -Aedes, Culex -Marsupiales | Oceanía |
| Virus Semliki Forest (SFV) | -Culex -Múltiples animales | África Central, Sur, Este |
| Virus Sindbis (SINV) | -Culex, Culiseta -Aves | África Oriental, África Sur, Europa, Australia |
La confluencia de varios factores en los últimos años ha permitido la diseminación de algunos virus tropicales que previamente estaban confinados a ciertas áreas geográficas específicas3. Quizás, los mayores determinantes hayan sido el crecimiento poblacional y el aumento de los desplazamientos internacionales, el intercambio comercial global y el cambio climático. Estamos frente a una globalización de las enfermedades tropicales, sobre todo aquellas transmitidas por mosquitos y como ejemplos paradigmáticos tenemos los virus del dengue, Chikungunya (CHIKV) y recientemente el virus Zika. Entre 2009 y noviembre de 2014, en la red española para el estudio de las infecciones importadas por viajeros e inmigrantes se reportaron 136 casos de arboviriasis importadas y hasta julio de 2015 el número aumentó a 228 casos, siendo el virus del dengue la primera causa, seguido de CHIKV4.
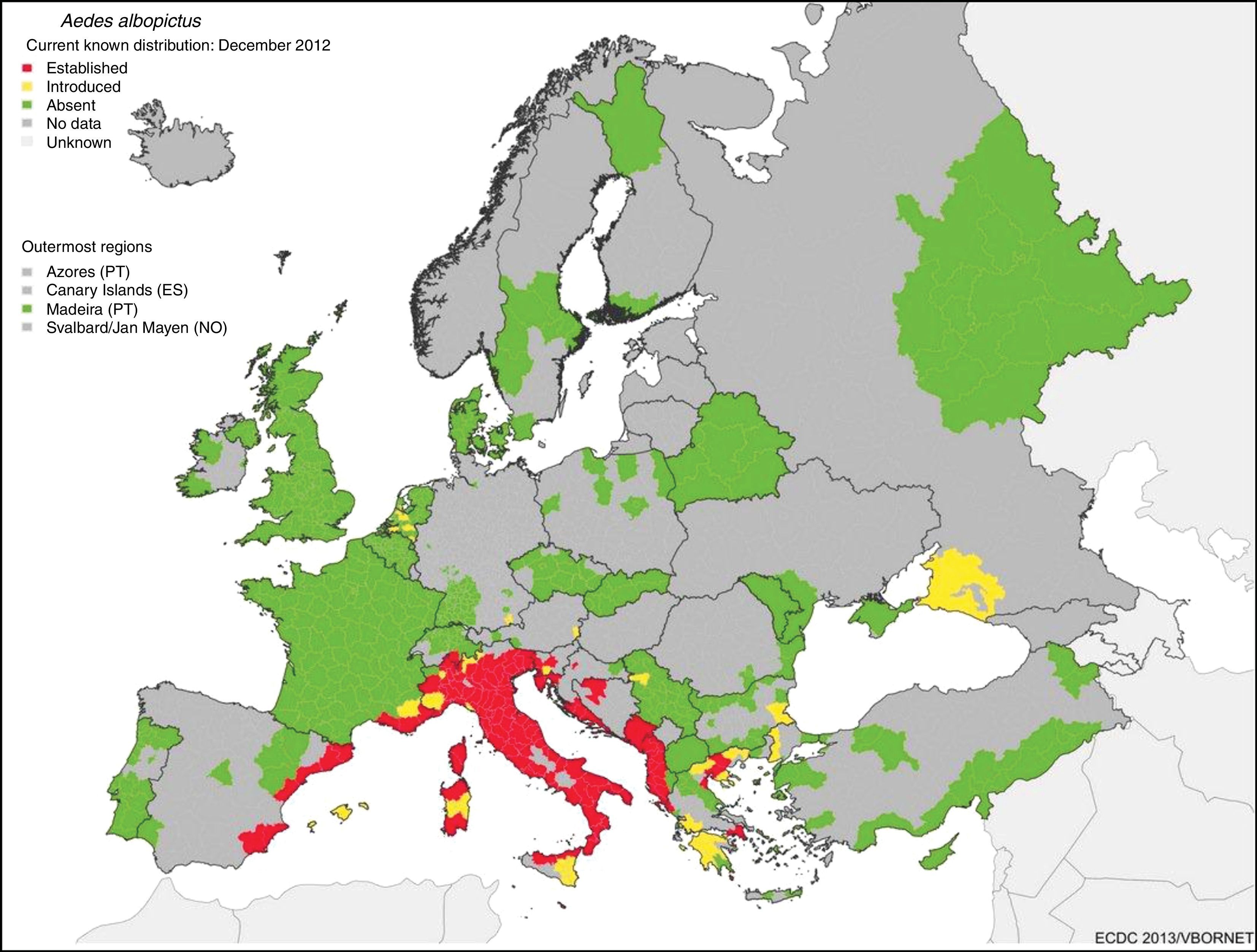
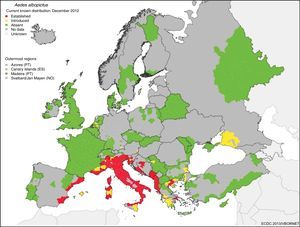
El gran potencial de diseminación de estas enfermedades desde su nicho tropical a zonas templadas se debe a que hay vectores alternativos competentes ampliamente distribuidos por la geografía mundial. Aedes albopictus (A. albopictus) se detectó por primera vez en Europa (Albania) en 1979 y en España (San Cugat del Vallés) en 2004 y desde entonces se ha expandido por todo el sur de Europa. En la figura 1 se muestra el riesgo de transmisión por el establecimiento de A. albopictus en zonas templadas como en el sur de Europa.
Las manifestaciones clínicas causadas por estos agentes virales pueden confundirse con enfermedades reumatológicas clásicas por su curso prolongado, fluctuante e invalidante en algunos casos. El objetivo de esta revisión es la de una aproximación clínica a los distintos alfavirus tropicales artritogénicos, especialmente de aquellos en los que la patología reumática crónica es más frecuente.
FisiopatologíaDespués de la inoculación por la picadura del vector, el virus se disemina vía hematógena a través de los monocitos infectados hacia el bazo, el sistema linfático y el hígado. A diferencia de otros virus, infectan hueso, músculo esquelético, inserciones miotendinosas y cápsulas articulares. Recientemente se ha observado que el virus Ross River (RRV) es capaz de afectar a los osteoblastos ocasionando resorción ósea y que el virus Sindbis (SINV) es capaz de replicarse en el periostio y tendones de los huesos largos. En animales, se ha observado una diseminación al SNC (plexos coroideos, meninges, células ependimarias), pero se desconoce si infecta neuronas o endotelio cerebral. No infecta trofoblastos, lo que explica que la transmisión vertical sea solo durante el parto. Los tejidos diana infectados presentan una extensa infiltración de linfocitos, células NK, neutrófilos y macrófagos5. La patogenia de la enfermedad crónica se debe a la conjunción de una respuesta autoinmune a antígenos virales persistentes y a la presencia crónica del virus (o de sus productos) en las células diana, con la consecuente acumulación local de mediadores inflamatorios6. En el macrófago, el virus se replica y persiste, aun cuando la carga viral sea indetectable en sangre periférica. En macacos experimentalmente infectados por CHIKV se ha observado la presencia de antígenos virales y RNA viral en órganos linfoides y tejido sinovial meses después de la fase aguda de la infección7–9. En pacientes con síntomas crónicos, las biopsias musculares y de tejido sinovial han mostrado RNA viral y antígenos del RRV, CHIKV y SINV hasta 6 meses después de la infección aguda10,11. La presencia de citoquinas proinflamatorias se asocia a la presencia de artritis o miositis. La interacción de péptidos de la cápside de los alfavirus con HLA-DR4 y HLA-DR1 puede causar artritis. En la enfermedad persistente por CHIKV se encuentran IL-6, MCP-1, MMP2, GM-CSF y MIG. En modelos animales el tratamiento con anticuerpos o inhibidores contra algunas de estas moléculas y medicamentos que acaban con los macrófagos disminuyeron la respuesta inflamatoria con evidencia de menor gravedad de las lesiones10.
Algunos pacientes previamente asintomáticos manifestarán al cabo de semanas o meses una enfermedad reumatológica crónica que cumplirá criterios de AR o espondilitis anquilosante12. Se ha demostrado que existen péptidos de la cápside de los alfavirus que tienen capacidad para interaccionar con el HLA-DR4 y el HLA-DR1, de tal manera que el virus, junto con otros factores, sería un factor desencadenante de la AR13. Se han imputado varios factores asociados a la cronicidad, tales como ser mujer, la edad mayor o igual a 45 años, una escala numérica del dolor en la fase aguda mayor o igual a 7, la afectación simétrica al inicio de la enfermedad y la existencia de osteoartritis previa14,15. Todo esto reafirma a los alfavirus como auténticos inductores de enfermedad reumática.
Virus ChikungunyaEpidemiologíaEtimológicamente la palabra «chikungunya» proviene del Makonde (dialecto hablado por un grupo étnico del sureste de Tanzania y norte de Mozambique) que significa «el hombre que camina encorvado», por el aspecto que presentan los pacientes como consecuencia del dolor articular.
El CHIKV es un alfavirus transmitido por mosquitos del género Aedes (A. albopictus, Aedes aegypti [A. aegypti]). Los picos de actividad máxima de estos vectores son durante el día, especialmente en las primeras horas de la mañana y al atardecer.
Utilizando la secuenciación genética de la proteína de la envoltura E del virus, se han identificado tres linajes independientes de CHIKV, que surgieron en forma casi simultánea: linaje de Asia, linaje de África occidental (WA) y linaje de cepas africanas del este, centro y sur (ECSA)16. El genotipo viral que afectó a las islas del Océano Índico y la India (IOL) a partir del año 2004 es diferente a los ya existentes y según los análisis filogenéticos procede del linaje ECSA, que ha desplazado al linaje autóctono de Asia17.
Durante la epidemia de la Reunión se identificó la mutación E1 en el gen de la envoltura viral (sustitución de alanina por valina en la posición 226 de la glucoproteína de superficie del ECSA-CHIKV) que permitió que el virus se adaptara satisfactoriamente al A. albopictus, mejorando su infectividad, replicación y transmisión18. Asimismo, se ha documentado la transmisión transovárica19. Al ser el A. albopictus un mosquito que sobrevive en entornos urbanos y subtropicales, permitió que la transmisión humano-mosquito-humano se extendiera por el mundo. En la tabla 3 se muestra la evolución mundial de la epidemiología y en la tabla 4 los casos importados en Europa y España.
Evolución de la epidemiología del CHIKV
| Número de casos/años | Población afectada |
|---|---|
| 1954-2004: 1 millón 2005-2014: 3-6 millones | -1952-3: se identifica el virus en distrito de Newala, Tanzania, luego en África del Este y Asia -2004 ECSA: Kenia -2005-6 ECSA: La Reunión (266.000 casos=35% población), Mauricio e India (varios millones de casos) -2007 ECSA: Italia, Emilia Romagna (217 casos) -2010 ECSA: Francia, Costa Azul (2 casos) -2013 IOL: Caribe, San Martín y diseminación al continente (1.600.000 casos, con >250 muertes, hasta octubre 2015) -2014 ECSA: Brasil (desde Angola, transmitido por A.aegypti) >1.300 casos -2014 IOL: Pacífico -2014 ECSA: Francia, Montpelier (12 casos) |
ECSA: East-Central-South African; IOL: Indian Ocean «Asian» linage.
Casos de CHIKV importados en Europa y España
| Año | Número de casos | Lugar de origen |
|---|---|---|
| Europa | ||
| 2005-2006 | 783 | Francia, importados de la Reunión e Islas Comoras |
| 2009-2013 | 547 | 38% Asia 19% Islas del Índico (Comoras, Maldivas) 17% Sudeste Asia |
| 2014-2015 | 1 450 | 81% Caribe 11% Resto de América 2% África 1% Asia |
| España | ||
| 2008-2014 | 264 | 51% República Dominicana 49% Resto de América (Venezuela, Haití) |
Otras formas de transmisión no vectorial documentadas son la vertical (50% en pacientes virémicas al parto) y por trasplante corneal. La vía sanguínea no está documentada pero se considera como posible.
Una vez expuesto al CHIKV los individuos desarrollan inmunidad prolongada que los protege de la reinfección.
Antes del 2004 los estudios realizados sobre el CHIKV eran escasos, probablemente porque se le consideraba una enfermedad benigna y de poca trascendencia. Pero tras la epidemia en las Islas del Océano Índico (2004-2011), donde se reportó una tasa de ataque de hasta el 50%, se evidenciaron cuadros invalidantes graves y crónicos. A partir de ese año existe abundante literatura sobre la evolución de las manifestaciones reumatológicas de los pacientes afectados en epidemias pasadas donde se evalúa el pronóstico de la enfermedad20.
ClínicaSe describen 3 fases clínicas: la fase aguda, desde la semana 0 hasta la semana 3; la fase posaguda, desde la semana 4 hasta la 12 y; la fase crónica, más allá de la 12 semana tras la aparición de los síntomas.
Entre el 5 y 18% de los pacientes jóvenes (<25 años) la infección puede presentarse de manera asintomática. El período de incubación es entre 3-7 días (rango 1-12).
Durante la fase aguda aparece un cuadro de fiebre alta (90-95%), poliartralgias (>80%) y otros síntomas como dolor generalizado, mialgias y exantema (36-64%)21. Este último es de tipo maculopapular distribuido en tronco y extremidades y se presenta a los 2-5 días del inicio de la fiebre. La afectación articular es de patrón simétrico, bilateral, de predominio distal y poliarticular (hasta 10 grupos articulares), siendo las más afectadas las interfalángicas, las articulaciones de las muñecas y tobillos. Las articulaciones axiales y proximales también pueden estar comprometidas e incluso con derrames articulares importantes en rodillas y hombros. El cuadro es incapacitante y es frecuente que se acompañe de edema periarticular y tenosinovitis22. De todas las series estudiadas se ha observado que aproximadamente un 43% de la población adulta se recupera completamente en 3 semanas.
Durante la epidemia en la Isla La Reunión (2005-2006) se observaron cuadros atípicos agresivos neurológicos (encefalopatía, parálisis flácida, síndrome de Guillain-Barré), mucocutáneos, respiratorios, de fracaso renal y hepático. Aunque la mortalidad global fue baja, entre 0,01-0,1%, los casos graves se presentaron en pacientes con comorbilidades y mayores de 75 años. Además, se observó una tasa de transmisión vertical del 50% cuando la madre estaba en la fase de viremia (desde 4 días antes hasta 2 días después del parto) y se describieron casos de abortos espontáneos y complicaciones neonatales (afectación del SNC, hemorragias y miocarditis). La cesárea no fue eficaz de impedir la transmisión y no se demostró la transmisión por la lactancia23.
Los síntomas de la fase posaguda son similares a los de la fase aguda pero con menor intensidad. Se describen exacerbaciones del dolor (en las mismas articulaciones afectadas inicialmente o en otras no afectadas previamente), edema periarticular y sinovitis.
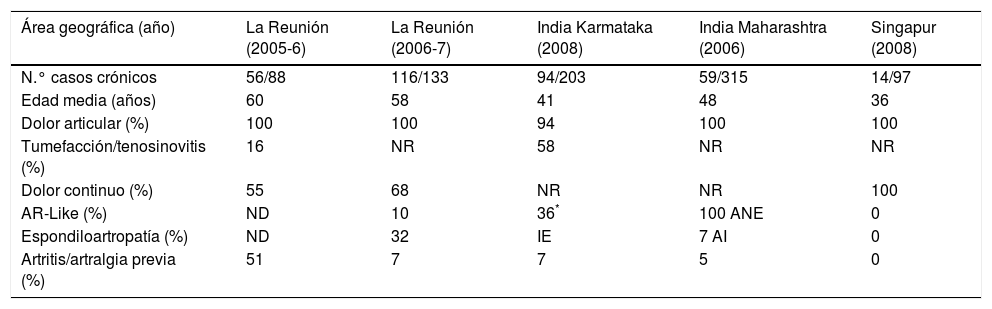
Los cuadros reumatológicos durante la fase crónica después de la infección por CHIKV pueden tener una evolución intermitente o persistente. La primera se caracteriza por la fluctuación entre periodos libres de enfermedad y reaparición de los síntomas y la segunda por síntomas continuos sin remisión21. En la tabla 5 se muestran algunos estudios que en los últimos años han evaluado el compromiso reumatológico crónico causado por el CHIKV22,24. La localización de la afectación articular en la fase crónica suele ser la misma que en la fase aguda, de tipo simétrica y en menor proporción de tipo migratoria. La mitad (41-79%) de los pacientes relatan rigidez matutina (>30 min de duración)14, también se ha descrito edema de partes blandas, síndrome del túnel carpiano, neuropatía de fibras pequeñas y síndrome de Raynaud. La afectación periarticular comprende la tenosinovitis, tendinitis con riesgo de rotura de tendón, entesitis, bursitis, capsulitis y periostitis. Otros signos asociados son las mialgias, astenia, alteración de la calidad del sueño y problemas neuropsicológicos. La duración de los síntomas articulares puede ser de años y suele acompañarse de fatiga, cefalea o humor depresivo, con repercusión importante en la calidad de vida25,26.
Síntomas reumatológicos crónicos por CHIKV (10-36 meses tras el cuadro agudo)
| Área geográfica (año) | La Reunión (2005-6) | La Reunión (2006-7) | India Karmataka (2008) | India Maharashtra (2006) | Singapur (2008) |
|---|---|---|---|---|---|
| N.° casos crónicos | 56/88 | 116/133 | 94/203 | 59/315 | 14/97 |
| Edad media (años) | 60 | 58 | 41 | 48 | 36 |
| Dolor articular (%) | 100 | 100 | 94 | 100 | 100 |
| Tumefacción/tenosinovitis (%) | 16 | NR | 58 | NR | NR |
| Dolor continuo (%) | 55 | 68 | NR | NR | 100 |
| AR-Like (%) | ND | 10 | 36* | 100 ANE | 0 |
| Espondiloartropatía (%) | ND | 32 | IE | 7 AI | 0 |
| Artritis/artralgia previa (%) | 51 | 7 | 7 | 5 | 0 |
AI:artritis inflamatoria; ANE:artritis no específica; AR:artritis reumatoidea; IE:artritis inflamatoria y erosiva; ND: no detectado o prevalencia no evaluada; NR: no reportado.
Se estima que el 5% de los pacientes que llegan a la fase crónica sufrirán un verdadero reumatismo inflamatorio crónico similar a la AR (1/3 con anticuerpos antipéptido citrulinado) o la espondiloartritis (ocasionalmente HLA B27+) o poliartritis indiferenciada (poliartritis crónica sin criterios de artritis reumatoide ni de espondilitis).
DiagnósticoSe define como «caso típico» el paciente con clínica compatible (fiebre >38,5°C y artralgia de inicio súbito), con antecedente epidemiológico (residente o visitante de áreas con transmisión local del CHIKV en los últimos 15 días) y con una prueba microbiológica diagnóstica positiva (PCR o serología). Se define como «caso grave» cuando el paciente presenta disfunción importante de al menos un órgano y que requiere hospitalización24,27.
Las pruebas diagnósticas a realizar dependen del tiempo de evolución que presente el paciente. La detección genómica por PRC es la más precoz. Los anticuerpos específicos IgM, se detectan desde el 5.° día de la infección y los IgG entre el 7.°-10.° día, cuyo pico máximo es a los 15 días. En los cuadros persistentes se ha llegado a detectar anticuerpos IgM hasta 6 meses después del cuadro agudo. Por tanto, se recomienda solicitar la PCR entre 0-5.° día, serología y PCR entre el 5-7.° día y solo serología a partir del 7.° día de la infección28. Se solicitarán otras pruebas microbiológicas durante la fase aguda cuando se sospechen otros agentes que puedan causar cuadros clínicos similares (sepsis, dengue, malaria, leptospirosis, etc.).
Otras pruebas de laboratorio ayudan al diagnóstico. Durante la fase aguda se puede observar leucopenia, linfopenia, leve trombocitopenia y elevación leve de aminotransferasas. Pero no suele ser necesario realizar más pruebas adicionales a no ser que el paciente tenga una enfermedad atípica o complicada. En la fase posaguda es apropiado realizar pruebas para descartar otras enfermedades que puedan causar afectación reumatológica como las enfermedades autoinmunes, gota, hepatitis crónica, disfunción tiroidea, etc. Si durante cualquiera de las fases de la enfermedad se detecta un derrame articular moderado-grave, se deberá valorar la punción articular para confirmar la naturaleza inflamatoria y excluir otras causas (gota, artritis séptica, etc.).
Las técnicas de imagen no se recomiendan durante la etapa aguda. Se pueden solicitar pruebas radiográficas si existe duda diagnóstica o enfermedad grave de más de 6 semanas de evolución. En la fase crónica está indicada la realización de radiografías de manos, muñecas y pies si la sintomatología es periférica, o bien de pelvis y columna dorso-lumbar si la sintomatología es axial. Se solicitará ecografía en caso de sospecha de rotura de tendón o compromiso de partes blandas27.
Tratamiento y prevenciónDurante la fase aguda el tratamiento es principalmente analgésico, teniendo en cuenta el empleo escalonado de los mismos. El analgésico de primera elección es el paracetamol, sin exceder los 4g/día24. La adición de AAS o AINE puede estar recomendada. El AAS está contraindicado durante los primeros 14 días de la infección si no se ha excluido dengue como agente causal (riesgo de complicaciones hemorrágicas) o el paciente es menor de 12 años (riesgo de síndrome de Reye). El uso de glucocorticoides no se recomienda a no ser que existan complicaciones como neuritis o encefalopatía. El uso de opiáceos como la morfina debe reservarse solo para los pacientes graves. En pacientes de mayor edad y en niños puede ser necesario tratamiento de soporte.
La fase subaguda se trata con AINE (cambiando de familia si no es efectivo tras 10 días de tratamiento). Los glucocorticoides sistémicos están indicados solo en cuadros poliarticulares y especialmente cuando se asocia a tenosinovitis, sinovitis activa, o en el caso de resistencia o contraindicación para usar AINE. La dosis de prednisona recomendada es de 10mg/d durante 5 días con disminución progresiva en 10 días en casos de afectación moderada y de 0,5mg/kg/d durante 5 días con disminución progresiva durante al menos 10 días (máximo 4 semanas) en casos graves y continuar con AINE para evitar el rebote de los síntomas. Las infiltraciones articulares están indicadas en aquellos pacientes con capsulitis o sinovitis que no respondan al tratamiento con AINE. Pueden prescribirse analgésicos generales o medicamentos para el tratamiento del dolor neuropático si estuviera presente (pregabalina, gabapentina) y se pueden usar opiáceos si el dolor es muy intenso. Se debe considerar también la fisioterapia complementaria y analgésica (presoterapia, crioterapia, ortesis, etc.) y el tratamiento de las enfermedades asociadas.
El tratamiento de la fase crónica es similar al de la fase subaguda. Se recomienda derivar al paciente a un especialista en reumatología para su valoración y tratamiento. La cloroquina no ha mostrado ser efectiva en las manifestaciones musculoesqueléticas crónicas aunque los estudios realizados tuvieron un tamaño muestral pequeño29. Durante la epidemia de La Reunión muchos pacientes fueron tratados con metotrexato y otros agentes modificadores de la enfermedad30. Ganu et al. reportaron los resultados de 16 pacientes tratados en los que solo 2 (12,5%) tuvieron una buena respuesta a la combinación de hidroxicloroquina y sulfasalacina; 14 necesitaron la adición de MTX en dosis de 15-20mg por semana en pulsos orales o inyectables, obteniéndose una buena respuesta en 10 de ellos (71,4%)31. En la tabla 6 se muestra el tratamiento del reumatismo crónico tras la infección por CHIKV propuesto por la Sociedad Francesa de Reumatología27.
Tratamiento del reumatismo crónico poschikungunya
| Tipo de presentación | Tratamiento recomendado |
|---|---|
| Artritis reumatoide después de CHIKV | -Primera línea: metotrexato -Segunda línea: otros FAME: leflunomida, sulfasalazina -Tercera línea: agentes biológicos |
| Espondiloartritis después de CHIKV | -Primera línea: AINE -Segunda línea: metotrexato o sulfasalazina si hay sinovitis periférica. Agentes biológicos si hay alguna contraindicación o efecto adverso de los AINE o FAME |
| Poliartritis indiferenciada después de CHIKV | -Primera línea: AINE -Segunda línea: glucocorticoides -Tercera línea: metotrexato o hidroxicloroquina para disminuir la dosis glucocorticoides. |
AINE: antiinflamatorios no esteroideos; CHIKV: virus chikungunya; FAME: fármacos modificadores de la enfermedad.
Fuente: Simon et al.27.
La prevención, al no existir vacuna ni quimioprofilaxis medicamentosa, se basa en la utilización de medidas de barrera durante la estancia en áreas de alta transmisión con el fin de evitar la picadura del mosquito vector. Tales medidas incluyen vestir ropa que cubra las áreas más expuestas, el uso de repelentes de insectos y dormir bajo mosquiteras, preferiblemente impregnadas con insecticidas residuales. Durante la fase aguda (virémica) se debería considerar el aislamiento altruista del paciente allá donde existan vectores competentes.
Virus SindbisEpidemiologíaLa infección por este virus es frecuente en el Norte de Europa, principalmente en Finlandia (enfermedad de Pogosta). Las epidemias suelen presentarse cada 7 años, mayormente entre agosto y septiembre (en relación con la proliferación vectorial), con cientos o miles de casos reportados. La última de ellas ocurrió en 2002 con 597 casos32. Los vectores principales son especies ornitofílicas de Culex spp. y Culiseta spp, aunque también se ha aislado el virus en mosquitos Aedes spp.y en garrapatas. Dado que se han encontrado anticuerpos en aves como el urogallo, se plantea la hipótesis de que estos podrían actuar como reservorio.
ClínicaLa mayoría de las infecciones suelen ser asintomáticas. El periodo de incubación suele ser de 4 días (6-18 días). Los síntomas típicos incluyen exantema papular (96%), síntomas articulares (96%), fatiga (77%), mialgias (62%) y cefalea. La presencia de fiebre y síntomas respiratorios altos se ha descrito en un 36% de pacientes. El exantema suele durar unos 6 días y localizarse en extremidades y torso. Las articulaciones más afectadas son las rodillas, tobillos, manos, pies y muñecas33. Suele cursar con escasa repercusión a nivel analítico, sin evidencia de alteraciones en el hemograma ni en la coagulación. Los pacientes que manifiestan persistencia de síntomas (a los 6 meses de la infección) pueden cursar con edema articular, mialgias, tendinitis y niveles de IgM aún detectables en suero. Estudios recientes indican que hasta el 50% mantienen los síntomas articulares al año, y que a los 3 años el 25% de ellos aún tiene dolor articular y el 4% manifiesta artritis34.
DiagnósticoEl diagnóstico de la infección se realiza con la detección de anticuerpos IgM e IgG específicos en la primera y segunda semana de la enfermedad respectivamente. Sin embargo solo se detectan en el 40% de pacientes34. La PCR no suele ser útil para el diagnóstico ya que debido al corto tiempo y bajo nivel de viremia suele ser negativa, aunque podría ser de utilidad para detectar el virus en mosquitos y en huéspedes potenciales32.
Tratamiento y prevenciónEl tratamiento es sintomático. La prevención mediante el uso de medidas barrera. No hay vacuna disponible.
Virus O’nyong nyongEpidemiología«O’nyong nyong» significa en las lenguas nilóticas de Sudán y Uganda «debilidad de las articulaciones». Este virus fue aislado por primera vez en 1959 en Uganda desde entonces han ocurrido tres grandes epidemias. La primera entre 1959-1962, en la que se vieron afectadas más de 2 millones de personas, y las dos últimas en 1996 y en 2002 respectivamente35. Este virus tiene orígenes genéticos similares al CHIKV y muchas infecciones por virus o’nyong nyong han sido atribuidas al CHIKV, sin embargo a diferencia de otros alfavirus es transmitido por mosquitos Anopheles (Anopheles gambiae y Anopheles funestus) que son también vectores de la malaria. No se ha llegado a identificar un reservorio animal y se cree que el ser humano es el único hospedador.
ClínicaEn la mitad de los casos la infección evoluciona de manera asintomática. El periodo de incubación suele ser de 8 días. La enfermedad se caracteriza por un cuadro de inicio súbito de fiebre, cefalea, poliartralgia simétrica o artritis, exantema papular o maculopapular generalizado (60-70%). Puede cursar con dolor faríngeo, dolor ocular, dolor torácico, malestar general, linfadenopatías con frecuencia en la zona cervical posterior y síndrome de ojo rojo en un 50% de pacientes36. Puede detectarse una leve neutropenia durante la fase aguda. La duración de las artralgias suele ser de una semana pero se han reportado casos de hasta 90 días de duración. Las articulaciones más afectadas son rodillas (90%), tobillos (83%), hombros (75%), muñecas (75%) y dedos de la mano (63%). Los dolores suelen ser invalidantes, impidiendo la movilización hasta durante 28 días en algunos casos. No se han reportados casos mortales secundarios a esta infección.
DiagnósticoEl virus puede ser amplificado por PCR desde el tercer día de la enfermedad. Se detectan anticuerpos específicos IgM, cuyo pico ocurre a los 21 días de iniciada la enfermedad y que persisten hasta un mes, y anticuerpos IgG que se elevan a partir de la tercera semana del inicio de los síntomas. La serología tiene reactividad cruzada con el CHIKV.
Tratamiento y prevenciónEl tratamiento es solo sintomático, siendo de primera elección el paracetamol, asociado o no a AINE. El uso de repelentes y mosquiteras son las medidas habituales para evitar la picadura del mosquito. No hay vacuna disponible.
Virus Ross RiverEpidemiologíaEl virus fue aislado por primera vez en 1963 en mosquitos colectados cerca del río Ross en Townsville al norte de Queensland, Australia. Este virus puede causar enfermedad tanto en humanos como en animales (caballos). Se transmite entre mamíferos marsupiales, siendo estos el reservorio. Los vectores principales son mosquitos Aedes vigilax (A. vigilax), Aedes camptorhynchus (A. camptorhynchus) y C. annulirostris, que se encuentran confinados en Australia y en la región Asia-Pacífico37. La incidencia de la infección por RRV es de 5.000-8.000 casos anuales, habiéndose declarado en junio 2015 un total de 7.552 casos (la mayor cifra desde 1996). El pico de transmisión es entre los meses de febrero y abril38. En Australia la enfermedad se presenta de forma endémica en el norte (Queensland) y de forma estacional o epidémica en el sur (New South Wales). También afecta otras regiones como Papua Nueva Guinea, Timor Este e Islas Salomón.
ClínicaLa enfermedad afecta principalmente a los adultos entre 20 y 60 años, siendo más susceptibles aquellos con enfermedad reumatológica previa. La infección es rara en niños y se presume que se debe a una diferencia en la respuesta inmune comparada con los adultos. El RRV es capaz de afectar las vías de funcionamiento de los osteoblastos causando un incremento de resorción ósea39.
El período de incubación es de unos 9 días (3-21 días). El cuadro clínico se inicia súbitamente con artralgias incapacitantes, acompañándose de exantema maculopapular (66%) en extremidades y tronco y que dura entre 5-10 días, síndrome constitucional (50%) y fiebre (33%). Analíticamente se observa una elevación de la VSG sin alteraciones relevantes en el hemograma. Los afectados pueden tener incapacidad para trabajar durante los primeros 2-3 meses. La fase aguda de la enfermedad se resuelve paulatinamente en los meses sucesivos pero son frecuentes remisiones y exacerbaciones de los síntomas (artralgia, entesitis, efusión articular, mialgia, fatiga) durante más de un año40–42.
DiagnósticoEl diagnóstico se puede realizar a través de la detección de anticuerpos específicos, pero tiene la desventaja de tener reacciones cruzadas con otros virus similares como dengue que circula en la misma zona. La respuesta IgM ocurre a los 7-10 días de la infección y el pico máximo es a las 2-3 semanas. Mediante técnicas de PCR se puede amplificar el virus durante los primeros 7 días de la enfermedad en la sangre o en el líquido sinovial37.
Tratamiento y prevenciónEl tratamiento se realiza fundamentalmente con medidas de soporte y analgésicos (paracetamol y AINE). La efectividad del tratamiento fue evaluada en un estudio prospectivo con 255 pacientes y encontraron que el 36,4% sentía mayor alivio de los síntomas con AINE y solo un 16,4% mejoraban con paracetamol o aspirina. La terapia física (natación, hidroterapia o masajes) fue beneficiosa en un 10% de los pacientes mientras que en el 24% fue el único tratamiento que alivió los síntomas43. El uso de repelentes y mosquiteras son las medidas habituales para evitar la picadura del mosquito. No hay vacuna disponible.
Virus Barmah ForestEpidemiologíaEndémica en Australia (donde se aisló por primera vez en 1974, en Victoria) con una incidencia de 13,2 por 100 000 habitantes. Tiene carácter estacional con picos de transmisión de febrero a abril44,45. Los vectores principales son A.vigilax, Aedes procax, A. camptorhychus y en zonas urbanas Ae. notoscriptus y Culex annulirostris (C. annulirostris). Dado que comparten el mismo vector y la misma distribución geográfica no es raro encontrar personas con infecciones mixtas por RRV y BFV. Aunque se han encontrado anticuerpos neutralizantes en muchos vertebrados (marsupiales, caballos, perros), la infección experimental en estos animales ocasiona un nivel muy bajo de viremia para que el vector pueda adquirir el virus46,47.
ClínicaLa mayoría de las infecciones son subclínicas o inaparentes. La infección puede ocurrir a cualquier edad pero la población que se ve más afectada es aquella entre 45-64 años.
La enfermedad tiene un periodo de incubación entre 5-21 días y suele iniciarse súbitamente con fiebre, artralgias incapacitantes y exantema maculopapular47. El último brote de BFV ocurrido en febrero del 2002 recoge los datos de 40 pacientes, en los cuales el 95% presentó artralgias, el 72,5% exantema, el 62,5% cefalea, el 52,5% mialgias, el 52,5% fiebre y el 42,5% escalofríos48. La poliartralgia es muy común y las articulaciones más afectadas son las rodillas, muñecas, tobillos y articulaciones de la mano. Se han descrito casos de derrame articular con hallazgo de monocitos. Usualmente hay una elevación leve de marcadores inflamatorios como la PCR o la VSG. No suelen encontrarse alteraciones en el hemograma. Hasta un 10% de casos se mantienen con artralgias durante un periodo de más de 6 meses49.
DiagnósticoSe realiza a través de la detección de anticuerpos IgM específicos o seroconversión de IgG. Hasta un 19% muestran reacciones cruzadas con otras viriasis. Mediante técnicas de PCR se puede detectar el material genético del virus durante los primeros días de la enfermedad44.
Tratamiento y prevenciónSolamente se usan medidas sintomáticas como AINE y paracetamol. El uso de repelentes y mosquiteras son las medidas habituales para evitar la picadura del mosquito. No hay vacuna disponible.
Virus MayaroEpidemiologíaAislado por primera vez en Trinidad en 1954, siendo una enfermedad típica de áreas rurales de Sudamérica, especialmente de la zona norte y de la cuenca del Amazonas50. El reservorio del virus se cree que son las aves, lagartos y algunos mamíferos como los monos. Transmitida por mosquitos de la familia Culicidae, principalmente por Haemagogus janthinomys con hábitos de alimentación diurnos. El vector habita bosques selváticos tropicales lluviosos cerca de los nichos de los monos y las hembras ponen los huevos en huecos de árboles, bambús rotos y recipientes artificiales como cauchos, latas. Estudios experimentales han demostrado que A. aegypti, Aedes scapularis y Aedes albopictus pueden ser infectados por el virus y ser transmitido de manera efectiva, por lo que potencialmente podría causar brotes urbanos51–52.
ClínicaEl periodo de incubación no está claramente descrito en la literatura, pero algunos autores refieren que es de 8 días. El cuadro clínico es de inicio súbito con aparición de fiebre (100%), artralgias (50-89%), mialgias (75%), cefalea (64-100%), edema articular (58%), exantema, que aparece al quinto día (32-49%) y dolor retroocular (44-63%). Otras manifestaciones menos frecuentes son prurito, mareos, anorexia, linfadenopatías, ictericia y vómitos50,53. El hemograma puede mostrar cambios como leucopenia y trombocitopenia pero de poca importancia. Las artralgias que afectan las muñecas, tobillos, codos rodillas y dedos, pueden permanecer hasta 12 meses e interfieren en la actividad diaria y el trabajo, e incluso se pueden observar derrame y rigidez articular50,54.
DiagnósticoMediante pruebas serológicas específicas, IgM e IgG. La técnica de PCR es útil durante los primeros días de la enfermedad. Las pruebas serológicas pueden tener reacciones cruzadas con otros alfavirus.
Tratamiento y prevenciónSolo sintomático con AINE y paracetamol. El uso de repelentes y mosquiteras son las medidas habituales para evitar la picadura del mosquito. No hay vacuna disponible.
Conclusiones- •
Los alfavirus asociados a poliartritis más importantes son los virus Sindbis, Ross River, Mayaro, O’nyong nyong y Barmah Forest, pero el prototipo indiscutible es Chikungunya.
- •
A diferencia de otros virus, infectan hueso, músculo esquelético, inserciones miotendinosas y cápsulas articulares.
- •
El período de incubación es corto, menor de 14 días. Durante la fase aguda (semanas 0-3) aparece fiebre, poliartralgias, mialgias y exantema. La mitad se recupera completamente en 3 semanas. Algunos pacientes entran en una fase crónica (>12.a semana) con síntomas osteoarticulares que pueden durar años. El 5% sufrirá un verdadero reumatismo inflamatorio crónico similar a la AR o la espondiloartritis o poliartritis indiferenciada.
- •
El diagnóstico se realiza mediante PCR durante la primera semana y posteriormente mediante serología.
- •
Se trata con paracetamol al que se pueden añadir AAS o AINE. Los glucocorticoides están indicados en cuadros poliarticulares, tenosinovitis, sinovitis activa, o si resistencia o contraindicación a los AINE. En la fase crónica se pueden emplear hidroxicloroquina, sulfasalacina, metotrexato y otros agentes modificadores de la enfermedad en distintas pautas.
- •
Se recomienda derivar al paciente a un especialista en reumatología para su valoración y tratamiento.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.